Сообщение особенности номенклатуры этиленовых углеводородов многообразие и перспективы
Обновлено: 18.05.2024
Алкены (иначе олефины или этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации.
Содержание
Гомологический ряд
Алкены, число атомов углерода в которых больше трёх, имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная.
| этен | C2H4 |
| пропен | C3H6 |
| н-бутен | C4H8 |
| н-пентен | C5H10 |
| н-гексен | C6H12 |
| н-гептен | C7H14 |
| н-октен | C8H16 |
| н-нонен | C9H18 |
| н-децен | C10H20 |
Физические свойства
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Алкены химически активны. Их химические свойства определяются наличием двойной связи.
- Озонолиз: алкен окисляется до альдегидов (в случае монозамещенных вицинальных углеродов), кетонов (в случае дизамещенных вицинальных углеродов) или смеси альдегида и кетона (в случае три-замещенного у двойной связи алкена):
- Озонолиз в жёстких условиях — алкен окисляется до кислоты:
- Присоединение по двойной связи:
- Окисление надкислотами:
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Этиленовые углеводороды" в других словарях:
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что олефины … Большой Энциклопедический словарь
этиленовые углеводороды — то же, что олефины. * * * ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ, то же, что олефины (см. ОЛЕФИНЫ) … Энциклопедический словарь
Этиленовые углеводороды — то же, что Олефины … Большая советская энциклопедия
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что олефины … Химическая энциклопедия
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что олефины … Большой энциклопедический политехнический словарь
ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ — то же, что алкены … Естествознание. Энциклопедический словарь
этиленовые углеводороды — алкены, олефины … Cловарь химических синонимов I
Углеводороды ацетиленовые — Под этим названием подразумевают непредельные У. формулы CnH2n 2, представителем которых являлся с давних пор ацетилен C2H2 (см. Ацетилен и Углеродистый кальций). В настоящее время У. формулы CnH2n 2 можно подразделить на следующие виды: а)… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Жирные углеводороды, или алифатические углеводороды — ► aliphatics, aliphatic hydrocarbons Углеводороды с открытой цепью. Представлены следующими гомологическими рядами: ■ метановые углеводороды СnН2n+2 ■ олефиновые (этиленовые) углеводороды СnН2n с одной двойной связью ■ ацетиленовые углеводороды… … Нефтегазовая микроэнциклопедия
непредельные углеводороды — ▲ углеводороды этиленовые, алкены, олефины имеют двойную связь между молекулами углерода и водорода. этилен. пропилен. бутилены. изобутилен. ацетиленовые, алкины имеют тройную связь. ацетилен. диеновые. пропадиен. бутадиен, дивинил. изопрен … Идеографический словарь русского языка

Aлкенами (олефиновыми, этиленовыми) называют непредельные углеводороды с открытыми углеродными цепями, молекулы которых содержат одну двойную углерод-углеродную связь. Простейшим представителем алкенов является этилен СН2=СН2.
Электронное и пространственное строение молекулы этилена.
В молекуле этилена атомы углерода имеют иной тип гибридизации по сравнению с метаном. Гибридизации подвержены одна s – и две р – орбитали; третья р – орбиталь остается без изменения. Такое состояние атома углерода называют sр 2 – гибридизацией (рис. 3.1).

В результате у атома углерода имеются четыре орбитали: три гибридные sр 2 – орбитали и одна негибридизованная р – орбиталь. На каждой из них находится по одному неспаренному электрону, за счет которых углерод образует четыре ковалентные связи. В результате взаимного отталкивания электронов орбитали стремятся расположиться в пространстве на максимальном удалении. Такое удаление орбиталей друг от друга достигается в том случае, если оси sр 2 -орбиталейлежат в одной плоскости под углом 120 0 , а ось р-орбитали будет перпендикулярна этой плоскости (рис.3.2).

Каждый атом углерода в молекуле этилена за счет перекрывания Sp 2- оpбиталей образует три -связи: с двумя атомами водорода и соседним атомом углерода. При параллельном расположении осей р-орбиталей двух атомов происходит их боковое перекрывание с образованием второй углерод-углеродной связи π-типа (рис. 3.3).

π –Связь является менее прочной и более доступной для атаки реагентов по сравнению с -связью. Однако суммарная энергия двойной связи больше, чем одинарной.
Электронное строение молекулы этилена определяет и ее пространственное строение (рис. 3.4). Центры ядер всех шести атомов расположены в одной плоскости, перпендикулярной плоскости π-связи. Все валентные углы 0 . Длина двойной связи значительно меньше длины одинарной и составляет 0,134нм. Свободное вращение атомов углерода относительно связи С=С невозможно.

Гомологический ряд и изомерия алкенов. Этилен является первым представителем гомологического ряда этиленовых (олефиновых) углеводородов, или алкенов. Как и в случае алканов, два ближайших гомолога отличаются по составу на гомологическую разность – СН2 –.
Общая формула углеводородов гомологического ряда алкенов СnН2n. В табл. 3.1 приведены структурные формулы и названия первых четырех гомологов ряда алкенов.
Названия и структурные формулы первых четырех гомологов ряда алкенов
Для алкенов характерны три типа изомерии: изомерия углеродного скелета, изомерия положения двойной связи и геометрическая изомерия.
Изомерия начинается с углеводорода состава С4Н8 – бутена. При расположении двойной связи между первым и вторым углеродными атомами возможны два структурных изомера: бутен-l и 2-метилпропен. Для углеводородов, в молекулах которых двойная связь расположена в середине цепи, существуют два геометрических изомера: цис-бутен-2 и транс-бутен-2. Они отличаются взаимным расположением атомов водорода относительно линии двойной связи:

Поскольку поворот молекулы относительно двойной связи в алкенах невозможен, цuс-бутен-2 и транс-бутен-2 являются разными веществами.
Не любой алкен имеет геометрические изомеры. для этого необходимо, чтобы каждый из двух атомов углерода в состоянии sр-гибридизации имел по два разных заместителя. Например, 3-этилгексен-3 пространственных изомеров не имеет (третий углеродный атом связан с двумя одинаковыми группами), а 3-метилгексен-3 имеет. Изображение начинают с атомов углерода, связанных двойной связью, затем указывают четыре заместителя:

Следует иметь в виду, что в алкенах все атомы углерода, не связанные двойной связью, находятся в состоянии sр З -гибридизации.
Приведенные правила иллюстрируют следующие примеры:


Простейшие алкены наряду с названиями согласно международной номенклатуре: этен, пропен и бутен - называют исторически сложившимися (тривиальными) названиями: этилен, пропилен, бутилен соответственно.
При отщеплении одного атома водорода от молекул алкенов образуются непредельные радикалы общей формулы СnH2n-1, простейшие из которых: винил СН2=СН – и аллил СН2 = СН – СН2
Физические свойства. При обычных условиях алкены состава С2Н4, С3Н6, С4Н8 являются газообразными веществами без цвета и запаха; углеводороды СnH2n, где n = 5 – 15 – бесцветные жидкости; при n 16 – твердые вещества. Алкены не растворимы в воде, однако могут растворяться в органических растворителях. Газообразные алкены образуют с воздухом взрывоопасные смеси.
3.2. Получение и химические свойства алкенов
В отличие от предельных углеводородов алкены встречаются в природе нечасто. Промышленные способы получения этиленовых углеводородов основаны на превращении алканов (природных источников углеводородов, главным образом нефти и природного газа) в алкены. Все лабораторные способы получения основаны на реакциях отщепления, или элиминирования. При этом от двух соседних атомов углерода отщепляются два атома или группы, и между атомами углерода возникает π-связь.
Промышленные способы получения алкенов. Основными промышленными способами получения алкенов являются крекинг и дегидрирование алканов.
1. Крекинг алканов. Главным промышленным способом получения алкенов является крекинг алканов, входящих в состав нефти и попутного нефтяного газа:

В зависимости от условий про ведения процесса различают термический и каталитический крекинг. С целью получения алкенов используют, как правило, крекинг термический, протекающий при температуре 400 – 700 0 С.
2. Дегидрирование алканов. Этот процесс рассматривался в подразд.2.2 как химическое свойство предельных углеводородов:

Лабораторные способы получения алкенов. В лаборатории для получения алкенов используют реакции дегидратации спиртов и дегидрогалогенирования производных предельных углеводородов.
1. Дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты до температуры выше 180 0 С происходит внутримолекулярное отщепление воды с образованием этиленового углеводорода:

Реакция дегидратации - это реакция, в результате которой от молекулы органического вещества отщепляется молекула воды
2. Дегидрогалогенирование галогеналканов. Отщепление галогеноводородов проводят при действии спиртовых растворов щелочей на бром- и хлорпроизводные алканов, например:

Реакция дегидрогалогенирования - это реакция, в результате которой от молекулы органического вещества отщепляется молекула галогеноводорода.
Обратите внимание на тот факт, что во всех реакциях элиминирования углеродный скелет молекулы н е и з м е н я е т с я, происходит лишь образование кратной связи между двумя атомами углерода.
Химические свойства алкенов. По химическим свойствам алкены коренным образом отличаются от алканов. Наличие в молекуле двойной углерод-углеродной связи обусловливает характерные свойства олефинов: реакции присоединения, окисления, полимеризации.
Реакции присоединения. π-Связь в молекулах алкенов значительно менее прочная, чем
-связь. Она относительно легко разрывается, за счет освободившихся валентностей атомы углерода способны присоединять различные реагенты: водород, галогены, галогеноводороды, воду.
1. Г и д р и ро в а н и е а л к е н о в. Происходит при повышенных значениях температуры и давления в присутствии металлических катализаторов. Наиболее распространенным катализатором процессов гидрирования (равно как и обратного процесса - дегидрирования) является никель

Присоединение водорода по кратным углерод-углеродным связям называют реакцией гидрирования
2. Г а л о г е н и р о в а н и е а л к е н о в. Алкены легко присоединяют молекулы хлора и брома с разрывом двойной связи и образованием дигалогенопроизводных:

Присоединение галогенов по кратным углерод-углеродным связям называют реакцией галогенирования.
Если газообразный этилен пропускать через раствор брома в воде то желтая окраска бромной воды постепенно исчезает. Обесцвечивание бромной воды является качественной реакцией на непредельные соединения, в том числе на алкены.
3. Г и д р о г а л о г е н и р о в а н и е а л к е н о в. При взаимодействии алкенов с хлороводородом или бромоводородом образуются галогеналканы:

Присоединение галогеноводородов по кратным углерод-углеродным связям называют реакцией гидрогалогенирования.
При присоединении галогеноводородов к гомологам этилена строение образующегося продукта в ряде случаев определяется правилом Марковникова:
При присоединении молекул типа их НХ (Х= ОН, галогены и т.п.) к алкенам водород преимущественно присоединяется к наиболее гидрогенизированиому атому углерода двойной связи
Наиболее гидрогенизированный – это тот атом углерода двойной связи, который содержит большее число атомов водорода. Например, при взаимодействии пропена с бромоводородом образуется 2-бромпропан:

Правило Марковникова отражает распределение электронной плотности в молекулах алкенов. π-Связь в молекулах этиленовых углеводородов очень чувствительна к влиянию заместителей sр 2 -гибридных атомов углерода. Если заместитель при двойной связи обладает электронодонорным эффектом (например, алкильный радикал), т. е. подает на связанный с ним атом электронную пару, то электронная плотность двойной связи в ответ смещается к наиболее гидрогенизированному атому углерода.
Так, алкены с несимметричным расположением двойной связи имеют следующее распределение электронной плотности:

Молекула бромоводорода также полярная, причем атом водорода как менее электроотрицательного, чем бром, элемента обладает частичным положительным зарядом:

По законам электростатического взаимодействия атом водорода присоединяется к более гидрогенизированному атому углерода двойной связи.
4. Г и д р а т а ц и я а л к е н о в. При взаимодействии алкенов с водой в присутствии серной или фосфорной кислот образуются спирты. Кислота в данном случае выполняет роль катализатора. Строение образующегося спирта также определяется правилом Марковникова:

Присоединение воды по кратным углерод-углеродным связям называют реакцией гидратации.
Реакции окисления.
1. Г о р е н и е. Как и любые другие углеводороды, алкены горят с образованием углекислого газа и воды:
За счет большей массовой доли углерода в алкенах по сравнению с алканами пламя этиленовых углеводородов имеет красноватый оттенок, оно более светящееся.
2. О к и с л е н и е п е р м а н г а н а т о м к а л и я. Пропускание газообразного алкена через водный раствор перманганата калия при комнатной температуре приводит к обесцвечиванию раствора:

В результате реакции двойная связь разрывается, и оба атома углерода присоединяют по гидроксильной группе. Соединения такого класса называют гликолями. Эта реакция также является качественной на двойную углерод-углеродную связь.
Реакция полимеризации. При повышенных значениях температуры и давления в присутствии катализаторов двойные связи молекул алкенов разрываются и атомы углерода соединяются друг с другом с образованием длинных цепочек:
Какие углеводороды называют непредельными? Охарактеризуйте класс органических соединений алкены. Относятся ли этиленовые углеводороды к непредельным соединениям?
Какие типы изомерии характерны для алкенов? Приведите примеры изомеров различного типа и назовите эти вещества.
Напишите структурные формулы следующих углеводородов: а) 2-метилбутен-2; б) 2-метилпропен; в) 2,3-диметилгексен-3; г) 2,5,5 -триметилгексен-2; д) цис-4-метилпентен-2.
Какие из них имеют геометрические изомеры? Напишите их структурные формулы и назовите.
10л паров этиленового углеводорода при нормальных условиях имеют массу 18,75г. Определите его формулу и плотность по воздуху.
Напишите реакции получения следующих алкенов: а) бутена-2; б) 3-метилпентена-1; в) 2-метилбутена-2 – дегидратацией и дегидрогалогенированием соответствующих исходных соединений.
Сформулируйте правило Марковникова. Приведите примеры реакций гидрогалогенирования и реакций гидратации, иллюстрирующие это правило.
С помощью каких реакций можно отличить алкены от алканов? Напишите уравнения этих реакций для пропена.
Какова структурная формула этиленового углеводорода, если 11,2г его при взаимодействии с избытком HBr превращаются в 27,4г бромалкана с положением галогена у третичного атома углерода?
Сколько граммов 1,2-дихлорэтана можно получить взаимодействием этилена с хлором, полученным при действии 200г хлороводородной кислоты с массовой долей НСl 36,5% на избыток оксида марганца(IV)?
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с
Строение углеводородов: 1) этилен – первый представитель гомологического ряда веществ, в молекулах которых имеется двойная связь между атомами углерода; 2) ближайшие гомологи этилена – пропилен и бутилен; 3) названия углеводородов ряда этилена образуются путем изменения суффикса – ан соответствующего предельного углеводорода на – илен (этилен, пропилен и т.
Особенности систематической (международной) номенклатуры: а) названия этих углеводородов принимают суффикс – ен (этен, пропен, бутен и т. д.); б) гомологи этилена должны отличаться друг от друга по составу молекул на группу атомов СН2; в) в молекуле каждого непредельного углеводорода при образовании двойной связи на два атома водорода меньше, чем в молекуле соответствующего предельного углеводорода; г) состав углеводородов ряда этилена (этена) выражается формулой СnН2n; д) непредельные углеводороды могут образовывать радикалы.
Реакция присоединения, характерная для всех алкенов:
1. Присоединение водорода.
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре.
Реакция гидрирования, или гидрогенизация, – это присоединение водорода к веществу.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов.
Реакция протекает при обычных условиях.
Дихлорэтан – это жидкость, которая хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды.
3. Присоединение галогеноводородов.
Галогенопроизводные углеводороды можно получить двумя путями:
1) присоединение к этилену хлороводорода;
2) замещение водорода в этане на хлор.
4. Присоединение воды.
Реакция протекает в присутствии катализатора – серной кислоты.
Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием этилсерной кислоты.
Затем этилсерная кислота при взаимодействии с водой образует спирт и кислоту.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, которые содержатся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться при обычной температуре.
При этом окислению подвергаются оба атома углерода, соединенные двойной связью.
Этилен горит светящимся пламенем с образованием оксида углерода и воды: С2Н4 + 3O2 ? 2СO2 + 2Н2О.
Этиленовые углеводороды, или олефины (ср. ХLIІ, приложение углеводороды, 34, 35), гомологический ряд углеводородов, СnН2n, простейший член которого представляет этилен, С2Н4; ещё более простой углеводород, метилен (см.), СН2, не получен, и при различных попытках его получения образовывался этилен. В этилене и его гомологах обычно признаётся двойная связь между атомами углерода и формула строения этилена изображается так: СН2 = СН2. Согласно современным воззрениям на строение атомов и некоторым теориям относительно характера связи в органических соединениях признают, что простая связь устанавливается при помощи двух, двойная — четырёх, тройная — шести электронов. В таком случае формула строения этилена будет:
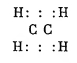
Пространственная (стереохимическая) формула этилена изображается двумя тетраэдрами, соприкасающимися по ребру; в центре тетраэдров находятся атомы углерода, на свободных (4) вершинах — атомы водорода, или радикалы: метил, этил и т. д.
Номенклатура. Названия либо оканчиваются на илен и производятся от тех же корней, как и у предельных углеводородов; либо рассматривают углеводороды этиленового ряда как производные этилена и называют С3Н6, или СН3СН = СН2 метил-этиленом, С4Н8 этил-этиленом и диметил-этиленом. По женевской номенклатуре названия оканчиваются на ен: этен, пропен и т. д.
Этиленовые углеводороды мало распространены в природе. Встречаются в нефти и образуются при сухой перегонке различных веществ (каменного угля, дерева и пр.), а также при разложении нагреванием под давлением предельных углеводородов (крекинг) — технически важном процессе.
Физические свойства этиленовых углеводородов в общем сходны со свойствами предельных углеводородов, и закономерности изменения свойств в гомологическом ряду также весьма близки. Кроме молекулярного веса, на некоторых свойствах сказывается влияние строения: к таким свойствам относятся температура кипения и особенно молекулярная рефракция
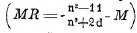
Последней величиной пользуются для установления нахождения двойной связи.
Способы получения этиленовых углеводородов довольно многочисленны и разнообразны, но, в общем, большинство главнейших сводится к косвенному отнятию у предельных углеводородов двух атомов водорода от двух соседних атомов углерода. Сущность приёмов заключается в отнятии элементов воды от спиртов и отнятии HCl или Вr2 от галоидных производных предельных углеводородов. Воду отнимают нагреванием с водоотнимающими веществами (Н2SO4, Р2O3, В2O3, ZnCl2) или пропусканием паров спирта над нагретой окисью алюминия, Аl2O3. Йодистый водород отнимают спиртовым раствором KОН, Вr2 — посредством цинковой пыли и спирта или вообще металлов (Na). Известны и другие общие способы добывания этиленовых углеводородов, но они имеют меньшее значение.
Химические свойства. Главной особенностью этиленовых углеводородов является чрезвычайная склонность вступать в реакции прямого присоединения с разнообразными веществами как с элементами, так и с соединениями. Многие из этих реакций обратны способам получения. Так, этиленовые углеводороды способны при известных условиях присоединять Н2, переходя в предельные углеводороды. Энергично соединяются с Вr2 (Сl2 и J2), а также с кислотами галоидоводородными и кислородными; при этом молекула кислоты распадается на две части, из которых одной является обычно Н, а другой — остальная часть, но иногда ОН кислоты присоединяется к одному атому углерода, а остальная часть к другому, например:
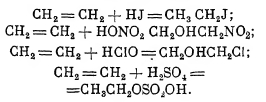
Кроме кислот, присоединяются и ангидриды кислот, N2O5, N2O4, N2O3 (работа Н. Я. Демьянова и др.). При действии озона присоединяется озон с образованием озонидов (см. перекиси органические). Указанными реакциями и примерами превращения этиленовых углеводородов далеко не исчерпываются. Особенно следует указать на способность этиленовых углеводородов полимеризоваться под влиянием физических условий: нагревания под давлением, действия тихого разряда, нагревания в присутствии катализаторов, действия кислот и солей (Н2SО4, ZnCl2 и др.). Процесс этот имеет практическое значение как метод превращения газообразных углеводородов в жидкие.
Наконец, в отличие от прочных, неспособных к изомеризации, предельных углеводородов, этиленовые углеводороды во многих случаях способны претерпевать более или менее глубокие изомерные превращения, причём не только может перемещаться двойная связь, но и происходить глубокая перестройка углеродного скелета.
Этилен получен в 1795 г. голландскими химиками (см. XXVIII, 288). По способности давать с хлором маслянистую жидкость — хлористый этилен, С2Н4Сl2, — называется маслородным газом. Газ с эфирным сладковатым запахом, малорастворимый в воде, несколько более в спирте и эфире. Температура кипения — 102,5°(при 1 атм.), температура плавления — 169°; при 0° сжижается при 43 атм. Так как при испарении сгущённого в жидкость этилена поглощается много тепла, то такой этилен применяется для охлаждения. Горит светящим пламенем. Содержится в светильном газе. Образуется при разложении нагреванием многих органических соединений (даже метана: 2СН4 = С2Н4 + 2Н2). Технически получается пропусканием паров спирта над нагретой до 300° окисью алюминия, действующей как катализатор:
Обратно из этилена можно получить спирт, соединив этилен, при известных условиях, с крепкой серной кислотой и разложив образующуюся этилосерную кислоту водой:

Полимеризуясь, превращается в сложную смесь жидких и даже твёрдых полимеров, напоминающую продукты, получаемые из нефти.
Читайте также:

