Сообщение о различных областях применения ферментов в промышленности
Обновлено: 30.06.2024
Ферменты, их определение, классификация, основные свойства и особенности действия. Роль ферментов в биохимических реакциях, протекающих в живых организмах. Строение молекулы и химические соединения ферментов, их применение в современной промышленности.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 21.05.2014 |
| Размер файла | 18,9 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство сельского хозяйства РФ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Рязанский государственный агротехнологический университет имени П.А Костычева
Выполнил: Тимофеева А.И
Проверил : Гречухина Э.Б
3.Область применения ферментов
Список использованных источников
ферментный биохимический молекула организм
Фермемнты, или энзиммы (от лат. fermentum, греч. жэмз, ?нжхмпн -- закваска) -- обычно белковые молекулы или молекулы РНК (рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах.
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах. К 2013 году было описано более 5000 разных ферментов. Они играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Одна из особенностей ферментов - способность к направленному и регулируемому действию. За счёт этого контролируется согласованность всех звеньев обмена веществ. Эта способность определяется пространственностью структурной молекулы ферментов. Она реализуется через изменение скорости действия ферментов и зависит от концентрации соответствующих субстратов и кофакторов, рH среды, температуры, а также от присутствия специфических активаторов и ингибиторов (например, адениловых нуклеотидов, карбонильных, сульфгидрильных соединений и др.).
1. Свойства ферментов
Будучи белками, ферменты обладают всеми их свойствами. Вместе с тем биокатализаторы характеризуются рядом специфических качеств, тоже вытекающих из их белковой природы. Эти качества отличают ферменты от катализаторов обычного типа. Сюда относятся термолабильность ферментов, зависимость их действия от значения рН среды, специфичность и, наконец, подверженность влиянию активаторов и ингибиторов.
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа.
Зависимость каталитической активности фермента от температуры выражается типичной кривой. До некоторого значения температуры (в среднем до 5О°С) каталитическая активность растет, причем на каждые 10°С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50°С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает.
Детальные исследования роста активности ферментов с повышением температуры, проведенные в последнее время, показали более сложный характер этой зависимости, чем указано выше: во многих случаях она не отвечает правилу удвоения активности на каждые 10°С в основном из-за постепенно нарастающих конформационных изменений в молекуле фермента.
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом.
Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50°С, а растительного - между 50 и 60°С. Однако есть ферменты с более высоким температурным оптимумом, например, у папаина (фермент растительного происхождения, ускоряющий гидролиз белка) оптимум находится при 8О°С. В то же время у каталазы (фермент, ускоряющий распад Н2О2 до Н2О и О2) оптимальная температура действия находится между 0 и -10°С, а при более высоких температурах происходит энергичное окисление фермента и его инактивация.
Зависимость активности фермента от значения рН среды была установлена свыше 50 лет назад. Для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты.
Переход к большей или меньшей (по сравнению с оптимальной) концентрации водородных ионов сопровождается более или менее равномерным падением активности фермента.
Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях рН в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса.
Специфичность - одно из наиболее выдающихся качеств ферментов. Эго свойство их было открыто еще в прошлом столетии, когда было сделано наблюдение, что очень близкие по структуре вещества - пространственные изомеры расщепляются по эфирной связи двумя совершенно разными ферментами.
Таким образом, ферменты могут различать химические соединения, отличающиеся друг от друга очень незначительными деталями строения, такими, например, как пространственное расположение метоксильного радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида.
По образному выражению, нередко употребляемому в биохимической литературе, фермент подходит к субстрату, как ключ к замку. Это знаменитое правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента.
В 50-е годы нашего столетия это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выряжено формулой “перчатка - рука”. При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. Гипотеза Кошланда, основанная на допущении гибкости активного центра фермента, удовлетворительно объясняла активирование и ингибирование действия ферментов и регуляцию их активности при воздействии различных факторов. В частности, конформационные перестройки в ферменте в процессе изменения его активности Кошланд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат), подчеркивая этим крайнюю лабильность структуры фермента в процессе каталитического акта.
В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
2. Классификация ферментов
По первой в истории изучения ферментов классификации их делили на две группы: гидролазы, ускоряющие гидролитические реакции, и десмолазы, ускоряющие реакции негидролитического распада. Затем была сделана попытка разбить ферменты на классы по числу субстратов, участвующих в реакции. В соответствии с этим ферменты классифицировали на три группы. 1. Катализирующие превращения двух субстратов одновременно в обоих направлениях 2. Ускоряющие превращения двух субстратов в прямой реакции и одного в обратной 3. Обеспечивающие каталитическое видоизменение одного субстрата как в прямой, так и в обратной реакции.
Одновременно развивалось направление, где в основу классификации ферментов был положен тип реакции, подвергающейся каталитическому воздействию. Наряду с ферментами, ускоряющими реакции гидролиза (гидролазы), были изучены ферменты, участвующие в реакциях переноса атомов и атомных групп (феразы), в изомеризации (изомеразы), расщеплении (лиазы), различных синтезах (синтетазы) и т. д. Это направление в классификации ферментов оказалось наиболее плодотворным, так как объединяло ферменты в группы не по надуманным, формальным признакам, а по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.
1. Оксидоредуктазы - ускоряют реакции окисления - восстановления. 2. Трансферазы - ускоряют реакции переноса функциональных групп и молекулярных остатков. 3. Гидролазы - ускоряют реакции гидролитического распада. 4. Лиазы - ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). 5. Изомеразы - ускоряют пространственные или структурные перестройки в пределах одной молекулы. 6. Лигазы - ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей. Эти классы и положены в основу новой научной классификации ферментов.
К классу оксидоредуктаз относят ферменты, катализирующие реакции окисления - восстановления. Окисление протекает как процесс отнятия атомов Н (электронов) от субстрата, а восстановление - как присоединение атомов Н (электронов) к акцептору.
В класс трансфераз входят ферменты, ускоряющие реакции переноса функциональных групп и молекулярных остатков от одного соединения к другому. Это один из наиболее обширных классов: он насчитывает около 500 индивидуальных ферментов. В зависимости от характера переносимых группировок различают фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, трансферазы, переносящие одноуглеродные остатки (метилтрансферазы, формилтрансферазы), и др. Например, амидазы ускоряют гидролиз амидов кислот. Из них важную роль в биохимических процессах в организме играют уреаза, аспарагиназа и глутаминаза.
Уреаза была одним из первых белков-ферментов, полученным в кристаллическом состоянии. Это однокомпонентный фермент (М=480000), молекула его глобулярна и состоит из 8 равных субъединиц. Уреаза ускоряет гидролиз мочевины до NН3 и СО2.
Характерные черты действия ферментов класса лигаз (синтетаз) выявлены совсем недавно в связи со значительными успехами в изучении механизма синтеза жиров, белков и углеводов: Оказалось, что старые представления об образовании этих соединений, согласно которым они возникают при обращении реакций гидролиза, не соответствуют действительности. Пути их синтеза принципиально иные.
Главная их особенность - сопряженность синтеза с распадом веществ, способных поставлять энергию для осуществления биосинтетического процесса. Одним из таких природных соединений является АТФ. При отрыве от ее молекулы в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ. Лигазы же каталитически ускоряют синтез органических соединений из активированных за счет распада АТФ исходных продуктов. Таким образом, к лигазам относятся ферменты, катализирующие соединение друг с другом двух молекул, сопряженное с гидролизом пирофосфатной связи в молекуле АТФ или иного нуклеозидтрифосфата.
Механизм действия лигаз изучен еще недостаточно, но, несомненно, он весьма сложен. В ряде случаев доказано, что одно из участвующих в основной реакции веществ сначала дает промежуточное соединение с фрагментом распадающейся молекулы АТФ, а вслед за этим указанный промежуточный продукт взаимодействует со вторым партнером основной химической реакции с образованием конечного продукта.
3. Область применения ферментов
Применение ферментов нельзя назвать достижением современности: они использовались на протяжении веков при дублении кож, изготовлении сыра, в производстве солода для пивоварения, в заквасках для хлеба и т.д. В этих процессах ферменты применялись в составе животных и растительных тканей или целых микроорганизмов. Начало применения промышленных ферментов в виде частично очищенных препаратов относится к концу XIX столетия.
Из более чем 5000 известных в настоящие время ферментов в промышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз, из которых 60% составляют пептидогидролазы (в основном щелочные и нейтральные протеазы), использующиеся в качестве детергентов а производстве синтетических моющих средств, а 30% - гликозидазы, применяющиеся в производстве кондитерских изделий, фруктовых и овощных соков. Ферменты находят применение в текстильной, кожевенной, целлюлозно-бумажной, медицинской, химической промышленности .
По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают гликоизомераза и глюкоамилаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50% рынка пищевых энзиматических препаратов.
В настоящие время многие отрасли промышленности - хлебопечение, виноделие, пивоварение, производство спирта, сыроделие, производство органических кислот, чая, аминокислот, витаминов, антибиотиков - основано на использовании различных ферментативных процессов. В связи с этим возникла и развивается новая отрасль промышленности - производство ферментных препаратов.
Производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем её отраслям, объем продукции которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы. Резкий рост этой индустрии наблюдается в США и Японии.
Список использованных источников
Подобные документы
Ферменты - белки-катализаторы, регулирующие процессы жизнедеятельности и обмена веществ в организме. Строение ферментов, их специфичность к субстрату, селективность и эффективность, классификация. Структура и механизм действия ферментов; их применение.
презентация [670,0 K], добавлен 12.11.2012
Свойства и строение ферментов - специфических белков, присутствующих во всех живых клетках и играющих роль биологических катализаторов. Их номенклатура и классы. Методы выделения ферментов из клеточного содержимого. Основные этапы цикла лимонной кислоты.
презентация [221,2 K], добавлен 10.04.2013
Сущность понятия "иммобилизованные ферменты". Главные преимущества иммобилизации. Типы связывания ферментов. Главные отличительные признаки химических методов иммобилизации. Применение иммобилизованных ферментов в производстве кукурузного сиропа.
реферат [10,9 K], добавлен 30.11.2010
Ферменты как биологические катализаторы. Отличие ферментов от обычных катализаторов и их использование в медицине. Понятие активного центра фермента. Ферменты поджелудочной железы и механизм их работы. Скорость ферментативной реакции и ингибиторы.
реферат [22,5 K], добавлен 30.03.2009
Номенклатура аминов, их физические и химические свойства. Промышленные и лабораторные способы получения аминов. Классификация аминокислот и белковых веществ. Строение белковых молекул. Катализ биохимических реакций с участием ферментов (энзимов).
На сегодняшний день в различных отраслях хозяйства применение ферментов является передовым достижением. Особое значение ферменты нашли в пищевой промышленности. Ведь именно из-за наличия ферментов в тесте происходит его поднятие и разбухание. Как известно, разбухание теста происходит под действием углекислого газа CO2, который в свою очередь образуется в результате разложения крахмала под действием фермента амилазы, которая уже содержится в муке. Но в муке этого фермента не достаточно, его, обычно, добавляют. Ещё один фермент протеазы, придающий тесту клейковину, способствует удержанию углекислого газа в тесте.
Изготовление алкогольных напитков также не обходится без участия ферментов. В этом случае широко применяются ферменты, которые находятся в дрожжах. Разнообразие сортов пива получают именно различными комбинациями комплексных соединений ферментов. Ферменты, также участвуют в растворении осадков в спиртных напитках, например, чтобы в пиве не появлялся осадок в него добавляют протеазы (папаин, пепсин), которые растворяют выпадающие в осадок белковые соединения.
Производство кисломолочных продуктов, например, простокваши, основана на химическом превращении лактозы (то есть молочного сахара) в молочную кислоту. Кефир производят подобным образом, но производственной особенностью является то, что берут не только кисломолочные бактерии, но и дрожжи. В результата переработки лактозы образуется не только молочная кислоты, но ещё и этиловый спирт. При получении кефира происходит ещё одна достаточно полезная для организма человека реакция - это гидролиз белков, что в последствии употребления человеком кефира способствует его лучшему усвоению.
Производство сыра тоже связано с ферментами. Молоко содержит белок - казеин, который в процессе химической реакции под действием протеаз изменяется, и в результате реакции выпадает в осадок.
Протеазы широко используют для обработки кожевельного сырья. Его способность производить гидролиз белков (расщепление белков) широко применяют для выведения стойких пятен от шоколада, соусов, крови и т.д. Фермент целлюлаза - используется в стиральных порошках. Он способен удалять "катышки" с поверхности тканей. Важной особенностью стирки с порошками, содержащими целые комплексы ферментов, является то, что стирка в должна выполняться в тёплой, но не горячей воде, так как горячая вода для ферментов является губительной.
Применение ферментов в медицине связано с их способностью заживлять раны, растворять образующиеся тромбы. Иногда ферменты умышленно вводят в организм для их активизации, а иногда из-за излишней активности ферментов, могут вводить вещества, которые действуют как ингибиторы (вещества, замедляющие протекание химических реакций). Например, под действием отдельных ингибиторов, бактерии теряют способность размножаться и расти.
Применение ферментов в медицине также связано с проведением различных анализов по определению заболеваний. В этом случае ферменты играют роль веществ, вступающих в химическое взаимодействие или способствующие химическим превращениям в физиологических жидкостях организма. В результате получаются определённые продукты химических реакций, по которым в лабораториях распознают наличие того или иного возбудителя заболевания. Среди таких ферментов и их применения наиболее известен фермент глюкозооксидаза который позволяет определить наличие сахара в моче или крови человека. Кроме того, наравне с отмеченным, существуют ферменты, которые способны определять наличие алкоголя в крови. Этот фермент называется алкогольдегидрогеназа
Как отделить фермент от продуктов реакции
Представим себе, что у нас имеется фермент в жидком состоянии, он готов к проведению химической реакции. Но как же отделить фермент от продуктов реакции!? Для таких целей специально используются твёрдые катализаторы, тогда отделение продуктов реакции не составляет труда. Кроме того, ещё во второй половине 20 века научились прикреплять ферменты к твёрдым веществам – носителям. Такой процесс носить название - иммобилизация ферментов, то есть их неподвижность; он стал широко применяться в каталитических реакция.
Существует два способа прикрепления ферментов к носителю: первый способ – на физическом уровне, то есть фермент не образует химических связей с носителем; второй – химический – соответственно с образованием химических связей. В физическом методе используется адсорбция (связывание вещества с поверхность тела). В этом случае фермент прикрепляется к твёрдому телу-носителю с помощью, например, электростатических связей. Конечно такое крепление фермента не является прочным!
По-другому, существуют физические методы, которые крепко держат фермент возле носителя. Для этого нужно, чтобы структура носителя представляла собой решёточный вид, за которую попадает фермент и задерживается там. В процессе химической реакции реагенты попадают за решётку, подвергаются действию фермента, после чего продукты реакции свободно выходят из-за решётки.
Для иммобилизации фермента (его неподвижности) можно использовать гели, которые представляют собой один из видов дисперсных системы, состоящих из множества мелких частичек различных молекул. Путём водородных связей эти частицы удерживаются друг возле друга, таким образом формируя пространственную решётку (или структуру). Если в таком растворе будет содержаться фермент, то он удерживается такой структурой.
Иммобилизация фермента может осуществляться химическим способом: белок фермента прикрепляется химической связью к носителю и к соседнему ферменту, таким образом, образуя целые неподвижные цепочки больших размеров (снаружи - будто твёрдая частица). Соединённые таким способом ферменты в химических реакциях не соединяются с продуктами реакций. Кроме того, белок фермента менее подвержен денатурации из-за того, что его он теряет чрезмерную подвижность и к тому же в таком состоянии, как показали исследования, ферменты трудно разрушить.
Заказать 3D коврики EVA можно по каталогу нашего магазина

Перейти на английский
Use of enzymes
Обладая высокой степенью избирательности, ферменты используются живыми организмами для осуществления с высокой скоростью огромного разнообразия химических реакций; они сохраняют свою активность не только в микропространстве клетки, но и вне организма. Ферменты нашли широкое применение в таких отраслях промышленности, как хлебопечение, пивоварение, виноделие, чайное, кожевенное и меховое производства, сыроварение, кулинария (для обработки мяса) и т.д. В последние годы ферменты стали применять в тонкой химической индустрии для осуществления таких реакций органической химии, как окисление, восстановление, дезамини-рование, декарбоксилирование, дегидратация, конденсация, а также для разделения и выделения изомеров аминокислот L-ряда (при химическом синтезе образуются рацемические смеси L- и D-изомеров), которые используют в промышленности, сельском хозяйстве, медицине. Овладение тонкими механизмами действия ферментов, несомненно, предоставит неограниченные возможности получения в огромных количествах и с большой скоростью полезных веществ в лабораторных условиях почти со 100% выходом.
Разработаны проекты получения пищевых продуктов из целлюлозы, превращения ее с помощью иммобилизованных ферментов – целлюлаз – в глюкозу, которую можно превратить в пищевой продукт – крахмал. С помощью ферментной технологии в принципе можно также получить продукты питания, в частности углеводы, из жидкого горючего (нефти), расщепив его до глицеральдегида, и далее при участии ферментов синтезировать из него глюкозу и крахмал. Несомненно, имеет большое будущее моделирование при помощи инженерной энзимологии процесса фотосинтеза, т.е. природного процесса фиксации СО2; помимо иммобилизации, этот жизненно важный для всего человечества процесс потребует разработки новых оригинальных подходов и применения ряда специфических иммобилизованных коферментов.
В качестве примера иммобилизации ферментов и использования их в промышленности приводим схему непрерывного процесса получения аминокислоты аланина и регенерации кофермента (в частности, НАД) в модельной системе. В этой системе исходный субстрат (молочная кислота) подается при помощи насоса в камеру-реактор, содержащий иммобилизованные на декстране НАД + и две НАД-зависимые дегидрогеназы: лактат- и аланиндегидрогеназы; с противоположного конца реактора продукт реакции – аланин – удаляется с заданной скоростью методом ультрафильтрации.
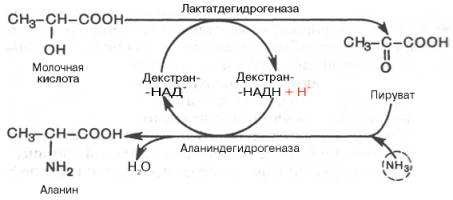
Не менее важными направлениями исследований являются иммобилизация клеток и создание методами генотехники (генного инженерного конструирования) промышленных штаммов микроорганизмов – продуцентов витаминов и незаменимых аминокислот. В качестве примера медицинского применения достижений биотехнологии можно привести иммобилизацию клеток щитовидной железы для определения тиреотропного гормона в биологических жидкостях или тканевых экстрактах. На очереди – создание биотехнологического способа получения некалорийных сластей, т.е. пищевых заменителей сахара, которые могут создавать ощущение сладости, не будучи высококалорийными. Одно из подобных перспективных веществ – аспартам, который представляет собой метиловый эфир дипептида – аспартилфенилаланина (см. ранее). Аспартам почти в 300 раз слаще сахара, безвреден и в организме расщепляется на естественно встречающиеся свободные аминокислоты: аспарагиновую кислоту (аспар-тат) и фенилаланин. Аспартам, несомненно, найдет широкое применение как в медицине, так и в пищевой промышленности (в США, например, его используют для детского питания и добавляют вместо сахара в диетическую кока-колу). Для производства аспартама методами генотехники необходимо получить не только свободную аспарагиновую кислоту и фе-нилаланин (предшественники), но и бактериальный фермент, катализирующий биосинтез этого дипептида.
Значение инженерной энзимологии, как и вообще биотехнологии, возрастет в будущем. По подсчетам специалистов, продукция всех биотехнологических процессов в химической, фармацевтической, пищевой промышленности, в медицине и сельском хозяйстве, полученная в течение одного года в мире, будет исчисляться десятками миллиардов долларов к 2000 г. В нашей стране уже к 2000 г. будет налажено получение методами генной инженерии L-треонина и витамина В2. Уже к 1998 г. предполагается производство ряда ферментов, антибиотиков, α1-, β-, γ-интерферонов; проходят клинические испытания препараты инсулина и гормона роста. Гибридомной техникой в стране налажен выпуск реактивов для иммуно-ферментных методов определения многих химических компонентов в биологических жидкостях.
Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи с чем их применение в промышленности выгодно с экономической и экологической точек зрения.
По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из более чем 2000 известных в настоящее время ферментов в промышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз, из которых 60 % составляют пептидогидролазы (в основном щелочные и нейтральные протеазы), использующиеся в качестве детергентов в производстве синтетических моющих средств, а 30 % — гликозидазы, применяющиеся в производстве кондитерских изделий, фруктовых и овощных соков. Ферменты находят применение в текстильной, кожевенной, целлюлозо-бумажной, медицинской, химической промышленности (табл. 4.1).
По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоами- лаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов.
Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление а-кетокислот в а-гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфатазу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных ферментативных реакций с участием алкогольоксидазы и катал азы дрожжей Hansenulla polimorpha и формальдегиддисмутазы бактерии Pseudomonas putidaпозволило осуществить окисление метанола в муравьиную кислоту с выходом 88 — 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе, в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 “С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине.
Применение ферментов

Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирозиназу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А.Я. Данилевским в 1886 г. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда протеолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых компонентов отходов под воздействием пептидогидролаз микроорганизмов. Данная технология, активно внедряющаяся во
Франции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод.
Важнейшую область применения ферментов в медицине составляет энзимодиагностика — тестирование патологии того или иного органа человека по уровню активности фермента или соотношению его множественных форм и изоферментов. Так, аспартатаминотрансфераза, изоцитратдегидрогеназа, лактатдегидрогеназа и альдолаза служат для выявления инфаркта миокарда; аланина- минотрансфераза, аспартатаминотрансфераза и лактатдегидрогеназа — для диагностики заболеваний печени; глутамилтрансфераза — для блокировки отторжения органов при их пересадке и т.д.
Таким образом, производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем ее отраслям, объем продукции которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы. Резкий рост этой индустрии наблюдается в США и Японии.
4.2. ИСТОЧНИКИ ФЕРМЕНТОВ
Ферменты присущи всем живым существам, однако для их выделения используют те природные объекты, в которых содержание искомого энзима составляет не менее 1 %. Для крупномасштабного получения ферментов пригодны только некоторые растительные организмы на определенной фазе их развития (проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений), а также отдельные ткани и органы животных (поджелудочная железа, слизистая оболочка желудочно-ки- шечното тракта, сычуг крупного рогатого скота, семенники половозрелых животных). Практически неограниченный источник ферментов — микроорганизмы (бактерии, грибы, дрожжи), содержащие набор большинства известных в настоящее время энзимов, количество которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
4.3. ТЕХНОЛОГИЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ – ПРОДУЦЕНТОВ ФЕРМЕНТОВ
В зависимости от источника технология получения ферментных препаратов имеет свои особенности. При извлечении ферментов из растительного сырья и животных тканей технология сводится к экстракции энзимов и очистке их от сопутствующих балластных веществ. Технология ферментных препаратов микробного происхождения более сложная, так как дополнительно включает этапы культивирования микроорганизмов — продуцентов ферментов, в том числе этапы получения посевного материала и производственной культуры соответствующего микроорганизма.
Для производства посевного материала используют исходный штамм продуцентов, получаемый из лабораторных чистых культур, который выращивают разными способами на предварительно стерилизованной твердой или жидкой питательной среде до определенного возраста. Посевной материал консервируют (высушиванием или хранением при низких температурах) вплоть до дальнейшего использования. Производственные культуры продуцента получают, выращивая посевной материал микроорганизмов как на поверхности твердых или жидких сред, так и в глубине жидких питательных сред.,
Поверхностный метод выращивания продуцентов, предложенный И.Такамине еще в 1894 г., состоит в культивировании микроорганизмов на поверхности увлажненных стерилизованных отрубей, размещенных в кюветах, к которым иногда добавляют солодовые ростки, древесные опилки, свекловичный жом. Инкубацию микроорганизмов ведут в специальном термостатируемом цехе при постепенном контроле в нем температуры, влажности и подачи воздуха.
В последние 15 лет для выращивания продуцентов ферментов; чаще используют более экономный — глубинный метод культивирования (рис. 4.1). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха. Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения инфекции в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокс-потенциала и другими условиями культивирования.

В настоящее время наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала. Размножение микроорганизмов и биосинтез фермента регулируют при использовании этого метода по мере поступления питательной смеси в ферментер. Такой ферментер представляет собой вращающийся трубкообразный реактор, через один конец которого в него поступает питательная среда и культура микроорганизмов, а из другого — выводятся ферменты, продукты жизнедеятельности и бактериальная масса. Основное достоинство метода — возможность длительное время поддерживать в автоматическом режиме рост культуры микроорганизма. Например, культура ацетонобутиловых бактерий находилась в таком реакторе в состоянии непрерывного размножения в течение 200 суток (И.Д.Иерусалимский с сотр., 1986).
Важнейшим фактором эффективности технологии ферментных препаратов является качество питательной среды. Основное требование к качеству питательной среды состоит в полноценности ее состава, обеспечивающей рост продуцента и биосинтез целевого фермента. Микроорганизмы нуждаются прежде всего в соединениях, содержащих углерод, азот, водород и кислород. К ним относятся органические вещества, соли аммония и вода. Кроме того, в состав питательной среды должны быть включены минеральные соединения, содержащие Mg, Са, Р, S, Fe, К и другие макро- и микроэлементы, витамины, ростовые вещества (биотин, инозит) и пр. Питательные среды в зависимости от состава делятся на синтетические и комплексные. Синтетическими считают те среды, которые состоят из определенного по качественному и количественному составу набора индивидуальных веществ. В комплексные среды входят различные природные продукты, часто отходы пищевых производств. К их числу относятся различные жмыхи, барда спиртовых заводов, картофельная мезга, кукурузный экстракт, меласса, отруби и прочие продукты. Благодаря использованию отходов комплексные питательные среды доступны, дешевы и обеспечивают безотходность биотехнологических производств.
4.4. ТЕХНОЛОГИЯ ВЫДЕЛЕНИЯ И ОЧИСТКИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Выделение и очистка фермента как из культуры микроорганизма (выращенного любым способом), так и из других природных источников весьма трудоемкая и дорогостоящая процедура, поэтому, если фермент можно использовать в виде неочищенного препарата, его не очищают. В промышленности широко применяют коммерческие препараты ферментов, чистота которых составляет всего 0,1 % (т.е. 99,9 % составляют примеси). К таким отраслям относятся спиртовая, кожевенная, текстильная промышленность, а также сельское хозяйство, производство бытовой химии. Например, ферментный препарат, употребляемый в пивоварении, представляет собой высушенную биомассу плесневых грибов. В большинстве отраслей пищевой промышленности, практике научных исследований и особенно в медицине используют только очищенные препараты ферментов, частично или полностью освобожденные от балластных веществ и полностью охарактеризованные в отношении их специфичности и физико-химических свойств. Исходным материалом для получения препаратов ферментов служат: биомасса продуцента, фильтрат культуральной жидкости, экстракт из культуры микроорганизма или из тканей и органов растений и животных, из которых готовят препараты различной степени очистки.
Неочищенные ферментные препараты получают путем высушивания в мягком режиме культуры микроорганизмов вместе с остатками питательной среды. Такие препараты получают и путем упаривания экстракта из культуры продуцента, выращенного поверхностным способом, или из фильтрата культуральной жидкости (в случае глубинного выращивания микроорганизмов). Распространен также метод ацетоновых порошков, состоящий в осаждении и быстром обезвоживании при температуре не выше -10 °С тканей или вытяжек из них, содержащих ферменты. Технические препараты ферментов представляют собой либо высушенные до порошкообразного состояния продукты, либо жидкие концентраты, обычно характеризующиеся 50 %-м содержанием сухой массы веществ.
Для успешного выделения ферментов из клеточного содержимого необходимо очень тонкое измельчение исходного материала вплоть до разрушения субклеточных структур: лизосом, митохондрий, ядер и др., которые имеют в своем составе многие индивидуальные ферменты. Для этого используют специальные мельницы и гомогенизаторы, а также ультразвук, метод попеременного замораживания и оттаивания ткани. Для высвобождения ферментов из мембранных структур клетки к гомогенатам добавляют небольшие количества детергентов (твин, тритон Х-100) или обрабатывают их энзимами — лизоцимом, целлюлазой, лецитиназой С. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, исключающих денатурацию белка (нейтральные значения рН, стабилизирующие добавки в виде белков, солей и специальных соединений).
Пример, иллюстрирующий получение частично очищенного препарата (3-галактозидазы из мутанта Е. coli, представлен на рис. 4.2.

Схема очистки включает отделение клеток микроорганизма по выходе их из ферментера от культуральной жидкости посредством центрифугирования и последующее разрушение клеток в гомогенизаторе высокого давления. Для освобождения белков от нуклеиновых кислот полученный гомогенат обрабатывают сульфатом марганца до конечной концентрации этой соли в смеси, равной 0,05 М. Осадок нуклеиновых кислот отделяется с помощью ротационной вакуум-фильтрации, а в образовавшийся фильтрат добавляют сульфат аммония до 45 % от его насыщения. Возникший осадок белков, содержащий бетта-галактозидазу, собирают с помощью центрифугирования или вакуум-фильтрации. Вся процедура очистки энзима от момента подачи бактерий в систему до момента получения осадка (3-галактозидазы занимает всего 1 ч.
В зависимости от свойств выделяемого фермента и сопутствующих ему балластных веществ при получении очищенных препаратов ферментов комбинируют различные приемы и методы (рис. 4.3), такие, как термическое фракционирование, осаждение органическими растворителями, солями и тяжелыми металлами, фильтрация на молекулярных ситах, ионообменная хроматография, электрофорез, изоэлектрофокусирование.
На заключительных этапах очистки часто используют аффинную хроматографию (биоспецифическая хроматография, хроматография по сродству), которая основана на способности ферментов избирательно связывать те или иные лиганды — субстраты, коферменты, конкурентные ингибиторы, аллостерические эффекторы и т.п. Такое связывание весьма специфично (Кs -4 М), что позволяет выделить тот или иной энзим из множества других белков. Например, из желудочного сока человека методом одноэтапной аффинной хроматографии выделена кислая липаза, использующаяся в заместительной терапии при заболеваниях печени.
Для синтеза аффинного сорбента, соответствующего специфичности данного фермента, лиганд (субстрат или его аналог) присоединяют к инертной матрице (макропористые гидрофильные гели, синтетические полимеры, неорганические носители). Для уменьшения пространственных трудностей при взаимодействии фермента с матрицей лиганд присоединяют к носителю через промежуточное звено (вставку, ножку, спейсер). Присоединение лигандов к поперечносшитой агарозе — сефарозе обычно проводят, активируя ее бромцианом (см. с. 91). Связывание с сефарозой, активированной бромцианом, л-амино-бензилянтарной кислотой, используемой в качестве лиганда, обеспечивает взаимодействие сорбента с каталитическим центром только карбоксипептидаз благодаря сходству лиганда с субстратами карбоксипептидазы:


Сорбенты, содержащие цибакрон голубой и некоторые другие красители антрахинонового ряда, используют для аффинной хроматографии НАД-зависимых дегидрогеназ, а носители, имеющие цикло- пептидный антибиотик грамицидин, — для протеолитических ферментов:

Таблица 4.2 Схема очистки глюкоамилазы из культуры Endomycopsisssp. 20-9 (по И.М.Грачевой, 1987)

В процессе выделения повышается доля фермента в массе тотальных белков, т.е. увеличивается его удельная активность. В табл. 4.2 представлены данные, характеризующие процедуру очистки от сопутствующих ферментов и балластных белков глюкоамилазы из культуры Endomycopsis ssp. 20-9. Анализ таблицы показывает, что чистота глюкоамилазы в препарате возросла в 37 раз и в полученном препарате отсутствует активность двух ферментов углеводного обмена — гликозилтрансферазы и а-амилазы.
В производственных условиях активность получаемого ферментного препарата оценивается количеством субстрата, преобразованного 1 мг (1кг) препарата при оптимальных условиях за 1 мин, и измеряется в Е/мг, моль/мг или каталах/кг белка.
Очищенные ферментные препараты хранят при низкой температуре (до -80 °С). Для стабилизации ферментов в их препараты добавляют коферменты и субстраты. Ферментные препараты для промышленного применения стабилизируют, добавляя глицерин, моносахариды, дисахариды (глюкоза, сахароза, лактоза), HS-co- единения (цистеин, глутатион, меркаптоэтанол, дитиотреитол и др.), отдельные аминокислоты, желатину и другие белки-наполнители.
Существенно, что из 2003 включенных в список известных в настоящее время ферментов более 1500 выделено и в той или иной степени очищено; это служит не только базой для изучения физико-химических основ ферментативного катализа, но и фундаментом для совершенствования химического производства и промышленности.
4.5. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ, ЕЕ ЗАДАЧИ
Развитие прикладной энзимологии долгое время сдерживалось дороговизной чистых ферментных препаратов, неустойчивостью их при хранении и невозможностью многократного использования. Принципиально новые перспективы открылись перед прикладной энзимологией в 60-е годы XX в. в результате появления на стыке химии и биологии новой отрасли — инженерной энзимологии. Ее задачи заключаются в развитии прогрессивных методов выделения ферментов, их стабилизации и иммобилизации; конструировании катализаторов с нужными свойствами и разработке научных основ их применения.
В частности, методами белковой инженерии, сущность которых состоит в изменении первичной структуры природной молекулы фермента посредством химической модификации самого; энзима или его гена, удается принципиально трансформировать структуру активного центра и его функцию, модулировать субстратную специфичность и физико-химические свойства фермента. Так, замена остатка глутамина-102 в молекуле лактатдегидрогеназы на аргинин превратила фермент в высокоактивную малатдегидрогеназу. Описанным способом получены термостабильные формы лизоцима Т-4 и субтилизина (каталитическая константа субтилизина изменена в 100 раз), созданы гибридные формы ферментной системы, ценной в иммуноферментном анализе, сочетающие в себе свойства бета-галактозидазы и бета-галактокиназы.
Многие проблемы технологии синтеза органических соединений, пищевой и медицинской промышленности, мониторинга человека и окружающей среды, защиты окружающей среды, энергетики не могут быть решены без использования методов современной инженерной энзимологии.
Важным этапом развития инженерной энзимологии стала разработка способов получения и использования иммобилизованных ферментов.
Читайте также:

