Сообщение о раковых клетках
Обновлено: 08.07.2024
История онкологии началась с незапамятных времён. Первые систематические попытки лечения опухолей предпринимались ещё в Древнем мире. С тех пор прошло несколько тысячелетий, но и сейчас в подавляющем большинстве случаев полное излечение злокачественных новообразований недостижимо. Однако теперь мы хотя бы знаем, что за преграда не даёт нам достигнуть заветной цели. Раковые стволовые клетки, практически никому не известные ещё каких-нибудь пятнадцать лет назад, сегодня оказались в центре внимания учёных. Выяснилось, что буквально все клинические проблемы, от устойчивости онкологических заболеваний к различным препаратам до фатальных рецидивов спустя десятилетия после кажущегося исцеления, связаны с этими клетками.
Модель раковых стволовых клеток (РСК) подразумевает, что любое злокачественное новообразование (неоплазия) развивается из одной клетки. В результате неких событий генетический аппарат некогда нормальной клетки трансформируется настолько, что происходит её перерождение в инициирующую раковую клетку. В результате последующей пролиферации (деления) этой клетки формируется злокачественная опухоль. Согласно концепции РСК, эта опухоль устроена иерархически, то есть разные типы раковых клеток обладают разной способностью к делению.
Раковые стволовые клетки составляют лишь небольшую популяцию опухолевых клеток. Однако, будучи истинно стволовыми клетками, они (и только они) способны к неограниченному числу делений и постоянному самовоспроизведению. Число делений остальных клеток, если они способны к пролиферации (то есть формально обладают неким стволовым потенциалом), строго ограничено.
В основе процесса самовоспроизведения РСК лежит так называемый асимметричный тип деления стволовых клеток, который заключается в том, что родительская стволовая клетка даёт начало двум клеткам. Одна из них — с такими же стволовыми свойствами, что и материнская, другая же способна к ограниченному числу делений и поэтому называется частично дифференцированной, временно пролиферирующей раковой клеткой. Конечные потомки таких клеток — раковые клетки, не способные к делению. Их называют терминально дифференцированными. Соответственно иерархия опухолевой ткани выглядит так: раковые стволовые клетки → временно пролиферирующие раковые клетки → терминально дифференцированные раковые клетки. Два последних типа клеток образуют при этом основную массу опухоли.
Точно такая же иерархия имеет место и в нормальных тканях, стволовые клетки которых, способные к самовоспроизведению и поддержанию собственной популяции, также дают начало ограниченно пролиферирующим клеткам — предшественникам зрелых клеток. Эти зрелые тканевые клетки не способны к делению вовсе и погибают через какое-то время после выполнения свойственных им функций.
Итак, согласно модели раковых стволовых клеток, не все опухолевые клетки обладают равной способностью к делению и самовоспроизведению. И несмотря на то что основная масса опухоли состоит из злокачественных клеток той или иной степени дифференцировки, её рост и развитие определяются небольшой по численности, но наивысшей в иерархии популяцией раковых стволовых клеток.
Cловарик к статье
Клеточная дифференцировка — процесс клеточной дифференцировки заключается в так называемом созревании стволовой клетки-предшественника в клетку со строго определённым фенотипом (например, кардиомиоцит или пирамидный нейрон), называемую дифференцированной.
Пролиферация (от лат. proles — отпрыск, потомство и fero — несу) — разрастание ткани организма путём размножения клеток делением.
Репарация ДНК — внутриклеточная молекулярная система восстановления исходной последовательности ДНК после её повреждений.
Стохастический (от греч. στοχαστικός — умеющий угадывать) означает неопределённость, случайность чего-либо.
Фенотип (от греческого слова phainotip — являю, обнаруживаю) — совокупность характеристик, присущих индивиду на определённой стадии развития (особенности строения и жизнедеятельности).
Упреждая аргументы критиков РСК-модели, следует отметить, что некоторые злокачественные новообразования не вписываются в эту модель, а, скорее, соответствуют модели клональной эволюции. Есть виды неоплазий, при которых могут встречаться разные популяции раковых стволовых клеток, имеющих разные хромосомные нарушения. Хрестоматийные примеры таких новообразований — хроническая миелоидная лейкемия и колоректальный рак. В этих случаях РСК-модель не может полностью описать развитие опухоли, так как в соответствии с ней все клетки опухоли — потомки одной инициирующей РСК. Здесь же возможна либо инициация опухоли сразу из нескольких злокачественных стволовых клеток, формирующих несколько генетически различающихся клонов, либо эволюция одного клона из другого за счёт последовательного накопления генетических нарушений. Разные клоны могут обладать разной злокачественностью и соответственно могут конкурировать за ресурсы. Иными словами, будет проходить эволюция опухолевых клонов.
Некоторые новообразования, отличающиеся экстремальной злокачественностью, также больше соответствуют модели клональной эволюции, нежели иерархической модели РСК. К ним относятся, например, различные злокачественные меланомы, при которых доля активно делящихся раковых клеток составляет чуть ли не более половины опухолевой массы. При этом в пределах одной опухоли сосуществуют РСК с различными фенотипами, которые при различных воздействиях на опухоль могут легко превращаться один в другой. Очевидно, что и для этих случаев РСК-модель не вполне подходит.
Однако, как можно заметить, в современной интерпретации модели клональной эволюции центральная роль инициирующих раковых стволовых клеток в запуске развития злокачественного новообразования ни в коей мере не оспаривается. Дискуссии продолжаются лишь относительно тех или иных сценариев развития опухоли * . А коли так, мы со спокойной совестью можем говорить о раковых стволовых клетках.
Более полувека спустя, в 1930-х годах, теория зародышевого остатка получила новый импульс. Гистологические наблюдения одной из опухолей мозга — медуллобластомы — показали, что её клетки морфологически очень напоминают клетки эмбрионального мозжечка, на основании чего было выдвинуто предположение, что эта форма опухолей мозга развивается из зародышевого остатка, состоящего из медуллобластов, утративших способность к дифференцировке.
Очередной значительный шаг на пути к концепции раковых стволовых клеток сделан в середине прошлого века. Исследования различных миелопролиферативных заболеваний (особой группы злокачественных новообразований, развившихся из клеток крови ** ) показали, что в развитие данной группы заболеваний могут быть вовлечены все ветви гемопоэза, за исключением лимфоидных ростков. Это послужило основанием для предположения, что все указанные патологии связаны со злокачественным перерождением клеток — предшественников всех остальных клеток миелоидного ряда, теперь известных как миелоидные cтволовые клетки.
А уже в 1960 году Питер Ноуэл (Peter Nowell) и Дэвид Хангерфорд (David Hungerford) открыли уникальную взаимосвязь так называемой филадельфийской хромосомы с одним из миелопролиферативных заболеваний — хронической миелоидной лейкемией. Филадельфийская хромосома — следствие хромосомной аномалии, которая приводит к образованию мутантного белка BCR-ABL1. К несчастью, этот мутантный белок сохраняет способность одного из своих родительских белков (ABL) к передаче пролиферативного (стимулирующего деление клетки) сигнала внутрь клетки. Более того, он передаёт сигналы гораздо интенсивнее и при этом делится вне зависимости от внешних сигналов. В результате клетки, несущие такую мутацию, начинают быстро и неконтролируемо делиться. В дальнейшем наличие филадельфийской хромосомы при этом заболевании было подтверждено во всех клетках, не относящихся к лимфоидному ряду, на основании чего выдвинули гипотезу о происхождении всех клонов лейкемических клеток от одного предшественника.

Питер Ноуэлл (университет Пенсильвании, США, на фото — слева) и Дэвид Хангерфорд (Фокс Чэйс Раковый центр при Институте исследования рака, США) — первооткрыватели филадельфийской хромосомы (1960).
Как видно, модель клональной эволюции подразумевает, что одни раковые клоны отличаются большей злокачественностью, другие — меньшей, но в целом все они обладают сопоставимой способностью к делению. И в этом заключается принципиальное отличие стохастической теории канцерогенеза от иерархической теории, которая базируется на модели раковых стволовых клеток.
Тем не менее, как уже было упомянуто выше, модель клональной эволюции до сих пор не потеряла своей актуальности, поскольку в несколько большей степени, нежели модель РСК, объясняет развитие нескольких типов новообразований.
Долгое время концепция РСК находилась на вторых ролях. Однако в 1997 году Доминик Бонне (Dominique Bonnet, London Research Institute) и Джон Дик (John Dick, Toronto General Research Institute) продемонстрировали, что единичные лейкемические стволовые клетки, взятые у пациентов с острой миелоидной лейкемией, при трансплантации мышам дают начало полному спектру клеток с различными злокачественными фенотипами, наблюдаемыми при этом заболевании у человека. После этой работы число исследований, посвящённых РСК, стало лавинообразно нарастать.
В начале 2000-х годов раковые стволовые клетки были идентифицированы и в солидных опухолях (при одной из форм рака молочной железы). На сегодняшний день РСК описаны для абсолютного большинства форм онкологических заболеваний, и с этими клетками связывают все основные клинические проблемы в онкологии.
Поскольку любое новообразование может развиться только из активно делящейся клетки, наиболее подходящие кандидаты для злокачественной трансформации — нормальные тканевые стволовые клетки (дающие начало полностью дифференцированным клеткам, выполняющим свои узкоспецифические задачи в том или ином типе тканей), так как они обладают длительным сроком жизни и высокой скоростью деления. В соответствии с этим концепция РСК подразумевает, что инициирующее событие в канцерогенезе — злокачественное перерождение нормальных тканевых стволовых клеток *** , которые становятся инициирующими РСК.

Схематическое изображение возможных механизмов гетерогенности опухолевых клеток. Внизу — фенотипические различия раковых клеток первичной опухоли и метастазов. Схема сильно упрощена, поскольку не учитывает фенотипические различия между вторичными метастатическими РСК и первичными инициирующими РСК. Вверху — схема путей генерации опухолевой гетерогенности. Рисунок автора
Ещё одна неприятная особенность раковых стволовых клеток — их чрезвычайная устойчивость ко всем известным видам лечения. Какой бы вид противоопухолевой терапии ни применялся (радио-, химио-, иммунотерапия, таргетная), РСК будут погибать последними, когда все дифференцированные раковые клетки уже успешно побеждены.
Известно несколько механизмов терапевтической устойчивости РСК. Во-первых, РСК характеризуются повышенной экспрессией транспортных белков семейства ABC (ATP-binding cassette). Это эволюционно консервативные белки, присутствующие у всех организмов — от бактерий до человека. В норме они локализуются преимущественно в плазматической мембране клеток и отвечают за транспорт полезных веществ (например, витаминов) в клетку и выведение из неё вредных токсинов и ксенобиотиков. В РСК эти белки экспрессируются на особенно высоком уровне и отвечают за выведение из них различных химиотерапевтических препаратов.
Во-вторых, РСК, как никакие другие клетки, отличаются обилием фермента альдегид-дегидрогеназы (ALDH). В норме функция этого белка — окисление токсичных для организма альдегидов до карбоновых кислот. В РСК же он отвечает за инактивацию многих химиотерапевтических препаратов.
Это основные, но далеко не все механизмы устойчивости РСК. В тех же случаях, когда системы резистентности РСК к терапии дают сбой, раковые стволовые клетки впадают в дормантность (состояние покоя), в которой они могут пребывать несколько десятилетий, после чего активируются и обусловливают скоротечный фатальный рецидив. Дормантные РСК отличаются очень низким уровнем метаболизма, экстремальной устойчивостью к повреждающим воздействиям и практически не экспрессируют поверхностные белки, которые могли бы послужить мишенями для создания таргетных препаратов. На сегодняшний день дормантные РСК представляют собой наибольшую трудность для лечения. Однако надежда на успех есть. Во-первых, испытываются и неплохо себя проявляют различные сложные комбинации уже существующих таргетных препаратов. Во-вторых, удалось вплотную приблизиться к получению препаратов, воздействующих на процессы, лежащие в основе образования вторичных метастатических РСК. В-третьих, обнаружены белки, отвечающие за дормантность РСК и обеспечение их жизнеспособности в состоянии покоя. Наконец, разрабатываются препараты, способствующие выходу РСК из дормантности, что делает их более чувствительными к существующим формам терапии.
• Раковым клеткам присущи несколько определенных свойств
• В отличие от здоровых клеток, при росте на чашках Петри, при контакте с окружающими клетками раковые не прекращают деление
• Для поддержания роста и пролиферации для раковых клеток характерна пониженная потребность в ростовых факторах
• В отличие от здоровых, раковые клетки, растущие в культуре не нуждаются в прикреплении к физическим субстратам — эта независимость роста от фиксации с поверхностью является их характерной чертой
• В отличие от культуры здоровых клеток, у которые деление останавливается через определенное количество циклов, раковые клетки бессмертны и поэтому после образования определенного числа поколений клеток не прекращают деления
• Для раковых клеток часто характерны хромосомные аберрации, в том числе, изменение числа хромосом и их структуры
Годами исследователи описывали специфические особенности раковых клеток. Они суммированы в таблице ниже. Многие эти особенности лучше изучать, выращивая клетки в культуре (in vitro), чем исследовать ткани организма (in vivo). Большинство раковых клеток удобно выращивать в чашках Петри. В то же время многие типы здоровых клеток гораздо труднее растить in vitro.
Здоровые клетки, помещенные в чашку Петри с питательной средой, оседают на дно и делятся до тех пор, пока не заполнят все дно, после чего их рост прекращается. Этот феномен носит название контактное торможение и означает, что при контакте клеток друг с другом механизм пролиферации выключается. Поэтому нормальные клетки образуют слой, толщина которого соответствует одной клетке, т. е. монослой. Когда слой клеток полностью покрывает дно чашки Петри, он называется конфлуентным монослоем.
Раковые клетки ведут себя совершенно другим образом. На рисунке ниже показано, что, когда они растут на чашках Петри, их рост продолжается в течение долгого времени после того, как они образовали межклеточные контакты. Невозможность прекратить деление приводит к тому, что клетки начинают образовывать слои на поверхности друг у друга.
Если раковые клетки растут среди большого количества нормальных клеток на чашках Петри, то в конце концов их потомки образуют плотные скопления клеток, окруженные монослоем здоровых клеток, которые называются фокусы. Количество таких фокусов легко подсчитать даже невооруженным глазом. Таким образом, биологи легко подсчитывают число клонов трансформированных клеток, находящихся в популяции здоровых.

Потеря контактного торможения является не единственным отличительным свойством раковых клеток. Когда суспензия этих клеток смешивается с агаровом гелем и помещается в чашку Петри, они образуют сферические колонии. Напротив, здоровые клетки не способны расти в суспензии, и для того, чтобы они начали размножаться, они должны прочно прикрепиться к поверхности дна чашки Петри. Поэтому для здоровых клеток характерен прикрепленный рост, в отличие от раковых клеток, рост которых не зависит от прикрепления.
К числу клеток, легко культивируемых in vitro, относятся клетки соединительной ткани, называемые фибробластами. Когда культуру фибробластов, растущую в чашках Петри, по мере достижения конфлуентности пересаживают в другие чашки, клетки продолжают расти и делиться, но по прошествии определенного времени прекращают пролиферировать. Прекращение роста означает, что клетки каким-то образом способны ограничивать количество циклов деления и что, когда линия клеток исчерпывает отпущенное число циклов деления, рост ее останавливается.
Это происходит даже несмотря на то, что окружающие условия остаются оптимальными для пролиферации. Об этом свидетельствуют наблюдения, согласно которым, в зависимости от типа клеток и их источника (организма), пролиферация останавливается после образования 30, 40 или 50 поколений клеток.
Рисунок ниже иллюстрирует это положение. По сравнению со здоровыми клетками, раковые представляют собой полный контраст. Адаптировавшись к условиям культивации, они способны к бесконечной пролиферации и, таким образом, являются иммортализованными.
Культуры раковых клеток также обладают другими особенностями, которые отличают их от здоровых клеток. При выращивании культуры здоровых клеток они нуждаются в питательных добавках, представляющих собой больше чем просто питательные компоненты (аминокислоты, глюкоза, витамины). Питательная среда должна также содержать сыворотку, полученную из телячьей крови. Эта сыворотка содержит ростовые факторы (GF), представляющие собой белки, которые выделяются одними клетками для поддержания роста других.
Один из распространенных ростовых факторов сыворотки, тромбоцитарный фактор роста (PDGF), выходит из тромбоцитов в процессе свертывания крови, наступающего после повреждения тканей. Обычно при высвобождении PDGF на участке раневой поверхности он оказывает стимулирующее действие на рост соседних фибробластов, которые затем участвуют в регенерации ткани. Аналогичным образом, присутствие фактора в ростовой среде необходимо для стимуляции роста фибробластов на чашках Петри; без добавления PDGF клетки в течение недель остаются жизнеспособными не не делятся и не растут.
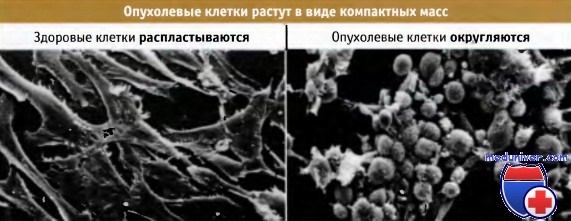
В сканирующем электронном микроскопе видно,
что здоровые клетки распластываются и образуют длинные выросты,
в то время как опухолевые клетки округляются и образуют плотные компактные массы.
Для роста различных типов эпителиальных клеток в культуре необходимы другие ростовые факторы, например такие, как эпидермальный ростовой фактор (EGF). На рисунке ниже представлены механизмы действия ростовых факторов.
Фактически все типы здоровых клеток для стимуляции своего размножения требуют присутствия в среде одного или нескольких ростовых факторов. Это наблюдение привело к важному заключению, касающемуся биологических характеристик большинства клеток: они не пролиферируют, если отсутствует индуцирующий внешний стимул, особенно относящийся к сигалам, передаваемым с помощью GF, присутствующего в окружающей среде. Этот вывод совершенно неприложим к раковым клеткам, и для них необходимы существенно меньшие концентрации GF, чем для здоровых клеток.
Раковые клетки способны сами стимулировать свою пролиферацию, рост и деление, и поэтому в основном не зависят от экзогенных ростовых сигналов.
Важно, что раковые клетки редко становятся совершенно независимыми от внешних ростовых факторов. Гораздо чаще они сохраняют зависимость от определенных клеточных факторов, которые необходимы для пролиферации соответствующего типа здоровых клеток. Так, для роста большинства типов опухолей молочной железы необходимы эстрогены, а для роста опухолей предстательной железы, андрогены. (Хотя обычно считают, что оба агента относятся к гормонам, они регулируют пролиферацию раковых клеток, функционируя как ростовые факторы.) Также для поддержания выживаемости многих типов раковых клеток человека необходим инсулиноподобный фактор роста 1(IGF-1).
В отличие от PDGF и EGF, которые стимулируют рост, некоторые внеклеточные факторы ингибируют пролиферацию клеток. К числу наиболее изученных факторов такого рода относится TGF-b, проявляющий мощное ингибирующее действие на пролиферацию различных типов эпителиальных клеток. По своему действию он напоминает GF с отрицательным эффектом (из-за способности индуцировать неприкрепленный рост некоторых клеток, он получил свое первоначальное название фактора роста опухоли). Опять-таки, в отличие от здоровых, раковые клетки по-разному реагируют на присутствие этого фактора.
Многие из них выработали способность противостоять ингибирующему эффекту TGF-b и продолжают делиться в присутствии довольно значительных концентраций этого GF с отрицательным эффектом.
Таким образом, раковые клетки проявляют неодинаковое отношение к сигнальным молекулам, присутствующим во внешнем окружении. Они относительно независимы от экзогенных сигналов, стимулирующих рост, и в то же время вырабатывают устойчивость к сигналам, его подавляющим. Такое отношение к сигнальным молекулам позволяет сделать общий вывод, касающийся биологии раковой клетки: эти клетки теряют связь с сигнальными молекулами, присутствующими в их окружении (а именно с положительно и отрицательно действующими GF).
Еще одна важная особенность раковых клеток заключается в том, что они часто характеризуются аберрантным хромосомным набором: некоторые хромосомы отсутствуют, другие присутствуют в избыточном количестве, а при объединении сегментов нормальных хромосом образуются необычные хромосомы. Такая аномалия хромосом, называемая анеуплоидией, контрастирует с нормальной картиной хромосомного набора, характерной для здоровых клеток — эуплоидией. На рисунке ниже показана микрофотография анеуплоидной опухолевой клетки, полученная после флуоресцентной гибридизации in situ.
Суммируя все вышесказанное, можно прийти к выводу, что раковым клеткам свойственно значительное количество различных аномалий. Однако перечисленными их особенностями список не исчерпывается. Необходимо учитывать, что раковые и здоровые клетки разделяют также ряд общих черт, что часто делает очень трудной задачу их избирательного уничтожения, не затрагивая при этом здоровые.
Рост популяции здоровых клеток прекращается через 30-40 удвоений.
После этого популяция вступает в т.н. фазу покоя. Типичная схема внутриклеточных событий при пе редаче сигнала.
Лиганд (в данном случае PDGF) связывается рецептором и активирует каскад внутриклеточных событий,
при водящий к изменению состояния клетки.
Основными сигнальны ми процессами в клетке является фосфорилирование белков, также гидролиз липидов и ГТФ. На этой микрофотографии показан препарат хромосом клетки одного из колоректальных раков.
Хромосомы окрашены с помощью специфических гибридизационных зондов, меченных различными флуорохромами,
которые позволяют визуализировать дефекты их структуры и количества.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Раковая опухоль является чрезвычайно сложным заболеванием. Чтобы понять процесс образования и развития раковых опухолей, сначала необходимо разобраться, как функционируют клетки нашего тела. Проще говоря, рак является заболеванием, вызванным неконтролируемым размножением клеток.
Образование и развитие раковых опухолей
Большинство клеток, ставшими непригодными для дальнейшего функционирования, просто отмирает, и затем их остатки удаляются при помощи специальных клеточных механизмов. Этот нормальный процесс отмирания клеток и удаления их остатков, называемый апоптозом, постоянно осуществляется в организме.
Если клетка подвергается мутации, то определенные соединения, ответственные за проверку сохранности ДНК, могут активировать апоптоз. За счет этого защитного механизма организм избавляется от сбойных и аномальных клеток. Проблема в том, что некоторые мутировавшие клетки могут терять способность к апоптозу, что может приводить к развитию рака. Отталкиваясь от этого, медики стремятся разработать препараты, активизирующие механизмы апоптоза в таких сбойных клетках и тем самым препятствующие образованию раковых опухолей.
Поведение раковых клеток
Раковые клетки, в отличие от здоровых, делятся неконтролируемо, им больше не контролируют внутренние и внешние клеточные механизмы, управляющие этим процессом в норме. Независимо от того, каким образом клетка стала злокачественной, в основе ее раковой природы лежит ее неконтролируемое деление. К счастью, множество механизмов служит для предотвращения трансформации клетки в злокачественную форму. Для образования раковой опухоли требуется сбой сразу нескольких механизмов (сбой механизма контроля деления, нарушение клеточного цикла, развитие способности проникать в окружающие ткани и метастазировать в другие части тела).
Для того чтобы клетка стала раковой, требуются многочисленные мутации в геноме. В ходе развития раковой опухоли отмечается появление способности раковых клеток распространяться внутри нормальной ткани, в которой они изначально возникли. Также у них может появиться способность метастазировать. Наиболее часто образование метастаз отмечается в лимфатических узлах, легких, печени, костной ткани и мозге. В последнем случае наблюдаются раковые опухоли мозга.
Потеря клеткой способности к контролю собственного деления может происходить не только по причине сбоев в ходе митоза. Клетки могут содержать онковирусы, которые зачастую вредоносно влияют на функционирование клеточных белков. Это может приводить к нарушению механизмов митоза. Женщины, зараженные ВПЧ, характеризуется повышенным риском развития раковой опухоли матки, так как этот вирус противодействуют нормальному функционированию клеток данного органа.
Взаимодействие нормальных и сбойных клеток в ходе развития раковой опухоли
Раковая клетка характеризуется сложным окружением в виде других клеток и тканей. Специфика раковых клеток накладывает отпечаток на их взаимодействие с окружающими тканями. Например, при раковой опухоли молочной железы они соседствуют с нормальными клетками различных типов (соединительные, железистые и т.д.). Однако при раковой опухоли груди здоровые клетки характеризуются намного большей уязвимостью по сравнению с раковыми. В частности, раковые клетки не отмирают в отличие от нормальных при потере контакта с базальной мембраной молочной железы, то есть они более жизнестойки.
Проблема осложняется тем, что воспалительные процессы в тканях порой создают благоприятные условия для развития и образования раковых опухолей. Этот механизм зачастую используются в лечении раковых опухолей и их профилактике. Например, химиопрофилактика, снижая воспалительный процесс в целевой ткани, уменьшает риска развития раковой опухоли желудка, толстого кишечника и других онкологических заболеваний.
Симптомы раковых опухолей
Невозможно привести полный перечень признаков и симптомов, указывающих на наличие раковой опухоли. Это обусловлено тем, что существует более 200 различных типов рака, поражающих разнообразные органы и системы организма, что приводит к чрезвычайно широкому спектру проявлений этого заболевания. В случае наличия подозрения на рак следует безотлагательно обратиться к врачу, ведь раковые заболевания эффективнее лечить на ранних стадиях. Ниже приведены некоторые примеры, которые в случае присутствия у пациента на протяжении более 2 недель, могут свидетельствовать о вероятности раковой опухоли:
- изменения ритма опорожнения мочевого пузыря и кишечника;
- наличие незаживающих язв в ротовой полости или на коже;
- присутствие любой формы необычного кровотечения или выделения из вагины, заднего прохода, мочевого пузыря или молочных желез;
- уплотнение или образование сгустко в в молочных железах, в семенниках или других частях тела;
- расстройство пищеварения или проблемы с глотанием;
- различимые изменения в размерах , форме и окраске родинок и бородавок;
- непрекращающийся кашель , осиплость или потеря голоса.
Диагностика раковых опухолей
При обнаружении опухолевидных структур требуется уточнение их природы, являются ли они злокачественными или доброкачественными. Для этого может использоваться биопсия, а также различные инструментальные и биохимические методы исследования. В случае обнаружения злокачественной природы опухоли могут быть назначены дополнительные виды диагностики раковых опухолей.
Именование определенного типа рака осуществляется на основании органа его исходной локализации. Даже если рак пускает метастазы в другие части тела, название не меняется. Например, при раковой опухоли груди говорят именно о раке груди, даже если метастазы обнаруживаются в легких. Рак простаты, распространившийся в костную ткань, называется метастатическим раком простаты.
К другим, широко распространенным типам рака относится карцинома, саркома и лимфома. Названия этих типов рака также соответствуют их начальной локализации в организме. Карцинома является общим термином для опухолей, возникших в эпителиальных тканях, например, в коже или слизистой таких органов, как матка и легкие. То есть сказать, что у женщины имеется раковая опухоль матки, это то же самое, как если заявить, что у нее карцинома матки. Аналогично, раковая опухоль желудка может именоваться карциномой желудка.
Опухоли, возникающие в соединительной ткани, например, в мышечной или костной, называются саркомами. Первичные раковые опухоли мозга называются глиомами, а злокачественные образования, возникшие в лимфатической системе — лимфомами. Опухоли, локализующиеся в костном мозге, называются лейкемиями.
Скрининг и диагностика раковых опухолей
Одной из причин, по которым доктора рекомендуют проходить плановые медицинские проверки, заключается в возможности обнаружения опухолевидных структур на ранних стадиях. Регулярный скрининг позволяет повысить выявление раковых опухолей на ранних стадиях заболевания. Раковая опухоль, будучи выявлена на ранних стадиях заболевания, обычно легче поддается лечению.
Если в ходе стандартного медицинского осмотра у доктора возникают подозрения, что он обнаружил раковую опухоль, то он может назначить цервикальный мазок (для выявления раковой опухоли матки), маммограмму (в целях диагностики раковой опухоли груди) и другие виды анализов. Для оценки рисков развития рака простаты может быть назначен анализ крови, а для диагностики раковых опухолей легких применяется спиральное КТ-сканирование.
Возраст человека, семейный анамнез и характер профессиональной деятельности могут в значительной степени определять рекомендуемую частоту плановых медицинских освидетельствований для диагностики раковых опухолей. В случае отклонения результатов диагностики от нормы требуется их внимательное изучение и назначение уточняющих видов обследования.
Например, результаты цервикального мазка могут указывать на присутствие в шейке матки аномальных клеток. Гинекологические исследования показывают, что со временем эти клетки могут привести к раковой опухоли шейки матки, однако это происходит не всегда. В таких случаях гинеколог может порекомендовать более частую сдачу цервикальных мазков в целях отслеживания ситуации и заблаговременной диагностики. В некоторых случаях цервикальный мазок может выявить раковые клетки на шейке матки. После этого обычно назначаются анализы для стадирования раковой опухоли или биопсия.
Некоторые люди обращаются к врачу при наличии определенных симптомов, говорящих о риске образования раковой опухоли (уплотнение в груди, изменения цвета или размера родинки, сильные головные боли и т. д.). В случае, когда доктор посчитает, что такие симптомы могут быть вызваны образованием раковых опухолей, может быть назначена биопсия — процедура, используемая для диагностики раковых опухолей. Если биопсия покажет наличие раковых клеток во взятом образце, то затем проводится стадирование раковой опухоли. Стадирование заключается в уточнении расположения раковой опухоли, ее стадии и влияния на организм. Следует отметить три важных момента, касающиеся диагностики:
- не для всех типов раковых опухолей разработаны качественные методы скрининга;
- даже при качественном скрининге при некоторых типах раковых опухолей ранняя диагностика не всегда успешна;
- патологические изменения, выявленные в ходе скрининговой диагностики, не всегда относятся к раковым опухолям.
Диагностика клинической стадии
Клиническая стадия раковой опухоли устанавливается на основании медицинского освидетельствования, анализов крови и инструментальных методов обследования. Эти меры необходимы для диагностики стадии заболевания, выработки подходящего лечения раковой опухоли и выдачи прогноза. В некоторых случаях для корректной диагностики может потребоваться проведение биопсии. Список, приведенный ниже, указывает на некоторые особенности проведения диагностики раковых опухолей:
- Подозрительные припухлости или аномальные участки могут быть полностью изъяты в ходе биопсии (например, определенный лимфатический узел или язва на коже).
- Биопсия может включать взятие образцы клеток из глубоко расположенной опухлости (например, при подозрении на раковую опухоль в молочной железе).
- Иногда в целях диагностики используется эндоскоп, для забора небольшого фрагмента ткани из определенного органа. Например, при подозрении на раковую опухоль желудка может применяться гастроскоп, вводимый в полость этого органа с целью взятие образца ткани.
- При подозрении на лейкемию забор клеток производится из костного мозга.
- В диагностике раковых опухолей иногда применяется анализ образцов мочи или мокроты на присутствие в них раковых клеток.
Биомаркеры
Биохимическая структура, характеризующая определенное заболевание или эффективность его лечения, называются биомаркером. Простатспецифический антиген является биомаркером на присутствие рака простаты. Если после проведения антиангиогенной терапии в образцах пациента выявляется снижение биомаркера VEGF, то обычно это свидетельствует об эффективности лечения раковой опухоли.
Различные виды анализов крови позволяют выявить присутствие в ней определенных биомаркеров, активно синтезируемых раковыми клетками. В норме маркеры присутствуют в крови в незначительном количестве. Увеличение концентрации определенного маркера может говорить об образовании раковых опухолей определенного типа. Анализы на биомаркеры также применяются в процессе лечения раковых опухолей, чтобы определить эффективность применяемой терапии. Ученые постоянно ведут исследования с целью выявления новых биомаркеров. Ниже приведён перечень аббревиатур некоторых наиболее распространенных онкомаркеров и некоторые примеры соответствующих им форм рака:
- CEA — раковая опухоль в молочной железе, раковая опухоль желудка;
- CA 19-9 — раковая опухоль желудка;
- AFP и beta-HCG — герминогенные опухоли;
- OC-125 — карцинома яичника;
- PSA — рак простаты.
Заключение
Рак является сложным заболеванием, принимающим множественные формы. Большое значение имеет своевременное выявления раковых опухолей на ранних стадиях. Для выработки окончательного формата лечения необходимо проведение всего комплекса обследований для обеспечения адекватной диагностики этого заболевания.

Обзор
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
Автор
Редакторы



Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Важными факторами, вызывающими мутации и провоцирующими раковое перерождение, являются ионизирующее излучение, воздействие ультрафиолетовых лучей, влияние цитотоксических веществ, повреждающих ДНК (к ним относятся наркотические вещества и некоторые лекарственные препараты — например, цисплатин, повреждающий структуру двойной спирали) и органические яды.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Протоонкогены
Основные изменения, происходящие с протоонкогенами:

Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Биохимические продукты онкогенов
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
- Факторы роста. Раковые клетки продуцируют белки, способные вызывать пролиферацию и дифференцировку клеток. Наиболее известным фактором роста является HER2, кодируемый геном ERBB2. Мутации и гиперэкспрессия этого гена обнаружены при раке молочной железы и ассоциированы с крайней агрессивностью опухоли. Суперэкспрессия гена приводит к запуску белковых каскадов, ответственных за клеточное деление. Постоянные сигналы к делению вызывают неконтролируемую пролиферативную активность клеток и их злокачественное перерождение.
- ГТФ-связывающие белки. Гуанозинтрифосфат-связывающие белки участвуют во многих клеточных процессах: передача сигналов, транспорт метаболитов внутри клетки и др. Первыми открытыми ГТФ-связывающими белками были белки семейства Ras — продукты онкогена RAS. При постоянном производстве они вызывают злокачественный рост. Наиболее изученный эффектор Ras — это RAF, который запускает белковый каскад MAPK, отвечающий за клеточное деление и пролиферацию [6].
- Мембранные рецепторы. В онкогенезе основную роль играют рецепторы с тирозинкиназной активностью. Они служат для связывания с ростовыми факторами. К ним относится рецептор эпидермального фактора роста, повышенный синтез которого приводит к перерождению клетки.
- Онкогенные протеинкиназы. Протеинкиназы — это группа ферментов, которые модифицируют белки путем фосфорилирования (присоединения остатка фосфорной кислоты). Протеинкиназы регулируют апоптоз, процессы роста и дифференцировки клеток. Нарушения в их работе приводят к сбою в клеточном цикле и, как следствие, к развитию рака. Например, протеинкиназа AKT1, ответственная за ингибирование апоптоза, при перепроизводстве способна вызывать перерождение клеток. Также, она связана с ростом сосудов в опухоли, что помогает раковым клеткам расселяться по организму и давать метастазы.
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
Гены и белки — супрессоры
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Эпигенетические факторы рака
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.

Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].

Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].

Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Читайте также:

