Сообщение о натрии биология
Обновлено: 07.07.2024
Вы можете изучить и скачать доклад-презентацию на тему Натрий. Его биологическая роль. Презентация на заданную тему содержит 14 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!














Натрий. Его биологическая роль Выполнила: студентка 1 курса 4 группы педиатрического факультета Архипова Алина Геннадьевна
Натрий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с порядковым номером 11. Обозначается символом Na (лат. Natrium), мягкий щелочной металл серебристо-белого цвета.
Пищевые источники и суточная потребность Натрий содержится практически во всех продуктах питания в количестве 15-80 мг на 100 г, однако наибольшее количество натрия человек получает с поваренной солью (хлоридом натрия). Для взрослого человека составляет 4-6 г. Потребность существенно возрастает при обильном потоотделении, в условиях жаркого климата, повышенном потреблении воды или физических нагрузках. Снижают количество натрия при гипертонии, ревматизме, нагноительных процессах в лёгких, ожирении, переломах костей, приёме гормональных препаратов, заболеваниях почек, печени, поджелудочной железы, некоторых болезнях желудка.
Натрий - калиевый насос - это особый белок, пронизывающий всю толщу мембраны, который постоянно накачивает ионы калия внутрь клетки, одновременно выкачивая из нее ионы натрия; при этом перемещение обоих ионов происходит против градиентов их концентраций.
Важнейшие биологические функции натрия: Главная роль в поддержании осмолярности плазмы крови и внеклеточной жидкости в целом; Участие (совместно с калием) в возникновении электрохимического потенциала на плазматических мембранах клеток, обеспечение их возбудимости и мембранного транспорта; Стабилизация молекул белков и ферментов, обеспечение протекания ряда ферментативных реакций; Совместно с калием предотвращает обезвоживание, регулируя водный баланс.
Меры предосторожности В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, так, чтобы керосин покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе).
Меры предосторожности Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке) необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в сухой керосин, либо тут же вводят в реакцию. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков граммов. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание на то, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать разрушение трубы. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Меры предосторожности Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может причинить серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щелочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающего разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).
Натрий (Natrium, Na) – химический элемент, выполняющий важную роль макроэлемента в организме человека, который участвует в создании условий и поддержания передачи нервных импульсов между клетками всех тканей. Особенно важен для умения мышечных тканей сокращаться.
Основными функциями натрия также являются – регулирование кислотно-щелочного баланса и поддержание нормального уровня водного баланса, обеспечение транспорта между мембранами клеток и поддержка осмотической концентрации крови. Является активатором ряда ферментов (энзимов).

История – краткая справка
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, I группа, в новой версии таблицы – 1 группа, 3 период.
- Атомный номер – 11
- Атомная масса – 22,9898
- Электронная конфигурация – [Ne] 3s1
- Температура плавления (°С) – 97,81
- Температура кипения (°С) – 882,95
- CAS: 7440-23-5

Физико-химические свойства. Натрий представляет собой щелочный мягкий металл серебристо-белого цвета, иногда с фиолетовым оттенком, который легко можно отрезать ножом. На срезе получается серебристый блеск. Под воздействием высокого давления приобретает красный цвет. При контакте с кислородом достаточно быстро окисляется, превращаясь в оксид натрия (Na2O).
При контакте с водой происходит бурная реакция с выделением водорода, который в свою очередь может легко воспламенится. Также взрывоопасен при контакте с алкилгалогенидами, с которыми может даже самовоспламенятся.
Хорошо растворяется в жидкообразном аммиаке, образовывая в конечном итоге раствор синего цвета.
Обладает высоким коэффициентом электропроводности и теплопроводности.
Несмотря на огромную долю среди других элементов Земной коры – 6 место, в свободном виде Na не найти. Чаще всего он встречается в составе каменной соли (NaCl), содалите, полевом шпате и многих других минералов.
В целом кларк натрия в земной коре составляет 25 кг/т. В морской воде в составе соединений Na составляет 10,5 г на 1 л.
Биологическая роль натрия в организме
Большая часть натрия находится в межклеточной жидкости, что связано с тем, что в мембране клетки интегрирован натрий-калиевый насос, выполняющий роль откачивания ионов Na из цитоплазмы клетки в межклеточную жидкость. Разница содержания натрия в клетке и за ее пределами составляет 15 раз!
Натрий выполняет множество важных и полезных функций, среди которых:
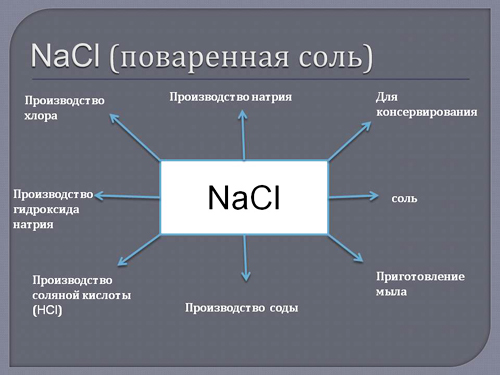
Применение натрия в других сферах человеческой жизни
Суточная потребность
Рекомендуемые суточные дозы натрия в зависимости от пола и возраста 1 :
| Дети | до 1 года | 200-350 мг |
| от 1 до 3 лет | 500 мг | |
| от 3 до 7 лет | 700 мг | |
| от 7 до 11 лет | 1000 мг | |
| Юноши и девушки | от 11 до 14 лет | 1100 мг |
| от 14 до 18 лет | 1300 мг | |
| Взрослые | от 18 лет и старше | 1300 мг |
В перерасчете на поваренную соль – в ¾ ч. ложке соли содержится 1725 мг натрия.
Суточная доза натрия повышается при:
- Обильном потоотделении, обильных физических нагрузках;
- Повышенном потреблении питьевой воды;
- Проживании в странах с жарким климатом;
- Работе в местах с повышенной температурой окружающей среды.
Суточную дозу соли понижают при: ожирении, артериальной гипертензии, аллергиях, ревматизме, переломах, заболеваниях различных органов (печени, поджелудочной железы, почек), применении гормональных препаратов.
Нехватка натрия — симптомы
Дефицит натрия в организме может вызвать ряд осложнений со здоровьем, среди которых:
-
, быстрая утомляемость, потеря сил;
- Сильная жажда, пересыхание слизистых оболочек в ротовой полости, обезвоживание организма;
- Появление отеков;
- Нарушение белкового метаболизма;
- Нарушение кислотно-щелочного (pH) и водного баланса; , дискоординация при движении, головная боль, галлюцинации; , тошнота, рвота;
- Потеря веса;
- Невралгия, мышечные судороги;
- Нарушение ритма работы сердца (аритмии);
- Нарушение функции усвоения организмом аминокислот и моносахаридов.
Причины нехватки натрия
Длительную нехватку Na вызвать достаточно сложно, поэтому это редкое явление. Однако, спровоцировать кратковременный дефицит натрия могут:
- Отсутствие восполнения потерянной из организма жидкости или наоборот – чрезмерное употребление питьевой воды;
- Применение мочегонных препаратов (диуретиков);
- Обильное потоотделение;
- Вегетарианские диеты;
- Расстройства в ЖКТ – рвота, поносы;
- Употребление пищи, богатой на калий (К);
- Потеря крови в большом количестве.
Применение натрия
Применение натрия с лечебной целью целесообразно в следующих случаях:

- Дефицит Na в организме;
- Повышенные физические нагрузки на организм, занятие спортом, кардионагрузки;
- Обезвоживание организма;
- Нормализации кислотно-щелочного баланса в организме;
- Тяжелые формы диареи, рвоты;
- Отравление алкоголем, продуктами питания и другими веществами;
- Изотонический раствор (NаСl) используют для разбавления инъекционных лекарственных препаратов;
- Бикарбонат Na применяют при гастритах и других болезнях органов пищеварения с повышенной кислотностью;
- Физиологический раствор Na применяют для обработки ран, ожогов, а также промывания носовой полости и глаз;
- Различные заболевания: диспепсия, холера и другие.
Необходимо отметить, что область применения натрия в медицине зависит от конкретного состава того или иного препарата. Поэтому, выбор и применения Na в медицине делает врач, исходя из потребностей организма.
Избыток натрия
Избыток натрия в организме также, как и нехватка может вызвать ряд осложнений со здоровьем, среди которых:
-
и лица;
- Повышенное мочеотделение;
- Повышенное кровяного, в т.ч. и артериального давления;
- Повышенная возбудимость, гиперактивность, неврозы;
- Недостаточное количество в организме калия, которые ускоренно выводится почками с мочой;
- Повышенный уровень в крови инсулина;
- Гормональные расстройства;
- Уменьшение плотности костей (развитие остеопороза) и повышенная восприимчивость к переломам;
- Нарушения в работе сердца и почек; – иногда проявляется при парентеральном введение изотонического раствора.
Повышенное употребление поваренной соли каждый день в течение длительного времени способно вызвать развитие воспалительный процесс в почках и органах желудочно-кишечного тракта, что нередко приводит к некрозу тканей данных органов.
Также установлено, что прием 8,2 г Na на 1 кг массы человека в сутки способно вызвать его летальный исход.
Максимальное количество поваренной соли, с которым почки могут справится составляет – от 20 до 30 г в сутки.
Источники натрия
В каких продуктах содержится натрий больше всего?

Конечно же, больше всего натрия в поваренной соли – в 100 г соли содержится 38758 мг, или 38,8 г Na.
Растительные и животные источники (мг на 100 г): треска соленая (5670), соевый соус (5666), Сельдь тихоокеанская среднесоленая (5380), горбуша соленая (5343), килька (4917), лещ вяленый (4566), скумбрия соленая (4450), кета соленая (4053), оливки консервированные (2250), икра горбуши зернистая (2245), сервелат (2226), икра минтая пробойная (2206), икра осетровая паюсная (2022), икра белужья зернистая (1630), икра осетровая зернистая (1620), сыр рокфор (1300), брынза коровья или овечья (1200), огурец соленый (1111), сыр голландский (1100), тунец в масле консервированный (961), капуста белокочанная квашеная (930), курага (170), помидоры (40), гречка и овес (33), смородина черная (32), абрикосы (30), картофель (28), пшено (28), крыжовник (23,6), морковь (21), малина (19), лук репчатый (18), сливы (18), земляника (18), арбуз (16), свекла (16), тыква (14), груши (14), капуста белокочанная (13), мандарины (12), лимон (12), кабачки (10), какао (7).
Синтез в организме: — .
Взаимодействие натрия с другими веществами
- Избыточное количество Na вытесняет из организма калий (К), т.к. они являются антагонистами друг к другу;
- Употребление большого количества соли приводит к выведению из организма калия, кальция и магния;
- Недостаток в организме Na и K приводит к увеличению в организме лития (Li);
- Недостаток в организме калия и хлора нарушают усвояемость Na;
- Для хорошего усвоения Na организму необходимы витамины D и K;
- При контакте с алкилгалогенидами может самовоспламенится и спровоцировать взрыв.
Видео
Источники:
1. Методические рекомендации о нормах физиологических потребностей в энергии и пищевых веществах для различных групп населения России от 18.12.2008 г. №2.3.1.2432-08.

Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Применение
- 7 Изотопы натрия
- 8 Биологическая роль
- 9 Меры предосторожности

История и происхождение названия
Металлический натрий впервые был получен английским химиком Хемфри Дэви электролизом расплава гидроксида натрия. Дэви сообщил об этом 19 ноября 1807 года в Бейкеровской лекции (в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года, а натрий — через несколько дней после калия).
Нахождение в природе
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л . Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Получение

Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью
Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля):
Na2CO3 + 2C → 1000oC 2Na + 3CO
Вместо угля могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий.
С появлением электроэнергетики более практичным стал другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия:
4NaOH → электрический ток 4Na + 2H2O + O2 , 2NaCl → электрический ток 2Na + Cl2 .
В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить цирконийтермическим методом или термическим разложением азида натрия.
Физические свойства


Натрий — серебристо-белый металл, в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C ), температура плавления 97,86 °C , температура кипения 883,15 °C .
Под высоким давлением становится прозрачным и красным, как рубин.
При комнатной температуре натрий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм , Z = 2 .
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc , параметры ячейки a = 0,3767 нм , c = 0,6154 нм , Z = 2 .
Химические свойства
Щелочной металл на воздухе легко окисляется до оксида натрия. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
При горении на воздухе или в кислороде образуется пероксид натрия:
Кроме того, существует озонид натрия NaO3.
С водой натрий реагирует очень бурно, помещённый в воду кусочек натрия всплывает, из-за выделяющегося тепла плавится, превращаясь в белый шарик, который быстро движется в разных направлениях по поверхности воды, реакция идёт с выделением водорода, который может воспламениться. Уравнение реакции:
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, йода, углерода, благородных газов):
2Na + Cl2 → 2NaCl 2Na + H2 → 250−400oC,p 2NaH
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):
С разбавленными кислотами взаимодействует как обычный металл:
2Na + 2HCl → 2NaCl + H2↑
С концентрированными окисляющими кислотами выделяются продукты восстановления:
Растворяется в жидком аммиаке, образуя синий раствор:
С газообразным аммиаком взаимодействует при нагревании:
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой. При недостатке металла происходит реакция Вюрца.
Реагирует со спиртами, фенолами, карбоновыми кислотами с образованием солей.
Растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1).
Применение
Металлический натрий широко используется как сильный восстановитель в препаративной химии и промышленности, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах двигателей грузовиков как жидкий теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Жидкометаллический теплоноситель в ядерных реакторах на быстрых нейтронах БН-600 и БН-800.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12—24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна).
Хлорид натрия (NaCl) (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия (NaN3) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Изотопы натрия
В настоящее время (2012 г.) известно 20 изотопов с массовыми числами от 18 до 37 и 2 ядерных изомера натрия. Единственный стабильный изотоп 23 Na. У большинства изотопов период полураспада меньше одной минуты, лишь один радиоактивный изотоп — 22 Na — имеет период полураспада больше года. 22 Na претерпевает позитронный распад с периодом полураспада 2,6027 года , его используют в качестве источника позитронов и в научных исследованиях. 24 Na, с периодом полураспада по каналу β − -распада 15 часов, используется в медицине для диагностики и для лечения некоторых форм лейкемии.
Биологическая роль
Натрий входит в состав всех живых организмов. В высших организмах натрий находится большей частью в межклеточной жидкости клеток (примерно в 15 раз больше, чем в цитоплазме клетки). Разность концентраций поддерживает встроенный в мембраны клетки натрий-калиевый насос, откачивающий ионы натрия из цитоплазмы в межклеточную жидкость.
Совместно с калием натрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов. Для взрослых по данным Американской Ассоциации сердечных заболеваний минимальная необходимая доза составляет меньше 500 миллиграммов, рекомендуемая до 1500 миллиграммов в день (за исключением некоторых болезней или профессий, при которых нужно повышенное количество натрия). В виде поваренной соли в 3/4 чайной ложки содержится 1725 миллиграммов натрия. По другим данным здоровым взрослым стоит ограничивать употребление натрия 2300 миллиграммами, а людям с повышенным давлением и рядом других заболеваний 1500 или меньшим количеством.
Натрий содержится практически во всех продуктах в разных количествах, хотя большую его часть организм получает из поваренной соли, в том числе в составе консервов, полуфабрикатов, соусов, колбасных изделий и т.п. В качестве источника натрия служат также такие пищевые добавки как глутамат натрия, пищевая сода (бикарбонат натрия), нитрит натрия, сахаринат натрия и бензоат натрия. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако чрезмерно солёная пища и пища, богатая белками, препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированной пищей человека не встречается, однако некоторые проблемы могут возникнуть при голодании. Временный недостаток может быть вызван использованием мочегонных препаратов, поносом, обильным потением или избыточным употреблением воды.
Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте и нарушение усвоения аминокислот и моносахаридов. Продолжительный недостаток вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, повышенное выделение калия с мочой, у некоторых людей повышенное кровяное давление и скопление жидкости. Максимальное количество соли, которое может быть переработано почками, составляет примерно 20—30 граммов, большее количество уже опасно для жизни.
Меры предосторожности
Чистый металлический натрий огнеопасен. На воздухе склонен к самовоспламенению. Особенно опасен контакт с водой и влажными поверхностями, так как натрий очень бурно реагирует с водой, часто со взрывом, образуя едкую щёлочь (NaOH). В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, лигроина, бензина или вазелинового масла так, чтобы слой жидкости покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе). Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке); необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в керосин, либо тут же вводят в реакцию. Прежде чем приступить к работе с натрием, необходимо пройти инструктаж по охране труда. Лица, впервые приступающие к работе с натрием, должны производить эту работу под наблюдением сотрудников, имеющих опыт такой работы. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков граммов. Для показательных опытов, например, в школе на уроках химии, следует брать не более одного грамма натрия. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание на то, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать взрыв и разрушение трубы. Все работы с натрием, как и вообще с щелочами и щелочными металлами, должны проводиться в очках или защитной маске. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может причинить серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щёлочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающий разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).
Натрий в чистом виде получил в 1807 году Хемфри Дэви – английский химик, который незадолго до натрия открыл калий. Дэви проводил процесс электролиза одного из соединений натрия – гидроксида, расплавив который и получил натрий. Соединениями натрия человечество пользовалось со времён глубокой древности, содой природного происхождения пользовались ещё в Древнем Египте (calorizator). Называли элемент содий (sodium), иногда именно это название можно встретить даже сейчас. Привычное название натрий (от латинского natrium – сода) было предложено шведом Йенсом Берцелиусом.
Общая характеристика натрия
Натрий является элементом I группы III третьего периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 11 и атомную массу 22,99. Принятое обозначение – Na (от латинского natrium).

Нахождение в природе
Соединения натрия содержатся в земной коре, морской воде, в виде примеси, имеющей свойство окрашивать каменную соль в синий цвет из-за действия радиации.
Физические и химические свойства
Натрий является мягким пластичным щелочным металлом, имеет серебристо-белый цвет и блеск на свежем срезе (натрий вполне возможно разрезать ножом). При применении давления превращается в прозрачное вещество красного цвета, при обычной температуре кристаллизуется. При взаимодействии с воздухом быстро окисляется, поэтому хранить натрий необходимо под слоем керосина.

Суточная потребность в натрии
Натрий – важный для организма человека микроэлемент, суточная потребность в нём для взрослых составляет 550 мг, для детей и подростков – 500-1300 мг. В период беременности норма натрия в сутки составляет 500 мг, а в некоторых случаях (обильное потоотделение, обезвоживание, приём мочегонных препаратов) должна быть увеличена.
Продукты питания богатые натрием
Натрий содержится практически во всех морепродуктах (раках, крабах, осьминогах, кальмарах, мидиях, морской капусте), рыбе (анчоусах, сардинах, камбале, корюшке и т.д.), куриных яйцах, крупах (гречневой, рисе, перловой, овсяной, пшённой), бобовых (горохе, фасоли), овощах (томатах, сельдерее, моркови, капусте, свёкле), молочных продуктах и мясных субпродуктах.

Полезные свойства натрия и его влияние на организм
Полезными для организма свойствами натрия являются:
- Нормализация водно-солевого обмена;
- Активизация ферментов слюнной и поджелудочной желез;
- Участие в выработке желудочного сока;
- Поддержание нормального кислотно-щелочного баланса;
- Генерирование функций нервной и мышечной системы;
- Сосудорасширяющее действие;
- Поддержание осмотической концентрации крови.
Усвояемость натрия
Натрий содержится практически во всех продуктах, хотя большую его часть (около 80%) организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонком кишечнике. Витамин D улучшает усвоение натрия, однако, чрезмерно соленая пища и пища богатая белками препятствуют нормальному всасыванию.
Взаимодействие с другими
Повышенное потребление натрия вызывает накопление жидкости в организме, отеки, повышает кровяное давление. Большой прием натрия (соли) приведет к истощению запасов калия, кальция и магния.
Применение натрия в жизни
Применение металлического натрия – химическая и металлургическая промышленность, где он выступает в роли сильнейшего восстановителя. Хлоридом натрия (поваренной солью) пользуются все без исключения жители нашей планеты, это самое известное вкусовое средство и древнейший консервант.
Признаки нехватки натрия
Нехватка натрия обычно случается при чрезмерном потоотделении – в жарком климате или при физических нагрузках. Недостаток натрия в организме характеризуется ухудшением памяти и потерей аппетита, головокружением, быстрой утомляемостью, обезвоживанием, мышечной слабостью, а иногда – судорогами, кожными высыпаниями, желудочными спазмами, тошнотой, рвотой.
Признаки избытка натрия
Излишнее количество натрия в организме даёт о себе знать постоянной жаждой, отёками и аллергическими реакциями.
Читайте также:

