Сообщение о химических веществах 5 класс
Обновлено: 19.05.2024
Химический элемент – это атомы одного и того же вида.
Органические вещества – это вещества, которые входят в состав живых организмов и образуются только при их участии.
Неорганические вещества – это вещества, которые входят в состав неживой природы и могут образовываться без участия живых организмов.
Обязательная и дополнительная литература по теме
- Биология. 5–6 классы. Пасечник В. В., Суматохин С. В., Калинова Г. С. и др. / Под ред. Пасечника В. В. М.: Просвещение, 2019
- Биология. 6 класс. Теремов А. В., Славина Н. В. М.: Бином, 2019.
- Биология. 5 класс. Мансурова С. Е., Рохлов В. С., Мишняева Е. Ю. М.: Бином, 2019.
- Биология. 5 класс. Суматохин С. В., Радионов В. Н. М.: Бином, 2014.
- Биология. 6 класс. Беркинблит М. Б., Глаголев С. М., Малеева Ю. В., Чуб В. В. М.: Бином, 2014.
- Биология. 6 класс. Трайтак Д. И., Трайтак Н. Д. М.: Мнемозина, 2012.
- Биология. 6 класс. Ловягин С. Н., Вахрушев А. А., Раутиан А. С. М.: Баласс, 2013.
Теоретический материал для самостоятельного изучения
Сейчас на Земле известно более ста химических элементов. Из их атомов состоят все вещества, встречающиеся на Земле. 80 химических элементов обнаружены в составе живых организмов. При этом четыре из них – углерод, водород, азот и кислород составляют около 98 % массы любого организма. Остальные химические элементы встречаются в живых организмах в малых количествах.
Клетки всех живых организмов состоят из одних и тех же химических элементов. Эти же элементы входят и в состав объектов неживой природы. Сходство состава указывает на общность живой и неживой природы.
На этом уроке вы узнаете, из каких химических элементов состоят клетки живых организмов, и какие изменения претерпевают эти химические соединения по мере роста и развития клеток.
В клетках живых организмов больше всего содержится таких химических элементов, как углерод, водород, кислород и азот. Вместе они составляют до 98 % массы клетки. Около 2 % массы клетки приходится на восемь элементов: калий, натрий, кальций, хлор, магний, железо, фосфор и серу. Остальные химические элементы содержатся в клетках в очень малых количествах.
Химические элементы, соединяясь между собой, образуют неорганические (вода и минеральные соли) и органические (белки, жиры, углеводы, нуклеиновые кислоты и др.) вещества.
Значение каждого из веществ, содержащегося в клетке уникально. Вода придаёт клетке упругость, определяет её форму, участвует в обмене веществ. Неорганические вещества используются для синтеза органических молекул. При недостатке минеральных веществ важнейшие процессы жизнедеятельности клеток нарушаются. Углеводы придают прочность клеточным оболочкам, а также служат запасающими веществами. Белки входят в состав разнообразных клеточных структур, регулируют процессы жизнедеятельности и тоже могут запасаться в клетках. Жиры откладываются в клетках. При расщеплении жиров освобождается необходимая живым организмам энергия. Нуклеиновые кислоты играют ведающую роль в сохранении наследственной информации.
Клетка – это миниатюрная природная лаборатория, в которой синтезируются и претерпевают изменения различные химические соединения. Сходство химического состава клеток разных организмов доказывает единство живой природы.
Химический элемент – это атомы одного и того же вида. Например, все атомы углерода – это химический элемент углерод, все атомы железа – это химический элемент железо. В настоящее время известно более 120 видов химических элементов.

В данной таблице элементы были сгруппированы по рядам. Вертикальные ряды называются группами, а горизонтальные – периодами. Всего в таблице Менделеева есть 8 групп и 7 периодов. Все элементы в периодической таблице расположены в соответствии с их порядковыми номерами. Число порядкового номера равно положительному заряду ядра атома, то есть количеству протонов в ядре. А если речь идет об атоме, значит, порядковый номер равен и количеству электронов в электронной оболочке.
Все вещества по своему составу делятся на простые, в состав которых входят атомы только одного химического элемента, и сложные, в состав которых входят атомы разных химических элементов
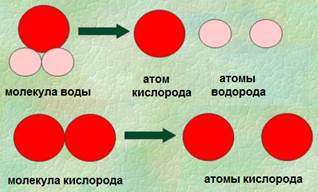
Хорошо известная нам вода – это уже сложное вещество, имеющее в своем составе два атома водорода и один атом кислорода (Н2О). Всего вода состоит из двух элементов – кислорода и водорода. При протекании химических реакций сложные вещества могут разделяться на ряд простых.
Итак, атомы одного и того же вида или имеющих один и тот же заряд называются химическими элементами, которые классифицированы в периодической таблице Менделеева. Все вещества делятся на простые и сложные. Простые вещества содержат атомы одного химического элемента, а сложные вещества содержат атомы разных химических элементов.
Вы уже знаете, что все живые организмы состоят из клеток. Однако сходства на этом не ограничиваются, и все клетки состоят из одних и тех же химических элементов.
Химический элемент. Что это?
Для начала разберемся, что такое химический элемент.
Химический элемент — это совокупность одинаковых мельчайших неделимых частиц (атомов).
Более подробно вы узнаете о химических элементах на уроках физики и химии. Простыми примерами химических элементов могут быть различные металлы (алюминий, медь, золото и т.п.), кислород, которым мы дышим, углерод и другие.
Из каких химических элементов состоят клетки?
Теперь наглядно изучим химический состав живых клеток, а также сравним состав тел живой и неживой природы.
Как вы могли заметить, в составе живых клеток, в отличие от неживых тел, очень много углерода. Дело в том, что атомы углерода являются обязательным компонентом всех органических веществ, образующих живую материю.
Вообще в природе все вещества можно разделить на неорганические и органические.
Неорганические вещества – это знакомые вам поваренная соль, сода, вода, компоненты воздуха.
Органические вещества – это вещества, в состав которых обязательно входят атомы углерода. Органические вещества входят в состав живых клеток. К ним относятся белки, жиры, углеводы и нуклеиновые кислоты.
Для обнаружения некоторых веществ, входящих в состав живых клеток, можно провести ряд несложных опытов.
Обнаружение воды, неорганических и органических веществ
Попробуйте нагреть кусочек растения в пробирке. Через некоторое время на стекле появятся капельки воды, а затем вы увидите дым. Это горят органические вещества. При этом неорганика не сгорает, а остается на дне пробирки в виде золы. Золу, ввиду высокой концентрации неорганических веществ, активно используют в качестве доступного удобрения.
Обнаружение белков и углеводов
В сосуде с мутной водой вы сможете обнаружить крахмал. Для этого достаточно добавить к раствору несколько капель йода. Жидкость посинеет.
Крахмал — это сложный растительный углевод. Большинство растений используют крахмал в качестве запаса питательных веществ.
Крахмальные зерна самых разных форм откладываются в хлоропластах. Больше всего крахмала запасается в семенах, клубнях, корнях и корневищах. Это также можно легко проверить. Достаточно капнуть несколько капель йода на клубень картофеля.
Обнаружение жиров
Жир можно обнаружить в семенах подсолнечника. Поместите несколько семечек на лист белой бумаги и попробуйте раздавить их с помощью пестика. Вскоре на бумаге выступят характерные масляные пятна.
Химический состав клетки
Это самое распространенное вещество на Земле. Вода не только окружает каждый живой организм снаружи, но и находится внутри.
В среднем живые клетки состоят из воды на 60 — 80%. Потеря всего 20% воды приводит к смерти.
Почему же вода так важна?
Вода – это универсальный растворитель для большинства веществ, а также участник химических реакций важных организма.
Таким образом, от содержания воды в организме зависит скорость большинства химических процессов, а значит и обмена веществ в целом.
Форма клетки, ее объем и упругость также поддерживаются водой.
Вода участвует в процессе терморегуляции. За счет испарения воды с поверхности листьев и потоотделения тела растений и животных охлаждаются и регулируют температуру.
Минеральные вещества
Кровь и межклеточная жидкость содержат большое количество различных неорганических солей. Они позволяют поддерживать постоянство внутренней среды организма. Кальций входит в состав костей и раковин моллюсков, участвует в процессе сокращения мускулатуры. Вместе с калием кальций обеспечивает выполнение жизненно важных функций, таких как раздражимость.
Углеводы
Функции углеводов в организме разнообразны.
Углеводы придают прочность и жесткость клеточным стенкам растений (целлюлоза). Углевод хитин образует жесткие покровы насекомых. Раствор углеводов в растительной вакуоли поддерживает внутриклеточное давление.
В виде сложных углеводов, крахмала и гликогена, растения и животные запасают энергию. А в результате их расщепления живые организмы получают энергию.
Белки
Разнообразие белков в живом организме очень велико.
Белки входят в состав многих клеточных структур, регулируют процессы жизнедеятельности и могут запасаться в клетке. Из белков состоят мышцы, и сокращаются они именно благодаря белками. За счет белков волосы, ногти, рога и копыта обладают высокой прочностью. Гемоглобин, транспортный белок крови, переносит кислород и углекислый газ.
Без белков было бы невозможно пищеварение. Ведь ферменты, разлагающие компоненты пищи, также являются белками.
Жиры выступают в роли стратегического запаса энергии и даже воды.
Нуклеиновые кислоты
Нуклеиновые кислоты крайне важны для любого живого организма.
Структура нуклеиновой кислоты (ДНК)
Именно в виде нуклеиновых кислот хранится наследственная информация. С помощью нуклеиновых кислот наследственная информация передается от родителей потомкам.
В клетке нуклеиновые кислоты образуют специальные структуры (хромосомы), которые находятся в клеточном ядре.
Что указывает на общность живой и неживой природы?
Все живые клетки, как и объекты неживой природы состоят из одних и тех же химических элементов. Уже знакомые вам белки, жиры, углеводы и нуклеиновые кислоты состоят из углерода, водорода и кислорода. В состав белков входит также азот. Нуклеиновые кислоты содержат не только азот, но еще и фосфор.
Назовите известные вам углеводы. Какие из них встречаются в растительных а какие — в животных организмах? Охарактеризуйте значение этих веществ.
Глюкоза – органическое соединение, углевод. Это один из самых распространенных и доступных источников энергии для всех живых организмов. Этот углевод встречается в ягодных и фруктовых соках. Также глюкоза образует более сложные углеводы.
Фруктоза – органические соединение, углевод. Не смотря на свое название, фруктоза выполняет важные функции в организмах не только растений, но и животных. Как и глюкоза фруктоза входит в состав многих более сложных углеводов. Фруктозу активно используют в пищевой промышленности в качестве подсластителя безопасного для диабетиков.
Сахароза – углевод, состоящий из одной глюкозы и одной фруктозы. По сути сахароза – это хорошо знакомый вам сахар.
Крахмал – сложный очень разветвленный углевод, состоящий из большого количества глюкозы. Это основной запасной углевод в растительных клетках.
Гликоген – сложный ветвистый углевод, состоящий из глюкозы. Растения запасают крахмал, а животные – гликоген.
Целлюлоза (клетчатка) – сложный углевод, представляющий собой длинную цепочку глюкозы. Основной компонент жестких клеточных стенок растений.
Хитин – сложный углевод в составе жестких покровов насекомых, ракообразных и других беспозвоночных.
Ключевые слова конспекта: предмет химии, вещества и их свойства, чистые вещества и смеси, способо разделения смесей.
Химия – это наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти превращения. Химия является одной из наук, изучающих природу. Вместе с биологией и физикой химия принадлежит к числу естественных наук.
Вещество — это то, из чего состоит физическое тело. Вещество характеризуется определенными физическими свойствами.
Свойства веществ — это признаки, по которым вещества отличаются друг от друга или сходны между собой, например:
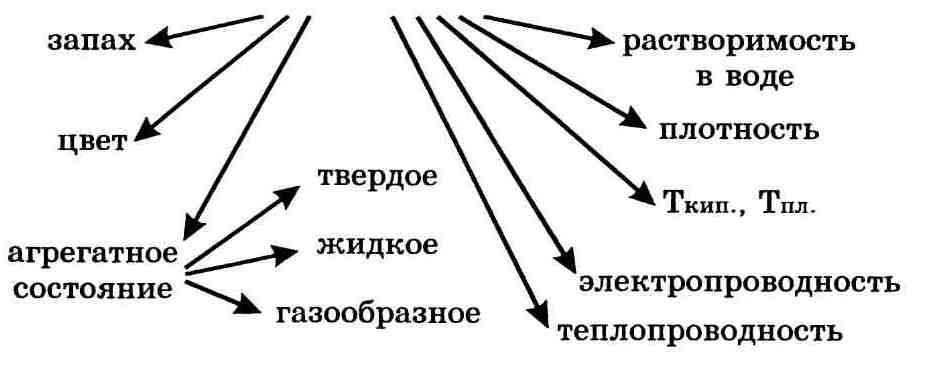
Важнейшие физические свойства вещества следующие: агрегатное состояние, цвет, запах, плотность, растворимость в воде, тепло-и электропроводность, температуры плавления и кипения.
Например, всем известное вещество алюминий можно охарактеризовать так: Алюминий — металл серебристо-белого цвета, сравнительно лёгкий (р = 2,7 г/см3), плавится при температуре 600°С. Алюминий очень пластичен. По электрической проводимости уступает лишь золоту, серебру и меди. Из-за лёгкости алюминий в виде сплавов широко используют в самолёто- и ракетостроении. Его также используют для изготовления электрических проводов и предметов быта.
Чистые вещества и смеси
Чистыми называются вещества, состоящие из одинаковых молекул. Смесь состоит из молекул разных веществ.
Каждое вещество имеет прежде всего свои, характерные именно для него свойства. Они в наибольшей степени проявляются, только если вещество является практически чистым, т. е. содержит мало примесей.
В природе чистых веществ не бывает, они встречаются преимущественно в виде смесей. Во многих случаях смеси нелегко отличить от чистых веществ. Например, сахар, растворяясь в воде, образует однородную по внешнему виду смесь. Даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в эту смесь. Такие смеси называют гомогенными (однородными).
Молоко на первый взгляд тоже кажется однородным веществом. Однако, если рассмотреть каплю молока под микроскопом, можно увидеть, что в ней плавает множество мельчайших капелек жира. Если дать молоку постоять, то эти капельки соберутся в верхнем слое, образуя сливки. Подобные неоднородные смеси называют гетерогенными смесями.
Однородные смеси — это смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь. Неоднородные смеси — это смеси, в которых невооруженным глазом или с помощью микроскопа можно заметить частицы веществ,составляющие смесь.
Способ разделения смесей
В смеси сохраняются свойства составляющих их веществ компонентов. На основании этих свойств выбирают рациональный способ разделения смесей.
Способы разделения смесей основаны на различии свойств веществ-компонентов, их составляющих: плотности, растворимости в воде и других жидкостях-растворителях, способности плавиться и испаряться.
Способы разделения смесей: неоднородные смеси — отстаивание и фильтрование, действие магнитом; однородные смеси — перегонка, выпаривание, кристаллизация и хроматография.
Отстаивание. Прием разделения смеси твердого и жидкого вещества путем осаждения твердого на дно под действием сил тяжести.
- а) При выдерживании воды, содержащей частички глины, в емкостях глина медленно осаждается на дно, отстаивается. Применяется при очистке питьевой воды.
- б) Чтобы разделить смесь поваренной соли и речного песка, надо поместить ее в колбу и добавить воды. Соль растворится, а песок опустится на дно. Затем осторожно слить раствор, чтобы песок остался в колбе. Соль из раствора получают выпариванием воды.
- в) Для разделения смеси малорастворимых друг в друге жидкостей с различной плотностью используют делительную воронку. Это цилиндрический сосуд с краником внизу. Помещенная в эту воронку смесь бензина с водой или растительного масла с водой быстро расслаивается, причем водный слой оказывается внизу. Открывая кран, сливаем воду, а когда вода заканчивается, закрываем кран. В воронке — бензин или масло.
Фильтрование. Чтобы избавиться от нерастворимых в воде примесей, воду пропускают через фильтр. Материал фильтра — бумага, ткань, пористая керамика. Примеси остаются на фильтре, а вода очищается.
Действие магнитом. Выделение из неоднородной смеси веществ, способных к намагничиванию. К магниту притягиваются железные опилки.
Перегонка. Прием разделения однородных жидких смесей путем испарения летучих жидкостей, различающихся температурами кипения, с последующей конденсацией паров. Так из нефти, представляющей собой смесь жидких, газообразных и твердых углеводородов, получают попутные газы, бензин, керосин, дизельное топливо и другие продукты.
Выпаривание. Способ извлечения растворенного в жидком растворителе твердого или жидкого вещества. Например, упаривая воду из сладкого сиропа, получают сахар.
Кристаллизация. Избирательное извлечение одного из нескольких твердых веществ, содержащихся в растворе. Частичное упаривание воды с последующим охлаждением раствора приводит к осаждению кристаллов главного компонента. Так из морской воды выделяют поваренную соль NaCl, а другие соли, присутствующие в меньшем количестве, остаются в растворе.
Хроматография. Метод разделения смесей, основанный на различиях относительной растворимости веществ в используемом растворителе (жидкая фаза) и прочности связывания этих веществ поверхностью сорбента (твердая фаза).
Бумажная хроматография. Нанесем каплю раствора смеси двух веществ на расстоянии 2 см от края длинной полоски фильтровальной бумаги. Подвесим полоску в стеклянном цилиндре, на дне которого находится растворитель. Нижнюю часть полоски погрузим в растворитель, при этом пятно со смесью находится чуть выше. Верхняя часть полоски удерживается проволокой у отверстия цилиндра. Сверху цилиндр закроем стеклом, чтобы не испарялся растворитель. Боковые стороны полоски не касаются стенок цилиндра. Растворитель смачивает полоску, и жидкий фронт движется вверх за счет капиллярных сил. Вместе с растворителем по бумаге движутся и растворенные вещества. Если они цветные, то за движением можно наблюдать визуально. Вещество, которое лучше растворимо и менее прочно удерживается сорбентом (бумагой), поднимется выше. Когда фронт поднимется достаточно высоко и пятна разделятся, полоску вынимают и разрезают.
Колоночная хроматография — процесс, родственный рассмотренному. В качестве твердой фазы служит силикагель, помещенный в колонку. Только в этом случае смесь наносят равномерно вверху колонки, а потом добавляют растворитель. Разделенные вещества собирают внизу в разные стаканчики.
Читайте также:

