Сообщение о галогене хлор
Обновлено: 17.06.2024
История открытия
Соединение с хлором — газообразный хлороводород — было впервые получено Джозефом Пристли в 1772 г. Хлор был получен в 1774 г. шведским химиком Карлом Вильгельмом Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите: 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природе
В природе встречаются два изотопа хлора 35 Cl и 37 Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов (содержание в морской воде 19 г/л). На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,017 %, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Физические свойства
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Газообразный хлор относительно легко сжижается. Начиная с давления в 0,8 МПа (8 атмосфер), хлор будет жидким уже при комнатной температуре. При охлаждении до температуры в −34 °C хлор тоже становится жидким при нормальном атмосферном давлении. Жидкий хлор — жёлто-зелёная жидкость, обладающая очень высоким коррозионным действием (за счёт высокой концентрации молекул). Повышая давление, можно добиться существования жидкого хлора вплоть до температуры в +144 °C (критической температуры) при критическом давлении в 7,6 МПа. При температуре ниже −101 °C жидкий хлор кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å. По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 10 22 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
В 1774 году Карл Шееле, химик из Швеции, впервые получил хлор, но считалось, что это не отдельный элемент, а разновидность соляной кислоты (calorizator). Элементарный хлор был получен в начале XIX века Г. Дэви, который разложил поваренную соль на хлор и натрий путём электролиза.
Общая характеристика хлора
Хлор (от греческого χλωρός – зелёный) является элементом XVII группы периодической таблицы химических элементов Д.И. Менделеева, имеет атомный номер 17 и атомную массу 35,452. Принятое обозначение Cl ( от латинского Chlorum).

Нахождение в природе
Хлор является самым распространённым в земной коре галогеном, чаще всего в виде двух изотопов. В силу химической активности встречается лишь в виде соединений многих минералов.
Физические и химические свойства
Хлор является ядовитым жёлто-зелёным газом, имеет резкий неприятный запах и сладковатый вкус. Именно хлор после его открытия предложили называть галогеном, в одноимённую группу он входит как один из самых химически активных неметаллов.
Суточная потребность в хлоре
В норме взрослый здоровый человек должен получать в сутки 4-6 г хлора, потребность в нём возрастает при активных физических нагрузках или жаркой погоде (при повышенном потоотделении). Обычно суточную норму организм получает из продуктов питания при сбалансированном рационе.
Продукты питания богатые хлором
Основным поставщиком хлора в организм является поваренная соль – особенно, если она не подвергается термической обработке, поэтому лучше солить уже готовые блюда. Также хлор содержат яйца, морепродукты, мясо, горох, фасоль и чечевица, гречка и рис, оливки.

Взаимодействие с другими
Кислотно-щелочной и водный баланс организма регулируется калием, натрием и хлором.
Признаки нехватки хлора
Нехватка хлора вызвана процессами, приводящими к обезвоживанию организма – сильное потоотделение в жару или при физических нагрузках, рвота, диарея и некоторые заболевания моче-выделительной системы. Признаками недостатка хлора являются вялость и сонливость, слабость в мышцах, явная сухость во рту, потеря вкусовых ощущений, отсутствие аппетита.
Признаки избытка хлора
Признаками избытка хлора в организме являются: повышение кровяного давления, сухой кашель, боль в голове и в груди, резь в глазах, слезотечение, расстройства деятельности желудочно-кишечного тракта. Как правило, переизбыток хлора может быть вызван употреблением обычной воды из-под крана, которая проходит процесс дезинфекции хлором и случается у работников тех отраслей промышленности, которые напрямую связаны с использованием хлора.
Полезные свойства хлора и его влияние на организм
Хлор в организме человека:
- регулирует водный и кислотно-щелочной баланс,
- выводит жидкость и соли из организма в процессе осморегуляции,
- стимулирует нормальное пищеварение,
- нормализует состояние эритроцитов,
- очищает печень от жира.

Применение хлора в жизни
Основное применение хлора – химическая промышленность, где с его помощью изготавливают поливинилхлорид, пенопласт, материалы для упаковки, также боевые отравляющие вещества и удобрения для растений. Обеззараживание питьевой воды хлором – практически единственный доступный способ очистки воды.
К галогенам относят фтор, хлор, бром, йод и астат. Они образуют VIIА-группу Периодической системы химических элементов.

Содержание галогенов в земной коре снижается от фтора к астату. Причем, если фтор, бром и йод можно отнести к распространенным химическим элементам, то содержание астата в земной коре крайне мало. Галогены входят в состав многих минералов. Исключение составляет астат. Астат обнаружен в продуктах радиоактивного распада урана.

Галогены – элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.

Физические свойства галогенов: F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.


Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:

Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде. Все галогены в свободном состоянии – окислители . Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель . Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
1. Взаимодействие с ксеноном. Наибольшей химической активностью обладает фтор, это сильнейший окислитель, который реагирует даже с инертными газами:
2. Взаимодействие с металлами. Все галогены взаимодействуют практически со всеми простыми веществами, наиболее энергично протекает реакция с металлами. Фтор при нагревании реагирует со всеми металлами, включая золото и платину, на холоде взаимодействует с щелочными металлами, свинцом и железом. Хлор, бром и йод при обычных условиях реагируют со щелочными металлами, а при нагревании – с медью, железом и оловом. В результате взаимодействия образуются галогениды, которые являются солями:
3. Взаимодействие с водородом. При обычных условиях фтор реагирует с водородом в темноте со взрывом, взаимодействие с хлором протекает на свету, бром и йод реагируют только при нагревании, причем реакция с йодом обратима.
4. Взаимодействие с неметаллами. С кислородом и азотом галогены непосредственно не взаимодействуют, реагируют с серой, фосфором, кремнием, проявляя окислительные свойства, химическая активность у брома и йода выражена слабее, чем у фтора и хлора:
5. Взаимодействие с водой. Галогены реагируют со многими сложными веществами. С водой фтор и остальные галогены реагируют по-разному:
Эта реакции является реакцией диспропорционирования, где галоген одновременно является окислителем и восстановителем.
10. Взаимное замещение галогенов. Реакционная способность галогенов снижается при переходе от фтора к йоду, поэтому предыдущий элемент вытесняет последующий из галогеноводородных кислот и их солей:



История открытия:
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства. Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты.
Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Название элемента происходит от греческого clwroz - "зелёный".

Нахождение в природе, получение:
Природный хлор представляет собой смесь двух изотопов 35 Cl и 37 Cl. В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2·6H2O, карналлита KCl·MgCl2·6Н2O, каинита KCl·MgSO4·3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В промышленных масштабах хлор получают вместе с гидроксидом натрия и водородом при электролизе раствора поваренной соли:
Для рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений используется процесс Дикона (каталитическое окисление хлороводорода кислородом воздуха):
4HCl + O2 = 2H2O + 2Cl2
В лабораториях обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Физические свойства:
При нормальных условиях хлор - жёлто-зелёный газ с удушающим запахом. Хлор заметно растворяется в воде ("хлорная вода"). При 20°C в одном объеме воды растворяется 2,3 объема хлора. Температура кипения = -34°C; температура плавления = -101°C, плотность (газ, н.у.) = 3,214 г/л.

В отсутствии влаги хлор довольно инертен, но в присутствии даже следов влаги активность его резко возрастает. Он хорошо взаимодействует с металлами:
Полученные растворы называются жавелевой водой, которая, как и хлорная вода, обладает сильными окислительными свойствами благодаря наличию иона ClO - и применяется для отбеливания тканей и бумаги. С горячими растворами щелочей хлор образует соответствующие соли соляной и хлорноватой кислот:
При нагревании хлор легко взаимодействует со многими органическими веществами. В предельных и ароматических углеводородах он замещает водород, образуя хлорорганическое соединение и хлороводород, а к непредельным присоединяется по месту двойной или тройной связи.
При очень высокой температуре хлор полностью отбирает водород у углерода. При этом образуются хлороводород и сажа. Поэтому высокотемпературное хлорирование углеводородов всегда сопровождается сажеобразованием.
Хлор - сильный окислитель, поэтому легко взаимодействует со сложными веществами, в состав которых входят элементы, способные окисляться до более высокого валентного состояния:
Важнейшие соединения:
Хлороводород HCl - бесцветный газ, на воздухе дымит вследствие образования с парами воды капелек тумана. Обладает резким запахом, сильно раздражает дыхательные пути. Содержится в вулканических газах и водах, в желудочном соке. Химические свойства зависят от того, в каком состоянии он находится (может быть в газообразном, жидком состоянии или в растворе). Раствор HCl называется соляной (хлороводородной) кислотой. Это сильная кислота, вытесняет более слабые кислоты из их солей. Соли - хлориды - твёрдые кристаллические вещества с высокими температурами плавления.
Ковалентные хлориды - соединения хлора с неметаллами, газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства, как правило легко гидролизующиеся водой с образованием соляной кислоты:
Оксид хлора(I) Cl2O., газ буровато-желтого цвета с резким запахом. Поражает дыхательные органы. Легко растворяется в воде, образуя хлорноватистую кислоту.
Хлорноватистая кислота HClO. Существует только в растворах. Это слабая и неустойчивая кислота. Легко разлагается на соляную кислоту и кислород. Сильный окислитель. Образуется при растворении хлора в воде. Соли - гипохлориты, малоустойчивы (NaClO*H2O при 70 °C разлагается со взрывом), сильные окислители. Широко используется для отбеливания и дезинфекции хлорная известь, смешанная соль Ca(Cl)OCl
Хлористая кислота HClO2, в свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается. Кислота средней силы, соли - хлориты, как правило, бесцветны и хорошо растворимы в воде. В отличие от гипохлоритов, хлориты проявляют выраженные окислительные свойства только в кислой среде. Наибольшее применение (для отбелки тканей и бумажной массы) имеет хлорит натрия NaClO2.
Оксид хлора(IV) ClO2, - зеленовато-желтый газ с неприятным (резким) запахом, .
Хлорноватая кислота , HClO3 - в свободном виде нестабильна: диспропорционирует на ClO2 и HClO4. Соли -хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния. Это сильные окислители, в смеси с восстановителями взрывоопасны. Хлорат калия (бертолетова соль) - KClO3, использовалась для получения кислорода в лаборатории, но из-за высокой опасности её перестали применять. Растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Хлорная кислота HClO4, в водных растворах хлорная кислота - самая устойчивая из всех кислородсодержащих кислот хлора. Безводная хлорная кислота, которую получают при помощи концентрированной серной кислоты из 72%-ной HСlO4 мало устойчива. Это самая сильная одноосновная кислота (в водном растворе). Соли -перхлораты, применяются как окислители (твердотопливные ракетные двигатели).
Применение:

Биологическая роль и токсичность:
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Ионы хлора жизненно необходимы растениям, участвуя в энергетическом обмене у растений, активируя окислительное фосфорилирование.
Хлор в виде простого вещества ядовит, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую Мировую войну.

1. В сосуде, имеется смесь водорода и хлора. Как изменится давление в сосуде при пропускании через смесь электрической искры?
В результате этой реакции общее количество молекул в газовой фазе не изменяется, поэтому давление в сосуде также остается неизменным.
2. Газ, выделившийся при действии 2,0 г цинка на 18,7 мл 14,6%-ной соляной кислоты (плотность раствора 1,07 г/мл), пропустили при нагревании над 4,0 г оксида меди (II). Чему равна масса полученной твердой смеси?
Найдем количества веществ в первой реакции: m(р-ра НСl) = 18,7 . 1,07 = 20,0 г. m(НСl) = 20,0 . 0,146 = 2,92 г. v(НСl) = 2,92/36,5 = 0,08 моль. v(Zn) = 2,0/65 = 0,031 моль. Цинк находится в недостатке, поэтому количество выделившегося водорода равно:v(Н2) = v(Zn) = 0,031 моль.
Во второй реакции в недостатке находится водород, поскольку v(СuО) = 4,0/80 = 0,05 моль. В результате реакции 0,031 моль СuО превратится в 0,031 моль Сu, и потеря массы составит:
3. Напишите уравнения реакций, которые могут происходить при действии концентрированной серной кислоты на все твердые галогениды калия. Возможны ли эти реакции в водном растворе?
При действии концентрированной серной кислоты на фторид и хлорид калия при нагревании выделяются, соответственно,фтороводород и хлороводород:
Бромоводород и иодоводород — сильные восстановители и легко окисляются серной кислотой до свободных галогенов, при этом НBrвосстанавливает серную кислоту до SО2, а НI (как более сильный восстановитель) — до Н2S:
В водном растворе серная кислота уже не является сильным окислителем. Кроме того, все галогеноводородные кислоты — сильные (за исключением плавиковой кислоты), и серная кислота не может вытеснять их из солей. В водном растворе возможна единственная обменная реакция:
ХЛОР, химический элемент VII группы периодической системы, относится к галогенам. Атомный номер 17, относительная атомная масса 35,453. Природный хлор состоит из смеси двух изотопов – хлора-35 (75,77%) и хлора-37 (24,23%).
История получения.
Многочисленные соединения хлора были известны, конечно, задолго до Шееле. Этот элемент входит в состав многих солей, в том числе и самой известной – поваренной соли. В 1774 Шееле выделил хлор в свободном виде, нагревая черный минерал пиролюзит с концентрированной соляной кислотой: MnO2 + 4HCl ® Cl2 + MnCl2 + 2H2O.
Хлор в природе.
Хлора в земное коре не очень много – всего 0,017%, причем в свободном состоянии он встречается лишь в небольших количествах в вулканических газах. В списке самых распространенных элементов хлор находится в конце второго десятка. Хлора меньше, чем даже ванадия и циркония (но больше, чем хрома, никеля, цинка, меди и азота). При этом хлор очень сильно распылен: небольшие количества этого элемента входят в состав множества различных минералов и горных пород. Очень высокая химическая активность хлора приводит к тому, что в природе он встречается, как правило, в виде соединений, в сочетании с натрием, калием, магнием, кальцием.
Хлор образует около ста минералов; главным образом это хлориды легких металлов – щелочных и щелочноземельных. Самый распространенный среди них – галит NaCl. Реже встречаются хлориды калия, кальция, магния. Из них наиболее распространены бишофит MgCl2·6H2O, карналлит KCl·MgCl2·6H2O, сильвин KCl, сильвинит NaCl·KCl, каинит KCl·MgSO4·3H2O, тахигидрит CaCl2·2MgCl2·12H2O. В виде таких соединений хлор содержится в соляных пластах, образовавшихся при высыхании древних морей. Особенно мощные залежи образует галит и калийные соли; их запасы оцениваются гигантским числом – более 10 триллионов тонн!
Очень много хлора содержится в морской воде – в среднем 1,9%. Происходит это потому, что хлор вымываемый из пород, нигде не может задержаться (почти все хлориды металлов растворимы) и выносится реками в моря и океаны. Но не следует думать, что попавший в морскую воду хлор уже не может вернуться на материки. В обратной миграции хлора большую роль играет ветер, уносящий соленую пыль с поверхности океанов, морей и соленых озер. Так хлор участвует в круговороте веществ. Но в засушливых и пустынных районах в результате интенсивного испарения воды концентрация хлора в грунтовых водах сильно повышается. Так образуются солончаки, особенно в низинах. Из различных источников ежегодно в мире добывают сотни миллионов тонн хлора.
Растворы хлоридов – обязательная составная часть живых организмов. Содержание хлора в теле человека 0,25%, в плазме крови – 0,35%. В теле взрослого человека содержится более 200 г хлорида натрия, из которых 45 г растворено в крови. В продуктах питания и природной воде часто недостаточно хлора для нормального развития человека, поэтому с древних времен люди подсаливают пищу. Вводят хлор и в подкормку животных. Растения же, в отличие от животных, никогда не испытывают дефицита хлора.
Получение хлора.
Метод Шееле в настоящее время используют редко – разве только во время лекционных демонстраций. В лабораториях для получения хлора используют более сильный окислитель – перманганат калия, который окисляет соляную кислоту уже при комнатной температуре: 2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 8H2O + 5Cl2. Этот способ был предложен немецким химиком Карлом Гребе. Аналогично идет реакция и с дихроматом калия:
K2Cr2O7 + 14HCl ® 2KCl + 2CrCl3 + 3Cl2 + 7H2O. Хлор выделяется также при действии соляной кислоты на хлорную известь: Ca(OCl)Cl + 2HCl ® CaCl2 + Cl2 + H2O. Можно окислить соляную кислоту до свободного хлора и концентрированным раствором пероксида водорода – пергидролем (реакция лучше идет на ярком свету). В 1867 английский технолог Генри Дикон разработал непрерывный способ получения хлора путем каталитического окисления хлороводорода кислородом воздуха над медным катализатором (диконовский процесс): 4HCl + O2 ® 2Cl2 + 2H2O. Сейчас этот метод имеет лишь историческое значение.
После того, как Алессандро Вольта создал в 1799 первый химический источник постоянного тока (вольтов столб), многие ученые начали изучать действие этого источника на различные вещества. Оказалось, что при пропускании тока через раствор поваренной соли можно получить хлор и гидроксид натрия. Однако промышленное значение этот метод приобрел только после 1872, когда для производства дешевой электроэнергии начали использовать изобретенные бельгийским мастером З.Т.Граммом динамо-машины. В настоящее время практически весь хлор получают электролизом водных растворов хлорида натрия: 2NaCl + 2H2O ® Cl2 + 2NaOH + H2. При этом хлор выделяется на аноде, тогда как на катоде также образуются ценные вещества – водород и гидроксид натрия. Путем повышения давления хлор сжижают и заливают в стальные баллоны, где он хранится под давлением около 6 атм. Чтобы выделяющийся при электролизе хлор не разрушал аноды, их делают из титановых сплавов и покрывают оксидами титана и рутения. Производство это энергоемкое – на тонну хлора расходуется в среднем 3000 кВт-ч электроэнергии. В развитых странах на производство хлора затрачивается около 2% всей вырабатываемой электроэнергии! Но одновременно получают и другие ценные продукты – едкий натр и водород. Получают свободный хлор в огромных количествах. Так, к началу 21 в. только в США его ежегодно производили в количестве более 11 млн. тонн!
Свойства хлора.
Хлор – тяжелый (в 2,5 раза тяжелее воздуха) желто-зеленый газ. Молекулы Cl2 легко диссоциируют на атомы при поглощении кванта света, а также при высокой температуре. При 730° С степень диссоциации составляет около 0,02%, а при 1730° С – уже почти 35%. При невысоких давлениях хлор близок к идеальным газам: 1 моль хлора при нормальных условиях занимает объем 22,06 л. При охлаждении до –34° С хлор сжижается, а при –101° С он затвердевает. Температуру сжижения газообразного хлора легко повысить, если увеличить давление; так при давлении 5 атм хлор кипит уже при +10,3° С.
Хлор неплохо растворяется в воде: при 10° С в 1 л воды растворяется 3,15 л хлора, при 20° С – 2,3 л. Образующийся раствор обычно называют хлорной водой. Если насытить хлором при атмосферном давлении холодную (ниже 9,6° С) воду, из раствора выделяются желтоватые кристаллы состава Cl2·6H2O. Такие же кристаллы гидрата хлора образуются при охлаждении влажного газообразного хлора. Нагревая гидрат хлора в одном колене запаянной изогнутой трубки и охлаждая второе колено льдом, Фарадей в 1823 получил жидкий хлор. Хлор хорошо растворяется во многих органических растворителях; так, в 100 г холодного бензола растворяется около 35 г хлора.
Химически хлор очень активен. Он реагирует почти со всеми веществами, даже с платиной (при температурах выше 560° С). А в хлорной воде растворяется и золото. В 1869 профессор химии в Эдинбурге Джемс Альфред Уанклин заметил, что хорошо высушенный хлор не действует на железо и некоторые другие металлы. В результате появилось возможность хранить безводный жидкий хлор в стальных баллонах. Промышленное производство жидкого хлора было налажено в 1888 немецкой фирмой БАСФ.
Хлор активно и с выделением значительного количества тепла реагирует с водородом:
Cl2 + H2 ® 2HCl + 184 кДж. Реакция идет по цепному механизму, и если скорость ее инициирования велика (сильное освещение ультрафиолетовым или сине-фиолетовым светом, нагрев до высокой температуры), смесь газов (если хлора в ней содержится более 11,5 и менее 95%) взрывается (см. также ЦЕПНЫЕ РЕАКЦИИ).
В водном растворе хлор частично и довольно медленно реагирует с водой; при 25° С равновесие: Cl2 + H2O HClO + HCl устанавливается в течение двух суток. Хлорноватистая кислота на свету разлагается: HClO ® HCl + O. Именно атомарному кислороду приписывают отбеливающий эффект (абсолютно сухой хлор такой способностью не обладает).
Хлор и его соединения с положительной степенью окисления – сильные окислители. В 1822 немецкий химик Леопольд Гмелин путем окисления хлором получил из желтой кровяной соли красную: 2K4[Fe(CN)6] + Cl2 ® K3[Fe(CN)6] + 2KCl. Хлор легко окисляет бромиды и хлориды с выделением в свободном виде брома и иода.
Хлор реагирует со многими органическими соединениями. Он быстро присоединяется к непредельным соединениям с двойными и тройными углерод-углеродными связями (реакция с ацетиленом идет со взрывом), а на свету – и к бензолу. При определенных условиях хлор может замещать атомы водорода в органических соединениях: R–H + Cl2 ® RCl + HCl. Эта реакция сыграла значительную роль в истории органической химии. В 1840-х французский химик Жан Батист Дюма обнаружил, что при действии хлора на уксусную кислоту с удивительной легкостью идет реакция
СН3СООН + Cl2 ® CH2ClCOOH + HCl. При избытке хлора образуется трихлоруксусная кислота ССl3СООН. Однако многие химики отнеслись к работе Дюма недоверчиво. Ведь согласно общепринятой тогда теории Берцелиуса положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора. Этого мнения придерживались в то время многие выдающиеся химики, среди которых были Фридрих Вёлер, Юстус Либих и, конечно, сам Берцелиус.
Чтобы высмеять Дюма, Вёлер передал своему другу Либиху статью от имени некоего Ш.Виндлера (Schwindler – по-немецки мошенник) о новом удачном приложении якобы открытой Дюма реакции. В статье Вёлер с явной издёвкой написал о том, как в уксуснокислом марганце Mn(CH3COO)2 удалось все элементы, в соответствии с их валентностью, заместить на хлор, в результате чего получилось желтое кристаллическое вещество, состоящее из одного только хлора. Далее говорилось, что в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные, и что при этом вещи сохраняют свой внешний вид. В сноске было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, так как этот материал очень хорош для ночных колпаков и теплых подштанников.
Либиху шутка понравилась, и он опубликовал ее (на французском языке) от имени Ш.Виндлера всего через несколько страниц после статьи Дюма. Намек получился очень прозрачным. Тем не менее прав оказался все же Дюма.
Реакция хлора с органическими соединениями приводит к образованию множества хлорорганических продуктов, среди которых – широко применяющиеся растворители метиленхлорид CH2Cl2, хлороформ CHCl3, четыреххлористый углерод CCl4, трихлорэтилен CHCl=CCl2, тетрахлорэтилен C2Cl4. В присутствии влаги хлор обесцвечивает зеленые листья растений, многие красители. Этим пользовались еще в XVIII в. для отбеливания тканей.
Хлор как отравляющий газ.
Получивший хлор Шееле отметил его очень неприятный резкий запах, затруднение дыхания и кашель. Как потом выяснили, человек чувствует запах хлора даже в том случае, если в одном литре воздуха содержится лишь 0,005 мг этого газа, и при этом он уже оказывает раздражающее действие на дыхательные пути, разрушая клетки слизистой оболочки дыхательных путей и легких. Концентрация 0,012 мг/л переносится с трудом; если же концентрация хлора превышает 0,1 мг/л, он становится опасным для жизни: дыхание учащается, становится судорожным, а затем – все более редким, и уже через 5–25 минут происходит остановка дыхания. Предельно допустимой в воздухе промышленных предприятий считается концентрация 0,001 мг/л, а в воздухе жилых районов – 0,00003 мг/л.
Вскоре химики указали, как спасаться от хлора: надо дышать через марлевую повязку, пропитанную раствором тиосульфата натрия (это вещество применяется в фотографии, его часто называют гипосульфитом). Хлор очень быстро реагирует с раствором тиосульфата, окисляя его:
Применение хлора.
Ежегодно во всем мире получают огромные количества хлора – десятки миллионов тонн. Только в США к концу 20 в. ежегодно путем электролиза получали около 12 млн. тонн хлора (10-е место среди химических производств). Основная его масса (до 50%) расходуется на хлорирование органических соединений – для получения растворителей, синтетического каучука, поливинилхлорида и других пластмасс, хлоропренового каучука, пестицидов, лекарственных средств, многих других нужных и полезных продуктов. Остальное потребляется для синтеза неорганических хлоридов, в целлюлозно-бумажной промышленности для отбеливания древесной пульпы, для очистки воды. В сравнительно небольших количествах хлор используют в металлургической промышленности. С его помощью получают очень чистые металлы – титан, олово, тантал, ниобий. Сжиганием водорода в хлоре получают хлороводород, а из него – соляную кислоту. Хлор применяют также для производства отбеливающих веществ (гипохлоритов, хлорной извести) и обеззараживания воды хлорированием.
Илья Леенсон
Якименко Л.М. Производство хлора, каустической соды и неорганических хлоропродуктов. М., Химия, 1974
Барков С.А. Галогены и подгруппа марганца: Элементы VII группы периодической системы Д.И.Менделеева. М., Просвещение, 1976
Фурман А.А. Неорганические хлориды. М., Химия, 1980
Хлор — химический элемент с атомным номером 17. Принадлежит к 17-й группе периодической таблицы химических элементов, находится в третьем периоде таблицы. Обозначается символом Cl. Активный неметалл. Галоген. Молекула хлора состоит из двух атомов. Кристаллическая решетка хлора ромбическая. Молярная масса хлора (M (Cl)) составляет 35,446-35,457 г/моль.
Ковалентная связь хлора:
В 1772 году Джозеф Пристли впервые получил первое соединение с хлором — газообразный хлороводород.
В 1774 году хлор был получен шведским ученым Вильгельмом Шееле, который описал выделение хлора при взаимодействии пиролюзита с соляной кислотой: 4 H C l + M n O 2 = C l 2 + M n C l 2 + 2 H 2 O
Шееле вывел хлор со следующими характеристиками:
- отбеливающие свойства;
- запах, как у водки;
- взаимодействие с Au(золото) и киноварью.
Однако Вильгельм, используя теорию флогистона, сделал предположение о том, что хлор состоит из дефлогистированной муриевой (соляной) кислоты.
В 1826 году химиком Йёнсом Якобом Берцелиусом была определена точная атомная масса хлора 35,446. 35,457 а. е. м
Физические и химические свойства
К физическим свойствам хлора относят:
К химическим свойствам относят:
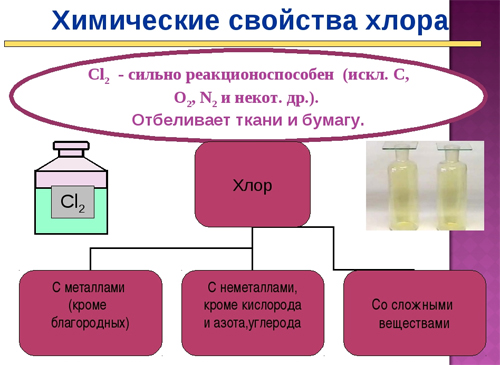
- хлор реагирует почти что со всеми металлами (чтобы взаимодействовать с некоторыми из них, нужны условия влаги или нагревания):
C l 2 + 2 H B r → B r 2 + 2 H C l — при таких реакциях хлор вытесняет бром из соединений с водородом или металлом;
2 N a + C l 2 → 2 N a C l — при взаимодействии натрия и хлора мы получаем хлорид натрия;
2 F e + 3 C l 2 → 2 F e C l 3 — при взаимодействии железа и хлора мы получим хлорид железа(III);
- хлорированием сухого гидроксида кальция получают хлорную известь: C l 2 + C a ( O H ) 2 → C a C l ( O C l ) + H 2 O ;
- под действием хлора на аммиак можно получить трихлорид азота: 4 N H 3 + 3 C l 2 → N C l 3 + 3 N H 4 C l ;
- при растворении в воде или щелочах:
C l 2 + H 2 O ⇄ H C l + H C l O
C l 2 + 2 N a O H → N a C l + N a C l O + H 2 O ;
- в реакции с монооксидом углерода образуется фосген: C l 2 + C O → C O C l 2 ;
- взаимодействие с неметаллами (кроме азота, кислорода, углерода, фтора и инертных газов): 5 C l 2 + 2 P → 2 P C l 5
- при взаимодействии водорода и хлора образуется активная реакция, иногда со взрывом, по радикально-цепному механизму, посмотрим на формулу:
H 2 + C l 2 → 2 H C l ;
Строение электронной оболочки
Электронная оболочка — совокупность всех электронов в атоме, которые окружают ядро.
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1s2 2s2 2p6 3s2 3p5. За счет присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и прочие степени окисления.
Обратимся к схеме возбужденных состояний атомов хлора:
Нахождение в природе
В природе хлор встречается только в виде соединений: сильвина KCl, галита NaCl, сильвинита K C l * N a C l , карналлита K C L * M g C l 2 * 6 H 2 O , каинита K C L * M g S O 4 * 3 H 2 O , бишофита M g C l 2 * 6 H 2 O . В земной коре хлор — самый распространенный галоген. Примерное содержание хлора в земной коре составляет 0,013%. Самые большие запасы хлора находятся в морских водах, где содержание составляет около 18 , 8 г / л . Содержание хлора в литосфере 0 , 25 м а с с . %
Биологическая роль хлора
Ионы хлора жизненно необходимы растениям, потому что они участвуют в энергетическом обмене у растений. Человек потребляет 5-10 г NaCl в сутки. Каждый день с пищей человек получает 3-6 г хлора, что абсолютно покрывает потребность в этом элементе откуда-либо из внешней среды.
Хлорные каналы присутствуют во многих типах митохондриальных мембран, скелетных мышцах и клетках. Эти каналы выполняют исключительные функции в нормализации объема жидкости, участвуют в поддержании кислотно-щелочного баланса — рН клеток. Всасывание хлора происходит в толстой кишке.
Получение и применение хлора
Получение хлора в химии
В настоящее время химические методы получения хлора не используют, так как они являются очень ресурсозатратными и малоэффективными.
Метод Дикона
В 1867 году ученым химиком Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха: 4 H C l + O 2 → 2 H 2 O + 2 C l 2 ↑
Современные лабораторные методы
На данный момент хлор используется в лабораториях в баллонах.
Получение хлора в лабораториях осуществляется посредством реакции кислот на гипохлорит натрия: 4 N a O C l + 4 C H 3 C O O H = 4 N a C H 3 C O O + 2 C l 2 ↑ + O 2 ↑ + 2 H 2 O .
Для того чтобы получить небольшое количество хлора, обычно используют процессы, основанные на окислении хлороводорода более сильными окислителями. Чаще всего это перманганат калия или диоксид марганца: 2 K M n O 4 + 16 H C l → 2 K C l + 2 M n C l 2 + 5 C l 2 ↑ + 8 H 2 O
Электрохимические методы
При невозможности использования сжиженного хлора в баллонах, используют электрохимические методы.
На сегодняшний день в промышленных масштабах хлор получают вместе с гидроксидом натрия и водородом путем электролиза раствора поваренной соли: 2 N a C l + 2 H 2 O + 2 e - → 2 N a O H + C l 2 ↑ + H 2 ↑
В промышленности применяются три варианта электрохимического метода: два из них — электролиз с твердым катодом, третий — электролиз с жидким ртутным катодом (ртутный метод производства). При таких методах качество получаемого хлора почти не отличается.
Мембранный метод
Мембранный метод производства хлора наиболее энергоэффективен, но при этом довольно сложен в организации и эксплуатации.
В мембранном методе катодное и анодное пространства полностью разделены непроницаемой для анионов катионообменной мембраной. Поэтому в мембранном электролизере два потока.
В анодное пространство поступает поток раствора соли. А в катодное — деионизированная вода. Все потоки предварительно очищаются от всевозможных примесей.
Применение хлора
- беление бумаги и тканей;
- получение хлорида олова для дымовых завес;
- хлорирование воды в бассейнах;
- получение красителей;
- получение растворителей и отбеливателей;
- получение при производстве синтетического каучука;
- получение синтетических волокон;
- получение средств для защиты растений и деревьев;
- получение и изготовление пластмассы;
- изготовление дезинфицирующих средств.
Реакции с органическими веществами
С насыщенными соединениями: C H 3 - C H 3 + C l 2 → C 2 H 5 C l + H C l
Замещение атомов водорода в молекулах О В :
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов: C 6 H 6 + C l 2 → C 6 H 5 C l + H C l
Присоединение молекул C l 2 по месту разрыва кратных углерод-углеродных связей: H 2 C = C H 2 + C l 2 → C l H 2 C - C H 2 C l — 1 , 2 -дихлорэтан
Особенности работы с хлором
Хлор — токсичный удушливый газ, который при попадании в легкие вызывает ожог легочной ткани или удушье. Раздражающее действие на дыхательные пути начинается при сосредоточении в воздухе около 0 , 006 м г / л . Хлор был использован в войнах одним из первых в качестве отравляющего вещества. При работе с хлором обязательно нужно использовать защитную спецодежду, противогаз, перчатки.
Читайте также:

