Сообщение на тему микробиологические способы получения металлов
Обновлено: 07.07.2024
Биогеотехнология металлов (биогидрометаллургия) – это наука об извлечении металлов из руд, концентратов, горных пород и растворов под воздействием микроорганизмов или их метаболитов при нормальном давлении и температуре от 5 до 80 – 90 °С.
Наиболее ранние сведения о выщелачивании меди встречаются в записях об античных горных производствах. Около 160 г. до н.э. К. Гален (натуралист и врач) сообщил о методе выщелачивания меди в древних медных рудниках острова Кипр. В 1497 г. в северном районе Венгрии получали медь из растворов, поступающих из руды, методом цементации на железном скрапе. В 1566 г. там же осуществили полный цикл выщелачивания с использованием системы орошения. На территории Германии выщелачивание меди из отвалов практиковалось также в XVI в.
Извлечение меди из растворов, поступающих из шахт медно-колчеданных месторождений, активно практиковали на Урале в середине 40 – 50-х годов XX в. В 1949 г. на Урале было добыто 5 730 т меди из сточных вод.
В 60-е годы в Канаде начали промышленное подземное выщелачивание урана. В настоящее время разработкой и освоением биогидрометаллургических технологий занимается более 100 фирм и организаций в 25 странах мира.
Открытие микроорганизмов, важных для биогеотехнологии металлов.Исследования русского ученого С. Н. Виноградского в конце XIX в. в области литотрофии стимулировали изучение роли микроорганизмов в круговороте серы и других элементов в природе. В 1902 г. крупнейший голландский микробиолог М. Бейеринк выделил новый автотрофный микроорганизм Thiobacillus thioparus, окисляющий серу и ряд ее восстановленных соединений при высоких значениях рН среды.
В 1921 – 1922 гг. В. Рудольф и А. Хельброннер впервые провели исследования на рудниках, которые показали, что некоторые неидентифицированные сероокисляющие микроорганизмы способны окислять пирит и сульфиды цинка.
В это же время С. А. Ваксман и Дж. С. Джоффи выделили автотрофный ацидофильный микроорганизм Thiobacillus thiooxidans (ныне Acidithiobacillus thiooxidans), окисляющий серу и ряд ее восстановленных соединений до серной кислоты. Предположения о возможной роли бактерий в образовании серной кислоты в шахтных водах в угольных месторождениях впервые были высказаны Л. Карпентором и Дж. Херндоном в 1933 г. В настоящее время известен ряд хемолитотрофных бактерий, важных для биогидрометаллургии. В практике добычи металлов особое внимание уделяется бактериям A. ferrooxidans, A. thiooxidans, A. caldus и Leptospirillum ferrooxidans, которые окисляют Fe 2+ , S 2- , S° и сульфидные минералы.
Определенный интерес представляют ацидофильные гетеротрофные бактерии Acidiphilium cryptum, Ac. angustum, Ac. rubrum и Ac. facilis. Они способствуют выщелачиванию металлов хемолитотрофными бактериями.
Физико-химические основы выщелачивания металлов из руд. Бактериально-химическое выщелачивание – извлечение химических элементов из минералов, руд, концентратов и горных пород посредством их окисления и/или растворения микроорганизмами или продуктами их метаболизма. Основными физико-химическими факторами при кучном, подземном и чановом выщелачивании меди, цинка, никеля, урана являются рН, Eh, температура, наличие кислорода, ионов сернокислого оксидного железа (Fe 3+ ) и т.д. От совокупности благоприятных факторов (рН 1,2 – 2,0; Eh 700 мВ, и др.) зависит активность сообщества бактерий, окисляющих сернокислое закисное железо (Fe 2+ ), серу (S°, S 2+ ) и сульфидные минералы.
Химические реакции, происходящие в процессе бактериального окисления:
Образующиеся продукты этой реакции (Fe 2+ , S° и др.) окисляются бактериями до конечных продуктов:
Fe 2+ + О2 + 4Н + бактерии 4 Fe 3+ + 2Н2О
Продукты этой и подобных ей реакций окисляются бактериями до Fe 3+ или H2SO4. Таким образом, эти бактериально-химические процессы едины и создают низкую величину рН, высокий окислительно-восстановительный потенциал среды, необходимую концентрацию Fe 3+ и обеспечивают активные процессы выщелаивания металлов из руд. Следует отметить особые окислительные свойства Fe 3+ в кислой среде в отношении вторичных сульфидных минералов меди, цинка и некоторых минералов никеля (окисное железо является сильным окислителем и растворителем сульфидов).
Механизм бактериального окисления Fe 2+ , S 2- /S° и сульфидных минералов.Хемолитотрофные бактерии окисляют неорганические субстраты и получают энергию в соответствии с хемиосмотической теорией Митчела, а также по электрохимическим (коррозионным) механизмам (рис 11.1).

Рис.11.1. Модель функционирования железоокисляющей системы A. ferrooxidans и транспорта электронов
Бактериальное окисление субстратов включает следующие стадии:
· взаимодействие поверхностных структур бактерий с окисляемым субстратом (сорбция, адгезия);
· изменение физико-химических свойств окисляемых субстратов и их транспорт в клеточную стенку;
· окисление субстратов в поверхностных структурах клеток;
· транспорт электронов и протонов; образование мембранного потенциала;
· синтез АТФ и образование воды на внутренней поверхности ЦПМ.
Кучное и подземное выщелачивание меди.Бактериально-химическое выщелачивание цветных металлов проводят из отвалов бедной руды (кучное) и из рудного тела в месте залегания (подземное). Более распространено кучное выщелачивание меди. Технологические схемы приведены на рис.11.2.
Орошение дробленой руды в отвале или в рудном теле осуществляется водными растворами H2SO4, содержащими Fe 3+ , O2 и бактерии. При нормальной и пониженной температуре процессы окисления сульфидных минералов при рН 1,0 – 2,0 катализируют хемолитотрофные бактерии A. ferrooxidans, A. thiooxidans, L. ferrooxidans и F. acidiphilum.

Рис.11.2 Процесс кучного выщелачивания:
1 – куча; 2 – поверхность почвы; 3 – прудок для сбора продуктивных растворов; 4– насос; 5 – желоба для цементации; 6 – прудок для отработанного раствора; 7– насос; 8 – система орошения отвала; 9 – металл
В зонах разогрева руды в результате экзотремических окислительных процессов при температуре 55 °С широко распространены умеренно-термофильные бактерии p. Sulfobacillus и A. caldus. При температуре выше 50 °С в окислительных процессах участвуют термофильные бактерии p. Acidianus и Metallosphaera.
Растворы подаются через скважины при подземном выщелачивании металлов или путем разбрызгивания, или создания прудков на поверхности отвалов при кучном выщелачивании металлов. В руде в присутствии окислителей (бактерии, О2, Fe 3+ ) и при оптимальных условиях орошения руды сульфидные минералы окисляются, а цветные металлы в кислой среде переходят в растворимое состояние.
Металлы из растворов извлекают:
· цементацией. Цементацияв цветной металлургии, гидрометаллургический процесс, основанный на вытеснении более электроположительных металлов из растворов их соединений менее электроположительными металлами, находящимися в твёрдом состоянии. Разность потенциалов позволяет осуществлять реакцию, например:
Чем больше разность потенциалов, тем меньше остаточное содержание в растворе осаждаемого металла
· концентрируют методом экстракции и затем извлекают электролизом.
После извлечения ценных элементов растворы опять поступают на орошение руды (схема замкнутая).
Переработка сложных руд и концентратов в реакторах (чановое выщелачивание).Процесс извлечения металлов из концентратов с использованием бактерий и осуществляемый в специальных аппаратах называется чановым. Он проводится в аппаратах, обеспечивающих перемешивание, аэрацию и регуляцию температурного режима в пульпе и предназначен для использования в комбинированных технологических схемах, включающих операции – гравитацию или флотацию, бактериальное окисление сульфидных минералов и переработку твердых остатков и растворов.
Бактериально-химическое окисление концентратов проводят в непрерывных условиях в серии последовательно соединенных реакторов с перемешиванием и аэрацией при 30 °С для мезофилов, от 45 – 40 °С для умеренных термофилов и 60 – 70 °С для облигатных термофилов.
Концентрат измельчают до размеров частиц 40 – 70 мкм, помещают в контактный чан и создают плотность пульпы от 20 до 40 % твердого вещества. После постепенного заполнения всех реакторов система работает в непрерывном проточном режиме. Схема переработки концентратов может быть замкнутой. Оборотные растворы после частичной или полной регенерации используют для выщелачивания или сбрасываются в хранилище.
Влияние технологических условий на процесс выщелачивания металлов. Размеры частиц и плотность пульпы. Размеры частиц руды или концентрата определяют площадь их поверхности, от которой зависит адгезия бактерий и скорость окислительных процессов. Наибольшая скорость окисления сульфидов в пульпе A. ferrooxidans при чановом выщелачивании наблюдается при размерах частиц от 2 – 3 до 40 мкм, однако в промышленных условиях обычно используются частицы флотационного концентрата размером 74 мкм. Частицы меньше 0,2 мкм повреждают структуру клетки, и FeS2 не окислялся.
При кучном и подземном выщелачивании металлов тонкое измельчение руды невозможно, так как с крупностью материала в тесной связи находится водопроницаемость и аэрация руды.
Плотность пульпы (соотношение твердого вещества к жидкому) при чановом выщелачивании зависит от типа концентрата или промпродукта. Переработку цинксодержащих продуктов мезофильными бактериями можно проводить при плотности пульпы 16 – 40 %, медных концентратов – до 30 %. Вскрытие золота в золото-мышьяковых концентратах эффективно проводится при плотности пульпы до 20 %.
Влияние химических элементов.Токсичность металлов для бактерий зависит от физиологического состояния бактерий, химического состояния металлов и степени их взаимодействия в среде. К наиболее токсичным катионам относят Cd, Ag, Hg и U. Анионы Se, Те, As и Mo более токсичны, чем большинство катионов металлов. Калий снижал токсичность серебра. Токсичность металлов снижается в присутствии комплексующих агентов. Например, добавление цистеина предотвращает ингибирование A. ferrooxidans Ag + . В целом A. ferrooxidans высокоустойчив к отдельным металлам: Сu – 50 г/л; Zn – 70 мг/л; Со – 30 г/л; As – 6–10 г/л; Мо – 200 мг/л; А1 – 20 г/л; Ni – 72 г/л; Ag – 1,0–10 мг/л; Cd – 120 мг/л; U3Og – 12 г/л. Резистентность других хемолитотрофов к металлам изучена недостаточно.
Источники питания.Важнейшими элементами для жизнедеятельности хемолитотрофных бактерий в биогидрометаллургии являются азот и фосфор. Как при чановом, так и при кучном и подземном выщелачивании металлов другие необходимые для бактерий элементы поступают из руды или концентратов. Азот и фосфор обычно либо отсутствуют, либо присутствуют в низких количествах, причем они постоянно выводятся из среды, вступая в реакции с другими элементами с образованием фосфатов железа и т.д., и поэтому требуется их постоянное добавление. С солями азота и фосфора поступает и калий. При замене в традиционных средах солей азота, фосфора и калия на аммофос снижается их стоимость в 10 раз без изменения.
Влияние микробиологических факторов.Штамм А. ferrooxidans является устойчивым в технологических условиях, который адаптирован к комплексу факторов (рН, ионы металлов, тип минерала и т. д.), а не к какому-либо одному из них. Этот тезис оказался справедливым и для других хемолитотрофов. В рудах и концентратах обычно присутствуют сообщества хемолитотрофных и некоторых ацидофильных гетеротрофных бактерий. В технологических условиях в окислении Fe 2+ , S 2- /S° и сульфидных минералов принимает участие сообщество бактерий. Хотя, как уже отмечалось выше, в зависимости от условий существует лидер или несколько штаммов-лидеров.
Влияние температуры.При снижении температуры до 15 о С средняя удельная скорость роста различных штаммов A. ferrooxidans уменьшалась в 2,8 – 4 раза, а средняя скорость окисления Fe 2+ – в 2,3 – 3 раза. При снижении температуры до 8 °С эти величины уменьшались в 6,1 – 13,3 и 4,5 – 8,0 раз соответственно. Роль термофильных бактерий в биогидрометаллургии изучена еще слабо. В отвалах руд, богатых сульфидными минералами, при их окислении происходит разогрев вплоть до самовозгорания. Из этих руд выделяются умеренно- и экстремально-термофильные бактерии.
При спонтанном разогреве руд в отвалах можно ожидать положительного эффекта от деятельности термофильных бактерий.
Экологические аспекты выщелачивания металлов. При рассмотрении экологических проблем биогидрометаллургии следует прежде всего иметь в виду технологические особенности этого способа добычи металлов. Все технологические схемы замкнутые, поэтому в значительной мере исключают выброс растворов в биосферу. Исключаются выбросы вредных газов в атмосферу. Подземное выщелачивание исключает необходимость отвода больших участков земли под горные предприятия, при этом сохраняется ландшафт. В кучном выщелачивании утилизируют металлы старых отвалов и вновь отсыпаемых, тем не менее каждый тип выщелачивания имеет свои отходы, опасные для окружающей среды. Общим для всех гидрометаллургических предприятий отходом являются растворы, содержащие тяжелые металлы. Обычно растворы, которые выводятся из оборота, нейтрализуются и сбрасываются в специальные прудки, а затем, после естественной доочистки, в реки. При такой операции они в значительной мере очищаются от металлов. Однако и эти воды нуждаются в полной очистке от металлов. Микробиологические способы сорбции и осаждения металлов, по-видимому, являются наиболее перспективными для решения этой проблемы. Некоторые из них испытаны в промышленных условиях.
Не менее актуальна также проблема обезвреживания твердых отходов биогидрометаллургических производств, например соединений мышьяка (арсенат железа или кальция), цианидов, роданидов и т. д., однако она окончательно еще не решена.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Что такое биогеотехнология металлов.
2. Характеристика микроорганизмов, важных для биогеотехнологии металлов.
3. Физико-химические основы выщелачивания металлов из руд. .
4. Химические реакции, происходящие в процессе бактериального окисления:
5. Механизм бактериального окисления Fe2+, S2- /S° и сульфидных минералов.
6. Стадии бактериального окисления субстратов?
7. Кучное и подземное выщелачивание меди.
8. Что такое цементация в цветной металлургии.
9. Влияние технологических условий на процесс выщелачивания металлов.
10. Экологические аспекты выщелачивания металлов.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Беккер, М.Е.Введение в биотехнологию/М.Е. Беккер. – М.: Пищевая промышленность, 1978. – 231 с.
2. Березин, И.В. Инженерная энзимология/ И.В. Березин, А.А.Клесов, В.К.Швядас. – М.: Высшая школа, 1987. – 144 с.
3. Березин, И.В. Иммобилизованные ферменты/И.В. Березин, Н.Л.Клячко, А.В.Левашев и др. – М.: Высшая школа, 1987. – 160 с.
4. Богданова, О.Ю. Основные питательные среды для культивирования микроорганизмов. Приготовление питательных сред/О.Ю. Богданова, Е.В. Макаревич// Методические указания к выполнению лабораторной работы. – Мурманск МГТУ, 2002. – 38 с.
5. Быков, В.А. Микробиологическое производство биологически активных веществ и препаратов/В.А. Быков, И.А. Крылов, М.Н. Манаков. – М.: Высшая школа, 1987. – 142 с.
6. Быков, В.А. Производство белковых веществ/В.А. Быков, М.Н. Манаков, В.И. Панфилов. – М.: Высшая школа, 1987. – 142 с.
7. Вербина, Н.М. Микробиология пищевых производств /Н.М. Вербина, Ю.В. Каптерова. – М.: Агропромиздат, 1988. – 288 с.
8. Голубовская, Э.К. Биологические основы очистки воды/Э.К. Голубовская. – М.: Высшая школа, 1978. – 270 с.
10. Жвирблянская, А.Ю. Микробиология в пищевой промышленности/А.Ю. Жвирблянская, О.А. Бакушинская. – М.: Пищевая промышленность, 1975. – 501 с.
11. Егоров, Н.С. Основы учения об антибиотиках/Н.С. Егоров. – М.: Высшая школа, 1986. – 448 с.
12. Егорова, Т. А. Основы биотехнологии/ Т. А. Егорова, С.М. Клунова, Е.А. Живухина// Учебное пособие. – М.: Академия, 2003. – 208 с.
13. Елдышев, Ю.Н. Современная биотехнология/Ю.Н. Елдышев. – М:Тайдекс Ко, 2004.
15. Макаревич, Е.В. Микроорганизмы заквасок кисломолочных продуктов/Е.В. Макаревич, М.Ю. Литвинова// Методические указания. – Мурманск МГТУ, 2008.
16. Макаревич, Е.В.Гидромикробиологический анализ сточных вод/Е.В. Макаревич, М.Ю. Литвинова//Методические указания. – Мурманск МГТУ, 2008. – 32 с.
17. Макаревич, Е.В. Микробиологическая деструкция ксенобиотиков/Е.В. Макаревич// Методические указания. – Мурманск МГТУ, 2008.
18. Мюнх, Г.Д. Микробиология продуктов животного происхождения/Г.Д. Мюнх, Х.Заупе, М. Шрайтер. – М.: Агропромиздат, 1985. – 592 с.
19. Нетрусов, А.И. Экология микроорганизмов/А.И. Нетрусов. – М.: Академия, 2004. –267 с.
20. Определитель бактерий Берджи /Под ред. Дж. Хоулта, Н. Крига, П. Смита и др.//В 2 т.: Пер. с англ. – М.: Мир,1997.
21. Промышленная микробиология/Под ред. Егорова Н.С. – М.: Высшая школа, 1989.
22. Хиггинс, И. Биотехнология. Принципы и применение /И. Хиггинс, Д. Бест, Дж. Джонс. – М.: Мир, 1988. – 480 с.
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Общая характеристика и способы получения металлов
Значительная химическая активность металлов (взаимодействие с кислородом воздуха, другими неметаллами, водой, растворами солей, кислотами) приводит к тому, что в земной коре они встречаются главным образом в виде соединений: оксидов, сульфидов, сульфатов, хлоридов, карбонатов и т. д. В свободном виде встречаются металлы, расположенные в ряду напряжений правее водорода (Аg, Нg, Рt,Аu, Сu), хотя гораздо чаще медь и ртуть в природе можно встретить в виде соединений.
Минералы и черные породы, содержащие металлы и их соединения, из которых выделение чистых металлов технически возможно и экономически целесообразно, называют рудами.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, и отрасль промышленности.
Любой металлургический процесс — это процесс восстановления ионов металла с помощью различных восстановителей. Суть его можно выразить так:
Чтобы реализовать этот процесс, надо учесть активность металла, подобрать восстановитель, рассмотреть технологическую целесообразность, экономические и экологические факторы.

В соответствии с этим существуют следующие способы получения металлов:
Пирометаллургия
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода (II), водорода, металлов — алюминия, магния.
Например, олово восстанавливают из касситерита SnО2, а медь — из куприта Cu2O
прокаливанием с углем (коксом):
SnО2+ 2С = Sn + 2СО ↑; Cu2O + С = 2Cu+ СО ↑
Сульфидные руды предварительно подвергают обжигу при доступе воздуха, а затем полученный оксид восстанавливают углем:
2ZnS + 302 = 2ZnО + 2SO2 ↑; ZnО + С = Zn + СО ↑
сфалерит (цинковая обманка)
Из карбонатных руд металлы выделяют также путем прокаливания с углем, т. к. карбонаты при нагревании разлагаются, превращаясь в оксиды, а последние восстанавливаются углем:
FeСO3 = FеО + СO2 ↑ ; FеО + С = Fе + СО ↑
сидерит (шпатовый железняк)
Восстановлением углем можно получить Fе, Сu, Zn, Сd, Ge, Sn, Рb и другие металлы, не образующие прочных карбидов (соединений с углеродом).
В качестве восстановителя можно применять водород или активные металлы:
К достоинствам этого метода относится получение очень чистого металла.
2) TiO2+ 2Мg = Тi + 2МgO (магнийтермия)
Чаще всего в металлотермии используют алюминий, теплота образования оксида
которого очень велика (2А1 + 1,5 O2 = Аl2O3 + 1676 кДж/моль). Электрохимический ряд напряжений металлов нельзя использовать для определения возможности протекания реакций восстановления металлов из их оксидов. Приближенно установить возможность этого процесса можно на основании расчета теплового эффекта реакции (Q), зная значения теплот образования оксидов:
где Q1— теплота образования продукта, Q2 -теплота образования исходного вещества.
Доменный процесс (производство чугуна):
C + O2 = CO2, CO2 + C ↔ 2CO
3Fe2O3 + CO = 2(Fe 2 Fe 3 2)O4+ CO2
(Fe 2 Fe 3 2)O4+ CO= 3FeO + CO2
FeO + CO= Fe + CO2
(чугун содержит до 6,67% углерода в виде зерен графита и цементита Fe3C);

Выплавка стали (0,2-2,06% углерода) проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (CO2, SO2), либо связываются в легко отделяемый шлак – смесь Ca3(PO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Гидрометаллургия
Гидрометаллургия — это восстановление металлов из их солей в растворе.
Процесс проходит в два этапа: 1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) из полученного раствора данный металл вытесняют более активным или восстанавливают электролизом. Например, чтобы получить медь из руды, содержащей оксид меди СuО, ее обрабатывают разбавленной серной кислотой:
Затем медь либо извлекают из раствора соли электролизом, либо вытесняют из сульфата железом:
Таким образом, получают серебро, цинк, молибден, золото, уран.
Электрометаллургия
Электрометаллургия — восстановление металлов в процессе электролиза растворов или расплавов их соединений.
Этим методом получают алюминий, щелочные металлы, щелочноземельные металлы. При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов.

Считается, что еще за 1000 лет до нашей эры жители Средиземноморья широко использовали дренажные воды рудников для добычи меди, но о том, как это тогда делалось, сведений почти не сохранилось. Известно, что в XVIII в. выщелачивание меди широко применялось на руднике Рио-Тинто в Испании. Всего 25 лет назад горняки, обрабатывавшие руду этим ставшим уже традиционным способом, и не подозревали, что ключевую роль в выщелачивании играют бактерии. При их непосредственном участии медь переходит в растворимые соединения, которые могут быть вымыты из руды водой. Сегодня бактерий сознательно используют при добыче меди из бедной руды; из миллиардов тонн руды получается несколько сотен тонн меди. В США, таким образом, получают более 10% от общего объема добычи этого металла. В последние годы аналогичный способ выщелачивания стали применять при добыче еще одного металла — урана.
Преимущества биологических методов в добыче и переработке руд
Хемолитрофы — пожиратели камня
Прямое и косвенное бактериальное выщелачивание
Бактериальное выщелачивание
Прочие методы выщелачивания руды
Будущее метода бактериального выщелачивания
Микробиологические процессы удаления металлов из растворов
Многие бактерии, водоросли и грибы способны накапливать неорганические ионы, поглощая их из сточных вод. Микробиологические процессы удаления металлов из растворов можно подразделить на три группы:
- адсорбция металлов на поверхности микробных клеток,
- поглощение металлов клетками,
- их химическое превращение.
Недавно было показано, что обычные пивные дрожжи Saccharomyces сеrevisiae и гриб Rhizopus arrhizus способны поглощать уран из сточных вод. Судя по оптимальной для связывания урана дрожжами кислотности среды, положительно заряженные ионы металла действительно взаимодействуют с отрицательно заряженными лигандами на поверхности клеток. Урана дрожжи могут адсорбировать до 10—15% от сухого веса клеток, а гриб R. arrhizus — до 18,5%. Это более чем вдвое превышает адсорбционную емкость имеющихся в продаже ионообменных смол. Иногда на поверхности клеток некоторых микроорганизмов откладываются нерастворимые соединения металлов. Так, клетки нитевидных имеющих капсулу бактерий из группы Sphaerotilus — Lepiothrix и полиморфных бактерий Hyphomicrobium бывают покрыты сплошной коркой окислов марганца. Не случайно Sphaerotilus — Lepiothrix и Gallionella называют железобактериями: на их извитых стебельках образуются чехольчики, содержащие железо. Чудеса транспорта ионов этим не исчерпываются. Оказалось, что в клетках некоторых микроорганизмов могут накапливаться токсичные металлы, причем в очень высокой концентрации. Так, в литре культуры Pseudomonas aeruginosa, обычного обитателя почвы и воды, менее чем за 10 с может накопиться до 100 мг урана. При помощи электронного микроскопа С. Шумейт-второй и Дж.Стрэндберг (Национальная лаборатория Окридж) установили, что уран накапливали только 44% клеток. Таким образом, содержание урана достигало 56% от сухого веса в тех клетках, которые активно его накапливали. Накопление токсичных металлов для клетки равнозначно самоубийству; о причинах такого поведения микробов нам ничего не известно. Можно надеяться, что когда-нибудь мы научимся использовать это явление для очистки сточных вод, загрязненных металлами. Для решения важной проблемы очистки полезными могут оказаться и другие микробиологические методы. Многие микроорганизмы синтезируют специфические хелатирующие соединения, способные связывать разнообразные тяжелые металлы; хелатные соединения металлов выпадают в осадок. Другие микробы способны включать атомы металлов в летучие соединения, которые можно потом удалить выпариванием. Обычно в природных условиях нейтрализованные растениями и микроорганизмами металлы накапливаются в осадках, образующихся из отмерших клеток. Нерастворимые осадки сульфидов металлов могут формироваться в результате взаимодействия с металлами сероводорода, продукта жизнедеятельности сульфатвосстанавливающих бактерий. Быть может, для очистки сточных вод, загрязненных металлами, удастся использовать микроорганизмы типа Desulfovibrio, которые могут синтезировать сероводород. Для извлечения растворимых форм железа из кислых пластовых вод шахт бактерии Т. ferrooxidans, способные образовывать ионы трехвалентного железа, поселяют на поверхности специальных пластмассовых дисков, которые погружают в подлежащие очистке воды. Микробные клетки превращают содержащиеся в этой кислой среде ионы двухвалентного железа в трехвалентное, в результате чего образуются малорастворимые соединения. Такой способ обработки пластовых вод, видимо, позволит уменьшить стоимость нейтрализации содержащихся в них кислот. Некоторые металлы в результате метилирования (это химическая реакция, при которой атом металла замещает атом водорода в гидроксильной группе метилового спирта) дают летучие производные. Металлы и металлоиды, которые могут метилироваться живыми организмами, — это ртуть, селен, теллур, мышьяк, олово, свинец и кадмий. Теоретически этим же способом могут быть получены летучие производные платины, палладия, золота и таллия.
Перспективы использования микроорганизмов
Перспективы промышленного использования биологического метилирования металлов неопределенны: их летучие соединения трудно собирать, а некоторые из них к тому же очень ядовиты. Микробиологические процессы получения металлов и металлоидов из растворов тщательно изучали как в лаборатории, так и в природе, где иногда создаются условия, способствующие такой своеобразной деятельности бактерий. Примером может служить озеро Шист в провинции Манитоба (Канада). В него попадают отходы добычи и переработки руд и сточные воды близлежащего небольшого города. Благодаря питательным веществам, которые приносит канализация, в озере бурно растут водоросли, накапливающие металлы. После их гибели и разложения микроорганизмами образуется сероводород, а затем — осадок сульфидов металлов. Наблюдения над такими естественными системами самоочистки побудили ученых попытаться имитировать их. На месторождении Нью-Лид-Белт (шт. Миссури) извилистую дренажную канаву, проложенную в накопителе отбросов разработки, заселили водорослями Spirogyra, Rhizoclonium, Hydro-diclyon и Cladophora. Сточные воды служили для них источником питательных веществ и одновременно очищались от растворенных тяжелых металлов и мелких частиц породы. Чтобы водоросли не выносило в реку, на выходе системы устроили специальный отстойник. На урановых рудниках Грантс-Юрениум-Дистрикт (шт. Нью-Мексико) шахтные воды направляют в систему прудов, заселенных водорослями Spirogyra, Oscillatoria, Rhizoclonium и Chara, в которых накапливаются ионы молибдена, селена, урана и радия. Образующийся в прудах ил обогащен этими металлами и металлоидами; видимо, они осаждаются тем же путем, что и в озере Шист. В таких донных осадках находят много сульфатвосстанавливающих бактерий. Вероятно, осаждению ионов металлов способствует образуемый ими сероводород. Судя по данным исследований поглощения металлов такими микроорганизмами, как S. cerevisiae, R. arrhizus и Р. aeruginosa, можно думать, что для них удастся создать промышленные установки, в которых извлечение металлов из сточных вод будет осуществляться в контролируемых условиях. Генная инженерия позволит, надо надеяться, получить новые разновидности этих микроорганизмов, более активные в процессах осаждения металлов. Выше уже упоминалось, что только 44

Этот видеофрагмент даёт возможность учащимся вместе с путешественником побывать в местах, где были найдены самые большие самородки металлов, он расскажет о распространённости металлов в земной коре, о некоторых исторических фактах, касающихся металлов, а также о рудах и минералах. Вместе с ним ребята побывают на дне водоёма и увидят отложения металлов, смогут представить себя в роли геолога и сравнить такие минералы, как красный, бурый и магнитный железняк. Путешественник расскажет им об основных методах получения металлов и затронет некоторые вопросы охраны окружающей среды, связанные с получением металлов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Получение металлов. Нахождение их в природе"
Получение металлов. Нахождение их в природе
Ребята, сегодня мы побываем с вами в местах, где получают металлы, а также узнаем, где же встречаются металлы.
Ну что ж, начинаем путешествие. Металлы встречаются в природе в свободном состоянии, их называют самородными металлами, так и в виде соединений.

А вот распространённость химических элементов металлов в земной коре различна. К наиболее распространённым металлам относятся алюминий (7,45%), железо (4,20%), кальций (3,25%), натрий (2,40%), калий (2,35%) и магний (2,35%). Содержание других металлов в земной коре может составлять тысячные доли процента и ниже.

Некоторые историки считают, что упадок Римской империи был обусловлен массовым отравлением свинцом. Известно, что водопроводы Древнего Рима были из свинца. В свинцовых чанах хранили воду и вино. Попадая в человеческий организм, свинец вызывает поражение центральной нервной системы, приводит к изменению состава крови.
Многие металлы являются элементами, необходимыми для функционирования живых организмов. На долю ионов Na + , K + , Mg 2+ , Ca 2+ в организме человека приходится 99% всех ионов металлов.

К биологически наиболее значимым металлам относятся: K, Na, Mg, Ca, Fe, Cu, Co, Mn, Zn, Mo.
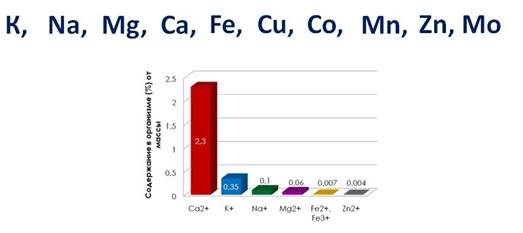
В земной коре металлы чаще всего встречаются в виде соединений: таких, как оксиды, силикаты, карбонаты, сульфиды и хлориды. Эти соединения входят в состав руд и минералов.
Рудой называют горную породу, получение из которой чистого металла экономически выгодно. В состав руды входят минералы и примеси в виде пустой породы. А минералы – это природные тела, имеющие определённый химический состав. Давайте с вами посмотрим названия и химический состав некоторых минералов.
Химический состав
Красный железняк (гематит)
Магнитный железняк (магнетит)
Железный колчедан (пирит)
Медный колчедан (халькопирит)
Свинцовый блеск (галенит)













К наиболее известным минералам относится пирит, или железный колчедан (FeS2), киноварь (HgS), малахит ((CuOH)2CO3). Пирит и киноварь используют в промышленности для получения соответствующих металлов, то есть железа и ртути, а малахит, как поделочный камень.

Представьте себя геологом или минералогом, как же это увлекательно. Для этого сравним такие минералы, как красный, бурый и магнитный железняк.
Цвет красного железняка коричнево-красный, сам он прочный, плотный, если провести образцом руды по поверхности фарфоровой ступки, то он оставляет красно-коричневый след, не притягивается магнитом.

Бурый железяк имеет жёлто-коричневую окраску, сам прочный и плотный, не притягивается магнитом, оставляет на фарфоровой ступки жёлто-бурую полосу.

Магнитный железняк чёрного цвета, сам прочный и плотный, притягивается магнитом, оставляет чёрный цвет черты на поверхности фарфоровой ступки, имеет металлический блеск.

Здорово, получается, что минералы отличаются между собой окраской, магнитными свойствами, цветом черты и некоторыми другими показателями.
В современной технике широко используют более 75 металлов и многочисленные сплавы на их основе. Поэтому большое значение придаётся промышленным способам получения металлов из руд. Обычно перед получением металлов из руды её измельчают, потом предварительно обогащают – отделяют пустую породу, примеси. В результате образуется концентрат, служащий сырьём для металлургического производства. Затем обогащённую руду превращают в оксид и только после этого восстанавливают металл.

Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов, о получении сплавов и обработке металлов. В зависимости от метода получения металла из руды (концентрата) существует несколько видов металлургических производств.
Представьте, что из одной т медной руды можно получить шестнадцать кг концентрата и только четыре кг чистой меди.

Такая отрасль металлургии, как пирометаллургия занимается переработкой руд, она основана на химических реакциях, при чём они проходят при высоких температурах, ведь от греч. пирос, означает огонь.
Пирометаллургические процессы включают обжиг и плавку.
При обжиге сульфиды переводят в оксиды, а сера удаляется в виде оксида серы (IV). А затем из оксида восстанавливают металл. Полученный металл или сплав подвергают механической обработке, придают ему соответствующую форму. В процессе выделения металлов (плавке) из оксидов в качестве восстановителей используют углерод, оксид углерода (II), водород, кремний или более активные металлы.
Например, ещё древние металлурги для получения железа из его руд использовали в качестве восстановителя углерод. Но этот способ неудобен тем, что реакция между твёрдыми веществами идёт только в местах их соприкосновения.
В промышленных масштабах для получения железа, цинка и других цветных металлов из оксидов используют в качестве восстановителя оксид углерода (II).
Сейчас мы посмотрим, как получают чугун и сталь. Восстановление железа проводят в специальных вертикальных печах, называемых доменными, высотой до нескольких десятков метров и внутренним объёмом до 5000 м 3 . Они имеют стальной корпус, а изнутри выложены огнеупорным кирпичом. По характеру своей работы доменная печь – аппарат непрерывного действия. Сверху в печь подаётся твёрдое сырьё – шихта, представляющая собой смесь железной руды, кокса (переработанного угля), известняка и других добавок, а снизу вдувается подогретый или обогащённый кислородом воздух. В нижней части печи кокс сгорает в горячем воздухе, образуя углекислый газ.

Углекислый газ поднимается вверх в печи и взаимодействует с новыми порциями раскалённого кокса
с образованием оксида углерода (II).
В результате реакций СО с оксидом железа (III) образуется железо.
В доменном процессе получается железо с относительно большим (более 2%) содержанием углерода – чугун.
Чугун превращают в сталь, удаляя избыточный углерод путём окисления кислородом воздуха в специальных установках – мартеновский печах, конвертерах или электропечах.

Для получения некоторых металлов в качестве восстановителя используют водород.

В роли восстановителей можно также использовать более активные металлы, способные вытеснять другие металлы из их оксидов и солей. Этот способ получения металлов называется металлотермией. Если используют алюминий, то говорят об алюминотермии:

Восстановление железа методом алюминотермии до сих пор применяется при сварке рельсов.

Этот метод получения металлов был предложен русским учёным
Н.Н. Бекетовым.

Гидрометаллургия – это методы получения металлов, основанные на химических реакциях, происходящих в растворе. Гидрометаллургические процессы включают стадию перевода нерастворимых соединений металлов из руд в растворы, с последующим восстановительным выделением металлов из полученных растворов с помощью других металлов или электрического тока.
Электрометаллургия – методы получения металлов, основанные на электролизе, т.е. выделение металлов из растворов или расплавов их соединений с помощью постоянного электрического тока. Этот метод применяют для получения активных металлов – щелочных и щелочноземельных, алюминия, также для получения легированных сталей. С помощью этого метода, английский химик Г. Дэви впервые получил калий, натрий, барий и кальций.


Таким образом, металлы встречаются в природе в виде соединений или в самородном состоянии. В земной коре металлы чаще всего встречаются в виде соединений: оксидов, силикатов, карбонатов, сульфидов, хлоридов. Эти соединения входят в состав руд и минералов. Для получения металлов из руд руду сначала измельчают, обогащают, переводят в оксид и только после этого восстанавливают металл. В качестве восстановителей используют C, CO, H2, Si или более активные металлы. Металлургия занимается получением металлов и их сплавов из руд. В зависимости от метода получения металла из руды существует несколько видов металлургических производств: пирометаллургия, гидрометаллургия и электрометаллургия.
Читайте также:

