Сообщение на тему качественные реакции
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Московский государственный университет имени М.В. Ломоносова
Факультет педагогического образования
по дисциплине "Методика преподавания химии"
" Качественные реакции в курсе химии "
студенты 3-го курса
Максакова С.А., Огородников С.С.
Поскольку эта тема представляет для авторов реферата интерес, мы попытались выявить, насколько хорошо качественные реакции изучаются в базовом, профильном курсах химии и во внеклассной работе.
Основными разделами аналитической химии являются качественный и количественный анализ.
Качественный состав вещества показывает, из атомов каких химических элементов состоит вещество. Количественный состав вещества показывает, сколько атомов каждого химического элемента входит в состав данного вещества.
Качественные реакции – это реакции, происходящие между анализируемым веществом и реагентом. Реагент – вещество известного состава, используемое для обнаружения ионов в составе анализируемого вещества.
Качественные реакции сопровождаются хорошо заметными изменениями:
• Образованием характерного осадка
• Интенсивным окрашиванием раствора
В настоящее время химический анализ используется в самых различных областях. В технике, промышленности, сельском хозяйстве, медицине, биологии. Необычайная широта использования химического анализа вызвала появление ряда отраслей аналитической химии.
Методы анализа
Химические методы анализа предусматривают химическое взаимодействие веществ. Важными являются результаты химической реакции между веществом и реагентом. Физические методы анализа используют физические свойства веществ:
изменение окраски пламени при внесении в него вещества,
температура плавления и кипения вещества,
спектры излучения и поглощения вещества
другие свойства, характерные для вещества.
Физико-химические методы анализа объединяют физические и химические методы. При проведении физико-химических методов результат химической реакции наблюдается по изменениям физических свойств вещества или раствора. Физико-химические методы получили широкое распространение и интенсивно развиваются.
Анализ сухим путем, т.е. без переведения в раствор твердых веществ, выражается в испытании их способности образовывать окрашенные стекла или окрашивать бесцветное пламя горелки. Окрашенные стекла получают при сплавлении в колечке платиновой проволоки над пламенем спиртовки или горелки небольшого количества буры (Na2B4O7×10H2O) с анализируемым веществом. Летучие соли некоторых металлов (соли соляной кислоты) при нагревании в бесцветном пламени спиртовки или горелки окрашивают пламя в характерный для данного элемента цвет. Так, соли натрия окрашивают пламя в желтый цвет, соли калия – в фиолетовый, кальция – в кирпично-красный, бария – в желто-зеленый, стронция – в карминово-красный, бора – в зеленый.
Мы, проработав программы профильного и базового уровня школьной подготовки, представляем таблицу:
Таблица 1. Требования к результатам освоения базового и профильного курса химии
Базовый уровень
Профильный (базовый + следующее):
1) Качественные реакции на ионы Cl-, SO42-, NH4+, Fe2+, Fe3+, CO32-, реакции на углекислый газ, на крахмал, многоатомные спирты.
2)Применение качественных реакций.
В медицине – при приготовлении лекарств, проведении анализов на содержание различных веществ в организме человека.
3)В судебной практике.
4)В лабораториях химических производств, в пищевой промышленности.
5)В аналитическом аспекте рассматриваются свойства индикаторов, аминокислот, взаимодействие этилена с бромной водой и перманганатом калия, реакция глюкозы с аммиачным раствором оксида серебра( и в целом, реакция на альдегиды) и даже цветные реакции белков. Далее дополнительно к ним добавляются аналитические свойства непредельных соединений, многоатомных спиртов, фенолов и других веществ. Предусматривается выполнение экспериментальных задач по распознаванию индивидуальных веществ сложного состава (смесей.)
Неорганическая химия
1) Качественные реакции на ионы Са2+, Ва2+(два способа), Pb2+(два способа), Ag (два способа), хлорид свинца и хлорид серебра различают по растворимости в аммиаке.
2)Групповые и селективные реакции анионов. Описываются некоторые реакции анионов. Групповыми реагентами являются ионы ВаCl2 и AgNO3. SO42-, SO32-,S2O32-,Cl-,I-,SCN-,PO43-, S2-.
3) Использование реакций комплексообразования в качественном анализе.
Fe2+ (образование турнбулевой сини)
Fe3+ (образование роданидов и берлинской лазури)
Co2+(реакция с аммиаком и его избытком)
Ni+( реакция с аммиаком и его избытком), (красный осадок диметилглиоксима с никелем в аммиачной среде)
Cu2+ и Zn2+ (реакции с гексацианоферратом)
Al3+(реакция с ализариновым красным)
Mg2+(реакция с хенализарином)
SCN- ,CH3COO-,PO43-, Si32-.
4) Использование окислительно-восстановительных реакций в качественном анализе:
Органическая химия:
Качественные реакции на одноатомные спирты:
1) Окисление спирта оксидом меди.
2) Проба Лукаса — конц. раствор соляной кислоты и хлорида цинка.
3) Иодоформная проба
Качественные реакции на карбоновые кислоты:
1) реакция на муравьиную (с серной кислотой(
2) на щавелевую кислоту ( раствором соли меди (II) => осадок оксалата меди (II)
Качественные реакции на амины.
1) окрашиванием лакмуса в синий цвет. Различение первичного амина от вторичного путем взаимодействия с азотистой кислотой HNO2.
2) Анилин образует осадок при добавлении бромной воды:
Качественная реакция на алкилхлориды.
Анализ обязательного минимума содержания основных общеобразовательных программ по химии позволяет выделить следующие знания и умения аналитической направленности, которые можно и нужно формировать в процессе обучения химии в основной и старшей школе (на базовом уровне):
• знания о простейших способах (методах) химического анализа;
• знания об объектах обнаружения: элементах, функциональных группах (группах атомов), молекулах, ионах;
• умение разделять смеси, определять качественный состав вещества опытным путем, решать экспериментальные задачи аналитической направленности, исследовать состав некоторых природных объектов;
• умение определять формулу химического соединения по результатам его анализа и, наоборот, рассчитывать количественное содержание элемента в чистом веществе по формуле соответствующего соединения.
Совершенно иной набор знаний и умений химико-аналитического характера должен быть сформирован при изучении факультативных и элективных дисциплин, а также на внеклассных (учебно-исследовательских) занятиях.
Внеклассная работа
Отдельно рассмотрим, как освещается тема качественных реакций во внешкольных занятиях.
1) Жёлтый осадок, или как обнаружить фосфаты.
3) Как обнаружить фосфорную кислоту в напитках.
4) Из бесцветного синий, или как йод и крахмал находят друг друга
5) Обнаружение крахмала в продуктах питания.
Лабораторные работы по химии (в классах профильного уровня).
Существовало четыре программы преподавания химии.
Базовый уровень. Час в неделю.
Школьный уровень. 2 часа в неделю.
Класс углублённого уровня (для физиков и математиков). 4 часа.
Биохимический класс. Если автор правильно помнит, 6 часов.
Ниже приводится программа лабораторных работ для класса углубленного уровня.
Занятие 1. Вводное. Даются общие принципы анализа раствора.
Предварительные испытания, наличие цвета и осадка в растворе.
Проба на окислитель-восстановитель.
Проведение специфических и селективных реакций.
Обнаружение и удаление неустойчивых ионов.
Преподаватель составляет таблицу со столбцами: катионы, реагент, продукт, характеристика группы.
Занятие 2. Использование метода осаждения в качественном анализе.
Учащимся раздаются описания, в которых приведены реакции обнаружения ионов и метод выполнения практической части. Приведены методы определения следующих ионов: Са 2+ , Ва 2+ (два способа), Pb 2+ (два способа), Ag (два способа), хлорид свинца и хлорид серебра различают по растворимости в аммиаке.
Занятие 3. Групповые и селективные реакции анионов. Описываются некоторые реакции анионов. Групповыми реагентами являются ионы Ва Cl 2 и AgNO 3. SO 4 2- , SO 3 2- , S 2 O 3 2- , Cl - , I - , SCN - , PO 43 - , S 2 - .
Занятие 4. Использование реакций комплексообразования в качественном анализе.
Занятие очень сложное, рассматриваются следующие реакции.
Fe 2+ (образование турнбулевой сини)
Fe 3+ (образование роданидов и берлинской лазури)
Co 2+ (реакция с аммиаком и его избытком)
Ni + ( реакция с аммиаком и его избытком), (красный осадок диметилглиоксима с никелем в аммиачной среде)
Cu 2+ и Zn 2+ (реакции с гексацианоферратом)
Al 3+ (реакция с ализариновым красным)
Mg 2+ (реакция с хенализарином)
SCN - , CH3COO - , PO 4 3- , Si 3 2- .
Занятие 5. Использование окислительно-восстановительных реакций в качественном анализе.
Проба с использование иодид-ионов с окислителем.
Обесцвечивание подкисленного раствора перманганата.
Реакция с бихроматом. Оранжевая окраска переходит в зеленую.
Далее по ходу занятий рассматривались следующие три темы.
Методы очистки веществ.
Способы оценки усвоения материала.
По ходу семестра учащимся даются контрольные растворы. Полугодие завершается анализом контрольного раствора. Раствор содержит от одного до трех катионов и анионов. Учащиеся должны самостоятельно определить состав своего раствора.
Отметили недостатки, которые, на наш взгляд, имеют место быть.
Мы считаем, что наличие в профильной программе заданий такого плана, не встречающихся в базовом курсе, хорошо для школьников. Это поможет ребятам при обучении в ВУЗах. Однако в рамках профильного обучения иногда рекомендуются такие задачи, которые достаточно трудны даже для профессионального аналитика, обоснованность их включения в школьные учебники вызывает серьезные сомнения.
Авторы надеются, что проведенная работа поможет им в будущей преподавательской деятельности.
Чернобельская Г.М. Методика обучения химии: учеб. пособие для студентов пед. ин-тов. М.: Владос, 2000г. –335 с.

Данный видеоурок основывается на изучении основных качественных реакций в химии. Учащиеся смогут посмотреть сюжеты качественного определения углекислого газа и известковой воды, крахмала и йода.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Качественные реакции в химии"
Многие вещества, которые нас окружают, мы можем определить по их специфическим признакам и свойствам. Например, алюминий несложно отличить от других металлов. Он легче, также легко изменяет свою форму, при трении о бумагу или белую ткань оставляет серую полосу. Медь – металл красного цвета, имеет металлический блеск, хорошо проводит электрический ток, поэтому медь применяют при изготовлении проводов.
Такие жидкости, как уксусная кислота и этиловый спирт, также легко отличить. У каждого из вас дома наверняка есть уксусная кислота. Определить её вы можете по специфическому резкому запаху. Уксусная кислота очень хорошо растворима в воде. Этиловый спирт имеет характерный запах и хорошо смешивается с водой.
Кристаллы медного купороса имеют синий цвет, легко растворяются в воде, образуя голубой раствор. У всех у вас в аптечке есть марганцовка, её также несложно отличить. Марганцовка представляет собой тёмно-фиолетовые кристаллы, которые хорошо растворяются в воде и образуют раствор ярко-розового цвета.
Однако многие вещества распознать достаточно сложно. Как распознать кислород и углекислый газ, ведь эти газы бесцветны и не имеют запаха? Или как узнать, какое вещество находится в пробирке: раствор кислоты или соли? Какой газ находится в сосуде? Для этого проводят химические реакции, в результате которых происходят изменения с веществами. Эти специфические признаки мы можем определить с помощью наших органов чувств: зрения, обоняния, слуха. Такие химические реакции называются качественными.

То есть качественные реакции – это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ.
Основными признаками химических реакций являются: изменение окраски, выпадение осадка, выделение газа, появление запаха, выделение тепла и света.
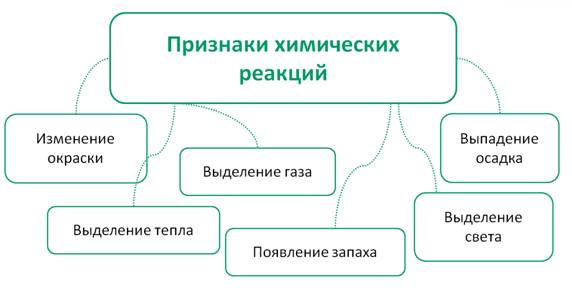
Такие явления при проведении качественных реакций называются аналитическими сигналами.
Если опустить тлеющую лучинку в пробирку с кислородом и углекислым газом, то в одной пробирке лучинка гаснет, а в другой – ярко вспыхивает. Этот опыт позволяет определить, в какой пробирке кислород, а в какой – углекислый газ. В той пробирке, где лучинка гаснет, находится углекислый газ, так как углекислый газ не поддерживает горение. В той пробирке, где лучинка вспыхнула, находится кислород, потому что кислород поддерживает горение.

А как отличить, например, углекислый газ от азота, ведь азот, как и углекислый газ, не поддерживает горение? Для этого существует качественная реакция на углекислый газ.
Если в стакан с углекислым газом добавить небольшое количество известковой воды и встряхнуть жидкость в стакане, то жидкость мутнеет. Таким образом, с помощью известковой воды, или раствора гашёной извести, можно обнаружить углекислый газ.
Если в пробирку с прозрачной известковой водой опустить стеклянную трубку и продуть через неё выдыхаемый воздух, то раствор мутнеет. Значит, и в выдыхаемом воздухе есть углекислый газ.

То есть вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество.
В нашем случае известковая вода является реактивом на углекислый газ и углекислый газ является реактивом на известковую воду.
Проведём небольшой эксперимент. В четырёх стаканах у нас находятся: вода, раствор поваренной соли, раствор сахара и известковая вода. Определим, в каком стакане известковая вода. Для этого нужно пропустить через жидкость в каждом стакане выдыхаемый воздух, который обогащён углекислым газом. В третьем стакане появилось помутнение, значит, здесь находится известковая вода.
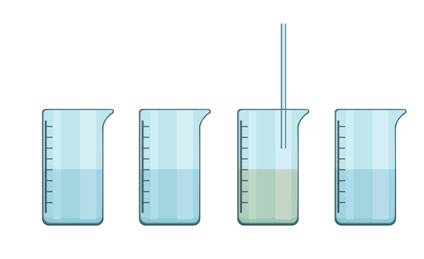
Чтобы реакцию можно было считать качественной, аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или немногими веществами. В противном случае трудно будет сделать вывод о том, какое вещество мы обнаружили с помощью реактива.
Например, крахмал можно обнаружить с помощью раствора йода и наоборот. Если капнуть несколько капель йодной настойки на кусочек картофеля, то наблюдается появление сине-фиолетовой окраски. Данная реакция является качественной на крахмал и подтверждает наличие крахмала в картофеле.
Качественные реакции неорганических веществ на катионы, анионы, для газов и для щелочных металлов
Качественные реакции на катионы
Катион
Реактив
Реакция
Характерные признаки
Н +
Красное окрашивание
Розовое окрашивание
Ва 2+
Растворимые сульфаты, серная кислота.
Пламя спиртовки.
Белый мелкодисперсный осадок BaSO4, нерастворимый в H2O и HNO3.
Желто-зеленая окраска пламени.
Ag +
Растворимые хлориды, соляная кислота
Белый творожистый осадок AgCl, нерастворимый в H2O и HNO3
NH 4+
Раствор щелочи, нагревание, влажная фильтровальная бумажка, пропитанная лакмусом или фенолфталеином; палочка, смоченная HCl(конц)
Al 3+
Растворы щелочи, кислоты
Белый осадок Al(OH)3, растворимый в кислоте в избытке щелочи
Zn 2+
Растворы щелочи, кислоты
Белый осадок Zn(OH)2, растворимый в кислоте в избытке щелочи
Mg 2+
Белый осадок Mg(OH)2, нерастворимый в избытке щелочи
Cr 3+
Растворы щелочи, кислоты
Cеро-зеленый осадок Cr(OH)3, растворимый в кислоте в избытке щелочи
Fe 2+
Раствор красной кровяной соли K3[Fe(CN)6]
Fe 3+
Раствор роданида аммония NH4CNS
Раствор желтой кровяной соли K4[Fe(CN)6]
Кроваво-красное окрашивание раствора Образование берлинской лазури Fe4[Fe(CN)6]3
Cu 2+
Раствор щелочи с последующим нагреванием
Ярко-голубой студенистый осадок, нерастворимый в избытке щелочи, разлагающийся при нагревании на черный осадок CuO и воду
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:

Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
Выпадение белого осадка, не растворимого в кислотах:
1) Выпадение осадка голубого цвета:
2) Выпадение осадка черного цвета:
Выпадение осадка черного цвета:
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O:
2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6]
1) Выпадение белого осадка, зеленеющего на воздухе:
2) Выпадение синего осадка (турнбулева синь):
2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6]
3) Роданид-ион SCN −
1) Выпадение осадка бурого цвета:
2) Выпадение синего осадка (берлинская лазурь):
3) Появление интенсивно-красного (кроваво-красного) окрашивания:
Fe 3+ + 3SCN − = Fe(SCN)3
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи:
и его растворение при дальнейшем приливании:
Выделение газа с резким запахом:
Посинение влажной лакмусовой бумажки
Качественные реакции на анионы
Выпадение белого осадка, не растворимого в кислотах:
1) Образование раствора синего цвета, содержащего ионы Cu 2+ , выделение газа бурого цвета (NO2)
Выпадение светло-желтого осадка в нейтральной среде:
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl:
Выпадение черного осадка:
1) Выпадение белого осадка, растворимого в кислотах:
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2:
Выделение газа SO2 с характерным резким запахом (SO2):
Выпадение белого осадка:
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.):
Читайте также:

