Сообщение на тему бериллий магний и щелочноземельные металлы
Обновлено: 30.06.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
15. Бериллий, магний и щёлочноземельные металлы
В главную подгруппу II группы входят бериллий (Be), магний (Mg), кальций (Са), стронций (Sr), барий (Ва) и радий (Ra). Кальций, стронций, барий и радий относятся к щёлочноземельным металлам. Первый элемент этой подгруппы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит. Второй элемент этой группы, магний, в некоторых отношениях значительно отличается от щелочноземельных металлов по ряду химических свойств
Атомы элементов II группы имеют на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2.
В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы. С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства возрастают.
Бериллий, магний и щелочноземельные металлы - это простые вещества. Лёгкие серебристо-белые металлы, исключение составляет только стронций, который имеет золотистый оттенок.
Например, кальций – серебристо белый и довольно твердый металл, легкий. Температура плавления и кипения выше, чем у щелочных металлов. Поскольку у кальция на энергетическом уровне находится 2 электрона, то его степень окисления во всех соединениях всегда равна +2. На воздухе кальций окисляется, поэтому его хранят в закрытых сосудах, обычно в керосине.
Химические свойства данной группы металлов рассмотрим на примере кальция.
С биологической точки зрения, кальций играет немаловажную роль для растений, животных и человека. В нашем организме он входит в состав костей. Кальций придает костям твердость. Например, при обычных условиях кальций реагирует с
галогенами, а с серой, азотом и углеродом – при нагревании. При взаимодействии кальция с хлором образуется хлорид кальция.
Ca + CI 2 = CaCI 2 (кальций плюс хлор два равно кальций хлор два)
При взаимодействии кальция с серой образуется сульфид кальция.
(кальций плюс сера равно кальций эс)
При взаимодействии кальция с азотом образуется нитрид кальция.
(три кальций плюс эн два стрелочка кальций три эн два)
Данные реакции происходят при нагревании.
Кальций ( Ca ) являясь активным металлом вытесняет водород из воды:
(кальций плюс два аш два о стрелочка кальций о аш дважды плюс аш два стрелочка вверх)
При этом не все металлы главной подгруппы II группы Периодической системы одинаково реагируют с водой: бериллий практически не взаимодействует с водой, т.к. взаимодействию препятствует защитная пленка на его поверхности, реакция магния с водой протекает довольно медленно, остальные же металлы взаимодействуют с водой аналогично кальцию.
При нагревании на воздухе кальций сгорает, образуя оксид кальция:
2С a + О 2 = 2 Ca О
(два кальций плюс о два равно два кальций о)
При взаимодействии кальций с углеродом образует карбид кальция С aC 2
С a + 2С = Ca С 2
(кальций плюс два це стрелочка кальций це два)
Вследствие своей высокой химической активности в природе щёлочноземельные металлы находятся только в форме соединений.
Оксиды данных металлов твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства. Исключение составляет оксид бериллия, который имеет амфотерный характер.
Рассмотрим оксиды на примере кальция.
Оксид кальция (техническое название: негашеная известь, жженая известь) – это порошок белого цвета.
Оксид кальция энергично взаимодействует с водой с образованием гидроксида кальция:
CaO + H 2 O = Ca ( OH ) 2 + Q
(кальций о плюс аш два о равно кальций о аш дважды плюс ку)
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашение извести, а образующийся Ca(OH) 2 - гашёной известью.
Гашеная известь – твердое вещество белого цвета, растворимое в воде. Раствор гашеной извести в воде называется известковой водой. Раствор обладает щелочными свойствами.
Рассмотрим щелочные свойства на примере:
Ca ( OH )2 + CO 2 → CaCO 3↓ + H 2 O
(кальций о аш дважды плюс це о два стрелочка кальций це о три стрелочка вниз плюс аш два о)
При пропускании через известковую воду оксида углерода ( IV ) раствор мутнеет
![]()
(кальций це о три плюс це о два плюс аш два о две стрелочки направленны противоположно друг другу кальций аш це о три дважды)
При дальнейшем пропускании замечаем, что муть исчезает.
Соли бериллия, магния и щёлочноземельных металлов получают при взаимодействии их с кислотами.
К солям кальция относится карбонат кальция. Карбонат кальция имеет следующую формулу - CaCO 3(кальций це о три)
Он содержится в известняке, меле и мраморе. Мрамор широко применяется в скульптуре и архитектуре, без известняка не обходится ни одно строительство, т.к. он сам является прекрасным строительным камнем и используется для получения таких материалов как стекло, цемент, гашеная и негашеная известь. В природе мел представляет собой остатки раковин древних животных, его можно увидеть в школе (школьные мелки), его используют в зубной пасте, при производстве бумаги, при побелке.
Сульфат кальция встречается в природе в виде минерала гипса - CaSO 4 *2 H 2 О ( кальций эс о четыре умножить два аш два о) .
Обжигом гипса при 150-180С 0 получают белый порошок – жженый гипс или алебастр
CaSO 4*0,5 H 2О( кальций эс о четыре умножить ноль целых пять десятых аш два о).
Если алебастр смешать с водой, то он быстро затвердевает, снова превращается в гипс.
CaSO 4*0,5 H 2О +1,5 H 2О = CaSO 4* 2 H 2О
(кальций эс о четыре умножить ноль целых пять десятых аш два о плюс одна целая пять десятых аш два о равно кальций эс о четыре умножить два аш два о)
Сульфат кальция широко используют в строительстве для изготовления скульптур и скульптурных элементов, для облицовочных и отделочных работ, в медицине для изготовления гипсовых повязок.
В главную подгруппу второй группы периодической системы элементов наряду с семейcтвом щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента – бериллий и магний.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту группу, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен. По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.
Бериллий (Beryllium)

В виде простого вещества бериллий получили в 1828 г. немецкий ученый Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия: BeCl2 + 2K = Be + 2KCl. В настоящее время бериллий получают, восстанавливая его фторид магнием: BeF2 + Mg = Be + MgF2, либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.

Бериллий — тугоплавкий металл(tпл= 1287 ̊ С) светло-серого цвета, покрытый тончайшей пленкой оксида, которая защищает его от коррозии. Для него характерно уникальное в мире металлов сочетание легкости с высокой твердостью. Чистый бериллий пластичен, однако даже незначительные примеси делают его хрупким.
Обладая высокой химической активностью, бериллий легко вступает в реакции с галогенами, серой и азотом. Вода на него не действует, зато он легко растворяется как в разбавленных кислотах: Be + 2HCl = BeCl2 + H2↑, так и в растворах щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2↑ Образующийся тетрагидроксобериллат натрия долгое время рассматривали как соль бериллиевой кислоты H2BeO2. На самом деле это комплексное соединение. Бериллаты более простого состава образуются при сплавлении оксида бериллия со щелочью или содой: Na2CO3 + BeO = Na2BeO2 + CO2↑. Здесь также проявляется сходство с алюминием.
Бериллий и его растворимые в воде соли ядовиты. Даже ничтожно малая их примесь в воздухе приводит к тяжелым заболеваниям. Несмотря на это, бериллий находит широкое применение в технике. Ещё в XIX в. обнаружили, что добавка Ве к меди сильно повышает ее твердость, прочность, химическую стойкость, делает ее похожей на сталь. Сплавы на основе меди, содержащие от 0,005 до 3% бериллия, получили название бериллиевых бронз. Из них изготовляют пружины, рессоры, подшипники, наиболее ответственные узлы машин и механизмов. В качестве легирующей добавки, значительно усиливающей прочность, бериллий вводят в состав сталей и некоторых других сплавов.
Основной потребитель бериллия – атомная энергетика, поскольку он обладает способностью отражать и замедлять нейтроны, образующиеся в ядерном реакторе. Отражатели нейтронов из бериллия отличаются высокой прочностью, химической стойкостью и легкостью. Потребность в этом металле и его добыча возрастает с каджым годом.
Магний (Magnesium)

Магний весьма распространен в природе. В больших количествах он встречается в виде карбоната магния, образуя минералы магнезит MgCO3 и доломит MgCO3∙CaCO3. Сульфат и хлорид магния входят в состав калийных минералов – каинита KCl∙MgSO4∙3H2O и карналлита KCl∙MgCl2∙6H2O. Ион Mg 2+ содержится в морской воде, придавая ей горький вкус. Общее количество магния в земной коре составляет около 2%.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в. При упаривании такой воды на стенках сосуда образовалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4∙7H2O. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией – карбонатом магния MgCO3. При его нагревании образуется жженая магнезия – оксид MgO. Это вещество А.Л.Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.
Впервые магний был получен в 1808 г. Г.Дэви при электролизе влажной жжёной магнезии. По его предложению, элемент вначале назвали Magnium – чтобы подчеркнуть связь с магнезией и в то же время отличать его от марганца, который тогда называли Manganesium. Позже магний переименовали в Magnesium, а марганец — в Manganum. Однако в русском языке сохранилось первоначальное название элемента.

В некотором смысле магний – противоположность бериллию. Он достаточно мягкий и пластичный, плавится при более низкой температуре (650̊ С). Но, как и бериллий, он обладает заметной химической активностью. На воздухе стружка магния сгорает с ослепительной вспышкой с образованием белого порошка – смеси оксида и нитрида:2Mg + O2 = 2MgO; 3Mg + N2 = Mg3N2. Недаром магниевую ленту фотографы использовали как фотовспышку.
При комнатной температуре магний, покрытый тончайшей пленкой оксида, достаточно инертен и не взаимодействует с водой. Лишь при кипячении он медленно восстанавливает воду с образованием белой взвеси гидроксида магния и выделением водорода: Mg + 2H2O = Mg(OH)2↓ + H2↑.
Магний легко взаимодействует не только с разбавленными кислотами, но и с раствором хлорида аммония, в котором из-за гидролиза этой соли присутствуют ионы Н + : Mg + 2NH4Cl = MgCl2 + 2NH3 + H2. В отличие от бериллия, со щелочами он не реагирует.
Магний — сильный восстановитель. Смеси его со многими окислителями, например пероксидом бария ВаО2, используют в пиротехнике. При поджигании такая смесь сгорает ярким зеленоватым пламенем:BaO2 + Mg = MgO + BaO. Магний присутствует в животных и растительных организмах. В теле человека его в среднем 19 г. Особенно он необходим растениям, так как является составной частью хлорофилла.
В технике магний применяется главным образом в виде сплавов с алюминием – магналия и электрона. Магналий содержит от 5 до 30% магния, а электрон помимо алюминия включает также, цинк, марганец, медь. Эти сплавы очень прочные и намного тверже чистых алюминия и магния, легко обрабатываются и полируются. Их используют в автомобильной промышленности, авиационной и ракетной технике. Некоторые соединения магния нашли применение в медицине: оксид магния служит средством понижения кислотности желудка, а кристаллогидрат сульфата магния – слабительным.
Щелочноземельные элементы

К семейству щелочноземельных элементов относятся кальций, стронций, барий и радий. Д.И.Менделеев включал в это семейство и магний. Щелочноземельными они называются потому, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т.е. являются щелочами.
По распространенности в земной коре кальций занимает пятое место (4,1% по массе), уступая лишь кислороду, кремнию, алюминию и железу. В природе он встречается в виде гипса CaSO4∙2H2O, флюорита CaF2, апатита Ca5(PO4)3(OH) и кальцита CaCO3(карбоната кальция, образующего залежи мела, мрамора и известняка). Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.

В организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80% потребности в этом элементе удовлетворяется за счёт молочных продуктов. В них кальций присутствует в виде солей фосфорной и лимонной кислот. В литре молока или кефира как раз и содержится средняя суточная норма – 1,2 г кальция. При его недостатке в организме врачи назначают его препараты, например глюконат кальция.
Металлический кальций был впервые получен Г.Дэви в 1808 г. при электролизе смеси влажной гашенной извести Са(ОН)2 с оксидом ртути HgO.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.

С пищей и питьевой водой человек ежедневно получает около 15-20 мг стронция. В большом количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням.
Кальций (tпл = 839̊ С), стронций (tпл = 768 ̊С) и барий (tпл = 727 ̊С) – пластичные металлы серебристо – белого цвета. Из-за недостаточной твёрдости их невозможно резать ножом, как натрий и калий.

Щёлочноземельные металлы по химической активности уступают лишь щелочным. Они взаимодействуют с водой и растворами кислот с выделением водорода.
Если оксид бария выдерживать в атмосфере кислорода или на воздухе при температуре 500 ̊С то реакция будет протекать дальше:2Ва + О2 = 2ВаО2
Образовавшийся пероксид бария при 700 ̊С отщепляет избыточный кислород, вновь переходя в оксид. Щёлочноземельные металлы выделяют либо алюмотермией: 4CaO + 2Al = CaAl2O4 + 3Ca, либо электролизом расплавов хлоридов. Практическое значение из них имеет в основном кальций – он используется в металлургии в качестве раскислителя. Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве.
Соединения стронция используются в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов, а также служит катализатором при переработке нефти.

Очень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает ее расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта.
Радий
Последним из щёлочноземельных металлов был открыт радий, для которого ещё Д.И.Менделеев выделил клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде. Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой руды входит новый элемент, по радиоактивности превосходящий уран. Вскоре удалось выделить его соединение. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом. Радий представляет собой тяжелый и тугоплавкий металл серебристо-белого цвета. В свободном виде он, как и другие щелочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra + 2H2O = Ra(OH)2 + H2↑.Образующийся при этом гидроксид радия – сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах.
Общие химические свойства
По химическим свойствам щелочноземельные металлы очень похожи на щелочные металлы, а магний имеет существенные отличия.
Во всех реакция магний и щелочноземельные металлы играют роль восстановителей и окисляются с образованием различных ионных соединений, содержащих ионы этих металлов с зарядом +2.
Щелочноземельные металлы уже при обычных условиях окисляются кислородом воздуха, а магний сгорает на воздухе при нагревании до 600 ̊ С; в результате образуются оксиды:
2Ca + O2 = 2CaO; 2Mg + O2 = 2MgO
Все рассматриваемые металлы при определенных условиях взаимодействуют с галогенами, серой, азотом, водородом:
Ca + S = CaS Mg + S = MgS
Щелочноземельные металлы активно реагируют с водой, а магний реагирует только с кипящей водой:
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.

- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
Природные соединения
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.

Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Получение
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:
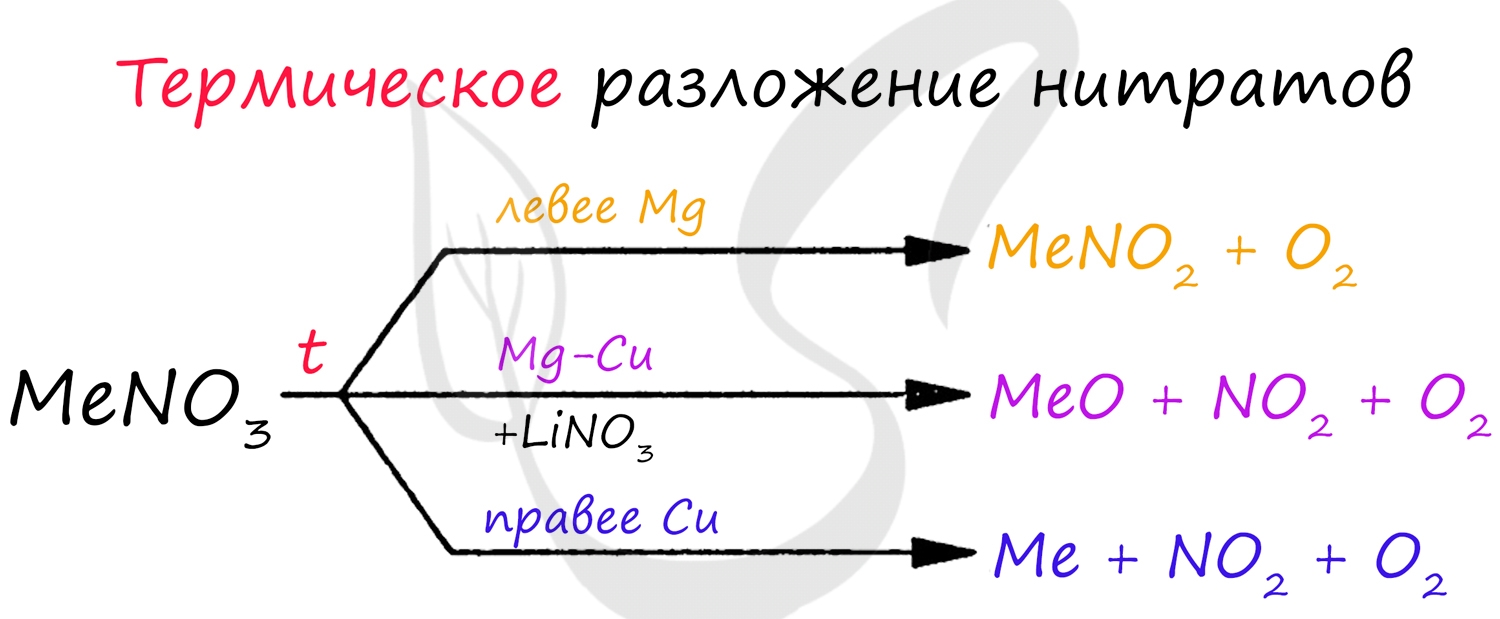
Химические свойства
Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
-
Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получение
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Химические свойства
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.

Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Строение и свойства атомов. Бериллий Be, магний Mg и щёлочноземельные металлы: кальций Са, стронций Sr, барий Ва и радий Ra — элементы главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева. Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2.

С увеличением порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий — радиоактивный элемент, содержание его в природе невелико.
Бериллий, магний и щёлочноземельные металлы — простые вещества. Лёгкие серебристо-белые металлы, стронций имеет золотистый оттенок. Он значительно твёрже бария, барий же по мягкости напоминает свинец.
На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной плёнкой. Щёлочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
При нагревании на воздухе все рассматриваемые металлы (обозначим их М) энергично сгорают с образованием оксидов:

Реакция сжигания магния сопровождается ослепительной вспышкой, раньше её применяли при фотографировании объектов в тёмных помещениях. В настоящее время используют электрическую вспышку.
Бериллий, магний и все щёлочноземельные металлы взаимодействуют при нагревании с неметаллами — хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды и нитриды:
При высоких температурах металлы главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева окисляются водородом до гидридов:
Гидриды — это твёрдые солеподобные соединения металлов с водородом, похожие на галогениды — соединения металлов с галогенами. Теперь, очевидно, вам стало понятно, почему водород находится и в главной подгруппе VII группы (VIIA группы).
Из всех металлов главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева только бериллий практически не взаимодействует с водой (препятствует защитная плёнка на его поверхности), магний реагирует с ней медленно, остальные металлы бурно взаимодействуют с водой при обычных условиях (рис. 54):


Рис. 54.
Взаимодействие с водой металлов главной подгруппы II группы (IIА группы) Периодической системы Д. И. Менделеева
Подобно алюминию, магний и кальций способны восстанавливать редкие металлы — ниобий, тантал, молибден, вольфрам, титан и др. — из их оксидов, например:

Такие способы получения металлов по аналогии с алюминотермией называют магниетермией и кальциетермией.
Магний и кальций применяют для производства редких металлов и лёгких сплавов. Например, магний входит в состав дюралюминия, а кальций — один из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочек кабелей.
Соединения бериллия, магния и щёлочноземельных металлов. В природе щёлочноземельные металлы, как и щелочные металлы, находятся только в форме соединений вследствие своей высокой химической активности.
Оксиды МО — твёрдые белые тугоплавкие вещества, устойчивые к воздействию высоких температур. Проявляют основные свойства, кроме оксида бериллия, имеющего амфотерный характер.
Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно взаимодействуют с ней:
Оксиды получают обжигом карбонатов:
В технике оксид кальция СаО называют негашёной известью, a MgO — жжёной магнезией. Оба этих оксида используют в производстве строительных материалов.
Лабораторный опыт № 15
Получение гидроксида кальция и исследование его свойств
| Небольшой кусочек или немного порошка оксида кальция поместите в стаканчик, прилейте в 5 раз больше воды. Размешайте содержимое с помощью стеклянной палочки и дайте постоять 2—3 мин. Отфильтруйте по 1—2 мл содержимого стаканчика в две пробирки. С помощью стеклянной трубочки осторожно продувайте выдыхаемый воздух через раствор в 1-й пробирке. Что наблюдаете? Как называется реакция? Запишите уравнение. К раствору во 2-й пробирке добавьте 2—3 капли спиртового раствора фенолфталеина. Что наблюдаете? Что можно утверждать на основании опыта о растворимости гидроксида кальция? |
Гидроксиды щёлочноземельных металлов относятся к щелочам. Их растворимость в воде увеличивается в ряду
Эти гидроксиды получают взаимодействием соответствующего оксида с водой.
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести (рис. 55), а образующийся Са(ОН)2 — гашёной известью:

Рис. 55.
Гашение извести
Прозрачный раствор гидроксида кальция называют известковой водой, а белую взвесь Са(ОН)2 в воде — известковым молоком. Гашёную известь широко используют в строительстве. Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Соли бериллия, магния и щёлочноземельных металлов получают взаимодействием их с кислотами. Галогениды (фториды, хлориды, бромиды и иодиды) этих металлов — белые кристаллические вещества, большинство из них растворимо в воде. Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов элементов главной подгруппы II группы Периодической системы Д. И. Менделеева уменьшается от BeSO4 к BaSO4. Карбонаты этих металлов малорастворимы или нерастворимы в воде.
Сульфиды щёлочноземельных металлов, содержащие в малых количествах примеси тяжёлых металлов, после предварительного освещения начинают светиться различными цветами — красным, оранжевым, голубым, зелёным. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов часов и других изделий.
Рассмотрим наиболее важные соединения элементов главной подгруппы II группы (IIA группы) Периодической системы Д. И. Менделеева.
СаСО3 — карбонат кальция — одно из самых распространённых на Земле соединений. Вам хорошо известны такие содержащие его минералы, как мел, мрамор, известняк (рис. 56).

Рис. 56.
Природные соединения кальция: а — мел; б — мрамор; в — известняк; г — кальцит
Мрамор — это минерал скульпторов, архитекторов и облицовщиков. Из него создавали свои прекрасные творения многие скульпторы (рис. 57).

Стены всемирно известного индийского мавзолея Тадж-Махал выложены из мрамора (рис. 58), им же облицованы многие станции московского метро (рис. 59).

Рис. 58.
Тадж-Махал — мавзолей-мечеть, находящийся в Агре (Индия), выполнен из мрамора

Однако самый важный из этих минералов — известняк, без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем (вспомните знаменитые одесские катакомбы — бывшие каменоломни, в которых добывали камень для строительства города), во-вторых, это сырьё для получения других материалов: цемента, гашёной и негашёной извести, стекла и др.
Известковой щебёнкой укрепляют дороги, а порошком уменьшают кислотность почв.
Природный мел представляет собой остатки раковин древних животных. Один из примеров его использования — это школьные мелки, зубные пасты. Мел применяют в производстве бумаги, резины, побелки.
MgCO2 — карбонат магния, необходим в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы, т. е. не содержащей соединения металла, в шлак.
CaSO4 — сульфат кальция, встречается в природе в виде минерала гипса CaSO4 • 2Н2O, представляющего собой кристаллогидрат. Используют в строительстве, в медицине для наложения фиксирующих гипсовых повязок, получения слепков (рис. 60). Для этого применяют полуводный гипс 2CaSO4 • Н2O — алебастр, который при взаимодействии с водой образует двуводный гипс:
Эта реакция идёт с выделением теплоты.

Рис. 60.
Гипс применяется:
в медицине для изготовления гипсовых повязок (1), искусственных облицовочных и отделочных камней (2), в строительстве для изготовления скульптур и скульптурных элементов (3), гипсокартона (4)
MgSO4 — сульфат магния, известный под названием горькая, или английская, соль, используют в медицине в качестве слабительного средства. Содержится в морской воде и придаёт ей горький вкус.

Са3(РO4)2 — фосфат кальция, входит в состав фосфоритов (горная порода) и апатитов (минерал), а также в состав костей и зубов. В организме взрослого человека содержится более 1 кг кальция в виде соединения Са3(РO4)2.
Кальций имеет важное значение для живых организмов, это материал для постройки костного скелета. Он играет существенную роль в процессах жизнедеятельности: ионы кальция необходимы для работы сердца, участвуют в процессах свёртывания крови.
На долю кальция приходится более 1,5% массы тела человека, 98% кальция содержится в костях. Однако кальций необходим не только при формировании скелета, но и для работы нервной системы.
Человек должен получать в день 1,5 г кальция. Наибольшие количества кальция содержатся в сыре, твороге, петрушке, салате.
Магний также является необходимым биоэлементом, играя роль стимулятора обмена веществ, содержится в печени, костях, крови, нервной ткани и мозге. Магния в человеческом организме намного меньше, чем кальция, — всего около 40 г. Магний входит в состав хлорофилла, а следовательно, участвует в процессах фотосинтеза. Без хлорофилла не было бы жизни, а без магния — хлорофилла, ведь в нём содержится 2% этого элемента.
Соли щёлочноземельных металлов окрашивают пламя в яркие цвета, поэтому эти соединения добавляют в составы для фейерверков (рис. 62).

Рис. 62.
Соли щёлочноземельных металлов добавляют в составы для фейерверков
Открытие магния и кальция. Магний был впервые получен Г. Дэви в 1808 г. из белой магнезии — минерала, найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу.
Полученный Г. Дэви металл был загрязнён примесями, а чистый магний получил француз А. Бюсси в 1829 г.
Читайте также:

