Сообщение на тему алюминий крылатый металл
Обновлено: 28.06.2024
Алюминий или еще одно его менее распространённое название Глиний — это хим. элемент, в периодической табл. Менделеева находится под атомным номером 13, химический элемент 3й группы. Алюминий относится к легким металлам, его цвет серебристо-белый, также к его свойствам относятся: гранецентрированная и кристаллическая кубическая решетка, невысокая плотность, а также он начинает плавиться при 660 ˚С. Атомный вес приблизительно равен 27,04. Элемент открыл Ганс К. Эрстед.
Название элемента произошло от латинского слова alumen, оно еще за полтысячелетия до н.э. означало алюминиевые квасцы. Они применялись в качестве протравы во время окрашивания ткани, а также во время дубления кожи.
Алюминий по распространённости в природной среде занимает 3-е место, а также по распространённости среди металлов занял 1-е место. По причине своих химических свойств алюминий не встречается в чистом и свободном виде в природной среде. Зато его множество во всевозможных соединениях, а конкретно в силикатах. Огромное количество соединений с алюминием находятся в горных породах. Он встречается в таких соединениях, как слюда, глина и корунда.
В 1827 году Велер сделал открытие, он 1-й добыл алюминий в свободном состоянии, его открытие выглядело в виде порошка серого цвета. А в 1846 году Велер сделал еще одно открытие получив алюминий в виде металлических шариков блестящего цвета. Также Велером были описаны свойства алюминия. Через 8 лет Сен-Клер Девиллему удалось разработать и значительно усовершенствовать способ получения алюминия.
Теплопроводность алюминия значительно зависит от уровня его чистоты. Для алюминия с техническими характеристиками и чистотой 99,49 и 99,70%, при 200°С теплопроводность равняется 209 и 222 Вт/(м×К). Для алюминия чистота которого равняется 99,9%, и он является рафинированным электролитиески, его теплопроводность при 190°С поднимается до показателя до 343 Вт/(м×К).
По характеристикам теплопроводности алюминий занимает 4-е место. Уровень деформации, при каком режиме была выполнена термообработка, очень важен аспект наличия примесей и то что собой представляют эти добавки, все это воздействует на уровень электропроводности металла. Самыми частыми и массовыми добавками в алюминии есть железо, цинк, кремний, титан и медь.
Чем меньше в алюминии различных добавок, тем выше поднимается уровень его умения отображать от своей поверхности белый свет.
Химический элемент с легкостью может вступить в реакцию с кислородом при комнатной температуре окружающей среды. В ходе реакции на поверхности образуется оксидная пленка, при которой металлу не страшна коррозия. После того как на поверхности металла образуется пленка металл не будет взаимодействовать с водой, концентратами азотной и серной кислоты, по этим причинам тара из алюминия используется для их перевозки.
Оксидная пленка с металла с легкостью снимается при помощи солей аммония, горячей щелочи, ртутных сплавов. Когда пленка будет разрушена, элемент может вступать в химическую реакцию с некоторым рядом неметаллов и различными соединениями.
При помощи электролиза раствора глинозема в расплавленном криолите при температуре 960-970°С, добывают алюминий в максимально чистом виде.
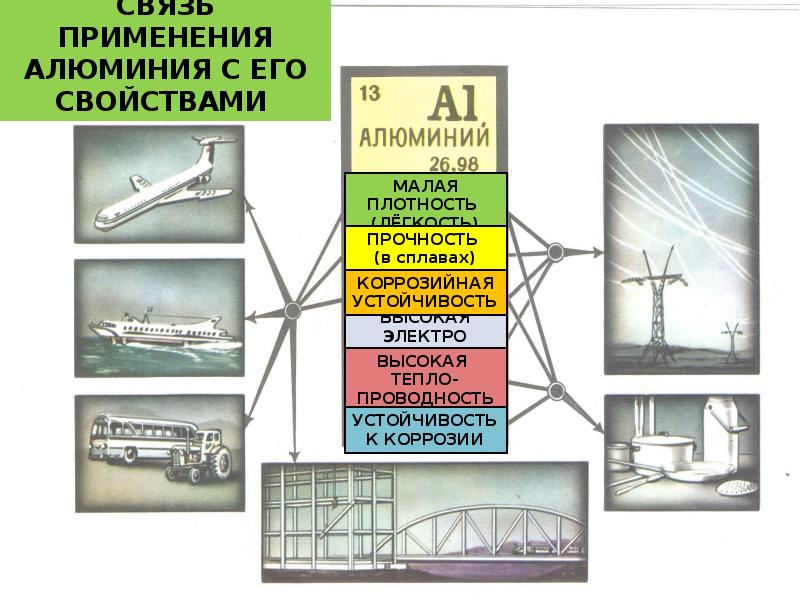
Алюминий широко распространён в качестве конструкционного материала. Его часто используют во время производства посуды, фольги. Его нередко используют в авиастроительстве включая космическую отрасль. Чистый алюминий нельзя применять в строении, в связи с малой прочностью, прочность металла повышают за счет сплава.
Также алюминий применяется в металлургии, во время производства взрывчатых веществ. Он активно используется во время перевозок жидких газов, некоторых кислот, пищевых масел, воды, а также перекиси водорода.
Потребность в алюминии, его производство и потребление все время поднимается.
Доклад №2
Алюминий – это серебристый металл с голубовато-серым оттенком. Он отличается пластичностью, малым весом, а также отличной проводимостью тепла и электричества. Поддаётся обработке давлением и сварке. В сочетании с кислородом, образует защитную пленку, предупреждающую дальнейшее распространение коррозии. Примеси различных металлов изменяют качественную характеристику алюминия. Например, соединения алюминия с марганцем или магнием снижают его проводниковые свойства, кремневое легирование – уменьшает пластичность, сочетание с железом снижает стойкость алюминия к коррозии.
Чистый алюминий применяют в производстве полупроводниковых приборов, проводов для электрической сети, а также зеркал. Металл сложно поддается обработке из-за своей хрупкости. Поэтому, для получения готовой продукции, чаще используются его сплавы.
Прочность сплавов, полученных с помощью литья, является их отличительной особенностью, так же как и повышенная твердость. Изменение свойств алюминия позволяет проводить качественную обработку металла, а также получать заготовки различной степени сложности.
Наиболее пластичными являются алюминиевые сплавы, которые деформируются путём обработки горячим или холодным давлением. В производстве выпускаются в форме пластин, прутиков, полос, проволоки. В свою очередь, сплавы, подвергающиеся деформации, можно разделить на два вида: упрочняемые и не упрочняемые тепловой обработкой.
Не упрочняемые сплавы в своей основе имеют алюминий в совокупности с магнием или марганцем. Такие сочетания металлов, являются самыми благоприятными для изготовления пластичных и не подверженных коррозии изделий, одним, из которых является алюминиевая посуда.
Упрочнение сплавов совершается за счет закалки и последующего старения металла. Это происходит либо естественным способом, либо в результате повышения и понижения температуры. Сплав с медью – дюралюминий, является упрочняемым, он в два раза превышает исходные качества чистого алюминия, не утяжеляясь, но имеет низкую стойкость к ржавлению. Для предотвращения коррозии, изделия, изготовленные из дюралюминия, плакируют, то есть, покрывают слоем лака или чистого алюминия.
Алюминиевые сплавы имеют широкое распространение. Из них изготавливают пластины, которые впоследствии используются для изготовления консервных банок. Пищевая фольга является алюминиевой. Но самое большое применение сплавов этого металла происходит при строительстве автомобилей и самолетов.
9 класс, свойства, применение
Алюминий

Владимир Алексеевич Солоухин - известный советский поэт и писатель, один из наиболее значимых представителей "деревенской прозы".
Тихий океан – самый глубокий. Средняя глубина этого океана около 4 километров, а самая глубокая точка – Марианский желоб, его глубина около 11 километров. Также Тихий океан самый большой. Он занимает половину от всего Мирового океана и треть всей
Внешней памятью компьютера принято называть память долговременного хранения информации различной формы. Данный тип памяти не имеет зависимости от процессора.

Алюминий (лат. Аluminium, химический символ Al, III группа периодической системы Менделеева, атомный номер 13, атомная масса 26,9815) — мягкий, легкий, серебристо-белый металл, быстро окисляющийся, удельная плотность 2,7 г/ см³, температура плавления 660 °C. По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. В природе представлен лишь одним стабильным нуклидом 27 Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий – 26 Al имеет период полураспада 720 тысяч лет.
Алюминий в природе
Алюминий - наиболее распространенный металл на земле, а по распространенности всех элементов в земной коре он занимает третье место. На его долю приходится 8% состава земной коры. Бокситная руда в настоящее время является главным сырьем для получения алюминия. Ежегодно в мире добывают от 80 до 90 млн. тонн бокситной руды. Почти 30% этого колличества добывают в Австралии и еще 15% на Ямайка. При нынешнем уровне мирового производства алюминия разведанных на земле запасов бокситов достаточно, чтобы обеспечивать потребности в алюминии еще несколько сотен лет.
Применение алюминия
Алюминий имеет наиболее разносторонние применения из всех металлов. Он широко используется в транспортном машиностроении, например для конструирования самолетов, судов, автомобилей. В химической промышленности алюминий используется в качестве восстановителя, в строительной промышленности - для изготовления оконных рам и дверей, а в пищевой промышленности - для изготовления упаковочных материалов. В быту он используется в качестве материала для кухонной посуды и в виде фольги для хранения пищевых продуктов.
Биологическое действие металла
Удивительно, но несмотря на широчайшую распространенность алюминия в природе, этот металл практически не встроен в биологические цепочки живых существ. Более того, соединения алюминия оказывают слабое токсическое воздействие на живые организмы. Солю алюминия, например хлориды, нитраты, вредны для тканей организма человека, поэтому в последнее время люди стали отказываться от использования алюминиевой посуды. Алюминий способен накапливаться в человеческом организме, поэтому следует избегать излишних контактов с крылатым металлом.

Алюминий — очень редкий минерал семейства меди-купалита подкласса металлов и интерметаллидов класса самородных элементов. Преимущественно в виде микроскопических выделений сплошного мелкозернистого строения. Может образовывать пластинчатые или чешуйчатые кристаллы до 1 мм., отмечены нитевидные кристаллы длиной до 0,5 мм. при толщине нитей несколько мкм. Лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
Смотрите так же:
СТРУКТУРА

Кубическая гранецентрированная структура. 4 оранжевых атома
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10 -10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10 -10 м, а атомный объем 9,999×10 -6 м 3 /г-атом.
Примеси в алюминии незначительно влияют на величину параметра решетки. Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10 -5 см), но прочной пленкой оксида алюминия А1203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
СВОЙСТВА

Самородный алюминий. Поле зрения 5 x 4 мм. Азербайджан, Гобустанский район, Каспийское море, Хере-Зиря или остров Булла
Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью, парамагнетик. Температура плавления 660°C. К достоинствам алюминия и его сплавов следует отнести его малую плотность (2,7 г/см 3 ), сравнительно высокие прочностные характеристики, хорошую тепло- и электропроводность, технологичность, высокую коррозионную стойкость. Совокупность этих свойств позволяет отнести алюминий к числу важнейших технических материалов. Он легко вытягивается в проволоку и прокатывается в тонкие листы. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой – оксидом алюминия.) надежно предохраняет металл от дальнейшего окисления. Но если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь в оксид алюминия. Алюминий растворяется даже в разбавленных соляной и серной кислотах, особенно при нагревании. А вот в сильно разбавленной и концентрированной холодной азотной кислоте алюминий не растворяется. При действии на алюминий водных растворов щелочей слой оксида растворяется, причем образуются алюминаты – соли, содержащие алюминий в составе аниона.
ЗАПАСЫ И ДОБЫЧА

По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
ПРОИСХОЖДЕНИЕ

Аллюминий, агрегированный с коркой байерита на поверхности. Узбекистан, Навойская область, Учкудук
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико. Самые распространенные вещества, содержащие рассматриваемый металл: полевые шпаты; бокситы; граниты; кремнезем; алюмосиликаты; базальты и прочие. В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
ПРИМЕНЕНИЕ

Украшение из алюминия
Широко применяется как конструкционный материал. Основные достоинства алюминия в этом качестве — лёгкость, податливость штамповке, коррозионная стойкость. Электропроводность алюминия всего в 1,7 раза меньше, чем у меди, при этом алюминий приблизительно в 4 раза дешевле за килограмм, но, за счёт в 3,3 раза меньшей плотности, для получения равного сопротивления его нужно приблизительно в 2 раза меньше по весу. Поэтому он широко применяется в электротехнике для изготовления проводов, их экранирования и даже в микроэлектронике при напылении проводников на поверхности кристаллов микросхем.
Когда алюминий был очень дорог, из него делали разнообразные ювелирные изделия. Так, Наполеон III заказал алюминиевые пуговицы, а Менделееву в 1889 г. были подарены весы с чашами из золота и алюминия. Мода на ювелирные изделия из алюминия сразу прошла, когда появились новые технологии его получения, во много раз снизившие себестоимость. Сейчас алюминий иногда используют в производстве бижутерии.














Положение в Периодической системе Алюминий располагается в 3 периоде, в главной подгруппе 3 группы. Порядковый номер элемента – 13 Относительная атомная масса – 27 Алюминий – металл, соединения которого обладают амфотерными свойствами.
Нахождение в природе По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния среди всех атомов и 1-е место — среди металлов. Встречается только в составе соединений.
Получение алюминия Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути. Название элемента образовано от лат. aluminis — квасцы. AlCl3 + 3K = 3KCl + Al В настоящее время алюминий получают электролизом оксида: эл.ток 2Al2O3 = 4Al + 3O2 – 3352 кДж
Физические свойства плотность (при 20°С) 2698,9 кг/м3; tпл 660,24°С; tкип около 2500°С; Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокие теплопровод-ность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость, обладает высокой отражательной способностью, близкой к серебру (он отражает до 90% падающей световой энергии). На воздухе алюминий покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.
Химические свойства Окисляется на воздухе: 4Al + 3O2 = 2Al2O3 Al0 - 3ē → Al+3 4 восстановитель O20 + 4ē → 2O-2 3 окислитель Вытесняет водород из воды 2Al + 6H2O = 2Al(OH)3 + 3H2↑ Al0 - 3ē → Al+3 4 восстановитель 2H+1 + 2ē → H20 3 окислитель
Химические свойства Взаимодействует с кислотами: 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ Взаимодействует со щелочами: 2Al + 2H2O + 2NaOH = 2NaAlO2 + 3H2↑ 2Al + 2H2O + 2OH- = 2AlO2- + 3H2↑
Химические свойства Вытесняет металлы из их оксидов (алюминотермия): 8Al + 3Fe3O4 = 9Fe + 4Al2O3 Al0 - 3ē → Al+3 8 вос-ль Fe+2 + 2ē → Fe0 3 24 ок-ль 2Fe+3 + 6ē → 2Fe0 3 ок-ль
Читайте также:

