Сообщение мое любимое химическое вещество
Обновлено: 18.05.2024
Золото является одним из немногих драгоценных металлов. Человечество использовало золото ещё задолго до нашей эры. Но использовалось она не как элемент роскоши. Древние люди применяли золото как оружие. С помощью золота они охотились на зверей. В основном из золота делались наконечники на копья и стрелы потому что метал было сложно найти.
Сейчас же золото чаще используется как элемент роскоши. Из золота очень много производят различные украшения, кольца, серьги и ещё много различенных ювелирных изделий.Золото является одним из немногих драгоценных металлов. Человечество использовало золото ещё задолго до нашей эры. Но использовалось она не как элемент роскоши. Древние люди применяли золото как оружие. С помощью золота они охотились на зверей. В основном из золота делались наконечники на копья и стрелы потому что метал было сложно найти.
| Вложение | Размер |
|---|---|
| himiya_zoloto_sadik.pptx | 2.77 МБ |
Предварительный просмотр:
Подписи к слайдам:
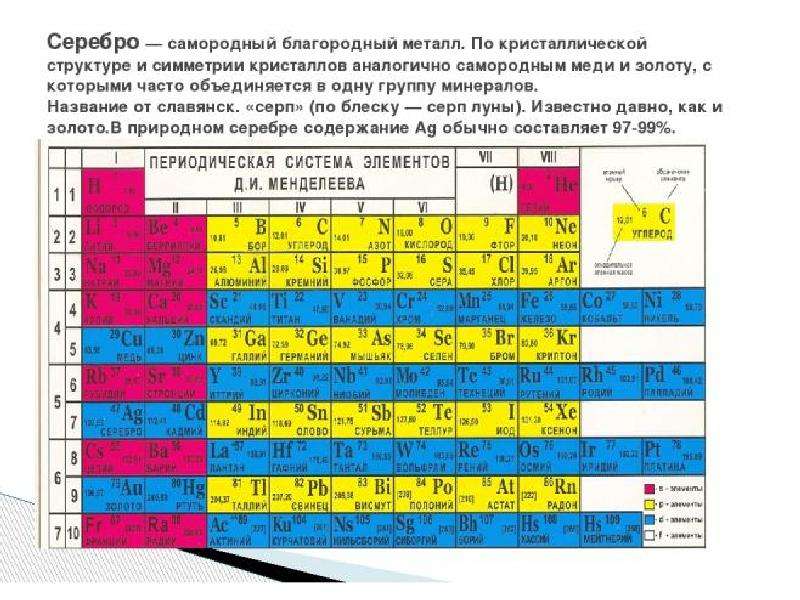
Этимология Зо́лото ( Au от лат. Aurum ) — благородный металл жёлтого цвета.
Физические свойства Золото обладает высокой теплопроводностью и низким электрическим сопротивлением; очень тяжёлый металл; очень мягкий металл; высокопластично
Применение Золото является одним из немногих драгоценных металлов. Человечество использовало золото ещё задолго до нашей эры. Но использовалось она не как элемент роскоши. Древние люди применяли золото как оружие. С помощью золота они охотились на зверей. В основном из золота делались наконечники на копья и стрелы потому что метал было сложно найти. Сейчас же золото чаще используется как элемент роскоши. Из золота очень много производят различные украшения, кольца, серьги и ещё много различенных ювелирных изделий.
Добыча золота Золото — это металл который крайне тяжело добыть. Но это не значит, что на нашей планете его мало. Существует предположение что золото есть даже в атмосфере, но она невидимо нашему глазу. Золото является первым металлом которое было найдено человеком. Основная концентрация золота находится в металлическом ядре земли. Именно поэтому его так тяжело добывать. Золото так же добывают в различных ручьях и реках. Так был найден самый крупный самородок весом в 72 килограмма. Был он всего в пяти сантиметрах под землёй.
Нахождение в природе В природе в чистом виде золото почти не встречается
Цвет золота Красное золото – серебро, медь Белое золото – палладий, никель, платина Желтое золото – серебро, медь (в другом процентном соотношении)






Слайд 1

Слайд 2

Слайд 3
Химически серебро малоактивно, с кислородом воздуха практически не взаимодействует. Образует сплавы со многими металлами. Химически серебро малоактивно, с кислородом воздуха практически не взаимодействует. Образует сплавы со многими металлами.

Слайд 4

Слайд 5
Серебро используют преимущественно в виде сплавов: из них чеканят монеты, изготовляют бытовые изделия, лабораторную и столовую посуду. Серебро используют преимущественно в виде сплавов: из них чеканят монеты, изготовляют бытовые изделия, лабораторную и столовую посуду.

Слайд 6
В медицинской практике наиболее часто применяют нитрат серебра, колларгол, протаргол; бактерицидную бумагу (пористая бумага, пропитанная нитратом и хлоридом серебра) применяют при небольших ранах, ссадинах, ожогах и т. п. В медицинской практике наиболее часто применяют нитрат серебра, колларгол, протаргол; бактерицидную бумагу (пористая бумага, пропитанная нитратом и хлоридом серебра) применяют при небольших ранах, ссадинах, ожогах и т. п.
Submit to our newsletter to receive exclusive stories delivered to you inbox!

Васян Коваль
Лучший ответ:

Пармезан Черница


Вы можете из нескольких рисунков создать анимацию (или целый мультфильм!). Для этого нарисуйте несколько последовательных кадров и нажмите кнопку Просмотр анимации.
Слайды и текст этой презентации
Об открытии, получении и значении выбранного химического вещества

Что такое вещества?
Чем вещества отличаются друг от друга?
На чем основано применение веществ?
Что мы знаем о веществах?
Вещество – это то из чего состоит физическое тело
Тела имеют форму и объем, а вещества – нет
Вещества могут быть простыми и сложными
Свойства веществ определяют их применение и т. п.
Безопасно ли жить в мире в котором много веществ, не всегда безобидных?
Все ли вещества полезны?
Какие вещества необходимы нашему организму?
Зачем мы изучаем вещества?

Какова роль веществ в жизни человека?

Что хотим узнать о веществах?

Что нам предстоит сделать?
1. Алмаз.
2. Аммиак.
3. Борная кислота.
4. Глауберова соль.
5. Инертные газы.
6. Йод.
7. Лимонная кислота
8. Мрамор.
9. Перекись водорода.
10. Перманганат калия.
11. Питьевая сода.
12. Поваренная соль.
13. Сахароза.
14. Углекислый газ.
15. Уксусная кислота.
16. Этиловый спирт.

Магний – химический элемент II группы ПСХЭ Д.И. Менделеева, в химическом отношении – весьма активный металл, соединения магния имеют основной характер. Магний – характерный элемент мантии Земли, минералы магния многочисленны. Более половины из них образовались в биосфере – на дне морей, озер, в почвах. В промышленности наибольшее количество магния получают электролизом расплава хлорида магния.
Электронное строение атома Mg
Строение простого вещества
Физические свойства Mg
Химические свойства Mg
Горение Mg в кислороде
Горение Mg в воде
Горение Mg в хлоре
Вспышка смеси Mg + AgNO 3 от капли воды
Магнийтермия
Нахождение Mg в земной коре
Получение Mg
Применение Mg и его сплавов
Отзыв
Интернет-ресурсы
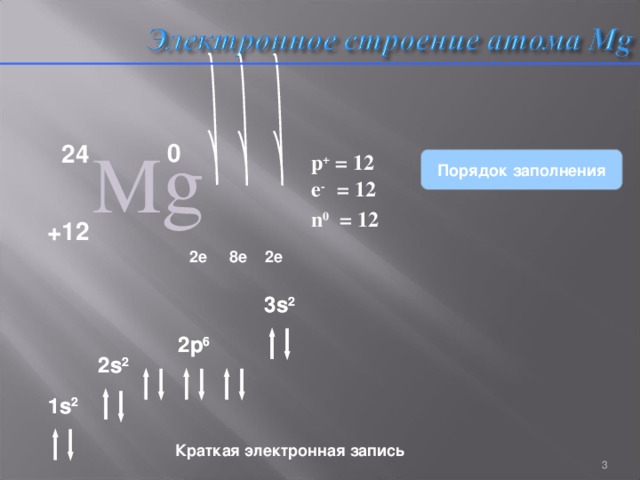
p + = 12
Порядок заполнения
e - = 12
n 0 = 12
2 s 2
2 s 2
1 s 2
1 s 2
Краткая электронная запись
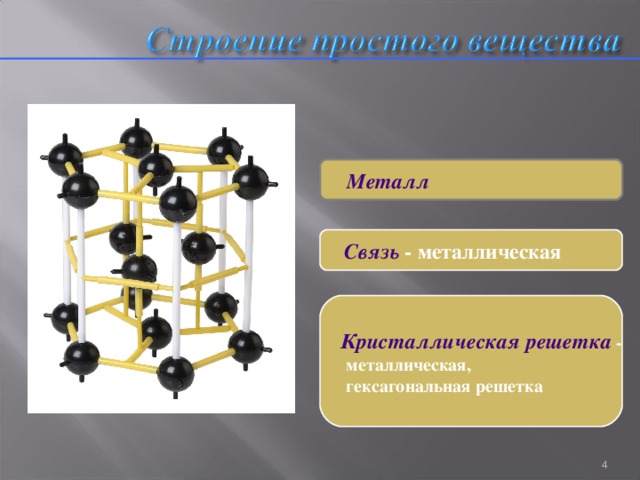
Металл
Связь - металлическая
Кристаллическая решетка -
металлическая,
гексагональная решетка

Цвет – блестящий, серебристо-белый
t пл. = 651 °C .
t кип. ≈ 1107 °C .
Электропроводный
Легкий, плотность ρ = 1,74 г/см 3
Относительно мягкий, пластичный .

C неметаллами ( кислородом, серой)
C неметаллами ( галогенами, азотом)
C водой
C кислотами
C оксидами металлов
2 Mg + O 2 = 2MgO
Mg + S = Mg S
Mg+ Cl 2 = Mg Cl 2
3Mg + N 2 = Mg 3 N 2
Mg + 2H 2 O = Mg(OH) 2 + H 2 ↑
Mg + 2HCl = Mg Cl 2 + H 2 ↑
4Mg +5H 2 SO 4 = 4Mg SO 4 +H 2 S+4H 2 O
4 Mg + Fe 3 O 4 = 4Mg O + 3Fe
3 Mg + Al 2 O 3 = 3Mg O + 2Al

2 Mg + O 2 = 2 MgO
2 Mg + O 2 = 2 MgO

Что будет, если тушить магний водой?
На заводе по переработке вторичного сырья в Уолтон Хиллс, штат Огайо возник пожар. В здании было большое количество металлов, среди них титан, сталь и магний. Пожарные, опасаясь, что огонь перекинется на соседнюю бензозаправку решили залить горящее здание водой. Результат не заставил себя ждать - произошел сильный взрыв, во все стороны разлетелись куски раскаленного добела магния. Ослепительный огонь поднялся на высоту 50 м. Однако пожарных это ни чему не научило - они продолжили заливать здание, что вызвало новые взрывы магния. Пожарные вынуждены были отступать под дождем горящего магния. От жара огня начали плавиться стены здания. Единственный способ погасить пожар магния - засыпать металл большим количеством песка, что было в данном случае технически невозможно, но это не повод заливать горящий магний водой. Некомпетентные действия пожарных значительно усугубили масштаб аварии.
Mg + 2H 2 O = Mg(OH) 2 + H 2

Mg + Cl 2 = MgCl 2

3Mg + AgNO 3 = 3MgO + 0.5N 2 + Ag

2Mg + O 2 = 2MgO

Магнийтермия – получение металлов восстановлением оксидов металлов магнием, которое сопровождается выделением значительного количества теплоты.
4 Mg+ Fe 3 O 4 = 4MgO + 3Fe
3Mg + Al 2 O 3 = 3MgO + 2Al
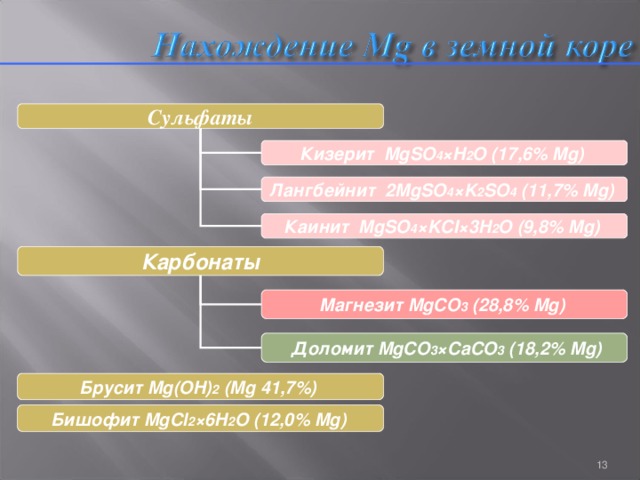
Сульфаты
Кизерит MgSO 4 ×H 2 O (17,6% Mg)
Лангбейнит 2MgSO 4 ×K 2 SO 4 (11,7% Mg)
Каинит MgSO 4 ×KCI×3H 2 O (9,8% Mg)
Карбонаты
Магнезит MgCO 3 (28,8% Mg)
Доломит MgCO 3 ×CaCO 3 (18,2% Mg)
Брусит Mg(OH) 2 (Mg 41,7%)
Бишофит MgCl 2 ×6H 2 O (12,0% Mg)

1830 год М. Фарадей: MgCl 2 = Mg + Cl 2
В 1852 году метод был усовершенствован Р. Бунзеном
В России электролитический метод получения магния
впервые разработал П.П.Федотьев в 1914 г. в Петроградском
политехническом институте


Магний – химический элемент II группы ПСХЭ Д.И. Менделеева, в химическом отношении – весьма активный металл, соединения магния имеют основной характер. Магний – характерный элемент мантии Земли, минералы магния многочисленны. Более половины из них образовались в биосфере – на дне морей, озер, в почвах. В промышленности наибольшее количество магния получают электролизом расплава хлорида магния. Широко применяются сплавы магния в промышленности. Магний – постоянная часть растительных и животных организмов. Из препаратов магния в медицинской практике применяют: сульфат магния (как успокаивающее, противосудорожное, спазмолитическое, слабительное и желчегонное средство), магнезию жженую (магния оксид) и карбонат магния (легкое слабительное).
Читайте также:

