Сообщение аминокислоты по химии
Обновлено: 07.07.2024
Аминокислоты — это органические вещества, в молекулах которых содержатся две функциональные группы: карбоксильная − COOH и аминогруппа − N H 2 .
Аминокислоты — это производные карбоновых кислот, в молекулах которых вместо атома водорода содержится аминогруппа.
Аминокислоты могут содержать в радикале разные группы атомов. Так, в молекуле фенилаланина содержится бензольное кольцо . Его структурная формула:
В состав аминокислот могут также входить атомы некоторых элементов. Например, в молекуле цистеина содержится атом серы . Формула цистеина может быть представлена следующим образом:
Аминокислоты — кристаллические вещества , хорошо растворимые в воде. Они могут быть сладкие, безвкусные и даже горькие. Температуры плавления всех аминокислот выше \(22\) °С.
Функциональные группы определяют химические свойства аминокислот: карбоксильная — кислотные, а аминогруппа — основные. Основность аминогруппы связана со способностью атома азота присоединять к себе протоны водорода за счёт свободной электронной пары:
Аминокислоты — амфотерные органические соединения, имеющие одновременно кислотные и основные свойства.
Благодаря наличию двух функциональных групп аминокислоты способны взаимодействовать друг с другом и соединяться в более сложные вещества — пептиды :
Реакция образования полимера, сопровождающаяся выделением низкомолекулярного вещества, называется реакцией поликонденсации .
При взаимодействии молекул аминокислот между их остатками возникает связь, которая называется пептидной связью.
Пептидная связь — связь, возникающая между остатком аминогруппы одной молекулы аминокислоты и остатком карбоксильной группы другой молекулы аминокислоты − NH − CO − в полипептидах.
Аминокислоты используются как лекарства . В сельском хозяйстве их применяют для подкормки животных. Некоторые аминокислоты служат исходными веществами для синтеза полимеров (например, капрона).

Органические вещества, в молекуле которых содержатся карбоксильные и аминные группы, называются аминокислотами или аминокарбоновыми кислотами. Это жизненно важные соединения, являющиеся основой построения живых организмов.
Строение
Аминокислота – мономер, состоящий из азота, водорода, углерода и кислорода. Также к аминокислоте могут присоединяться не углеводородные радикалы, например, сера или фосфор.
Условная общая формула аминокислот – NH2-R-COOH, где R – двухвалентный радикал. При этом аминогрупп в одной молекуле может быть несколько.
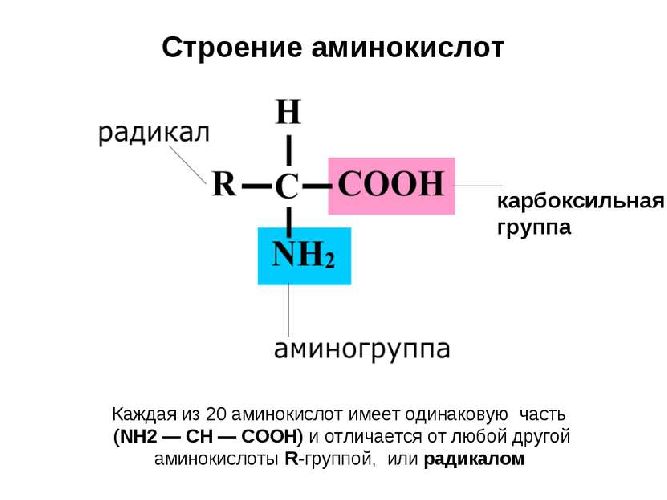
Рис. 1. Структурное строение аминокислот.
С химической точки зрения аминокислоты – производные карбоновых кислот, в молекуле которых атомы водорода заменены аминогруппами.
Аминокислоты классифицируются по нескольким признакам. Классификация по трём признакам представлена в таблице.
Признак
Описание
Пример
По расположению аминных и карбоксильных групп относительно друг друга
Содержат один атом углерода между функциональными группами
β-, γ-, δ-, ε- и другие аминокислоты
Содержат несколько атомов углерода между функциональными группами
β-аминопропионовая кислота (два атома между группами), ε-аминокапроновая кислота (пять атомов)
По изменяемой части (радикалу)
Не содержат ароматических связей. Бывают линейными и циклическими
Лизин, серин, треонин, аргинин
Содержат бензольное кольцо
Фенилаланин, триптофан, тирозин
Содержат гетероатом – радикал, не являющийся углеродом или водородом
Триптофан, гистидин, пролин
Содержат иминогруппу NH
По физико-химическим свойствам
Не взаимодействуют с водой
Глицин, валин, лейцин, пролин
Взаимодействуют с водой. Подразделяются на незаряженные, положительно и отрицательно заряженные
Лизин, серин, аспартат, глутамат, глутамин
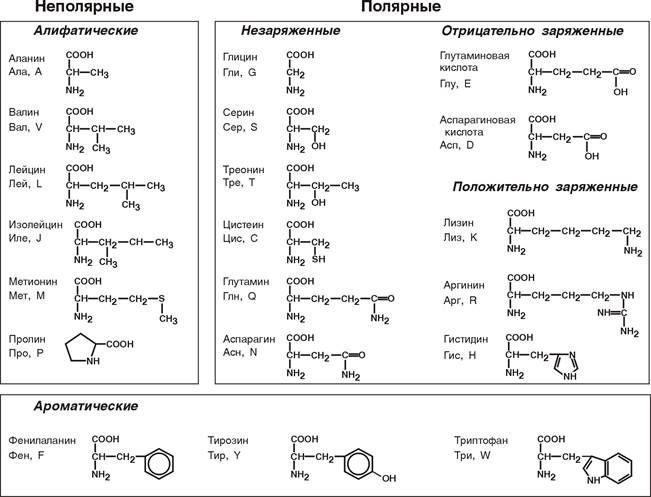
Рис. 2. Схема классификации аминокислот.
Свойства
Аминокислоты отличаются физическими свойствами от других органических кислот. Все соединения класса – кристаллические вещества, хорошо растворимые в воде, но плохо растворимые в органических растворителях. Они плавятся при высоких температурах, имеют сладковатый вкус и легко образуют соли.
Аминокислоты являются амфотерными соединениями. Благодаря наличию карбоксильной группы -СООН проявляют свойства кислот. Аминогруппа -NH2 обуславливает основные свойства.
Химические свойства соединений:
Из аминокислотных мономеров образуются длинные полимеры – белки. Один белок может включать несколько разных аминокислот. Например, содержащийся в молоке белок казеин состоит из тирозина, лизина, валина, пролина и ряда других аминокислот. В зависимости от строения белки выполняют различные функции в организме.
Рис. 3. Белки.
Что мы узнали?
Из урока химии 10 класса узнали, что такое аминокислоты, какие вещества содержат, как классифицируются. Аминокислоты включают две функциональные группы – аминогруппу -NH2 и карбоксильную группу -COOH. Наличие двух групп обуславливает амфотерность аминокислот: соединения обладают свойствами оснований и кислот. Аминокислоты делятся по нескольким признакам и отличаются количеством аминогрупп, наличием или отсутствием бензольного кольца, присутствием гетероатома, взаимодействием с водой.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
РЕФЕРАТ ПО ХИМИИ
Панина Дара Станиславовна
Воронаев Иван Геннадьевич
Что такое аминокислоты?
Применение аминокислот
Виды аминокислот
Классификация аминокислот
Группы аминокислот
Химические свойства
ЧТО ТАКОЕ АМИНОКИСЛЫТЫ?
Органические вещества — основной элемент построения всех белков животных и растительных организмов
Представляют собой органические соединения , в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известно около 500 встречающихся в природе аминокислот

ПРИМЕНЕНИЕ АМИНОКИСЛОТ
Аминокислоты способны к поликонденсации, что позволяет им образовывать полиамиды ( белки, пептиды, энант, капрон, нейлон). В результате взаимодействия аминокислот с полиамидами можно получить, к примеру, капроновые волокна или другие, более прочные ткани, которые в дальнейшем могут использоваться для изготовления веревок, канатов, сетей и т.д.
Также аминокислоты применяются в качестве лекарственных средств.
Аминокислоты в сельском хозяйстве применяются преимущественно в качестве кормовых добавок .
В пищевой промышленности аминокислоты применяются в качестве вкусовых добавок .
В химической промышленности введение в такие аминокислоты, как глутаминовая или аспарагиновая кислоты, гидрофобных группировок дает возможность получать поверхностно-активные вещества (ПАВ), широко используемые в синтезе полимеров, а также при производстве моющих средств, эмульгаторов, добавок к моторному топливу.

ВИДЫ АМИОКИСЛОТ
Глюкогенные : глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
Глюкогенные аминокислоты — аминокислоты, углеродная цепь которых в процессе метаболизма может быть превращена в глюкозу или гликоген.
К ним относятся аминокислоты, при распаде которых образуются пируват и метаболиты ЦТК

Кетогенные : лейцин, лизин.
Кетогенные аминокислоты - аминокислоты, в процессе обмена которых в организме образуются кетоновые тела; к кетогенным аминокислотам относятся пролин, лейцин и др.
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ

Аминокислоты отличаются друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты , связанную с α-углеродным атомом не участвующую в образовании пептидной связи при синтезе белка . Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы , теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот . Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам , и обладают химической индивидуальностью.
ГРУППЫ АМИНОКИСЛОТ
Существует три группы аминокислот :
Незаменимые аминокислоты — эти виды аминокислот не могут синтезироваться организмом, поэтому они должны поступать с пищей .
Заменимые аминокислоты — эти виды аминокислот могут синтезироваться организмом из других составляющих.
Условно заменимые аминокислоты — эти виды аминокислот обычно синтезируются организмом, но в условиях стресса (физические нагрузки, болезнь) вырабатываются в недостаточных количествах или же не синтезируются вообще.

Аминокислоты. Белки
Ключевые слова конспекта: Аминокислоты. Глицин. Пептидная связь. Белки. Качественные реакции на белки. Денатурация белка. ДНК. Ген.
Строение аминокислот
Аминокислоты представляют собой твёрдые кристаллические вещества, многие из них хорошо растворимы в воде, некоторые имеют сладкий вкус.

Способы получения и химические свойства аминокислот

В промышленности аминокислоты получают биотехнологическим путём как продукты жизнедеятельности микроорганизмов. Кроме того, разработано несколько лабораторных способов получения аминокислот. Один из них может быть представлен следующей схемой:
Простейшую аминокислоту называют аминоуксусной кислотой или глицином, её формула H2N—СН2—СООН.


Какие же свойства проявляют аминокислоты — кислотные или основные? Оказывается, подобно амфотерным неорганическим соединениям, в зависимости от природы реагента аминокислоты могут проявлять свойства как кислоты, так и основания. Например, глицин реагирует со щелочами с образованием солей, проявляя свойства кислоты:

В реакциях с кислотами глицин проявляет свойства органических оснований — аминов:
Понятие о пептидах и белках

Важное химическое свойство аминокислот — способность взаимодействовать друг с другом с отщеплением молекулы воды, образуя пептиды:

Между двумя остатками аминокислот образуется пептидная связь:
Получившийся в результате реакции дипептид может вступать в реакции с другими молекулами аминокислот, образуя полимеры — белки. Поскольку в результате этой реакции, помимо высокомолекулярного вещества, образуется второй продукт — вода, такой процесс относят к реакциям поликонденсации.
О важности белков для живых организмов свидетельствует тот факт, что в большинстве иностранных языков соединения такого типа называют протеинами (от греч. protos — первый). На Земле не существует ни одного живого организма, включая простейшие одноклеточные и бактерии, который не состоял бы из белковых молекул.
Структура и функции белков
Молекулы белков имеют также вторичную и третичную структуру. Характеристика этих структур белковых молекул приведена в таблице.

В зависимости от того, какую функцию выполняет белок в организме, различно его отношение к воде. Большинство белков в воде не растворяется, например кератины, которые составляют основу волос, ногтей, перьев, рогов и т. д. Для некоторых белков выполнение их функций невозможно без растворения. Так, в воде растворяются многие белки, выполняющие функции природных катализаторов, — ферменты.
Химические свойства белков
Для обнаружения белка проводят качественные реакции на белки. Белки дают фиолетовое окрашивание в щелочной среде под действием свежеприготовленного осадка гидроксида меди(II). Эту пробу называют биуретовой реакцией.
Вторую качественную реакцию на белки называют ксантопротеиновой. При действии на раствор белка концентрированной азотной кислоты образуется белый осадок, который быстро приобретает жёлтую окраску, а при добавлении водного раствора аммиака становится оранжевым.
Для обнаружения в белках соединений серы используют следующий тест. При горении серосодержащих белков появляется характерный запах жжёного рога.

Одно из важнейших химических свойств белков — реакции гидролиза. В присутствии природных катализаторов (ферментов) или сильных кислот молекулы воды расщепляют полимерную белковую молекулу до аминокислот:
Белки играют ключевую роль почти во всех структурах живых организмов и происходящих в них процессах.
В каждой клетке организма синтезируется множество белков. Информация о структуре всех белков организма зашифрована в ещё одних природных биополимерах — молекулах дезоксирибонуклеиновых кислот (ДНК). Мономеры ДНК — нуклеотиды. Молекулы ДНК человека содержат примерно 3,1 млрд пар нуклеотидов. Участок молекулы ДНК, отвечающий за синтез одного белка, называют геном.

Читайте также:

