Роль железа в природе сообщение
Обновлено: 05.07.2024
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Городская сессия научного общества учащихся
Роль железа в природе и в жизни человека
Выполнила: Увайдуллаева Лазиза Бердимуратовна
Научный руководитель: Имангажинова
Айгуль Кельгенбаевна, учитель химии
2.Глава 1. История изучения коррозии металлов……………… ………….5
1.3 Зависимость скорости коррозии от ряда условий ………………..7
1.4. Вещества, изменяющие скорость коррозии (Защита методом обработки среды)……………………………………………………………..8
1.5. Классификация методов защиты металлов………………………..9
Железо в организме человека…………………………………..10
3. Глава 2. Влияние различных агрессивных сред на коррозию железа…12
5.Список использованной литературы………………………………………15
“ Что будет, если железо исчезнет на земле?”.
А задумывался ли кто-нибудь из вас, что было бы, если все железо исчезло на земле и не осталось бы ни одного грамма этого элемента?
“ . На улицах стоял бы ужас разрушения: ни рельсов, ни вагонов, ни паровозов, ни автомобилей. не оказалось бы, даже камни мостовой превратились бы в глинистую труху, а растения начали бы чахнуть и гибнуть без живительного металла.
Разрушение ураганом прошло бы по всей земле, и гибель человечества сделалась бы неминуемой. Впрочем, человек не дожил бы до этого момента, ибо, лишившись трех граммов железа в своем теле и в крови, он бы прекратил свое существование раньше, чем развернулись бы нарисованные события. Потерять все железо — пять тысячных процента своего веса — было бы для него смертью!” Эту картину нарисовал академик А. Е. Ферсман.
Под призывный звон кольчуги
О железе, как о друге,
Каждый вспомнит и не раз.
Сколько силы в нем сокрыто:
Вилки, чайники, корыто,
И ведро, и даже таз!
Инструменты и машины,
Сталь, чугун оно дает,
Потому, не без причины,
Его очень уважает
Весь химический народ!
В клетках и морских глубинах,
Жизнь дает гемоглобину,
Кислород в крови храня.
Все сидящие здесь в зале
Вряд ли бы существовали,
Если б не было железа,
То бы не было меня!
Объект исследования: железо
Предмет исследования: коррозия железа
Цель исследования: Изучить процесс коррозии железа в различных средах.
Методы исследования:
Гипотеза: Предполагается, что железо по- разному с разной скоростью корродирует в разных средах
Для достижения поставленной цели и проверки гипотезы необходимо решить следующие задачи:
Рассмотреть историю изучения коррозии металлов.
Определить экспериментальным путём влияние различных агрессивных сред на коррозию железа.
Анализ полученных экспериментальных данных.
Глава 1. История изучения коррозии металлов
Люди издавна интересовались вопросами защиты от коррозии. Древнегреческий историк Геродот (5 век до нашей эры) и древнеримский ученый Плиний Старший (1 век до нашей эры) упоминают о применении олова для защиты железа от ржавчины.
Средневековые алхимики мечтали о получении нержавеющего железа. Уже в двадцатых годах 19 века электрохимическую коррозию изучают Г. Дэви и М. Фарадей. С тех пор во многих странах мира было выполнено очень много работ по коррозии различных металлических материалов. Однако правильной, научно обоснованной теории электрохимической коррозии не было. Существовала лишь теория, выдвинутая в 1830 году швейцарским ученым Де ла Ривом, оказавшаяся неверной, согласно которой подвергаться коррозии может лишь такой материал, в котором есть инородные включения. В начале тридцатых годов 20 века, советский ученый Фрумкин А.Н., изучая амальгамы металлов, показал, что активный металл амальгамы растворяется в кислотах, хотя амальгама – это однородное вещество. [6]
В 1935 году А.И. Шултин объяснил коррозию как индивидуальных металлов, так и сплавов. Он рассмотрел механизм протекания процесса коррозии и факторы, влияющие на его скорость. В том же 1935 году Я.В. Дурдин так же высказал обоснованную им мысль о растворении металлов в кислотах без наличия инородных включений в них. Таким образом, советские ученые, в первую очередь Шултин и Дурдин, сформулировали теорию электрохимической коррозии металлических материалов. В разработке общей теории электрохимической коррозии металлических материалов участвовали многие наши соотечественники, в том числе Владимир Александрович Кистяковский (1865–1952) и Александр Наумович Фрумкин (1895–1976). [7]
Виды коррозии.
Различают несколько видов коррозии:
1). Газовая коррозия, вызываемая агрессивными газами: сернистым газом, оксидами азота, оксидами углерода… К этой коррозии близка атмосферная коррозия, возникающая под влиянием атмосферы, именно кислородам, углекислого газа и примесей более менее случайного характера.
2). Коррозия в неэлектролитах: нефти, нефтепродуктах, тетрахлорметане…
3 ). Коррозия в растворах электролитов (почти всегда в водных растворах). Это наиболее распространенное явление называют электрохимической коррозией.
4). Коррозия блуждающими токами, вызываемая действием электрических токов, проходящих в почве (блуждающие токи), и развивающая на трубопроводах, кабелях. По существу является электрохимической. Источником появления таких токов служат различные виды электрифицированного транспорта (электропоезда, трамваи, метро), электросварочные аппараты.
5 ). Почвенная коррозия обуславливается некоторыми агрессивными веществами, находящимися в растворенном состоянии, например солями (особенно хлоридом магния) или гуминовыми кислотами. Глинистые почвы. Имеющие слабощелочную реакцию, тормозят коррозийные процессы.
(Приложение схема № 1).
Зависимость скорости коррозии от ряда условий.
Многие металлические предметы, которые мы повседневно применяем, не подвергают видимой коррозии, в то время как нож, к нашему огорчению, покрывается некрасивыми бурыми пятнами ржавчины; окрашенные трубы парового отопления, находясь в комнате, не имеют следов видимых коррозионных разрушений, в то время как эти же трубы, если их закрыть в почву, через некоторое время настолько разрушаются ржавчиной, что становятся непригодными к употреблению. Коррозия металла зависит от условий, в которых он находится.
Металлы стремятся перейти в свое естественное состояние, т. е. В котором они находятся в природе. И действительно, даже в условиях сухого воздуха при комнатной температуре блестящая поверхность металла тускнеет и становится матовой. При тщательной осмотре поверхности металла можно обнаружить, что она покрыта тончайшей пленкой оксидов – продуктов химического взаимодействия металлов и кислородов воздуха.
С повышением температуры скорость коррозии увеличивается. Кислород воздуха прежде всего взаимодействует с поверхностными атомами металлического изделия, образуя пленку оксидов. Эта пленка может быть той или иной прочности, в случае образования прочной пленки она препятствует дальнейшему коррозионному процессу. Особенно прочные пленки может получаются на поверхности алюминия и цинка. Такого рода пленки получили название защитных. Таким образом, коррозия не только разрушает металл, но и защищает его. При нагревании слитков железа или стали до температуры 1200 – 1300 С могут получатся пленки толщиной в несколько миллиметров, а иногда при нагревании больших слитков толщина слоя оксида достигает 1 см.
На металл оказывают влияние не только кислород воздуха, но и газы и пары воды, находящиеся в атмосфере. При соприкосновении поверхности металла с атмосферой , в котором содержится кислород, даже в случае полного отсутствия влаги в атмосфере на поверхности металла возникают пленки, появления которых и есть один из видов коррозии. Эти пленки у разных металлов их образования неодинаковы.
Вещества, изменяющие скорость коррозии.
(Защита методом обработки среды).
Нитротолуон – ускоряет растворение железа в серной кислоте в 10 – 15 раз.
Пассиваторы – вещества, которые замедляют разрушение металла в воде и в водных растворах солей 9 нейтральных растворах).
( Приложение схема № 2)
Классификация методов защиты металлов.
Вопрос о том, как защищать металлы от разрушения, является столь же древним, как и их применения. Можно сказать, что вместе с использованием металла возникла необходимость и его защиты. Однако научные методы защиты металлов от коррозии возникли много позже. Развитие этой науки было вызвано потребностями промышленности, неразрывно связанной с широким применением металлов.
Разработка методов защиты тесно связана с изучением причин, вызывающих коррозию металлов. Первые научные основы изучения коррозии металлов были заложены гениальным русским ученым М. В. Ломоносовым. Все применяемые методы защиты металлов можно разделить на три группы.
К первой группе относят различного рода покрытия. Сущность этого метода сводится к том, что на поверхности металла та или иная пленка, защищающая поверхность металла от контакта с внешней средой. Покрытия в свою очередь делятся на металлические, неметаллические и химические.
Ко второй группе относят способы защиты металлов путем обработки среды, в которой они находятся. Например, если причиной коррозии является кислород, растворенный в воде или в среде, которая соприкасается с металлом, то его удаляют тем или другим способом и таким образом предохраняют металл от воздействия на него кислорода. Если металл находится в кислоте, то создают условия, при которых кислота делается менее агрессивной по отношению к металлу.
Наконец, к третьей группе относят электрохимические методы защиты, с одной стороны, применяют для защиты металлов от коррозии блуждающими токами, а с другой – создают такие условия, при которых ослабляется действие электролитов.
( Приложение схема № 3 )
Железо в организме человека.
Распределение железа в организме человека.
Функциональное железо (составляет 75%) входит в состав гемоглобина, миоглобина, различных ферментов.
Транспортное железо (составляет менее 1%) представлено в форме трансферрина (железо, связанное с транспортным белком плазмы).
Депо железа (составляет около 25%), хранится в качестве запасов в печени, селезенке, костном мозге.
Пищевые источники железа:
Гемовое железо (составляет 10%) очень хорошо всасывается, и на его усвоение не влияют другие составляющие пищи. Содержится в мясных продуктах.
Негемовое железо (составляет 90%) плохо всасывается. Содержится в продуктах растительного происхождения, рыбе.
Обмен железа. В лечении больных железодефицитными анемиями важное место отводится продуктам питания, богатым соединениями железа (Приложение Таблица 1 )
Из поступающего в организм с пищей 15-20 мг железа в сутки всасывается не более 1 мг железа, причем интенсивность всасывания определяется потребностью в нем (при дефиците железа всасывание увеличивается). Наиболее полно всасывается железо из продуктов животного происхождения и значительно хуже из растительных продуктов. Высвобождение железа из продуктов несколько снижается при тепловой обработке, замораживании и длительном хранении пищевых продуктов. Всасывание железа усиливается под влиянием меди, желудочного сока, белков животного происхождения и особенно – аскорбиновой кислоты..
Средняя суточная потеря железа в норме составляет 1-1,5 мг. Количество теряемого железа компенсируется всасыванием такого же количества железа, поступившего с пищей.
Дополнительными кровопотерями являются заборы донорской крови, потери при проведении очищения крови и заборы крови на исследования. Последние имеют значение при длительном – многомесячном и многолетнем – наблюдении за биохимическим составом крови, например у онкологических больных.
Глава 2. Влияние различных агрессивных сред на коррозию железа
Коррозия металлов – разрушение металлов вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства. Физико - химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется. К качественным методам оценки степени коррозии относят следующие методы:
1.Наблюдение за изменениями внешнего вида образца после воздействия на него агрессивной среды;
2.Наблюдение за изменениями, происходящими в растворе (изменение окраски раствора, появление мути, хлопьев и других продуктов коррозии, выделение водорода).
Мы приготовили 7 образцов железных пластинок одинаковых по площади поверхности. 1 образец – эталон для сравнения и 6 для помещения в различную агрессивную среду. Образцы пластинок тщательно очистили от ржавчины и других загрязнений с помощью наждачной бумаги. Затем образцы обезжирили этиловым спиртом и поместили в емкость с агрессивной средой, выдержали их при заданной температуре необходимое время. После испытаний образцы тщательно промыли водой и удалили с них продукты коррозии. В нашем исследовании были применены следующие среды: вода, раствор слабощелочной ( KOH ), растворы фосфорной кислоты, поваренной соли и соляной кислоты. По прошествии недели образцы были сфотографированы и сравнены с эталоном.
Результаты исследования показали, что самой агрессивной средой для железа стала вода,, раствор соляной кислоты и раствор поваренной кислоты. Раствор щелочи практически не повлиял на процесс коррозии, т.к. щелочная среда является ингибитором, раствор фосфорной кислоты разрушил пластинку в связи с химической реакцией.
Процесс коррозии имеет место быть в современном мире. Он ухудшает качество металлов и металлические изделия, в том числе транспорт и подземные коммуникации нуждаются в надежной защите его от коррозии и применению в связи с эти высококачественных химически стойких материалов.
Необходимость осуществления мероприятий по защите от коррозии объясняется тем, что потери от коррозии приносят чрезвычайно большой ущерб. По имеющимся данным, около 10% ежегодной добычи металла расходуется на покрытие безвозвратных потерь вследствие коррозии и последующего распыления. Основной ущерб от коррозии металла связан не только с потерей больших количеств металла. Но и с порчей или выходом из строя самих металлических конструкций, т.к. вследствие коррозии они теряют необходимую прочность, пластичность, герметичность, тепло- и электропроводность, отражательную способность и другие необходимые качества.
Железо - это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar(Fe) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Fe 0 -2e - →Fe +2 , окисляется восстановитель
Fe 0 -3e - →Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3
II. Распространённость железа
Железо – один из самых распространенных элементов в природе . В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию . Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в не окисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe 3 O 4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:
гематит (железный блеск, кровавик)– Fe 2 O 3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:
лимонит (бурый железняк) – Fe 2 O 3 ‧nH 2 O содержит до 60% железа, месторождения встречаются в Крыму:
пирит (серный колчедан, железный колчедан, кошачье золото) – FeS 2 содержит примерно 47% железа, месторождения встречаются на Урале.
III. Роль железа в жизни человека и растений
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
IV. Физические свойства железа
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02-0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл. Химически чистое железо устойчиво к коррозии и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
V. Получение железа
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
VI. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
2) Накалённая железная проволока горит в кислороде, образуя окалину - оксид железа (II, III) - вещество чёрного цвета:
При пропускании кислорода через расплавленное железо возможно образование оксида железа (II):
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
4) Железо реагирует с неметаллами при нагревании:
Железо реагирует с галогенами с образованием галогенидов . При этом активные неметаллы (фтор, хлор и бром) окисляют железо до степени окисления +3:
Менее активный йод окисляет железо до степени окисления +2:
Железо реагирует с серой с образованием сульфида железа (II):
Железо реагирует с фосфором. При этом образуется бинарное соединения – фосфид железа:
С азотом железо реагирует при нагревании с образованием нитрида :
Железо реагирует с углеродом и кремнием с образованием карбида и силицида :
3Fe + C = t = Fe 3 C
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
При обычных условиях железо не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат железа (III) и вода:
Железо не реагирует при обычных условиях с концентрированной азотной кислотой также из-за пассивации . При нагревании реакция идет с образованием нитрата железа (III), оксида азота (IV) и воды:
С разбавленной азотной кислотой железо реагирует с образованием оксида азота (II):
При взаимодействии железа с очень разбавленной азотной кислотой образуется нитрат аммония:
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
8) Железо может реагировать с щелочными растворами или расплавами сильных окислителей. При этом железо окисляет до степени окисления +6, образуя соль (феррат)
При взаимодействии железа с расплавом нитрата калия в присутствии гидроксида калия железо окисляется до феррата калия, а азот восстанавливается либо до нитрита калия, либо до аммиака:
9) Простое вещество железо восстанавливает железо до степени окисления +2 при взаимодействии с соединениями железа +3:
VII. Качественные реакции на
VIII. Применение железа
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: Мn, Сr, Мо и другие, улучшающие качество стали.

В естественных водах, среднее содержание железа (в интервале 0,01-26 мг/л). Кроме того, животные особи, бактерии и растения содержат его в своих организмах. Даже в тканях и внутренних органах людей есть железо, поступающее в организм вместе с едой. Потребность в нем для взрослого человека составляет 11-30мг. Избыток железа приводит к гемохроматозу и серьезным нарушениям внутренних органов.
Так как месторождения железных руд возникают в разных геологических условиях, то и состав руд и условия их расположения разнообразны.
Железо содержится во многих рудах:
• гематит (железный блеск, красный железняк),
• пирит (серный колчедан) и гетит,
• магнетит (магнитный железняк),
• сидерит и гидрогенит.
Круговорот железа в природе

(На примере круговорота серы и других соединений в природе)
За счет жизнедеятельности железобактерий (нитевидные бактерии и одиночные железобактерии) происходит круговорот железа в природе. Они окисляют железо до гидроксида железа, а углерод получают из углекислоты. Таким образом, железобактерии получают энергию для своей жизнедеятельности, а после смерти осаждаются в почве в виде болотной руды.
Области применения железа

В чистом виде железо непрочно, поэтому практически не применяется. Его используют для выработки электромагнитов, как катализатор химических реакций и др.
Основное применение этот металл находит в виде сплавов. На их долю приходится 95% всей металлопродукции. Железо основной компонент стали и чугуна. В стали меньше углерода, чем в чугуне, и поэтому она более пластична и устойчива к резким ударным нагрузкам железа.
Так же железо входит в состав никелевых и других сплавов, использующихся в электротехнике, железо-воздушных аккумуляторах и железо — никелевых аккумуляторах.
На основе железа производятся материалы, которые могут выдерживать действие низкой и повышенной температуры, агрессивной среды, ядерных излучений, вакуума и высоких давлений и т. п.
Железо относится к группе тех металлов, которые очень широко применяются во всех областях народного и бытового хозяйства. Чугун и сталь стали основой современной техники. С их участием произошло развитие тяжелой промышленности, разнообразного наземного транспорта и др.
Железобактерия
Железобактерии или сульфатовосстанавливающие бактерии могут разрушать железо в металлических трубах, в результате чего содержание железа в воде повышается, особенно в условиях застоя воды в трубопроводах.
Железобактерии , в частности Gallionella, развиваются в виде яалета на стенке пробирки там, где для них создается оптималь-лая концентрация закисного железа и кислорода.
Железобактерии поглощают из окружающей среды растворенные в воде закисные соли железа и превращают их в гидрат окиси железа.
Железобактерии поглощают из окружающей средь: растворенные в воде закисные соли железа и превращают их в гидрат окиси железа.
Железобактерии относятся к автотрофной группе организмов и могут развиваться в среде, не содержащей органических веществ. Соотношение между окисленным железом и ассимилированным из углекислоты углеродом ( 500: 1) показывает, какое большое количество Ре ( ОН) з образуется при автотрофном росте. Гидроокись железа ( III) после отмирания бактерий служит материалом для образования болотных и озерных руд. Вода, содержащая железо ( II), способна давать железистые отложения в трубах и теплообменниках при малых скоростях движения воды и небольших температурных перепадах.
Железобактерии этой группы — облигатные аэробы, но могут удовлетворительно расти при низком содержании 02 в среде. Единственно возможный способ существования — хемоорганогетеротрофия, при этом представители рода Sphaerotilus предпочитают условия с относительно высоким содержанием органических веществ, а многие штаммы Leptothrix — среды с низким уровнем органики.
Железобактерии поглощают железо в ионном состоянии и выделяют в виде нерастворимых соединений, благодаря чему ускоряется процесс анодного растворения железа. На отдельных участках поверхности металла могут осаждаться продукты разложения микроорганизмов в виде пленок, обладающих более высоким потенциалом, чем железо. Одновременно с этим ранее образованные пассивные защитные пленки могут разрушаться бактериями.
Железобактерии широко используют в промышленности для бактериального выщелачивания меди из отходов и бедных руд.
Железобактерии широко распространены в природе: установлено их наличие в морской и пресной водах, почве, средах, содержащих неорганические и органические соединения железа. Эти бактерии не объединены общностью происхождения, поэтому термин железобактерии является скорее физиологическим и экологическим понятием.
Железобактерии представляют серьезную опасность для конструкционных материалов водоохлаждаемых теплообменников и оборудования систем промышленного и бытового водоснабжения, в первую очередь углеродистых сталей. Так, в воде, используемой в системах охлаждения ряда химических заводов, обнаружены представителижелезобактерий родов Leptothrix, Sidero-capse, Ochrobium, образующие отложения на внутренних поверхностях теплообменников.
Железобактерии могут вызвать коррозионное разрушение нержавеющих сталей. Через месяц были замечены сквозные разрушения стенок бака ( толщиной 3 мм) и сплошные коррозионные разрушения труб. В результате жизнедеятельности этих микроорганизмов в слое у поверхности металла создавались очень высокие концентрации хлоридов железа и марганца, вызывающие интенсивное питтингообразование.
Железобактерии широко используются в промышленности для бактериального выщелачивания меди из отходов и бедных руд.
Наиболее распространенная железобактерия — Clado-thrix dichotoma, образующая длинные ветвящиеся нити, покрытые слизистым влагалищем. В этих влагалищах откладывается гидрат окиси железа.
Некоторые железобактерии являются строгими прототро-фами, другие же могут существовать, питаясь органическими веществами.
Поскольку железобактерии поглощают железо только в ионном состоянии, непосредственно металл они разрушать не могут. Действие этих бактерий сводится к образованию на поверхности металла, в первую очередь углеродистых сталей, концентрационных гальванических элементов и микропар дифференциальной аэрации.
Удаление бактериального железа
При наличии в исходной воде большого количества железа пользователь может столкнуться еще с одной проблемой — появлением бактериальных загрязнений — активным развитием железобактерий.Если проблема железобактерий выявлена на ранней стадии, регулярное хлорирование или обработка хелатными агентами (органические вещества, образующие растворимые комплексы с железными отложениями), а также постоянное наблюдение за состоянием оборудования помогут минимизировать её последствия.
На ранней стадии появления железобактерий может помочь ударное хлорирование — необходимо создать избыточную концентрацию хлора 50 мг/л. Перед применением хлорирования нужно выяснить, насколько устойчиво к хлору установленное водоочистное оборудование.
Проблему с бактериальным железом может решить среда redox, однако, в подводящих трубопроводах при этом железобактерии будут продолжать развиваться и образовывать слизистые отложения.
Определение типа железа в воде
Прежде чем приступить к выбору оборудования для очистки воды от железа, следует понять, какой тип железа присутствует в воде.
- Двухвалентное железо (Fe+2) содержится в воде в растворенном состоянии и невидимо невооруженным глазом. Как правило, растворенное железо присутствует в воде из подземных источников (скважин). В присутствии двухвалентного железа вода выглядит прозрачной, но когда некоторое время находится в контакте с воздухом, приобретает рыжий цвет, и выпадает осадок. Это явление происходит вследствие окисления железа кислородом воздуха до трехвалентного состояния.
- Трехвалентное железо (Fe+3), окисленное — присутствует в воде в коллоидной форме (образует очень мелкие частицы рыжего цвета). Осаждение коллоидного железа может сопровождаться образованием и ростом железобактерий. Присутствие окисленного железа характерно для воды из поверхностных источников (колодцы, водоемы) и для воды из централизованного водопровода.
- Бактериальное железо (железобактерии) часто сопутствует минеральным отложениям Fe3+ и состоит из живых и мертвых бактерий, их оболочек и продуктов жизнедеятельности. Бактериальное железо достаточно легко отличить от минерального железа — это мягкие вязкие слизистые отложения. В некоторых случаях они безвредны, в других — наносят огромный ущерб. В трубопроводе и водоочистном оборудовании железобактерии часто становятся причиной язвенной коррозии железа и стали и сильно ускоряют образование железистых отложений.
Характеристика железа
Физические свойства

Железо – это серебристо-белый металл с сероватым оттенком. В чистом виде пластичен, но непрочен. При добавлении в него различных добавок (например, углерода) твердость и хрупкость сплава повышается. Железо хорошо проводит электричество, тепло и обладает мощными магнитными свойствами, то есть под действием магнитного поля оно намагничивается и потом само становится магнитом.
Железо особенно важно для живых организмов. Оно способствует дыхательным процессам и входит в состав гемоглобина крови (477 мг/л)
Это значит, что железо участвует в процессе доставки кислорода от органов дыхания к тканям.
Находясь в воде и на влажном воздухе железо меркнет и ржавеет, а при температуре 1539°С легко плавится и поддается ковке. При высоких температурах железо реагирует с паром воды.
Железо образует 300 разнообразных минералов (карбонаты, сульфиды и т.д.) и энергично мигрирует в земной коре. Его называют металлом земных недр, так как он копится в кристаллизации магмы.
Химические свойства

Железо — металл со средней степенью химической активности. На воздухе, на нем образуется защитная пленка, которая препятствует коррозии и ржавлению. Если воздух влажный, железо окисляется и покрывается ржавчиной.
Растворяется в разведенной соляной или серной кислотах, с выделением водорода. Вытесняет из растворов солей металлы. Во время нагревания взаимодействует с неметаллами.

Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Смотрите так же:
СТРУКТУРА
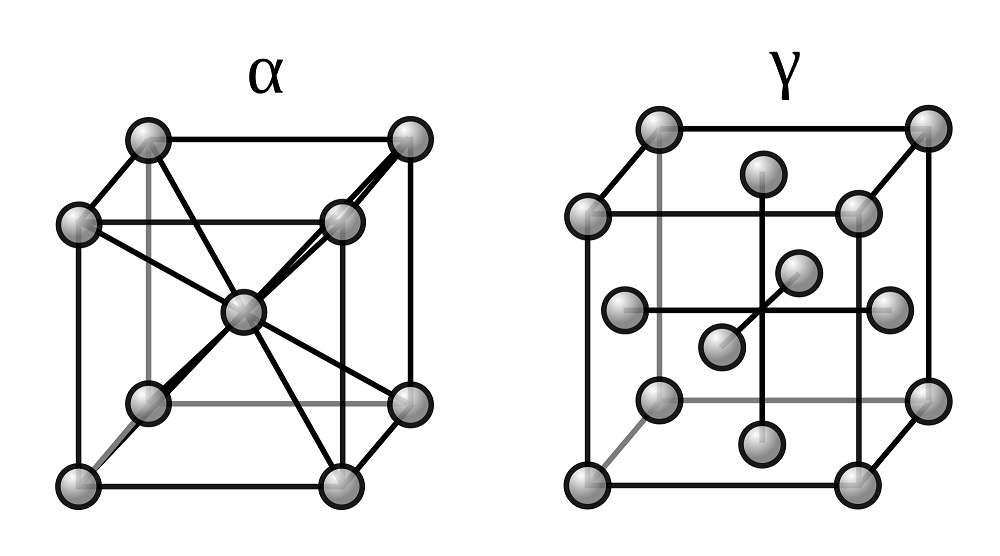
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация – γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная – α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, – единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

ПРОИСХОЖДЕНИЕ

ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Читайте также:

