Распространение элементов неметаллов в природе сообщение
Обновлено: 06.07.2024
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия — 2,3%
магния — 2,3%
калия - 2,1 %
титана — 0,56%
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей:
сульфидов: галенит PbS, киноварь НgS,
хлоридов: сильвин КС1, галит NaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит ВаSO4, ангидрид Са8О4 фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3.
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Нахождение неметаллов в природе
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень незначительных количествах), в воздухе (азот и кислород) , в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Положение неметаллов в Периодической системе Д.И. Менделеева
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Причисляя тот или иной элемент к разряду металлов, мы имеем в виду наличие у него определенного комплекса свойств:
1. Плотная кристаллическая структура.
2. Характерный металлический блеск.
3. Высокая теплопроводность и электрическая проводимость.
4. Уменьшение электрической проводимости с ростом температуры.
5. Низкие значения потенциала ионизации, т.е. способность легко отдавать электроны.
6. Ковкость и тягучесть.
7. Способность к образованию сплавов.
Все металлы и сплавы, применяемые в настоящее время в технике, можно разделить на две основные группы. К первой из них относят черные металлы - железо и все его сплавы, в которых оно составляет основную часть. Этими сплавами являются чугуны и стали. В технике часто используют так называемые легированные стали. К ним относятся стали, содержащие хром, никель, вольфрам, молибден, ванадий, кобальт, титан и другие металлы. Иногда в легированные стали входят 5-6 различных металлов. Методом легирования получают различные ценные стали, обладающие в одних случаях повышенной прочностью, в других - высокой сопротивляемостью к истиранию, в третьих - коррозионной устойчивостью, т.е. способностью не разрушаться под действием внешней среды.
Ко второй группе относят цветные металлы и их сплавы. Они получили такое название потому, что имеют различную окраску. Например, медь светло-красная, никель, олово, серебро - белые, свинец - голубовато-белый, золото -желтое. Из сплавов в практике нашли большое применение: бронза - сплав меди с оловом и другими металлами, латунь - сплав меди с цинком, баббит - сплав олова с сурьмой и медью и др.
Это деление на черные и цветные металлы условно.
Наряду с черными и цветными металлами выделяют еще группу благородных металлов: серебро, золото, платину, рутений и некоторые другие. Они названы так потому, что практически не окисляются на воздухе даже при повышенной температуре и не разрушаются при действии на них растворов кислот и щелочей.
Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они хорошо куются, вытягиваются в проволоку, прокатываются в листы и т.п.
Характерные физические свойства металлов находятся в связи с особенностями их внутренней структуры. Согласно современным воззрениям, кристаллы металлов состоят из положительно заряженных ионов и свободных электронов, отщепившихся от соответствующих атомов. Весь кристалл можно себе представить в виде пространственной решетки, узлы которой заняты ионами, а в промежутках между ионами находятся легкоподвижные электроны. Эти электроны постоянно переходят от одних атомов к другим и вращаются вокруг ядра то одного, то другого атома. Так как электроны не связаны с определенными ионами, то уже под влиянием небольшой разности потенциалов они начинают перемещаться в определенном направлении, т.е. возникает электрический ток.
Наличием свободных электронов обусловливается и высокая теплопроводность металлов. Находясь в непрерывном движении, электроны постоянно сталкиваются с ионами и обмениваются с ними энергией. Поэтому колебания ионов, усилившиеся в данной части металла вследствие нагревания, сейчас же передаются соседним ионам, от них - следующим и т.д., и тепловое состояние металла быстро выравнивается; вся масса металла принимает одинаковую температуру.
Неметаллы
Неметаллические элементы в основном расположены в правой верхней части периодической системы. Так как в периодах слева направо у атомов элементов увеличивается заряды ядер и уменьшаются атомные радиусы, а в группах сверху вниз атомные радиусы также возрастают, то понятно, почему атому неметаллов сильнее, чем атомы металлов, притягивают наружные электроны. В связи с этим у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Самым сильным окислителем является фтор. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке:
Si, B, H, P, C, S, I, N, Cl, O, F.
Следовательно, энергичнее всего взаимодействует с водородом и металлами фтор:
Менее энергично реагирует кислород:
Фтор - самый типичный неметалл, которому нехарактерны восстановительные свойства, т.е. способность отдавать электроны в химических реакциях.
Кислород же, судя по его соединениям с фтором, может проявлять и положительную степень окисления, т.е. являться восстановителем.
Все остальные неметаллы проявляют восстановительные свойства. Причем эти свойства постепенно возрастают от кислорода к кремнию: O, Cl, N, I, S, C, P, H, B, Si. Так, например, хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2 O, ClO2 , Cl2O2 ), в которых хлор проявляет положительную степень окисления. Азот при высокой температуре непосредственно соединяется с кислородом и, следовательно, проявляет восстановительные свойства. Еще легче с кислородом реагирует сера: она проявляет и окислительные свойства.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это H2, F2, Cl2, Br2, I2 (элементы VII группы Периодической системы), а также кислород O2 и азот N2. Из трехатомных молекул состоит газ озон (O3).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов - C, Si, S и т.д.
Такие простые вещества, как озон и кислород, имеющие одинаковый качественный состав (оба состоят из одного и того же элемента - кислорода), но различающиеся по числу атомов в молекуле, имеют различные свойства. Так, кислород запаха не имеет, в то время как озон обладает резким запахом, который мы ощущаем во время грозы. Свойства твердых неметаллов, графита и алмаза, имеющих также одинаковый качественный состав, но разное строение, резко отличаются (графит хрупкий, алмаз твердый). Таким образом, свойства вещества определяются не только его качественным составом, но и тем, сколько атомов содержится в молекуле вещества и как они связаны между собой.
Неметаллы в виде простых тел находятся в твердом или газообразном состоянии (исключая бром - жидкость). Они не имеют физических свойств, присущих металлам. Твердые неметаллы не обладают характерным для металлов блеском, они обычно хрупки, плохо проводят электрический ток и тепло (за исключением графита).
Химические элементы принято делить на металлы и неметаллы по их химическим свойствам. В периодической системе неметаллы расположены в А-группах : IА, IIIА–VIIIА . От металлов их отделяет ступенчатая линия водород — бор — оганесон. Неметаллы находятся выше этой линии, то есть занимают правый верхний угол таблицы, образуя своеобразный треугольник ( рис. 61 ).
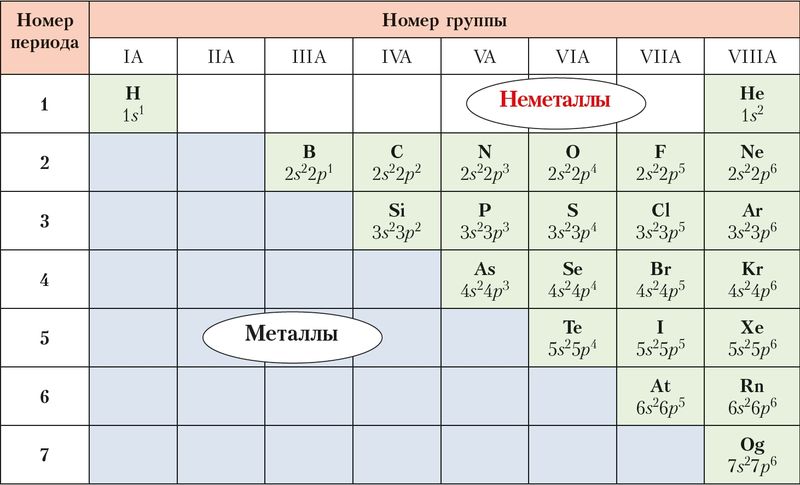
Рис. 61. Неметаллы и электронная конфигурация их внешнего энергетического уровня
Элементы, расположенные в одной группе, сходны по строению атома, а значит, во многом и по свойствам. Поэтому для некоторых групп неметаллов применяют общие названия. Так, неметаллы VIIIA-группы называют благородными газами. Для элементов VIIA-группы используют название галогены — рождающие соли. Неметаллы VIA-группы имеют общее название халькогены — рождающие руды.
По электрофизическим свойствам, в отличие от химических, простые вещества, состоящие из атомов тех или иных элементов, подразделяют на три группы: металлы, полупроводники и диэлектрики. Различить эти вещества можно не только по величине электропроводности, но и по характеру её зависимости от температуры. С ростом температуры электропроводность металлов падает, а полупроводников и диэлектриков растёт. Типичные полупроводники — кремний и германий.
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Электронная конфигурация валентных электронов неметаллов в общем виде — ns 2 np 1−5 Исключение составляют водород (1s 1 ) и гелий (1s 2 ), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Нахождение неметаллов в природе
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень незначительных количествах), в воздухе (азот и кислород) , в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Положение неметаллов в Периодической системе Д.И. Менделеева
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Получение неметаллов
Многообразие неметаллов породило многообразие способов их получения, так водород получают, как лабораторными способами, например, взаимодействием металлов с кислотами (1), так и промышленными способами, например, конверсией метана (2).
![]()
С)
Получение галогенов осуществляют в основном, путем окисления галогеноводородных кислот:
Для получения кислорода используют реакции термического разложения сложных веществ:
Серу получают неполным окислением сероводорода (1) или по реакции Вакенродера (2):
Для получения азота используют реакцию разложения нитрита аммония:
Основной способ получения фосфора – из фосфата кальция:
Химические свойства неметаллов
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
— взаимодействие с другими неметаллами
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
Атомы неметаллических элементов составляют подавляющее большинство соединений во Вселенной и верхних слоях Земли. Они более распространены в природе, чем металлы. Некоторые неметаллические элементы встречаются в природе в виде простых веществ: месторождения самородной серы в Прикарпатье; Завальевское месторождение графита; существуют залежи пород, содержащих алмазы. В состав воздуха входят: азот, кислород, инертные газы. Распространенным элементом в космосе является водород. Гораздо больше атомов неметаллических элементов образуют различные сложные вещества. Так, значительную часть литосферы составляет кремнезем SiO 2, гидросферы – вода.
Кислород один из самых распространенных элементов на Земле. В земной коре в составе соединений 49% по массе. Он входит в состав воды, горных пород, минералов, солей. Есть обязательной составной частью растительных, животных организмов: входит в состав белков, жиров, углеводов. В воздухе свободного кислорода 21% по объему.
Сера широко распространен в природе как в свободном виде (с примесями горных пород), так и в соединениях с различными металлами (сульфиды), а также в виде солей. Сульфиды: железный колчедан или пирит FeS2, цинковая обманка ZnS, медный блеск CuS, киноварь HgS. Сульфаты: гипс CaSO4 • 2H2O, глауберовая соль Na2SO4 • 10H2O, горькая соль MgSO4 • 7H2O. Содержится в живых организмах, входит в состав белка, в состав органических соединений в нефти.
Элемент Карбон входит в состав нефти, газа, угля, сланцев, органических соединений, углекислого и угарного газов. Важный элемент живой природы – входит в состав белков, жиров, углеводов, витаминов, ферментов, гормонов. В виде простых веществ графита и алмаза; сложных веществ: CaCO3 – мел, известняк, мрамор, CaCO3 • MgCO3 – доломит, MgCO3 – магнезит.
Чистый кремний в природе не существует, его добывают химическим способом. По распространенности занимает второе место после кислорода. Оболочка Земли на 97% состоит из соединений кремния. Встречается в виде: SiO2 – песок, кварц, кремнезем; минералов – слюда, асбест, тальк, нефелин, полевой шпат. В стеблях растений (хвощ, бамбук), в теле птиц и животных – перья, глаз, скелет, тело губок.
Фосфор в природе существует только в соединениях в виде фосфатов. Главные минералы в состав которых входит Фосфор – Ca3 (PO4) 2 – апатиты и фосфориты (0,08%). Элемент Фосфор входит в состав костной, мышечной, нервной тканей человека и животных, многие его в клетках мозга.
Из \(118\) известных на данный момент химических элементов \(96\) являются металлическими, и только \(22\) химических элемента относятся к неметаллическим.
Кислород и кремний составляют около \(76\) % (практически три четверти) от массы земной коры (\(O_2\) — \(49,4\) % , \(Si\) — \(25,8\) % ).

Такие химические элементы, как углерод \(C\), водород \(H\), кислород \(O\), азот \(N\), фосфор \(P\) и сера \(S\), составляют \(98,5\) % от массы растений и \(97,6\) % от массы тела человека.

В состав земной атмосферы входят как простые, так и сложные вещества, образованные элементами-неметаллами.
В объёмных долях на азот N 2 приходится \(78\) % , на кислород O 2 — \(21\) % , а инертные газы составляют \(0,96\) % от объёма воздуха. В состав земной атмосферы также постоянно входит углекислый газ CO 2 , доля которого (по разным оценкам) составляет около \(0,04\) % от состава чистого воздуха.
Следует иметь в виду, что в воздухе постоянно содержится водяной пар H 2 O и другие соединения неметаллов, доля которых не является постоянной.

Главный химический элемент Вселенной — это водород. Из него образованы Солнце и другие звёзды, газовые облака и т. д. И на нашей планете из каждых \(100\) атомов \(17\) — это атомы водорода.
В Периодической системе химических элементов неметаллы занимают правый верхний угол и находятся только в главных (А) группах.
В электронной оболочке атомов неметаллов на внешнем энергетическом уровне, как правило, содержится от \(4\) до \(8\) электронов. Исключение составляют только водород \(H\), у которого в электронной оболочке атома вообще только один электрон, гелий \(He\) с двумя электронами и бор \(B\), у которого на наружном энергетическом уровне имеются три электрона.
Радиусы атомов неметаллов меньше, чем у металлов того же периода, поэтому в силу близости положительно заряженного ядра атома неметаллы хорошо удерживают свои валентные электроны (электроны внешнего энергетического уровня).

Радиусы атомов неметаллов существенно меньше, чем радиусы атомов металлов, находящихся в том же периоде.
Главное отличительное свойство неметаллов — это их высокая электроотрицательность , т. е. способность в химических соединениях притягивать электроны.
Рис. \(6\). Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу)
ОЭО неметаллических химических элементов (выделены красным цветом) превосходит соответствующую величину металлических химических элементов
Атомы неметаллов способны как принимать, так и отдавать электроны, а значит, химические вещества, содержащие такие атомы, в ходе превращений могут выступать как в роли окислителей, так и в роли восстановителей.
Читайте также:

