Подготовьте сообщение об областях применения одного из следующих веществ фторида натрия
Обновлено: 05.07.2024
D1B : Токсичный материал, имеющий серьезные непосредственные последствия
Транспортировка опасных грузов: класс 6.1, группа III
D2A : Очень токсичный материал, вызывающий другие токсические эффекты
Хроническая токсичность: флюороз
D2B : Токсичный материал, обладающий другими токсическими эффектами
Раздражение глаз у животных
Раскрытие на уровне 1,0% в зависимости от ингредиента список раскрытия
Код Кемлера:
60 : материал токсичный или представляющий незначительную степень токсичности Номер
ООН :
1690 : ФТОРИД НАТРИЯ
Класс:
6.1
Этикетка: 6.1 : Токсичные вещества Упаковка: Группа упаковки III : вещества с низкой опасностью.
Код Кемлера:
60 : материал токсичный или представляющий незначительную степень токсичности Номер
ООН :
3415 : РАСТВОР ФТОРИДА НАТРИЯ
Класс:
6.1
Этикетка: 6.1 : Токсичные вещества Упаковка: Группа упаковки III : вещества с низкой опасностью.
Фторид натрия представляет собой химическое соединение по формуле NaF. Это бесцветное твердое вещество, используемое в качестве источника ионов фтора в различных областях. Он дешевле и менее гигроскопичен, чем фторид калия .
Резюме
Характеристики
Фторид натрия - это ионное соединение, которое при растворении дает ионы Na + и F - . Он кристаллизуется с кубической структурой, такой как NaCl, где катионы и анионы занимают все октаэдрические позиции . Минеральная форма NaF - виллиаумит , который встречается довольно редко.
Производство
NaF получают путем нейтрализации фтористоводородной кислоты или гексафторкремниевой кислоты , побочных продуктов производства удобрений на основе монофосфата кальция . Нейтрализация осуществляется с гидроксидом натрия и натрия карбонат , например. Для осаждения NaF можно использовать спирты:
HF + NaOH → NaF + H 2 O
В растворах , содержащих HF, фторид натрия осаждается в виде бифторида соли NaHF 2 . NaF получают нагреванием.
HF + NaF ⇌ NaHF 2
Согласно отчету 1986 года, мировое потребление NaF составило 7 миллионов тонн.
Меры предосторожности при использовании
Фторид натрия очень токсичен, и простое дыхание им может быть опасным. Он влияет на систему кровообращения, сердце, скелет, центральную нервную систему и почки. В конце концов, это может даже привести к смерти. С другой стороны, он очень раздражает кожу, глаза и дыхательные пути.
В случае вдыхания необходимо держаться подальше от всех источников пыли, сморкаться, при необходимости дышать искусственным кислородом и обратиться к врачу. В случае попадания в глаза и на кожу тщательно промойте водой и следите за осложнениями.

Фторид натрия — это неорганическое соединение, соль плавиковой кислоты и натрия. Представляет собой белое кристаллическое вещество без запаха. Химическая формула фторида натрия — NaF. Химическая связь — ионная.
Распространение в природе
В природе это вещество существует в основном в виде минерала виллиомита. Этот минерал и представляет фторид натрия в чистом виде. Он может иметь очень красивую расцветку от карминово-красной, розовой до бесцветной. Является довольно хрупким и относительно нетвердым. Блеск этого минерала напоминает блеск стекла. Его месторождения находятся в Северной Америке, Африке и на Кольском полуострове, но в целом он встречается довольно редко.
Получение в промышленности
Фторид натрия — довольно полезное соединение, поэтому синтезируется он в промышленных масштабах. Мировое производство составляет более 10000 тонн в год. В большинстве случаев сырьем являются гексафторсиликаты, которые также получают искусственно. На производстве их подвергают щелочному гидролизу, в результате которого в реакционной смеси выделяется фторид натрия. Но его еще необходимо отделить от примесей оксида кремния и силиката натрия. Делают это зачастую обыкновенной фильтрацией.
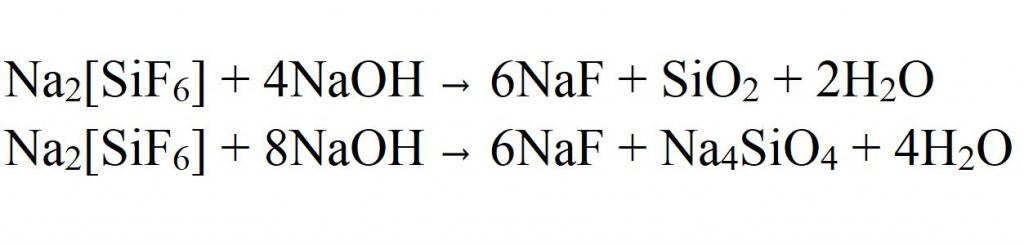
Но гексафторсиликаты даже при термическом разложении или при взаимодействии с карбонатом натрия могут давать фторид натрия. Это также может быть использовано при промышленном синтезе.

Также в промышленности существует способ получения фторида натрия из кальцинированной соды (карбоната натрия) и плавиковой кислоты. В результате их взаимодействия с помощью фильтрации удается получать технически чистый продукт:
Получение в лаборатории
В лаборатории возможны и другие способы получения этого соединения. Самый простой — это реакция нейтрализации гидроксида натрия плавиковой кислотой. Другой вариант: взаимодействие гидроксида натрия с фторидом аммония. Гидроксид натрия может давать фторид и при взаимодействии с простым фтором.

В теории фторид натрия можно получать и из простых веществ: натрия и фтора. Эта реакция протекает очень бурно, хотя на практике ее проводят очень редко.
Еще один способ получения — это термическое разложение дифторгидрата и некоторых комплексных солей. В этом случае получается продукт очень высокой чистоты.
При окислении простого фтора броматом натрия или другими окислителями, содержащими натрий, в качестве продукта может получаться фторид натрия.
Взаимодействием трифторида бора с гидридом натрия, также можно получить эту соль.
Физические свойства
Фторид натрия — это твердое кристаллическое вещество белого цвета. Температура плавления — 992°C, кипения — 1700°C. Не горюч. Так как химическая связь у фторида натрия - ионная, он хорошо растворим в воде, а еще лучше — во фтороводороде. Почти не растворим в органических растворителях. Не гигроскопичен и не образует кристаллогидратов.
Химические свойства
В водных растворах фторид натрия диссоциирует и образует комплексное соединение.
При взаимодействии с плавиковой кислотой образуется дифторгидрат. Но при избытке фтороводорода могут образовываться иные комплесксные соединения, которые называются гидрофториды натрия. Их состав может быть разным в зависимости от соотношения реагентов.
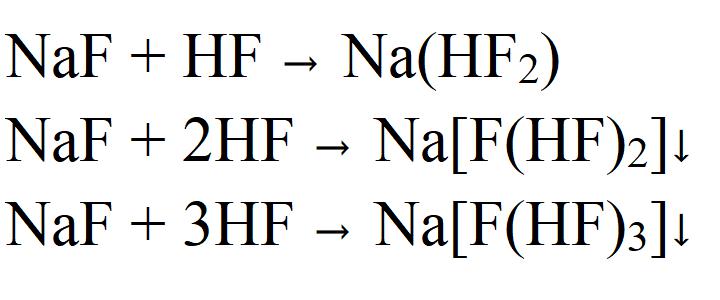
Как видно из химической формулы, фторид натрия — это типичная соль, поэтому он вступает в реакции обмена с другими солями, если в результате реакции образуется осадок или газ. При взаимодействии с кислотами выделяется газообразный фтороводород. А с гидроксидом лития образуется осадок фторида лития.

Фторид натрия может образовывать и другие комплексные соли, в зависимости от реагентов и условий реакции.

Токсичность
Фторид натрия — опасное вещество. Он имеет третий уровень опасности из четырех по стандарту NFPA 704. Смертельная доза для человека составляет 5-10 грамм. Это довольно много, но даже меньшие дозы фторида натрия вредят сердечно-сосудистой системе. Отравление может происходить как при вдыхании отравленного воздуха, так и при попадании этого неорганического соединения в пищу. В последнем случае может происходить раздражение желудка, вплоть до язвы.
Применение
Фторид натрия обладает хорошими антисептическими свойствами, поэтому его иногда добавляют в моющие средства. По той же причине он используется для обработки древесины. Раствор этой соли помогает бороться с плесенью, грибком и насекомыми. Чаще всего используют трехпроцентный раствор. Он хорошо проникает в древесину и защищает ее от гниения. Но у этого средства есть недостаток, из-за которого фторид натрия редко используют, — он легко вымывается из древесины во время дождей, так как эта соль хорошо растворима в воде.
Он также используется при синтезе некоторых химических соединений, в частности фреонов и инсектицидов. Ионы фтора останавливают гликолиз (окисление глюкозы), поэтому фторид натрия применяют для биохимических исследований.
Часто его используют и в металлургической промышленности для очистки поверхностей металлов, а также при их плавке и пайке. Вещество иногда добавляют и в цемент, делая бетон стойким к воздействию кислот, и в смазки для повышения термостойких качеств.
Самое спорное его применение — это добавление в зубные пасты. Для зубов фторид натрия — это источник фтора, который необходим для придания костям и зубам прочности, также служит для профилактики кариеса. Но при высоком потреблении этого элемента могут возникать негативные последствия. Поэтому до сих пор ведутся споры о применении фторидов в качестве добавок для зубной пасты.
Позитивное влияние фтора на организм
Фтор является довольно важным микроэлементом в организме человека, без которого невозможна нормальная его жизнедеятельность. В сутки необходимо потреблять 0,03 мг фтора на килограмм массы тела для взрослого человека. Ребенку же необходимо в 5 раз больше.
Функции фтора в организме очень разнообразны. Он способствует правильному росту и формированию костей, волос и ногтей, так как стабилизирует кальций в процессе минерализации. Особенно это важно во время роста и развития детей, а также при переломах. Этот элемент необходим для поддержания иммунитета. Железо лучше усваивается организмом, если в этом процессе участвует фтор.
При недостатке этого элемента ослабляется зубная эмаль, возрастает риск кариеса. У детей в этом случае могут появляться дефекты при развитии скелета. У взрослых появляется риск развития остеопороза. Это заболевание характеризуется пониженной плотностью костей, из-за чего возрастает их хрупоксть.
Проблемы при избытке фтора в организме
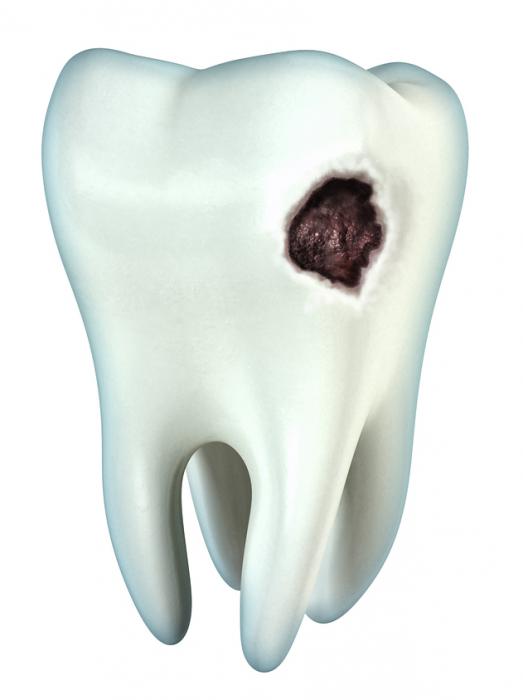
При повышенном содержании фтора в организме может возникнуть флюороз. Это заболевание характеризуется рядом необратимых последствий. В начальных периодах развития болезни страдает зубная эмаль. На ней появляются пятна разной формы и цвета. Пятна легко диагностируются стоматологом, и при своевременном лечении от них можно без труда избавится. Для отбеливания часто используют растворы неорганических кислот, раствор перекиси водорода или растворы других перекисей. После отбеливания эмали проводят реминерализацию раствором глюконата кальция. При лечении более тяжелых форм флюороза рекомендуется приминать глюконат кальция внутрь до окончания терапии. Если при флюорозе возникла эрозия зубной эмали, то применяют композитные материалы и восстанавливают форму зуба, примерно так же, как при пломбировании.
В качестве профилактики данного заболевания можно снизить поступление фтора в организм, если его концентрация в питьевой воде велика. Для этого обычно заменяют источник воды либо же просто проводят фильтрацию. Также можно убрать из рациона продукты, в которых содержится много фтора: морскую рыбу, животное масло, шпинат. Может помочь введение в пищу витаминов С и D, а также глюконата кальция.
Если избыток фтора наблюдается на протяжении длительного периода (10-20 лет), начинают страдать кости. Возникает остеосклероз, при котором, в отличие от остеопороза, плотность костей становится выше нормы, что приводит к снижению их упругости. Это также может стать причиной частых переломов. Но переживать не стоит. Настолько сильный переизбыток фтора в организме может возникнуть только у людей, работающих на производстве фторидов без соблюдения техники безопасности.
Фторирование воды
Как уже было сказано выше, фтор может использоваться для профилактики кариеса. По этой причине в середине прошлого века в некоторых странах начали применять фторирование водопроводной воды. Его суть напоминает хлорирование. В воду добавляют небольшое количество фторида натрия или иного компонента, содержащего фтор, для придания ей определенных свойств. Сегодня в США фторируется 2/3 всей воды.
Чтобы человек получал необходимое количество фтора, по данным Всемирной организации здравоохранения, питьевая вода должна содержать 0,5-1,0 мг фтора в литре. Но обыкновенная вода не всегда содержит такое количество, поэтому приходится увеличивать его искусственно.
Фторирование воды никак не влияет на ее вкус или запах. Благодаря этому процессу очень сильно снижается риск заболевания кариесом, особенно среди детей. Это происходит из-за того, что фтор уничтожает бактерии, которые могут растворять эмаль зубов и вызывать кариес.
Конечно, повышенное содержание фтора может привести к флюорозу, но, согласно авторитетным исследованиям, фторирование воды не может являться причиной развития данной патологии. Других побочных действий у такой воды также не наблюдается. Хотя в последнее время стали появляться некоторые низкокачественные исследования, говорящие об обратном. Набирал популярность и миф, что фторирование воды служит способом для утилизации фторидов, которые являются отходом алюминиевых предприятий. Но эта версия не нашла подтверждения.
Употребление фторированной воды не рекомендуется лишь при некоторых заболеваниях: диабете, гормональных нарушениях, артрите, болезнях щитовидной железы, почек и сердца.
В любом случае воду несложно избавить от присутствия фтора. Фильтры, работающие по принципу обратного осмоса, удаляют почти весь фтор, а дистилляция очищает воду от него полностью. Бытовые фильтры также могут частично или полностью задерживать фтор в себе. Пропуская воду через глинозем, костную муку или костный уголь можно также убрать фтор из воды. Некоторые фториды (например, фторид кальция) нерастворимы в воде, поэтому можно использовать метод осаждения, чтобы перевести весь фтор в осадок. Для этого зачастую используют известь.
Применение в фармакологии
Фторид натрия является действующим веществом некоторых лекарственных препаратов. Как правило, прием таких таблеток осуществляется по назначению врача, иногда терапия требует специального наблюдения и сопровождается регулярными исследованиями динамики протекания. Торговые названия препаратов фтора: "Натрия фторид", "Натриум флуоратум" и "Оссин". Их прописывают при недостатке фтора в организме, в частности при остеопорозе.
Препарат в виде драже и таблеток принимают внутрь. Почти весь фтор усваивается организмом, вне зависимости от приема пищи. Обычно такую терапию сочетают с приемом кальция и магния по 1-1,5 г в сутки. Это помогает костям более стабильно минерализоваться.
Но препарат опасно принимать свыше нормы. В таком случае может возникнуть избыток фтора, приводящий к флюорозу. При приеме лекарственных средств, содержащих фторид натрия, необходимо наблюдаться у стоматолога, чтобы предупредить развитие флюороза.

Фторид натрия — (Натрий фтористый) неорганическое бинарное соединение с химической формулой NaF. Белое кристаллическое вещество.
Содержание
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Использование
- 5 Опасность применения

Физические свойства
Фторид натрия — бесцветные кристаллы с кубической решеткой (a = 0,46344 нм, пространственная группа Fm3m, Z=4). Растворим в воде, безводном HF. Кристаллогидратов не образует.
Получение
В природе существует в виде относительно редкого минерала виллиомита: карминово-красные, темно-вишневые, изредка бесцветные кристаллы, содержит NaF с незначительными примесями, месторождения в Северной Америке, Африке, Кольский полуостров.
Так же NaF встречается в магматических породах, входит в состав в нефелинового сиенита.
В промышленности фторид натрия получают щелочным гидролизом гексафторсиликатов:
при избытке щелочи
Мировое производство фторида натрия оценивается в ~10 тыс. т.
Непосредственным взаимодействием щелочи и кислоты:
NaOH + HF ⟶ NaF + H2O
Чисто теоретический интерес представляет реакция получения фторида натрия из элементов:
реакция протекает очень бурно.
Плавиковая кислота разрушает соли более слабых кислот:
Также гидроксид натрия может разрушать соли летучих оснований:
Разложение дифторгидрата натрия при температуре ~350 °C:
Na(HF2) → 270−400oC NaF + HF
Нагрев до температуры 1100 °C гептафторониобата калия с натрием:
K2[NbF7] + 5Na → 1100oC Nb + 2KF + 5NaF
позволяет получить чистый ниобий, фторид калия и фторид натрия.
Химические свойства
В растворах фторид натрия подвергается гидролизу по аниону:
NaF + 4H2O → [Na(H2O)4] + + F − F − + H 2 O ⇄ H F + O H −
Степень гидролиза невелика, так как константа последней реакции pK = 10,8.
Присоединяет HF с образованием дифторгидрата натрия:
При избытке HF образуются высшие гидрофториды натрия:
известны соединения для n = 1÷4.
Сильные нелетучие кислоты разрушают фторид натрия:
Насыщенный гидроксид лития благодаря плохой растворимости фторида лития разрушает фторид натрия:
NaF + LiOH → NaOH + LiF↓
Образовывает гексафторсиликаты и гексафторалюминаты:
Расплав фторида натрия является электролитом, следовательно его можно разложить электролизом на элементы:
Использование
Фторид натрия и образующийся из него фторапатит используются для укрепления зубной эмали, которая и сама содержит фторапатит. Кроме добавления фтора в зубные пасты, производится фторирование питьевой воды. Зубная паста часто содержит фторид натрия, который необходим для предотвращения кариеса. Кроме того, фторид натрия используется как моющее средство. Используется в различных отраслях химической промышленности — при синтезе и в металлургии. Фторид натрия является реагентом при синтезе фреонов.
Натрия фторид используется для сохранения образцов тканей в биохимии и лекарственных тестирований; ионы фтора останавливают гликолиз. Натрия фторид часто используется вместе с иодуксусной кислотой, которая ингибирует создание фермента альдолазы.
Натрия фторид используют как компонент составов для очистки и алитирования металлов, флюсов для сварки, пайки и переплавки металлов, стекол, эмалей, керамики, огнеупоров, как компонент кислотоупорного цемента, термостойких смазок, составов для травления стекол, твердых электролитов, как консервант древесины, инсектицид, сорбент для поглощения UF6 из газовых потоков, реагент при получении фторуглеводородов, как компонент специальных сортов бумаги, как ингибитор брожения, компонент огнезащитных составов и средств пожаротушения.


Опасность применения
Натрия фторид классифицируется как токсичное вещество при ингаляции (например, через пыль) или при приеме пищи. Как было показано, при достаточно высоких дозах влияет на сердечно-сосудистую систему; смертельная доза для человека при весе 70 кг оценивается в 5—10 г. В больших дозах, когда нужно использовать фторид натрия для лечения остеопороза, может вызвать боль в ногах и перепады в артериальном давлении, когда дозы слишком высоки, то происходит раздражение желудка, иногда такое сильное, что это может вызвать язву. В малых дозах используется для фторирования воды. При большой концентрации фтора (или при частом употреблении продуктов, жидкостей и тому подобных продуктов, содержащих фтор) может вызвать флюороз зубов, который может привести к потере зубов.
Почти каждый день мы видим по телевидению рекламу зубной пасты. Предлагаются различные марки и бренды, но почти все они борются с кариесом и содержат фтор. Этот элемент является одним из важнейших в составе пасты и активно противодействует появлению кариозных зубов в полости рта. Однако медицина имеет альтернативное и довольно эффективное средство для пополнения запасов фтора в организме — фторид натрия (раствор или таблетки). Он помогает укрепить зубную эмаль и побороть кариес. Если речь идет о детях, то такой вариант лечения намного более результативен по сравнению с зубными пастами.
Фторид натрия: формула
Это неорганическое соединение имеет белый цвет и в природе встречается в виде кристалла виллиомита или является составной частью некоторых магматических пород. Бесцветные или белые кристаллы, которые растворяются в воде и не образуют кристаллогидратов, - это и есть фторид натрия. Кристаллическая решетка соединения образуется за счет ионных связей. Химическая формула довольно проста и известна ещё из школы – NaF.
По разным данным, в мире ежегодно синтезируется около 10 тысяч тонн этого соединения. Оно используется не только в медицине, но и в промышленности, химическом производстве, а также как моющее средство и консервант для дерева.
Натрия фторид: применение в медицине
Фтор является минералом, который обеспечивает правильное формирование костной ткани и укрепляет эмаль. За счёт включения этого элемента в процесс обмена кость становится более прочной и плотной, то есть налицо профилактика остеопороза. Также усиливается и эмаль, что защищает зубы от агрессивного воздействия пищи и напитков, которые мы потребляем каждый день.

Формы применения
Фторид натрия входит в состав большинства зубных паст, а также выпускается в виде медицинского препарата. Использование пасты обеспечивает местное действие фтора, то есть усиление эмали зубов. Фторид натрия (раствор или таблетки) имеет также системное действие, то есть химическое соединение разносится с током крови ко всем органам и тканям, что приводит к лучшей усвояемости.

Как действует соединение фтора на организм
Инструкция по применению препарата чётко описывает механизм действия натрия фторида на организм. Ионы фтора включаются в процесс образования кости и стабилизируют кальций, который входит в состав апатита. Как известно, гидроксиапатит является основным компонентом костной ткани. Поэтому фтор способствует образованию труднорастворимых апатитов, которые обеспечивают жёсткость и плотность кости. Кроме того, натрия фторид усиливает активность остеобластов - клеток, которые отвечают за синтез костной массы. Аналогичное влияние наблюдается и на эмаль, которая является самой прочной тканью в организме. Натрия фторид стимулирует её созревание и повышает крепкость, а также проявляет незначительное бактерицидное действие в отношении кариесогенной микрофлоры.
Показания к применению соединений фтора
Таблетки "Натрия фторид" применяют при различных формах остеопороза, кариеса, а также в том случае, когда концентрация фтора в воде меньше 0,6 мг/мл. Стоит отметить, что таблетированные препараты используются как для профилактики, так и лечения.
Как правильно подобрать дозировку

Подобрать дозу должен ваш лечащий врач. Инструкция по применению фторида натрия указывает, что при остеопорозе курс лечения должен быть длительным и составлять не менее года. Ориентировочная доза для взрослого составляет 0,015–0,02 грамма 3 раза в день. С профилактической целью достаточно принимать 1 таблетку натрия фторида 1 раз в день. Для лечения кариеса у ребёнка доза колеблется от 0,0011 до 0,0022 грамма в сутки, но её надо обязательно согласовать с врачом. Детям (в возрасте от 16 лет) лучше всего подойдут полоскания рта 0,05–0,2% раствором натрия фторида.
Возможные побочные эффекты
Побочное действие от таблеток фторида натрия встречается очень редко. Однако инструкция по применению препарата предостерегает: при системном применении лекарства могут отмечаться повышенная утомляемость, головная боль, аллергические реакции и идиосинкразия, незначительная отрыжка или вздутие живота. О таких проявлениях следует помнить, а при их возникновении - отменить препарат и проконсультироваться с врачом.
Когда натрия фторид противопоказан

Соединение фтора является неорганическим комплексом, поэтому требует
своевременной утилизации из организма. В случае если у пациента выявлено нарушение функции почек или печени, принимать препарат не рекомендуют. Фторид натрия обладает способностью повышать кислотность желудочного сока, что нежелательно для людей, страдающих от язвенной болезни. Беременность и кормление грудью также являются факторами, которые несовместимы с препаратами на основе фтора. Натрия фторид для детей с кариесом является необходимым компонентом лечения, однако оно должно проводиться под наблюдением лечащего врача.
Что делать при передозировке

Передозировка соединениями фтора встречается редко. Чаще симптоматика наблюдается у детей и является относительно неспецифической. Отмечается повышенное слюнотечение и слезотечение, диарея и тошнота, нарушения зрения и повышение температуры, падение артериального давления. Симптоматика не всегда может натолкнуть врача на правильный диагноз, поэтому всегда следует указывать препараты, которые вы принимаете. В случае длительного неправильного дозирования фторида
натрия у детей развивается флюороз — нарушение формирования и обызвествления эмали. Зубы становятся жёлтыми и имеют большое количество коричневых пятен, эмаль испещрена и становится хрупкой.
В случае острой передозировки следует выпивать большое количество жидкости (более 2 л в сутки) с раствором кальция (подойдёт кальция глюконат с водой или обычное молоко). Соединения кальция способствуют осаждению фторидов и вымыванию из желудка кислого содержимого. Обязательно назначаются слабительные препараты (натрия сульфат), вводятся электролиты (реосорбилакт). Важным условием лечения является контроль уровня кальция в крови.
Если у ребенка обнаруживается флюороз зубов, следует отменить употребление натрия фторида и провести несколько процедур отбеливания зубной эмали. Со временем пятна исчезнут, а поверхность зубов приобретёт естественный цвет и блеск.
Что обязательно нужно учитывать при лечении соединением фтора
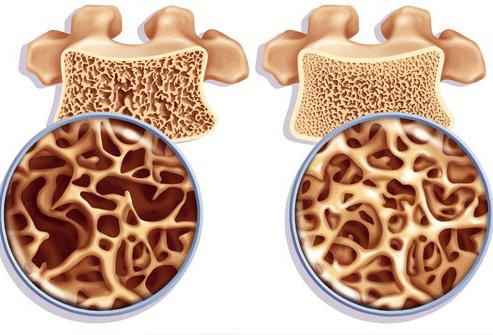
При лечении кариеса важно знать, сколько фтора содержится в питьевой воде из крана. Норма колеблется от 0,8 до 1,2 мг/л. В случае приема в высоких дозах
таблетированных форм фтора и потребления фторированной воды может быстро развиться флюороз или появятся боли в суставах, что чаще встречается у лиц пожилого возраста. К тому же нужно каждый год проводить рентгенологическое исследование для профилактики этого осложнения.
Для большей эффективности лечения остеопороза рекомендуют сочетать фторид натрия с соединениями кальция и магния. Богатыми кальцием являются молочные продукты, орехи, рыба, некоторые зелёные овощи. Достаточно магния содержится в тёмном шоколаде, фасоли, злаках и рисовых отрубях. Продукты нужно потреблять через некоторое время после приёма таблеток.
Пациенты с нарушениями кроветворения должны каждый месяц сдавать анализ крови
для динамического наблюдения за течением основного заболевания.
Взаимодействие
Инструкция указывает, что соли кальция связывают фторсодержащие соединения в желудочно-кишечном тракте. Кроме этого, препараты, в основе которых лежат алюминий или магний, имеют аналогичный эффект. Лекарства, которые обладают обволакивающими свойствами, также препятствуют усвоению фтора, поэтому их надо принимать отдельно. Усиливать действие натрия фторида могут витамины А и D.
Лечение натрия фторидом эффективно при борьбе с кариесом и остеопорозом, однако всегда необходимо соблюдать рекомендации врача и периодически сдавать анализ крови для предупреждения возможных побочных действий.
Фторид натрия — неорганическое бинарное соединение с химической формулой NaF. Белое кристаллическое вещество.
Содержание
Физические свойства
Фторид натрия — бесцветные кристаллы с кубической решеткой (a = 0,46344 нм, пространственная группа Fm3m, Z=4). Растворим в воде, безводном HF. Кристаллогидратов не образует.
Получение
В природе существует в виде относительно редкого минерала виллиомита: карминово-красные, темно-вишневые, изредка бесцветные кристаллы, содержит NaF с незначительными примесями, месторождения в Северной Америке, Африке, Кольский полуостров.
Так же NaF встречается в магматических породах, входит в состав в нефелинового сиенита.
В промышленности фторид натрия получают щелочным гидролизом гексафторсиликатов:

при избытке щелочи

Мировое производство фторида натрия оценивается в ~10 тыс. т.
Непосредственным взаимодействием щелочи и кислоты:

Чисто теоретический интерес представляет реакция получения фторида натрия из элементов:

реакция протекает очень бурно.
Плавиковая кислота разрушает соли более слабых кислот:

Также гидроксид натрия может разрушать соли летучих оснований:

Разложение дифторгидрат натрия при температуре ~350 °C:

Нагрев до температуры 1100 °C гептафторниобий калия и натрий получим чистый ниобий, фторид калия и фторид натрия:
![~\mathsf<K_2[NbF_7]+5Na \xrightarrow<1100^oC></p>
<p> Nb+2KF+5NaF>](https://dic.academic.ru/dic.nsf/ruwiki/4985cbc9de143206ce28a6440b5a8a83.jpg)
Химические свойства
В растворах фторид натрия подвергается гидролизу по аниону:
[Na(H_2O)_4]^++F^->" width="" height="" />
" width="" height="" />
Степень гидролиза невелика, так как константа последней реакции pK = 10,8.
Присоединяет HF с образованием дифторгидрата натрия:

При избытке HF образуются высшие гидрофториды натрия:
![~\mathsf<NaF+nHF \xrightarrow<></p>
<p> Na[F(HF)_n]\downarrow>](https://dic.academic.ru/dic.nsf/ruwiki/cf806262041fc89e388aa3e67e634fd5.jpg)
известны соединения для n = 1÷4.
Сильные нелетучие кислоты разрушают фторид натрия:

Насыщенная гидроокись лития благодаря плохой растворимости фторида лития разрушает фторид натрия:

Образовывает гексафторсиликаты и гексафторалюминаты:
Na_2[SiF_6]\downarrow + 2HF>" width="" height="" />
Na_3[AlF_6]\downarrow>" width="" height="" />
Расплав фторида натрия является электролитом, следовательно его можно разложить электролизом на элементы:

Использование


Фторид натрия и образующийся из него фторапатит используются для укрепления зубной эмали, которая и сама содержит фторапатит [1] [2] . Кроме добавления фтора в зубные пасты, производится фторирование питьевой воды. Зубная паста часто содержит фторид натрия, который необходим для предотвращения кариеса [3] . Кроме того, фторид натрия используется как моющее средство. Используется в различных отраслях химической промышленности — при синтезе и в металлургии. Фторид натрия является реагентом при синтезе фреонов.
Натрия фторид используется для сохранения образцов тканей в биохимии и лекарственных тестирований; ионы фтора останавливают гликолиз. Натрия фторид часто используется вместе с иодуксусной кислотой, которая ингибирует создание фермента альдолазы.
Натрия фторид используют как компонент составов для очистки и алитирования металлов, флюсов для сварки, пайки и переплавки металлов, стекол, эмалей, керамики, огнеупоров, как компонент кислотоупорного цемента, термостойких смазок, составов для травления стекол, твердых электролитов, как консервант древесины, инсектицид, сорбент для поглощения UF6 из газовых потоков, реагент при получении фторуглеводородов, как компонент специальных сортов бумаги, как ингибитор брожения, компонент огнезащитных составов и средств пожаротушения.
Опасность применения
Натрия фторид классифицируется как токсичное вещество при ингаляции (например, через пыль) или при приеме пищи. Как было показано, при достаточно высоких дозах влияет на сердечно-сосудистую систему; смертельная доза для человека при весе 70 кг оценивается в 5—10 г. В больших дозах, когда нужно использовать фторид натрия для лечения остеопороза, может вызвать боль в ногах и перепады в артериальном давлении, когда дозы слишком высоки, то происходит раздражение желудка, иногда такое сильное, что это может вызвать язву. В малых дозах используется для фторирования воды. При большой концентрации фтора (или при частом употреблении продуктов, жидкостей и тому подобных продуктов, содержащих фтор) может вызвать флюороз зубов, который может привести к потере зубов.
Читайте также:

