Подготовьте сообщение о положительном и отрицательном значении галогенов и их соединений в жизни
Обновлено: 28.06.2024
Сферы практического применения, преимущества и недостатки соединений фтора. Полезные и вредные свойства хлора. Отрасли использования брома и его химических соединений. Характер действия йода. Медицинское значение и оценка токсичности элемента астат.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 23.11.2014 |
| Размер файла | 17,2 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Галогены: вред или польза?
1. Фтор
Польза:
Соединения фтора применяются в ракетной технике как окислитель ракетного топлива.
Соединения фтора широко применяются в медицине как кровезаменители.
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита - Ca5F(PO4) 3, поэтому его добавляют в зубные пасты
Фторид натрия - очень опасен. Может привести к смертельному исходу, если его вдохнуть или проглотить. Первые симптомы отравления - тошнота, рвота, понос и слабость. Позднее - поражение центральной нервной и сердечно-сосудистой системы, смерть.
Поражает дыхательную систему, сердце, кости, кровеносную систему, центральную нервную систему и почки. Вызывает раздражение кожи, глаз и дыхательных путей. Раздражение может наступить не сразу.
При вдыхании, вызывает сильнейшее раздражение дыхательных путей. Симптомы - кашель, боли в горле, затруднённое дыхание. Раздражение может наступить не сразу.
При приёме вовнутрь, токсичен! Может вызвать слюнотечение, тошноту, рвоту, понос и боли в желудке. Слабость, дрожь, затруднённое дыхание, сердечный приступ, конвульсии и кому. Может поразить мозг и почки, сердечно-сосудистую систему. Смерть может наступить, в результате паралича дыхательных путей. Примерная смертельная доза - 5-10 граммов.
При контакте с кожей, вызывает раздражение, покраснение, боль. Растворы - разъедающие. Последствия могут появиться не сразу.
При контакте с глазами - раздражение и серьёзное повреждение глаз. Последствия могут появиться не сразу.
Постоянное воздействие фторида натрия может вызвать крапчатость зубов, повредить кости (остеосклероз) и флюорозис. Симптомами последнего являются хрупкие кости, потеря веса, анемия, отвердение (известкование) связок, ухудшение общего состояния, негибкость суставов.
Особенно подвержены влиянию фторида натрия люди, страдающие диабетом и почечной недостаточностью.
2. Хлор
Польза:
В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы.
Производство хлорорганических инсектицидов - веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов - гексахлорциклогексан. Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет - в 30-х годах ХХ столетия.
Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.
В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
Хлор - чрезвычайно ядовитый газ. Относится ко второму классу опасности. Он опасен в очень малой концентрации: всего 0,0001% содержания этого газа в воздухе грозит раздражением слизистых оболочек. Первые же признаки интоксикации - сухой кашель, учащённое дыхание, повышенная температура тела, ухудшение зрения, боль в груди, повышение содержания лейкоцитов в крови. Хроническое отравление организма хлором приводит к ухудшению аппетита, заболеваниям бронхов, токсическому отёку лёгких, депрессиям, судорогам. За ними следуют катары верхних дыхательных путей, пневмосклероз и рецидивирующий бронхит.
Большие концентрации хлора в воздухе (0,1%) вызывают острые симптомы отравления: в первую очередь, сильный кашель. Сильное отравление хлором может привести к очень быстрой остановке дыхания.
Хлор - один из главных канцерогенов, вызывающих раковые опухоли и туберкулёз лёгких.
При вдыхании паров хлора человек получает сильный ожог лёгочной ткани, чувствует удушье. Хлор одним из первых начал применяться Германией для химических атак во времена Первой мировой войны.
3. Бром
Бром применяют при получении ряда неорганических и органических веществ, в аналитической химии.
Соединения брома используют в качестве топливных добавок, пестицидов, ингибиторов горения, а также в фотографии.
Успокаивающее действие бромистых препаратов основано на их способности усиливать процессы торможения в центральной нервной системе.
Бром широко используется для производства антипиренов - веществ, защищающих материалы органического происхождения от воспламенения. Эти вещества используют для производства негорючих красок, пропитки изделий из древесины, тканей и пластмасс. Бромхлорметан используется как наполнитель огнетушителей. Элементный бром применяется в процессах водоочистки и водоподготовки.
Уже при содержании брома в воздухе в концентрации около 0,001% (по объёму) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях - спазмы дыхательных путей, удушье. ПДК паров брома 0,5 мг/мі. При попадании в организм токсическая доза составляет 3 г, летальная - от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
4. Йод
Элементарный йод оказывает противомикробное и противогрибковое (фунгицидное) действие, его растворы широко применяют для обработки ран, подготовки операционного поля и т.п. Они обладают противовоспалительными и отвлекающими свойствами, при нанесении на кожу и слизистые оболочки оказывают раздражающее действие и могут вызвать рефлекторные изменения в деятельности организма.
Препараты йода блокируют накопление радиоактивного йода в щитовидной железе и способствуют его выведению из организма, тем самым снижают лучевую дозу и ослабляют радиационное воздействие.
При приеме внутрь препараты йода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы.
Установлено также, что йод влияет на обмен жиров и белков. При применении йодных препаратов наблюдается снижение уровня холестерина в крови и уменьшение ее свертываемости.
Рефлекторным повышением выделения слизи железами дыхательных путей и протеолитическим действием (расщеплением белков) объясняется применение препаратов йода в качестве отхаркивающих и муколитических (разжижающих мокроту) средств.
Для диагностических целей используют рентгенконтрастные вещества, содержащие йод.
Переизбыток йода в организме приводит к заболеваниям и отравлениям.
Наиболее опасен дефицит йода во время беременности. Если беременной женщине не хватает йода, то ей это, возможно, и не навредит, а вот для ребенка это очень опасно. Чем? Угрозой выкидыша и серьезной патологией нервной системы - заболеванием кретинизм (выраженная умственная недостаточность). Врачи утверждают, что средний уровень интеллекта напрямую связан с уровнем дефицита йода.
5. Астат
астат хлор галоген фтор
Весьма перспективным является At для лечения заболеваний щитовидной железы. Имеются сведения, что радиобиологическое действие б-частиц астата на щитовидную железу в 2,8 раза сильнее в-частиц иода. При этом следует учесть, что с помощью иона роданида можно надёжно вывести астат из организма.
Будучи схожим по химическим свойствам с йодом, астат токсичен. При попадании в организм концентрируется в печени. Как и йод, астат способен накапливаться в щитовидной железе. б-излучение астата поражает близлежащие ткани, приводит к нарушению их функции и в перспективе - к образованию опухолей. Кроме того, частичное накопление астата наблюдается в молочных железах.
Подобные документы
Понятие и практическое значение галогенов, их физические и химические свойства, отличительные признаки. Характеристика и способы получения галогенов: йода, брома, хлора, фтора, астат. Реакции, характерные для данных галогенов, сферы их использования.
презентация [988,7 K], добавлен 11.03.2011
Фтор в химических реакциях, его окислительные свойства. Предельно допустимая концентрация связанного фтора в воздухе промышленных помещениях. Общая характеристика хлора, медико-биологическая роль его соединений. Основная биологическая функция йода.
реферат [153,7 K], добавлен 18.09.2014
История открытия галогенов – типичных неметаллов, их соединения в природе. Строение и свойства атомов фтора, хлора, брома, йода и астата. Особенности их взаимодействия с металлами, водородом и растворами солей. Физические свойства и строение галогенов.
презентация [599,8 K], добавлен 10.01.2012
История открытия и место в периодической системе химических элементов Д.И. Менделеева галогенов: фтора, хлора, брома, йода и астата. Химические и физические свойства элементов, их применение. Распространённость элементов и получение простых веществ.
презентация [656,9 K], добавлен 13.03.2014
Физические и химические свойства йода. Важнейшие соединения йода, их свойства и применение. Физиологическое значение йода и его солей. Заболевания, связанные с его нехваткой. Применение йода в качестве антисептика, антимикробные свойства его соединений.
реферат [26,7 K], добавлен 26.10.2009
Галогены - химические элементы, относящиеся к главной подгруппе VII группы периодической системы Менделеева. К галогенам относят фтор, хлор, бром, иод и астат. Все галогены - энергичные окислители, поэтому встречаются в природе только в виде соединений.
реферат [238,8 K], добавлен 20.03.2009
Фторирование как процесс введения атома фтора в молекулу химических соединений. Процессы фторирования органических соединений в промышленности. Фторирование молекулярным фтором и высшими фторидами металлов. Номенклатура фреонов, области их применения.
Вы можете изучить и скачать доклад-презентацию на тему Влияние галогенов на организм человека. Презентация на заданную тему содержит 20 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!


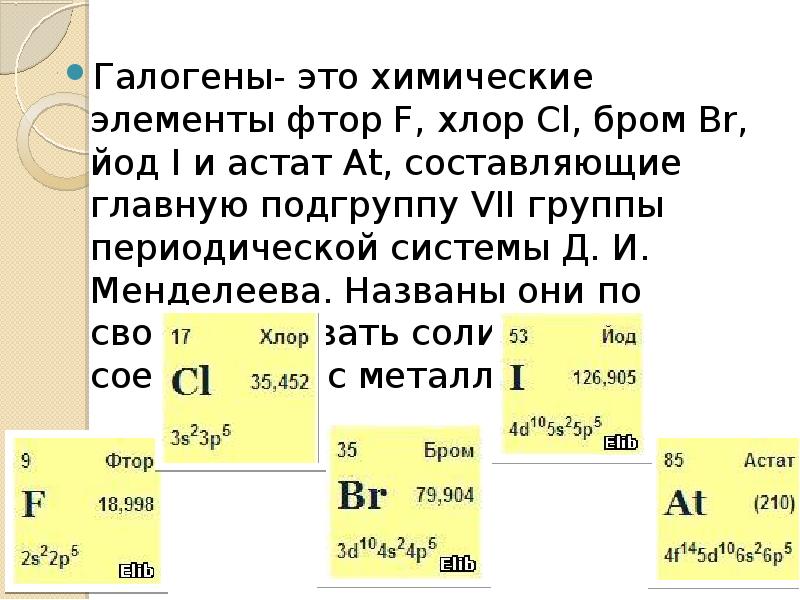

















Галогены- это химические элементы фтор F, хлор Cl, бром Br, йод I и астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы они по свойству давать соли при соединении с металлами. Галогены- это химические элементы фтор F, хлор Cl, бром Br, йод I и астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы они по свойству давать соли при соединении с металлами.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Статья для 9 класса - "Роль галогенов в жизни человека"
Удивительна диалектика элементов VII группы периодической таблицы. Фтор, хлор, бром, йод, астат одновременно являются токсичными и такими нужными человеку веществами. Общее название этой группы - галогены, - что означает в переводе с греческого “рождающие соли”. Именно так предложил назвать эту группу шведский химик Йенс Берцелиус в начале XIX века, обратив внимание на их особенность создавать вещества наподобие морской соли, вступая в реакции со щелочными металлами. За два века развития химии ученые изучили эти элементы и помогли применять их реактивность в тех ситуациях, когда необходимо.
Галогены расположены в таблице Менделеева в порядке уменьшения реактивности. Так, фтор химики не могли получить в чистом виде вплоть до последней четверти XIX века. Этот элемент в нормальных условиях представляет из себя двухатомный газ бледно-желтого цвета. Получив в награду за свою невероятную ядовитость говорящее греческое имя “разрушение”, фтор использовался вполне созидательно в промышленности. Например, хладоны - бесцветные газы или жидкости без запаха - ключевые составляющие системы холодильных устройств. К сожалению, природу не обмануть, и многие хладоны оказались “под запретом” в индустрии, так как доказано их пагубное влияние на сохранение количество озона в стратосфере. Попадая под солнечные лучи, эти газы распадаются на компоненты, которые активно участвуют в распаде озона в галогенном цикле.
Однако, человеку не обойтись без фтора, так как большое его количество содержится в эмали зубов в составе фторапатита. При недостаточном или чрезмерном поступлении фтора в организм у человека могут развиваться кариес и другие зубные заболевания. Поэтому врачи рекомендуют использовать зубные пасты с добавлением фторидов в качестве профилактических мер.
По сравнению со фтором гораздо заметней ведет себя хлор, который при нормальных условиях представляет собой ядовитый зеленоватый газ с резких запахом. Еще в момент открытия химики отметили его белящие свойства. Дело в том, что при взаимодействии с водой хлор образует кислоту HClO, которая не стойкая и распадается на соляную кислоту и атомарный кислород, который и уничтожает краски. Это удивительное свойство пришло в жизнь каждого человека, который хотя бы раз занимался стиркой. Кроме этого, хлор прекрасно дезинфицирует воду, поэтому его начали применять для очищения водопроводов.
В организме содержание хлора особенно велико в межклеточных и соединительных тканях. Именно он отвечает за удержание в них воды. Поступая в организм вместе с солями, в первую очередь с хлоридом натрия, хлор поддерживает наш кислотно-щелочной баланс в норме.
Неправильным было бы представлять себе все галогены газами. Тот же йод в нормальных условиях кристаллизуется. Йод - очень редкий в природе элемент. Источниками его промышленного производства служат или нефтяные месторождения, или, в странах, где они отсутствуют, сырье из водорослей. Кстати, именно с помощью водорослей был открыт в XIX веке этот элемент французским химиком Куртуа. Кипятя серную кислоту с рассолом золы водорослей ученый заметил выделение пара фиолетового цвета. И сегодня йод прочно ассоциируется у нас с этим цветом. Например, всем нам с детства знаком пятипроцентный спиртовой раствор йода, который продезинфицировал столько наших царапин.
Основным потребителем йода в организме является щитовидная железа, отвечающая за гормональный баланс. Очень просто проследить закономерность: при недостатке йода мы чувствуем усталость и подавленность. Именно поэтому потребитель может встретить на прилавке магазина йодированную соль, которая поможет восстановить баланс. Тем не менее, йод - токсичен, а смертельная для человека доза - 3 грамма.
История изучения и развитие применения галогенов - это великолепный пример того, как фундаментальная химия решает прикладные задачи. Проблема сохранения здоровья настойчиво напоминает о себе. И каждый человек должен владеть необходимым минимумом информации о причинах и следствиях, попадая в те или иные жизненные ситуации и выстраивая свой стиль жизни.
Здоровый образ жизни включает в себя несколько составляющих. Исходя из ваших жизненных ситуаций, правильно расставьте приоритеты, сформируйте свою программу и не отступайте от нее. Берегите себя и близких. И будьте всегда здоровы.
Положительное значение галогенов. Отрицательное значение галогенов. Применение галогенов.
Чтобы ответить на эти вопросы, нужно написать небольшую книжечку. А кратко = без галогенов не было бы ни человека, ни животных, ни растений. Ведь дословно, в переводе с греческого, слово "галоген" означает "рождающий соль". Во всех важных для жизни солях - галогенидах металлов галогены находятся в виде отрицательно заряженных анионов. Типичные (и биологически очень важные) примеры - хлорид натрия (поваренная соль) и хлорид калия. Очень важен для человека и йод - в виде солей (иодидов). Этот элемент входит в состав жизненно важных гормонов, которые синтезируются в щитовидной железе. А вот в свободном виде все галогены очень ядовиты. А жидкий бром вызывает на коже ожоги и долго не заживающие язвы. пары брома сжигают при дыхании дыхательные пути. На фотографии - утечка брома на железнодорожных путях.

Для начала нужно вспомнить, что такое галогены и какие вещества к ним относятся. Это хлор, фтор, бром, йод и астат. Последнее вещество нашло меньше применения, а вот остальные очень часто используются человеком. Все они - очень сильные окислители.
Положительное значение галогенов в жизни человека:
Спиртовые растворы йода используют в медицине для обеззараживания ран.
Йод добавляют в соль (соединения йода), чтобы получать йодированную соль, есть также и йодированная вода, чтобы бороться с недостаткам йода у населения.
Хлор и его соединения используют на станциях водоподготовки для обеззараживания воды. Хлоркой моют полы в больницах для тех же целей. Соединения хлора используют в быту для отбеливания одежды и выведения пятен, а также в промышленности, чтобы отбеливать бумагу.
Фтор добавляют в зубные пасты, чтобы защищать зубы от кариеса.
Соляная кислота - это соединение хлора, она является частью желудочного сока.
Обычная поваренная соль - это хлорид натрия.
Соединения брома в медицине применяют как успокаивающие средства.
Бромид серебра ранее использовали для фотобумаги - до того времени, как фото стали печатать на принтере :) а когда фотографии проявляли.
На основе фтора создают заменители крови.
Отрицательное значение галогенов в жизни человека:
Галогены - очень токсичные и опасные соединения. Взрывы на заводах, которые используют газообразный хор - это химическая катастрофа.
Излишек фтора в организме вредит костям и зубам еще больше, чем его недостаток, вызывает флюороз. Это обычно происходит в тех регионах, где в питьевой воде много фтора из-за того, что вода проходит сквозь породы с его содержанием.
При неаккуратном обращении даже с медицинским йодом можно получить очень сильный ожог.
Йод бывает также радиоактивным.
Вот отличная схема, которая иллюстрирует применение хлора.

Морские ежи обитают в морях и океанах с умеренно соленой водой. Одни ежи населяют коралловый риф, а другие предпочитают песчаное дно.
Они играют важную роль в жизни морской экосистемы, т.к являются важным звеном пищей цепи. А также, очищают дно от органических останков.
Морские ежи питаются водорослями, моллюсками, мелкими морскими звёздами и даже другими морскими ежами.
Эти обитатели морских глубин являются пищей для омаров, морских звёзд, рыб, птиц, морских котиков, и каланов.
Для человека морские ежи играют не последнюю роль, например, в разных уголках Земли морских ежей используют в пищу.
Останки ежа, являются хорошим удобрением, т.к содержат большое количество кальция и фосфора.

Эти иглокожие играют важную роль для морской экосистемы. А также являются неотъемлемым звеном пищевой цепочки в целом.
Вместе с моллюсками морские звёзды участвуют в поддержании солевого состава морской воды, а также в её фильтрации. Участвуют в почвообразовании, но могут существенно вредить кораллам, а также способны впитывать из воды радиоактивные вещества, которые после накапливаются в их теле.
Морские звёзды в жизни человека также играют не последнюю роль.
Полезными для человека являются останки иглокожих, которые применяются в строительстве, например, образовавшийся бельгийский мрамор или трахитовый известняк.
В основном морские звёзды не пригодны в пищу и не опасны для человека, но есть лишь один вид звёзд, который лучше обходить стороной, называется он "терновый венец".
Меня всегда интересовал вопрос, чем же питаются морские звёзды. И начав изучать данный материал, я наткнулась на интересную информацию.
Оказывается у них нет мозга, но зато на каждом лучике есть глаз, что позволяет им удачно охотиться.
А ещё у них нет крови, и сердце прокачает через сосуды просто морскую воду.
Эти животные обитают практически во всех морях и океанах, где вода достаточно солёная.
Это морские хищники, у которых довольно богатый рацион. Но, как и чем питаются морские красавицы, напрямую зависит от особенностей их строения.
Основная пища звёзд - это моллюски, но она не прочь полакомиться гребешками, морским ежом, трепангой и даже маленькой рыбкой.
А вот врагов у звёзд не так уж много, потому что она отпугивает всех своими ядовитыми лучами. Чаще всего их едят чайки, морская выдра-калан, осминоги, большие ракообразные, рыбы - треска, зубатка.
Читайте также:

