Плавление в природе и технике сообщение
Обновлено: 28.06.2024
Фазовая диаграмма воды. Плавлению (и кристаллизации) соответствует ветвь левее и выше тройной точки, сублимации — ветвь левее и ниже тройной точки.
— это процесс перехода тела из кристаллического твёрдого состояния в жидкое, то есть переход вещества из одного агрегатного состояния в другое. Плавление происходит с поглощением
теплоты плавления
и является фазовым переходом первого рода, которое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления.
Способность плавиться относится к физическим свойствам вещества[1]
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), среди простых веществ — углерод (по разным данным 3500 — 4500 °C[2]) а среди произвольных веществ — карбид тантала-гафния Ta4HfC5 (3942 °C). Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путём сублимации сразу переходят в газообразное состояние.
Плавление смесей и твёрдых растворов
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
Определение процесса плавления
Что такое плавление в физике? Определение этому явлению можно дать следующее: под плавлением понимают переход из твердого состояния вещества в жидкое в результате увеличения его температуры. То есть если постоянно нагревать твердое тело, то молекулы или атомы, которые его составляют, начинают увеличивать свою кинетическую энергию. И это происходит до тех пор, пока эта энергия не сравняется с энергией связи, после чего частота прыжков атомов (молекул) значительно возрастает, и твердый материал начинает плавиться.
Яркими примерами плавления являются процессы таяния льда или переход в расплавленное состояние какого-либо металла или сплава.
Кинетика плавления
Технически плавление вещества осуществляется с помощью подвода тепловой энергии снаружи образца (внешний нагрев, например, в термической печи) или непосредственно во всём его объёме (внутренний нагрев, например, резистивный нагрев при пропускании тока через образец, или индукционный нагрев в высокочастотном электро-магнитном поле). Способ плавления не влияет на основные характеристики процесса — температуру и скрытую теплоту плавления, но определяет внешнюю картину плавления, например, появление квази-жидкого слоя на поверхности образца при внешнем нагреве.
Природа плавления
Поясним вначале, почему при некоторой температуре тело предпочитает разорвать часть межатомных связей и из упорядоченного состояния (кристалл) перейти в неупорядоченное (жидкость).
Как известно из термодинамики, при фиксированной температуре тело стремится минимизировать свободную энергию F = E − T S . При низких температурах второе слагаемое (произведение температуры и энтропии) несущественно, и в результате всё сводится к минимизации обычной энергии E . Состояние с минимальной энергией — это кристаллическое твёрдое тело. При повышении температуры, второе слагаемое становится всё важнее, и при некоторой температуре оказывается выгоднее разорвать некоторые связи. При этом обычная энергия E слегка повысится, но при этом сильно возрастет и энтропия, что в результате приведёт к понижению свободной энергии.
Динамика плавления
Тепловые колебания атомов в решетке кристалла: точки — атомы, соединяющие линейные отрезки — межатомные связи Поведение атомов жидкости после перехода кристалла через точку плавления, как в среднем постоянные для заданной температуры разрывы и восстановления межкластерных и внутрикластерных межатомных связей (короткие утолщенные отрезки — разорванные связи)[3]
Изначально, в умозрительном, т.е. не количественном, представлении считалось, что в динамике плавление происходит следующим образом. При повышении температуры тела увеличивается амплитуда тепловых колебаний его молекул, и время от времени возникают структурные дефекты решётки в виде перескоков атомов, роста дислокаций и других нарушений кристаллической решетки[4]. Каждый такой дефект, возникновение и перемещение дислокаций требуют определённого количества энергии, поскольку сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Кроме того, на этой стадии, как правило, при внешнем нагреве возникает квази-жидкий слой на поверхности тела. Считается, что при некоторой температуре концентрация дефектов становится столь большой, что приводит к потере ориентационного порядка в образце, т.е. плавлению.
Плавление в двумерных системах
В двумерных или квази-двумерных системах кристалл является гораздо более шатким объектом, чем в трёхмерном случае, а именно у двумерного кристалла нет дальнего позиционного порядка. Для сравнения, в одномерном случае кристалл при конечной температуре вообще не может быть стабильным.
Как выяснилось, это приводит к тому, что плавление двумерного кристалла происходит в два этапа. Вначале кристалл переходит в так называемую гексатическую фазу, в которой теряется ближний позиционный порядок, но сохраняется ориентационный, а затем происходит потеря и ориентационного порядка и тело становится жидким.
| Межотраслевая Интернет-система поиска и синтеза физических принципов действия преобразователей энергии |
| Стартовая страница | О системе | Технические требования | Синтез | Обучающий модуль | Справка по системе | Контакты |
Общий каталог эффектов
Переход вещества из кристаллического состояния в жидкое
Описание
, переход вещества из кристаллического (твердого) состояния в жидкое, происходит с поглощение теплоты (фазовый переход
I
рода). Главными характеристиками плавления чистых веществ является
температура плавления
(
Тпл
) и
теплота плавления
(
Lпл
).
Температура плавления
зависит от внешнего давления
р
; на диаграмме состояния чистого вещества эта зависимость изображается кривой плавления (кривой сосуществования твердой и жидкой фаз,
AС
или
AС′
на рис.1).
Плавление
сплавов и твёрдых растворов происходит, как правило, в интервале температур (исключение составляют эвтектики с постоянной
Тпл
). Зависимость температуры начала и окончания
плавления
сплава от его состава при данном давлении изображается на диаграммах состояния специальными линиями (кривые
ликвидуса
и
солидуса
. У ряда высокомолекулярных соединений (например, у веществ, способных образовывать
жидкие кристаллы
) переход из твёрдого кристаллического состояния в изотропное жидкое происходит постадийно (в некотором температурном интервале), каждая стадия характеризует определённый этап разрушения кристаллической структуры.
Диаграмма состояния чистого вещества. Линии AС
и
AС′
– кривые плавления, по линии
AС′
плавятся вещества с аномальным изменением объема при плавлении. Точка
А
– тройная точка;
В
– критическая точка

Наличие определённой температуры плавления
Остановка температуры при плавлении кристаллического тела. По оси абсцисс отложено время t
, пропорциональное равномерно подводимому к телу количеству теплоты.

Характер зависимости Тпл
от давления
р
определяется направлением объёмных изменений (
ΔVпл
) при
плавлении
. В большинстве случаев
плавление
вещества сопровождается увеличением их объёма (обычно на несколько
%
). Если это имеет место, то возрастание давления приводит к повышению
Тпл
(рис.3). Однако у некоторых веществ (
воды, ряда металлов и металлидов
, см. рис.1) при плавлении происходит уменьшение объёма.
Температура плавления
этих веществ при увеличении давления снижается.
Изменение температуры плавления Тпл (°С)
щелочных металлов с увеличением давления
p (кбар)
. Кривая плавления
Cs
указывает на существование у него при высоких давлениях двух полиморфных превращений (
а
и
в
).
сопровождается изменением физических свойств вещества: увеличением
энтропии
, что отражает разупорядочение кристаллической структуры вещества; ростом
теплоёмкости
,
электрического сопротивления
[исключение составляют некоторые полуметаллы (
Bi, Sb
) и полупроводники (
Ge
), в жидком состоянии обладающие более высокой электропроводностью]. Практически до нуля падает при
плавлении
сопротивление сдвигу (в расплаве не могут распространяться поперечные упругие волны), уменьшается скорость распространения
звука
(продольных волн) и т.д.
Согласно молекулярно-кинетическим представлениям, плавление
осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки –
вакансий
; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др). В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию
предплавления
. С достижением
Тпл
в кристалле создаётся критическая концентрация дефектов, начинается
плавление
– кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение
дальнего порядка
в кристаллах. В самих же субмикроскопических областях
ближний порядок
в расположении атомов при плавлении существенно не меняется (
координационное число
расплава при
Тпл
в большинстве случаев остаётся тем же, что и у кристалла). Этим объясняются меньшие значения теплот плавления
Qпл
по сравнению с теплотами
парообразования
и сравнительно небольшое изменение ряда физических свойств веществ при их
плавлении
.
занимает особое положение в общей системе фазовых переходов как универсальное физическое явление, которое может быть обнаружено практически у всех веществ. В этом отношении
плавление
можно сравнить только с
кипением
, которое столь же универсально. Более существенна еще одна особенность
плавления
, на этот раз не имеющая аналогов, заключающаяся в том, что
плавление
представляет собой результат конкуренции между двумя конденсированными и вместе с тем принципиально различными состояниями вещества: жидкостью и твердым телом. Совершенно естественно, что это явление не могло не привлечь внимания. В результате кропотливой работы многих исследователей сейчас накоплено большое количество экспериментальных фактов и эмпирических обобщений, касающихся
плавления
и
кристаллизации
. Тем не менее все обилие экспериментального материала пока еще мало способствовало созданию сколько-нибудь приемлемой теории
плавления
, которая могла бы объединить уже известные факты и предсказать какие-либо новые стороны явления. Если не рассматривать известных трудностей строгого статистического подхода к проблеме
фазового перехода
вообще, то подобная ситуация связана прежде всего с отсутствием достаточно пригодных моделей жидкого состояния, качественно верно отражающих реальность.
- Дальний порядок
- Кривая солидуса
- Температура плавления
- Теплота плавления
- Кривая ликвидуса
- Плавление
- Теплоемкость
- Предплавление
- Кристаллическое состояние вещества
- Аморфное состояние вещества
- Ближний порядок
- Фазовый переход первого рода
- Переохлаждение
- Перегрев
- Фазовые переходы
- Жидкости
- Твердые тела
- Термодинамика
Процесс плавления
играет важную роль в природе (плавление снега и льда на поверхности Земли, плавление минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Працесс плавления
играют важную роль прежде всего в процессах
сварки
и
пайки
.
Сварка плавлением
осуществляется нагревом свариваемых кромок до температуры плавления без сдавливания свариваемых деталей.
При нагреве с повышением температуры снижается твёрдость металла и возрастает его пластичность. Металл, твёрдый и малопластичный при комнатной температуре, при достаточном нагреве может стать очень мягким и пластичным. Дальнейшим повышением температуры можно довести металл до расплавления; в этом случае отпадают все затруднения, связанные с твёрдостью металла; объёмы жидкого металла самопроизвольно сливаются в общую сварочную ванну.
Во многих случаях на процесс сварки существенно влияют загрязнения поверхности металла: преимущественно окислы и жировые плёнки. Эти загрязнения, попадая в сварное соединение, могут снижать качество сварки. Они, в отличие от адсорбированных газов, могут быть удалены с поверхности металла механически (щётками, абразивами и т.д.) или химически (растворителями, травителями, и флюсами).
У сплавов, как правило, нет определённой температуры плавления
Селективное лазерное плавление
металлического порошка (SLM) подходит для изготовления комплексных инструментов и элементов конструкции (деталей, узлов), причем в сравнении с обычными методами изготовления преимущество по издержкам и времени в настоящее время может достигать
30%
. Точность от
0,01 мм
, как при обычном изготовлении форм ручным или CNC/EDM методами.
Примером фазового перехода первого рода являются плавление и кристаллизация твердых тел. Процесс плавления играет важную роль в природе (плавление снега и льда на поверхности Земли, плавление минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Плавление — это процесс перехода тела из кристаллического твёрдого состояния в жидкое.
Главными характеристиками плавления чистых веществ являются температура плавления (Тпл) и теплота (теплота плавления Qпл), которая необходима для осуществления процесса плавления.
В процессе плавления температура кристалла остается постоянной. Эта температура и называется температурой плавления Тпл.. У каждого вещества своя температура плавления. Температура плавления для данного вещества зависит от атмосферного давления. Самую высокую температуру плавления среди чистых металлов имеет вольфрам (3410 °С), самую низкую –
ртуть (–38,9 °С).
Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. более высокая температура.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии. Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении. При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании - увеличивается. К ним относятся, например, вода и чугун, кремний и некоторые другие. Именно поэтому лёд плавает на поверхности воды, а твердый чугун - в собственном расплаве.
Плавление происходит с поглощением скрытой теплоты фазового перехода – теплоты плавления Qпл..
Удельная теплота плавления qпл. показывает, какое количество теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления: qпл. = Qпл./m, Дж/кг.
Плавление сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления. Практически до нуля падает при плавлении сопротивление сдвигу, уменьшается скорость распространения звука (продольных волн) и т.д.
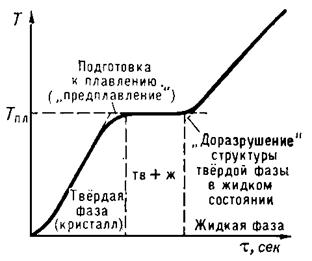
Рис. 1. Остановка температуры при плавлении кристаллического тела.
По оси абсцисс отложено время τ, пропорциональное равномерно подводимому к телу количеству теплоты.
Согласно молекулярно-кинетическим представлениям, плавление осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др. В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается плавление— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах. В самих же субмикроскопических областях ближний порядок в расположении атомов при плавлении существенно не меняется. Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их плавлении. По мере возрастания температуры молекулы движутся все интенсивнее. При нагревании возрастает не только молекулярно-кинетическая энергия тела, но и потенциальная энергия взаимодействия его атомов, поскольку при увеличении амплитуды колебаний атомы отходят друг от друга на большее расстояние и сближаются на меньшее расстояние, благодаря чему энергия взаимодействия их электрических зарядов возрастает. С повышением температуры наступает, наконец, такой момент, когда поддержание порядка среди сильно раскачивающихся атомов становится невозможным, и с этого момента начинается разрушение кристаллической решетки, в результате чего исчезает и дальний порядок. Твердое тело плавится.

У аморфных тел изменение температуры со временем не имеет участка с постоянной температурой, а только точку перегиба. Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости.
Обратный переход вещества в твердое состояние возможен как из жидкого, так и из газообразного состояния. И в том и в другом случае такой переход осуществляется из состояния, лишенного симметрии, в состояние, в котором симметрия существует (это относится к дальнему порядку, который имеет место в кристаллах и которого нет ни в жидкостях, ни в газах). Поэтому переход в твердое состояние должен происходить скачком при определенной температуре, в отличие от перехода жидкость–пар, который может происходить непрерывно. Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация) и происходит он при определенной температуре – температуре кристаллизации. Так как при таком превращении энергия системы уменьшается, то такой переход должен сопровождаться выделением энергии в виде теплоты кристаллизации. Из закона сохранения энергии следует, что теплота плавления и теплота кристаллизации должны быть равны друг другу.
Примером фазового перехода первого рода являются плавление и кристаллизация твердых тел. Процесс плавления играет важную роль в природе (плавление снега и льда на поверхности Земли, плавление минералов в её недрах и т.д.) и в технике (производство металлов и сплавов, литьё в формы и др.).
Плавление — это процесс перехода тела из кристаллического твёрдого состояния в жидкое.
Главными характеристиками плавления чистых веществ являются температура плавления (Тпл) и теплота (теплота плавления Qпл), которая необходима для осуществления процесса плавления.
В процессе плавления температура кристалла остается постоянной. Эта температура и называется температурой плавления Тпл.. У каждого вещества своя температура плавления. Температура плавления для данного вещества зависит от атмосферного давления. Самую высокую температуру плавления среди чистых металлов имеет вольфрам (3410 °С), самую низкую –
ртуть (–38,9 °С).
Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. более высокая температура.
Расплавленное вещество обладает большим запасом внутренней энергии, чем в твердом состоянии. Оставшаяся часть теплоты плавления расходуется на совершение работы по изменению объема тела при его плавлении. При плавлении объем большинства кристаллических тел увеличивается (на 3-6%), а при отвердевании уменьшается. Но, существуют вещества, у которых при плавлении объем уменьшается, а при отвердевании - увеличивается. К ним относятся, например, вода и чугун, кремний и некоторые другие. Именно поэтому лёд плавает на поверхности воды, а твердый чугун - в собственном расплаве.
Плавление происходит с поглощением скрытой теплоты фазового перехода – теплоты плавления Qпл..
Удельная теплота плавления qпл. показывает, какое количество теплоты необходимо для полного превращения 1 кг вещества из твердого состояния в жидкое, взятого при температуре плавления: qпл. = Qпл./m, Дж/кг.
Плавление сопровождается изменением физических свойств вещества: увеличением энтропии, что отражает разупорядочение кристаллической структуры вещества; ростом теплоёмкости, электрического сопротивления. Практически до нуля падает при плавлении сопротивление сдвигу, уменьшается скорость распространения звука (продольных волн) и т.д.

Рис. 1. Остановка температуры при плавлении кристаллического тела.
По оси абсцисс отложено время τ, пропорциональное равномерно подводимому к телу количеству теплоты.
Согласно молекулярно-кинетическим представлениям, плавление осуществляется следующим образом. При подведении к кристаллическому телу теплоты увеличивается энергия колебаний (амплитуда колебаний) его атомов, что приводит к повышению температуры тела и способствует образованию в кристалле различного рода дефектов (незаполненных узлов кристаллической решётки — вакансий; нарушений периодичности решётки атомами, внедрившимися между её узлами, и др. В молекулярных кристаллах может происходить частичное разупорядочение взаимной ориентации осей молекул, если молекулы не обладают сферической формой. Постепенный рост числа дефектов и их объединение характеризуют стадию предплавления. С достижением Тпл в кристалле создаётся критическая концентрация дефектов, начинается плавление— кристаллическая решётка распадается на легкоподвижные субмикроскопические области. Подводимая при плавлении теплота идёт не на нагрев тела, а на разрыв межатомных связей и разрушение дальнего порядка в кристаллах. В самих же субмикроскопических областях ближний порядок в расположении атомов при плавлении существенно не меняется. Этим объясняются меньшие значения теплот плавления Qпл по сравнению с теплотами парообразования и сравнительно небольшое изменение ряда физических свойств веществ при их плавлении. По мере возрастания температуры молекулы движутся все интенсивнее. При нагревании возрастает не только молекулярно-кинетическая энергия тела, но и потенциальная энергия взаимодействия его атомов, поскольку при увеличении амплитуды колебаний атомы отходят друг от друга на большее расстояние и сближаются на меньшее расстояние, благодаря чему энергия взаимодействия их электрических зарядов возрастает. С повышением температуры наступает, наконец, такой момент, когда поддержание порядка среди сильно раскачивающихся атомов становится невозможным, и с этого момента начинается разрушение кристаллической решетки, в результате чего исчезает и дальний порядок. Твердое тело плавится.
У аморфных тел изменение температуры со временем не имеет участка с постоянной температурой, а только точку перегиба. Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости.
Обратный переход вещества в твердое состояние возможен как из жидкого, так и из газообразного состояния. И в том и в другом случае такой переход осуществляется из состояния, лишенного симметрии, в состояние, в котором симметрия существует (это относится к дальнему порядку, который имеет место в кристаллах и которого нет ни в жидкостях, ни в газах). Поэтому переход в твердое состояние должен происходить скачком при определенной температуре, в отличие от перехода жидкость–пар, который может происходить непрерывно. Процесс образования твердого тела при охлаждении жидкости есть процесс образования кристалла (кристаллизация) и происходит он при определенной температуре – температуре кристаллизации. Так как при таком превращении энергия системы уменьшается, то такой переход должен сопровождаться выделением энергии в виде теплоты кристаллизации. Из закона сохранения энергии следует, что теплота плавления и теплота кристаллизации должны быть равны друг другу.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:


Определение плавления Плавление - переход вещества из твердого состояния в жидкое.

Температура плавления - - температура, при которой вещество плавится; зависит от вещества (в том числе и от добавления примесей); - зависит от давления. Эксперимент: исследование зависимости температуры твердого тела от времени нагревания В процессе плавления температура не изменяется.


Зависимость температуры плавления от примесей Примеры веществПрименение Железо и кремний: у чистых веществ температуры плавления высоки, а смесь окислов этих элементов с известью плавится при гораздо более низких температурах. Выплавка железа из руд, содержащих кремнезем: в рудную смесь добавляют известняк; кремнезем, известь и небольшая доля железа образуют легкоплавкий шпак, который всплывает и отделяется от более тугоплавкого чистого железа. Лед: при добавлении соли температура таяния льда сильно понижается; смесь одной части соли и трех частей воды тает при -23 º С; при смешивании с хлористым кальцием можно добиться температуры таяния -55 º С.1. Обработка дорожного полотна зимой. 2. Приготовление охлаждающих смесей (в мороженице температура тающего льда резко понижается)

У всех ли веществ есть определенная температура плавления? Твердые тела Аморфные Кристаллические Нет постоянной температуры плавления Есть определенная температура плавления

Удельная теплота плавления - Эксперимент – Определение удельной теплоты плавления льда физическая величина, показывающая, какое количество теплоты необходимо сообщить 1 кг кристаллического вещества, чтобы превратить его в жидкость при температуре плавления.

Расчет количества теплоты, необходимого для плавления Q=λm, где: Q - количество теплоты (Дж) λ - удельная теплота плавления (Дж/кг) m - масса тела (кг)

Расчет количества теплоты, необходимого для плавления Q1 = m · с ·(t2 – t1) - количество теплоты, необходимое для нагревания вещества до температуры плавления t2, где: m - масса вещества с - удельная теплоёмкость вещества t1 - начальная температура вещества Q2 = m ·λ - количество теплоты, необходимое для плавления вещества при температуре плавления λ - удельная теплота плавления Q = Q1 + Q2 - общее количество теплоты, необходимое для плавления Q1 Q - ? Q2

Определение кристаллизации Кристаллизация – переход вещества из жидкого состояния в твердое. Плавление и отвердевание олова

Температура отвердевания - температура, при которой вещество отвердевает; - температура отвердевания равна температуре плавления. ВС – плавление FG – отвердевание ? ? У аморфных тел нет определенной температуры отвердевания.

Расчет количества теплоты, выделяющегося при отвердевании Q=-λm, где: Q - количество теплоты (Дж) λ - удельная теплота плавления (Дж/кг) m - масса тела (кг) |Q|=λm Домашнее задание: придумайте и решите задачу.

Плавление и отвердевание в природе Извержение вулкана — процесс выброса вулканом на земную поверхность раскалённых обломков, пепла, излияние магмы, которая, излившись на поверхность, становится лавой. Кусочек застывшей магмы. Образование сосулек Самая крупная градина, зафиксированная людьми, упала в Канзасе, США. Масса ее составила почти 700 грамм.

Плавление и отвердевание в быту Плавление свечи Кубики льда для охлаждения напитков Заморозка продуктов Изготовление мороженого

Плавление и отвердевание в технике

Подведем итоги Q=λm Плавление Кристаллизация (отвердевание)

1. В какой момент времени начался процесс плавления вещества? 4. Сколько длилось: а) нагревание твердого тела; б) плавление вещества; с) остывание жидкости? 2. В какой момент времени закончилась кристаллизация? 3. Чему равна температура плавления вещества? Температура кристаллизации? Ответьте на вопросы

5. На рисунке показан график зависимости температуры тела от количества теплоты, которое оно получило. Какое тело является аморфным, а какое – кристаллическим? Ответ обоснуйте.

6. На рисунке показаны графики зависимости температуры тела от времени исследования. Соотнесите названия явлений с номерами графиков. Полученные цифры внесите в таблицу. А) Плавление Б) Нагревание В) кристаллизация АБВ

7. На рисунке показан график изменения температуры некоторого вещества. Что это за вещество? Ответ обоснуйте.

8. На рисунке изображены графики зависимости изменения температуры от времени двух тел одинаковой массы. а) У какого из этих тел выше температура плавления? б) У какого тела больше удельная теплота плавления?

9. В эксперименте отдельно нагревали до 10000С алюминий, железо, медь, цинк, сталь, серебро и золото. В каком состоянии – жидком или твердом – находились эти металлы при указанной температуре? сталь серебро золото медь железо алюминий цинк

Домашнее задание: на какие вопросы можно ответить, пользуясь графиком?

Это интересно 1. Горячий лёд. 2. Ледяные узоры на стекле. 3. Круги на льду и Эйнштейн. 4. О мороженом. Сделаем сами. 5. Почему лед скользкий? 6. Задача о ледяных сосульках. 7. Тайна летающего льда. 8. Сооружения изо льда. 9. Зелёный ёжик. 10. Что будет с сосульками ? 11. Кочка или ямка? 12. Какая вода замерзнет быстрее? 13. Тайна мороженого.


- подготовка к ЕГЭ/ОГЭ и ВПР
- по всем предметам 1-11 классов
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 933 человека из 80 регионов

Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 17 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- ЗП до 91 000 руб.
- Гибкий график
- Удаленная работа
Дистанционные курсы для педагогов
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 608 552 материала в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
Фазовая диаграмма воды.
Плавлению (и кристаллизации) соответствует ветвь левее и выше тройной точки,
сублимации — ветвь левее и ниже тройной точки.
Плавле́ние —это процесс перехода тела [источник не указан 1003 дня] из кристаллического твёрдого состояния в жидкое. Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества [1]
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), среди простых веществ - углерод (по разным данным 3500 — 4500 °C [2] ) а среди произвольных веществ — карбид тантала-гафния Ta4HfC5 (4216 °C). Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
Содержание
Плавление смесей и твёрдых растворов
Фиксированной температуры плавления нет также у аморфных тел; они переходят в жидкое состояние постепенно, размягчаясь при повышении температуры.
Кинетика плавления

Природа плавления
Поясним вначале, почему при некоторой температуре тело предпочитает разорвать часть межатомных связей и из упорядоченного состояния (кристалл) перейти в неупорядоченное (жидкость).
Как известно из термодинамики, при фиксированной температуре тело стремится минимизировать свободную энергию . При низких температурах второе слагаемое (произведение температуры и энтропии) несущественно, и в результате всё сводится к минимизации обычной энергии . Состояние с минимальной энергией — это кристаллическое твёрдое тело. При повышении температуры, второе слагаемое становится всё важнее, и при некоторой температуре оказывается выгоднее разорвать некоторые связи. При этом обычная энергия слегка повысится, но при этом сильно возрастет и энтропия, что в результате приведёт к понижению свободной энергии.
Динамика плавления
В динамике, плавление происходит следующим образом. При повышении температуры тела увеличивается амплитуда тепловых колебаний его молекул, и время от времени возникают дефекты решетки. Каждый такой дефект требует определённого количества энергии, поскольку он сопровождается разрывом некоторых межатомных связей. Стадия рождения и накопления дефектов называется стадией предплавления. Кроме того, на этой стадии, как правило, возникает квази-жидкий слой на поверхности тела. При некоторой температуре концентрация дефектов становится столь большой, что приводит к потере ориентационного порядка в образце.
Плавление в двумерных системах
В двумерных или квази-двумерных системах кристалл является гораздо более шатким объектом, чем в трёхмерном случае, а именно у двумерного кристалла нет дальнего позиционного порядка. (Для сравнения: в одномерном случае кристалл при конечной температуре вообще не может быть стабильным!) Как выяснилось, это приводит к тому, что плавление двумерного кристалла происходит в два этапа. Вначале кристалл переходит в так называемую гексатическую фазу, в которой теряется ближний позиционный порядок, но сохраняется ориентационный, а затем происходит потеря и ориентационного порядка и тело становится жидким.
Читайте также:

