Никель сообщение по географии
Обновлено: 03.07.2024
Никель (Ni) (Niccolum) - химический элемент с атомным номером 28 в периодической системе, ковкий и пластичный металл. Имеет серебристый цвет с желтоватым оттенком, хорошо полируется, притягивается магнитом. Плотность никеля составляет 8,902 г/см 3 , температура плавления tпл. = 1453°С, температура кипения tкип. = 2730-2915°С, данный металл является ферромагнетиком, точка Кюри около 358 °C. На воздухе компактный никель стабилен. Поверхность никеля покрыта тонкой пленкой оксида NiO, которая прочно предохраняет металл от дальнейшего окисления.
В земной коре содержание никеля составляет около 8·10 -3 % по массе. Возможно, громадные количества никеля - около 17·10 19 тонн - заключены в ядре Земли, которое, по одной из распространенных гипотез, состоит из железоникелевого сплава. В морской воде содержание никеля составляет примерно 1·10 -8 -5·10 -8 %.
История открытия никеля
Впервые присутствие никеля в соединении никеля и мышьяка NiAs ("купферникель") обнаружил шведский металлург А.Ф. Кронштедт в 1751 году. Тогда никель относили к "полуметаллу" - простому веществу, обладающему как свойствами металлов, так и неметаллов. Данная точка зрения подвергалась серьезным сомнениям. Но в 1775 году швед Т. Бергман доказал, что никель - простое вещество. Окончательное утверждение никеля произошло в 1804 году, когда немецкий химик И. Рихтер получил чистый никель путем восстановления никелевого купороса.
Свойства никеля
Физические свойства никеля
| Свойство | Никель |
|---|---|
| Атомный номер | 28 |
| Атомная масса, а.е.м | 58,69 |
| Атомный диаметр, пм | 248 |
| Плотность, г/см³ | 8,902 |
| Удельная теплоемкость, Дж/(K·моль) | 0,443 |
| Теплопроводность, Вт/(м·K) | 90,9 |
| Температура плавления, °С | 1453 |
| Температура кипения, °С | 2730-2915 |
| Теплота плавления, кДж/моль | 17,61 |
| Теплота испарения, кДж/моль | 378,6 |
| Молярный объем, см³/моль | 6,6 |
| Группа металлов | Тяжелый металл |
Химические свойства никеля
| Свойство | Никель |
|---|---|
| Ковалентный радиус, пм | 115 |
| Радиус иона, пм | (+2e) 69 |
| Электроотрицательность (по Полингу): | 1,91 |
| Электродный потенциал: | 0 |
| Степени окисления: | 3, 2, 0 |
Марки никеля и сплавов
- Н0, Н1 — никель первичный, содержание Ni+Co - не менее 99,99% и 99,93% соответственно. Никель данных марок выпускается в виде катодных листов, пластин, полос. Эту продукцию получают с помощью электролиза.
- Н2, Н3, Н4 — никель первичный, содержание Ni+Co - не менее 99,8%, 98,6% и 97,6% соответственно. Никель этих марок выпускается в виде пластин, полос, катодных листов, гранул, обрезов и слитков. Данную продукцию получают с помощью электролиза, переплава, прессования отходов никеля, огневого рафинирования.
- НП1, НП2, НП3, НП4 — никель полуфабрикатный, содержание Ni+Co - не менее 99,99%, 99,5%, 99,3% и 99,0% соответственно. Никель приведенных марок выпускается в виде никелевой проволоки, прутков, листов, полос и лент.
- НПА1, НПА2 — никель полуфабрикатный анодный, содержание Ni+Co - не менее 99,7%, 99,0% соответственно. Никель представленных марок выпускается в виде листов и стержней.
- НПАН — Никель полуфабрикатный анодный непассивирующийся (на поверхности изделий из никеля данной марки не образуется тонкая пленка с высоким сопротивлением), содержание Ni+Co - не менее 99,4%. Никель этой марки выпускается в виде стержней и листов.
- НК0,2 — Никель кремнистый, содержание Ni+Co - не менее 99,4%. Никель данной марки выпускается в виде проволоки.
- НМц1, НМц2, НМц2,5, НМц5 — никель марганцевый, содержит до 98,5% Ni+Co (марка НМц1). Никель приведенных марок выпускается в виде проволоки.
Достоинства / недостатки никеля
-
Достоинства:
- обладает высокой жаропрочностью и жаростойкостью;
- имеет высокую коррозионную стойкость во многих агрессивных средах.
-
Недостатки:
- имеет высокую стоимость.
Применение никеля
Никель по большей части является составным компонентом различных сплавов. Все нержавеющие стали обязательно содержат никель, так как никель повышает химическую стойкость сплава. Также сплавы никеля характеризуются высокой вязкостью и используются при изготовлении прочной брони. При изготовлении важнейших деталей различных приборов используется сплав никеля с железом (36-38% никеля), обладающий низким коэффициентом термического расширения.
При изготовлении сердечников электромагнитов широкое применение находят сплавы под общим названием пермаллои. Эти сплавы, кроме железа, содержат от 40 до 80% никеля. Из никелевых сплавов чеканятся монеты. Общее число различных сплавов никеля, находящих практическое применение, достигает нескольких тысяч.
Различные металлы никелируют, что позволяет защитить их от коррозии. На металл наносится тонкий никелевый слой, обладающий высокой коррозионной стойкостью. Вместе с этим никелирование придает изделиям красивый внешний вид.
Никель широко используют при изготовлении различной химической аппаратуры, в кораблестроении, в электротехнике, при изготовлении щелочных аккумуляторов, для многих других целей. Специально приготовленный дисперсный никель находит широкое применение как катализатор самых разных химических реакций. Оксиды никеля используют при производстве ферритных материалов и как пигмент для стекла, глазурей и керамики; оксиды и некоторые соли служат катализаторами различных процессов. Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.

Никель — элемент десятой (по устаревшей короткопериодной форме — восьмой) группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 28. Обозначается символом Ni (лат. Niccolum ). Простое вещество никель — это пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен.

Серебристо-белый металл

Содержание
- 1 Происхождение названия
- 2 История
- 3 Физические свойства
- 4 Химические свойства
- 5 Нахождение в природе
- 5.1 Месторождения никелевых руд
- 5.2 Природные изотопы никеля
- 7.1 Сплавы
- 7.2 Никелирование
- 7.3 Производство аккумуляторов
- 7.4 Химическая технология
- 7.5 Радиационные технологии
- 7.6 Медицина
- 7.7 Монетное дело
- 7.8 Музыкальная промышленность
- 7.9 Цены на никель
Происхождение названия
Элемент получил своё название от имени злого духа гор немецкой мифологии, который подбрасывал искателям меди минерал мышьяково-никелевый блеск, похожий на медную руду (ср. нем. Nickel — озорник); при выплавлении руд никеля выделялись мышьяковые газы, из-за чего ему и приписали дурную славу.
История
Физические свойства
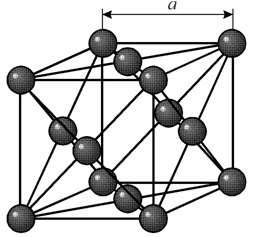
Никель — серебристо-белый металл, не тускнеет на воздухе. Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 нм, пространственная группа Fm3m. В чистом виде весьма пластичен и поддается обработке давлением. Является ферромагнетиком с точкой Кюри 358 °C.
- Удельное электрическое сопротивление 0,0684 мкОм∙м.
- Коэффициент линейного теплового расширения α=13,5∙10 −6 K −1 при 0 °C
- Коэффициент объёмного теплового расширения β=38—39∙10 −6 K −1
- Модуль упругости 196—210 ГПа.
Химические свойства
![никель хлористый]()
Атомы никеля имеют внешнюю электронную конфигурацию 3d 8 4s 2 . Наиболее устойчивым для никеля является состояние окисления Ni(II).
Никель образует соединения со степенью окисления +1, +2, +3 и +4. При этом соединения никеля со степенью окисления +4 редкие и неустойчивые. Оксид никеля Ni2O3 является сильным окислителем.
Никель характеризуется высокой коррозионной стойкостью — устойчив на воздухе, в воде, в щелочах, в ряде кислот. Химическая стойкость обусловлена его склонностью к пассивированию — образованию на его поверхности плотной оксидной плёнки, обладающей защитным действием. Никель активно растворяется в разбавленной азотной кислоте:
и в горячей концентрированной серной:
С соляной и с разбавленной серной кислотами реакция протекает медленно. Концентрированная азотная кислота пассивирует никель, однако при нагревании реакция всё же протекает (основной продукт восстановления азота — NO2).
С оксидом углерода CO никель легко образует летучий и очень ядовитый карбонил Ni(CO)4.
Тонкодисперсный порошок никеля пирофорный (самовоспламеняется на воздухе).
Никель горит только в виде порошка. Образует два оксида NiO и Ni2O3 и соответственно два гидроксида Ni(OH)2 и Ni(OH)3. Важнейшие растворимые соли никеля — ацетат, хлорид, нитрат и сульфат. Водные растворы солей окрашены обычно в зелёный цвет, а безводные соли — жёлтые или коричнево-жёлтые. К нерастворимым солям относятся оксалат и фосфат (зелёные), три сульфида: NiS (черный), Ni3S2 (желтовато-бронзовый) и Ni3S4 (серебристо-белый). Никель также образует многочисленные координационные и комплексные соединения. Например, диметилглиоксимат никеля Ni(C4H6N2O2)2, дающий чёткую красную окраску в кислой среде, широко используется в качественном анализе для обнаружения никеля.
![никель сернокислый]()
![никель сернокислый на паллетах]()
Водные растворы солей никеля(II) содержат ион гексаакваникеля(II) [Ni(H2O)6] 2+ . При добавлении к раствору, содержащему эти ионы, аммиачного раствора происходит осаждение гидроксида никеля (II), зелёного желатинообразного вещества. Этот осадок растворяется при добавлении избыточного количества аммиака вследствие образования ионов гексааминникеля(II) [Ni(NH3)6] 2+ .
Никель образует комплексы с тетраэдрической и с плоской квадратной структурой. Например, комплекс тетрахлороникелат (II) [NiCl4] 2− имеет тетраэдрическую структуру, а комплекс тетрацианоникелат(II) [Ni(CN)4] 2− имеет плоскую квадратную структуру.
В качественном и количественном анализе для обнаружения ионов никеля (II) используется щелочной раствор бутандиондиоксима, известного также под названиями диметилглиоксим и реактив Чугаева. То, что это вещество является реактивом на никель, установил в 1905 году Л. А. Чугаев. При его взаимодействии с ионами никеля (II) образуется красное координационное соединение бис(бутандиондиоксимато)никель(II). Это — хелатное соединение, и бутандиондиоксимато-лиганд является бидентатным.
Нахождение в природе
Никель довольно распространён в природе — его содержание в земной коре составляет ок. 0,01 %(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (от 5 до 25 %). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2 кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13—0,41 % Ni. Он изоморфно замещает железо и магний. Небольшая часть никеля присутствует в виде сульфидов. Никель проявляет сидерофильные и халькофильные свойства. При повышенном содержании в магме серы возникают сульфиды никеля вместе с медью, кобальтом, железом и платиноидами. В гидротермальном процессе совместно с кобальтом, мышьяком и серой и иногда с висмутом, ураном и серебром, никель образует повышенные концентрации в виде арсенидов и сульфидов никеля. Никель обычно содержится в сульфидных и мышьяк-содержащих медно-никелевых рудах.
- никелин (красный никелевый колчедан, купферникель) NiAs
- хлоантит (белый никелевый колчедан) (Ni, Co, Fe)As2
- гарниерит (Mg, Ni)6(Si4O11)(OH)6·H2O и другие силикаты
- магнитный колчедан (Fe, Ni, Cu)S
- мышьяково-никелевый блеск (герсдорфит) NiAsS,
- пентландит (Fe,Ni)9S8
Месторождения никелевых руд
Основные месторождения никелевых руд находятся в Канаде, России (Мурманская область, Норильский район, Урал, Воронежская область), Кубе, ЮАР, Албании, Греции, а также на Новой Каледонии и Украине.
Природные изотопы никеля
Природный никель содержит 5 стабильных изотопов: 58 Ni (68,27 %), 60 Ni (26,10 %), 61 Ni (1,13 %), 62 Ni (3,59 %), 64 Ni (0,91 %). Существуют также искусственно созданные изотопы никеля, самые стабильные из которых — 59 Ni (период полураспада 100 тысяч лет), 63 Ni (100 лет) и 56 Ni (6 суток).
Получение
Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5—50 % Ni+Co, в зависимости от состава сырья и технологических особенностей).
Наиболее железистые — латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90 % Ni), синтер (89 % Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт.
Менее железистые — нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей. Ещё один источник никеля: в золе углей Южного Уэльса в Англии — до 78 кг никеля на тонну. Повышенное содержание никеля в некоторых каменных углях, пефтях, сланцах говорит о возможности концентрации никеля ископаемым органическим веществом. Причины этого явления пока не выяснены.
Основную массу никеля получают из гарниерита и магнитного колчедана.
- Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8 % Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
- Карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
- Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3
![никель слитки]()
Применение
В 2015 году 67 % потребления никеля пришлось на производство нержавеющей стали, 17 % на сплавы без железа, 7 % на никелирование и 9 % на прочие применения, такие как аккумуляторы, порошковая металлургия и химические реактивы.
Сплавы
Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок.
- монель-металл (65—67 % Ni + 30—32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив;
- белое золото (например, 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля (или палладия));
- нихром, сплав никеля и хрома (60 % Ni + 40 % Cr);
- пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис;
- инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании;
- Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина.
- Никель присутствует в качестве компонента ряда нержавеющих сталей.
Никелирование
Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Проводится гальваническим способом с использованием электролитов, содержащих сульфат никеля(II), хлорид натрия, гидроксид бора, поверхностно-активные и глянцующие вещества, и растворимых никелевых анодов. Толщина получаемого никелевого слоя составляет 12—36 мкм. Устойчивость блеска поверхности может быть обеспечена последующим хромированием (толщина слоя хрома — 0,3 мкм).
Бестоковое никелирование проводится в растворе смеси хлорида никеля(II) и гипофосфита натрия в присутствии цитрата натрия:
Процесс проводят при рН 4—6 и 95 °C.
Производство аккумуляторов
Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Химическая технология
Во многих химико-технологических процессах в качестве катализатора используется никель Ренея.
Радиационные технологии
Нуклид 63 Ni, излучающий β - -частицы, имеет период полураспада 100,1 года и применяется в крайтронах, а также детекторах электронного захвата (ЭЗД) в газовой хроматографии.
Медицина
- Применяется при изготовлении брекет-систем (никелид титана).
- Протезирование.
Монетное дело
Музыкальная промышленность
Также никель используется для производства обмотки струн музыкальных инструментов.
Цены на никель
В течение 2012 года цены на никель колебались в пределах от $15 500 до $17 600 за тонну.
Биологическая роль
Никель относится к числу микроэлементов, необходимых для нормального развития живых организмов. Однако о его роли в живых организмах известно немного. Известно, что никель принимает участие в ферментативных реакциях у животных и растений. В организме животных он накапливается в ороговевших тканях, особенно в перьях. Повышенное содержание никеля в почвах приводят к эндемическим заболеваниям — у растений появляются уродливые формы, у животных — заболевания глаз, связанные с накоплением никеля в роговице. Токсическая доза (для крыс) — 50 мг. Особенно вредны летучие соединения никеля, в частности, его тетракарбонил Ni(CO)4. ПДК соединений никеля в воздухе составляет от 0,0002 до 0,001 мг/м 3 (для различных соединений).
Физиологическое действие
Никель и его соединения токсичны и канцерогены.
В XX веке было установлено, что поджелудочная железа очень богата никелем. При введении вслед за инсулином никеля продлевается действие инсулина и тем самым повышается гипогликемическая активность. Никель оказывает влияние на ферментативные процессы, окисление аскорбиновой кислоты, ускоряет переход сульфгидрильных групп в дисульфидные. Никель может угнетать действие адреналина и снижать артериальное давление. Избыточное поступление никеля в организм вызывает витилиго. Депонируется никель в поджелудочной и околощитовидной железах.
![никель]()
Никель — простое вещество, пластичный, ковкий, переходный металл серебристо-белого цвета, при обычных температурах на воздухе покрывается тонкой плёнкой оксида. Химически малоактивен. Относится к тяжелым цветным металлам, в чистом виде на земле не встречается – обычно входит в состав различных руд, высокой твердостью, хорошо полируется, является ферромагнетиком – притягивается магнитом, в периодической системе Менделеева обозначается символом Ni и имеет 28 порядковый номер.
Смотрите так же:
СТРУКТУРА
![структура никеля]()
Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 å нм, пространственная группа Fm3m. Эта кристаллическая структура устойчива к давлению, по меньшей мере 70 ГПа. При обычных условиях никель существует в виде b-модификации, имеющей гранецентрированную кубическую решётку ( a = 3,5236 å). Но никель, подвергнутый катодному распылению в атмосфере h 2 , образует a-модификацию, имеющую гексагональную решётку плотнейшей упаковки ( а = 2,65 å, с = 4,32 å), которая при нагревании выше 200 °С переходит в кубическую. Компактный кубический никель имеет плотность 8,9 г/см 3 (20 °С), атомный радиус 1,24 å
СВОЙСТВА
![никель]()
Никель — ковкий и тягучий металл, из него можно изготовлять тончайшие листы и трубки. Предел прочности при растяжении 400—500 Мн/м 2 , предел упругости 80 Мн/м 2 , предел текучести 120 Мн/м 2 ; относительное удлинение 40%; модуль нормальной упругости 205 Гн/м 2 ; твёрдость по Бринеллю 600—800 Мн/м 2 . В температурном интервале от 0 до 631К (верхняя граница соответствует Кюри точке ). Ферромагнетизм никеля обусловлен особенностями строения внешних электронных оболочек его атомов. Никель входит в состав важнейших магнитных материалов и сплавов с минимальным значением коэффициента теплового расширения (пермаллой, монель-металл, инвар и др.).
ЗАПАСЫ И ДОБЫЧА
![никель]()
Никель довольно распространён в природе — его содержание в земной коре составляет около 0,01%(масс.). В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8%). Содержание его в ультраосновных породах примерно в 200 раз выше, чем в кислых (1,2кг/т и 8г/т). В ультраосновных породах преобладающее количество никеля связано с оливинами, содержащими 0,13 — 0,41% Ni.
В растениях в среднем 5·10 −5 весовых процентов никеля, в морских животных — 1,6·10 −4 , в наземных — 1·10 −6 , в человеческом организме — 1…2·10 −6 .Основную массу никеля получают из гарниерита и магнитного колчедана.
Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8% Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
Карбонильный способ (метод Монда): Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3ПРОИСХОЖДЕНИЕ
![никель]()
Месторождения сульфидных медно-никелевых руд связаны с лополитоподобными или плитообразными массивами расслоенных габброидов, приуроченных к зонам глубинных разломов на древних щитах и платформах. Характерной особенностью медно-никелевых месторождений всего мира является выдержанный минеральный состав руд: пирротин, пентландит, халькопирит, магнетит; кроме них в рудах встречаются пирит, кубанит, полидимит, никелин, миллерит, виоларит, минералы группы платины, изредка хромит, арсениды никеля и кобальта, галенит, сфалерит, борнит, макинавит, валлерит, графит, самородное золото.
Экзогенные месторождения силикатных никелевых руд повсеместно связаны с тем или иным типом коры выветривания серпентенитов. при выветривании происходит стадийное разложение минералов, а также перенос подвижных элементов, с помощью воды из верхних частей коры в нижние. Там эти элементы выпадают в осадок в виде вторичных минералов.
В месторождениях этого типа заключены запасы никеля в 3 раза превышающие его запасы в сульфидных рудах, а запасы некоторых месторождений достигают 1 млн т. и более никеля. Крупные запасы силикатных руд сосредоточены на Новой Каледонии, Филиппинах, Индонезии, Австралии и др. странах. Среднее содержание в них никеля равно 1.1-2%. Кроме того в рудах часто содержится кобальт.ПРИМЕНЕНИЕ
Подавляющая часть никеля используется для получения сплавов с другими металлами (fe, cr, cu и др.), отличающихся высокими механическими, антикоррозионными, магнитными или электрическими и термоэлектрическими свойствами. В связи с развитием реактивной техники и созданием газотурбинных установок особенно важны жаропрочные и жаростойкие хромоникелевые сплавы. Сплавы никеля используются в конструкциях атомных реакторов.
Значительное количество никеля расходуется для производства щелочных аккумуляторов и антикоррозионных покрытий. Ковкий никель в чистом виде применяют для изготовления листов, труб и т.д. Он используется также в химической промышленности для изготовления специальной химической аппаратуры и как катализатор многих химических процессов. Никель — весьма дефицитный металл и по возможности должен заменяться другими, более дешёвыми и распространёнными материалами.
![Никель]()
Никель - это металл, отличающейся пластичностью и ковкостью, его относят к переходным. Он обладает серебристо-белым цветом, при нахождении на открытом пространстве поверхность детали закрывается оксидной пленкой, обеспечивающей защиту от ржавления. Никель это относящийся к малоактивным.
Возникновение наименования
Этот элемент вещество получил свое наименование по названию духа гор, заимствованное из немецкого фольклора. Этот дух славен тем, сто подкидывал изыскателям меди камень, имеющий мышьяково-никелевый глянец. Он походит на медную руду, но при попыток получения металла происходило активное выделение мышьяковистые газы, которые и приписали этому минералу дурную славу.
История открытия
Открытие металла произошло в 1751 году. Но, шахтеры из Саксонии уже имели определенные знания об этой руде, сильно походившей на медную. Ее применяли в процессах получения стекла, для окрашивания готовой продукции в зеленый цвет. Многочисленные потуги выплавить из нее медь не увенчались успехом.
В тот год, шведский исследователь Кронштедт проводил изучение этого минерала в ходе экспериментов он получил окислен зеленого цвета и после его регенерации смог выделить неизвестный металл, названный никелем.
Довольно скоро ученый Бергман, выделил чистый металл и выявил, то что по некоторым параметрам он довольно близок к железу.
Вообще слово никель - распространённое ругательство среди горняков.
ОКОНЧАТЕЛЬНАЯ ЦЕНА НА НИКЕЛЬ ЗАВИСИТ ОТ УСЛОВИЙ ПОСТАВКИ (КОЛИЧЕСТВА, УСЛОВИЙ ОПЛАТЫ, ДОСТАВКИ), ДАННЫЙ ПРАЙС-ЛИСТ НОСИТ ИСКЛЮЧИТЕЛЬНО ИНФОРМАЦИОННЫЙ ХАРАКТЕР!
Физические параметры
![никелевый катод]()
Никель - это серебристо-белый металл, не теряющий внешнего облика на воздухе. Он имеет гранецентрированную кубическую структуру. Пространственная группа имеет формулу Fm3m. В чистом виде этот материал отличается пластичностью и легко поддаётся переработке методом давления. У этого металла имеются следующие характеристики:
- сопротивление 0,0684 мкОм∙м;
- линейное тепловое расширение =13,5∙10−6 K−1 при 0 C;
- объёмное тепловое расширение =38—39∙10−6 K−1;
- модуль упругости 196—210 ГПа.
Химические параметры
Атомы никеля имеют следующую электронную формулу 3d84s2. Самое стабильное его состояние - это окисление.
Никель образовывает смеси уровнем оксидирования +1, +2, +3 и +4. Смеси никеля с уровнем оксидировния +4 встречаются нечасто и отличаются неустойчивостью.
![катоды никелевые]()
Еще одно отличительное свойство металла его устойчивость к коррозии. Причём, эта устойчивость сохраняется на воздухе, воде и некоторых агрессивны средах, например, щелочах и кислотах. Это свойство обусловлено тем, что на поверхности образуется плотная оксидная пленка, которая обладает защитными свойствами. Между тем, никель смешивается со слабой смесью азотной кислоты или в нагретой сконцентрированной серной.
Никель неторопливо входит в реакцию с соляной или смесью серной кислоты. Азотная кислота в концентрированной форме, образовывает на деталях из никеля оксидный слой.
При вступлении в связь с оксидом углерода появляется ядовитое вещество под названием карбонил, он обладает следующей формулы Ni(CO)4.
Мелкий порошок отличается тем, что может загореться на воздухе. Кстати, никель горит только в порошкообразном виде. В этом процессе происходит образование двух оксидов и двух гидрооксидов. Существуют несколько солей никеля - ацетат, хлорид, нитрат и сульфат.
Соли могут быть растворены в воде. Такие смеси обладают зеленым окрасом. Сухие соли окрашены в желтые оттенки.
Никель может образовывать различные виды соединений, в т. ч., координационные и комплексные. Как пример можно рассмотреть диметилглиоксимат, который выдает красный окрас в кислой среде и применяемый при проведении качественного анализа для выявления никеля.
Смесь сульфата никеля в воде обладает зеленым окрасом.
Водяные смеси обладают в себе ионы гексаакваникеля. После добавления к смеси, в котором находятся эти ионы , аммиака, происходит образование гидрооксида. Это вещество напоминает желе зеленого цвета.
При проведении разных реакций он может образовывать сочетания с тетраэдрической и с двумерной квадратной структурой.
В качественном и количественном исследовании, проводимого для выявления никеля применяют смесь бутандиондиоксима. Еще эта смесь имеет и второе наименование реактив Чунаева. Так звали учёного, выявившего, что эта смесь помогает выявлять никель.
Нахождение в природе
Никель получил широкое распространение в природе. В коре его содержится порядка 0,01%. В земле его находят только в связанном виде но в метеоритах, которые попадают к нам на планету обнаруживается никель в чистом виде, причём достаточно в большом количестве до 25% от массы.
![Никелин]()
При высокой концентрации в магме серы, происходит формирование солей никеля. В гидротермальной процедуре он может образовывать соединения в виде арсенидов и сульфидов.
Никель, чаще всего встречают в сульфидных и мышьяк-содержащих рудах.
К таким рудам относят:
- никелин;
- хлоантит;
- гарниерит;
- магнитный колчедан;
- мышьяково-никелевый блеск;
- пентландит.
Кстати, существует теория, согласно которой земное ядро состоит их никелистого железа.
Залежи руд
Базовые залежи руд расположились в Канаде, России, на Кубе и других странах
Натуральные изотопы никеля
Природный никель имеет 5 стабильных изотопов. Между тем имеются и синтезированные изотопы. Самый стабильный из них, это 59Ni с периодом полураспада 100 т. лет.
Добыча никеля
Разведанные запасы руд оценивают в 135 миллионов тонн. Из них доказанных 49 миллионов тонн. К основным рудам относят никелин, миллерит и некоторые другие. Остальные руды, которые используют для добычи чистого никеля, может содержать в своем рецепте, отдельные примеси, состоящие из кобальта, меди, железа.
Довольно часто для получения этого металла применяют технологию рафинирования. Нередко, его получают как добавочный продукт при выработке сторонних металлов. По отдельным данным, запасы никеля скапливается в окисленных рудах. В 1997 году, доля добытого никеля, полученного из обогащенных руд, равнялась 40% от уровня мировой добычи. В промышленных условиях никелевые руды делят на две группы – магнезиальные и железистые. Первая группа относится к тугоплавким и для выработки никеля их плавят в электрических печах. Таким образом, происходит выработка ферроникеля.
![лента никелевая]()
Железистые руды перерабатывают с применением методов гидрометаллургии. Часто применяют аммиачно-карбонатное выщелачивание. Другой метод – сернокислотное выщелачивание.
Латеритовые руды обрабатывают с помощью методов гидрометаллургии с использованием описанных выше методов выщелачивания.
В результате применения описанных выше описанных технологий продуктами переработки становятся - закись никеля, синтер, концентраты с разным смесям. Кроме названных продуктов, в итоге переработки образуются порошки никеля, кобальта и другие продукты
Нонтронитовые руды переплавляют на штейн (промежуточный продукт). На металлургических комбинатах полного цикл в ходе дальнейшей обработки производят конвертирование, обжиг файнштейна, плавление закиси никеля в электрической печи. В результате названных операций происходит получение металлического никеля. При выработке никеля, дополнительным продуктом становится кобальт. По некоторым подсчетом, в зольных остатках может содержаться до 80 кг никеля на одну тонну.
Высокая концентрация никеля в некоторых породах каменного угля говорит о его группировании никеля в ископаемой органике. Но до сих пор не ясно, как и почему это происходит.
Никель долго не могли выделить в чистом виде, это произошло потому что, в его рецепте постоянно присутствует сера, в виде солей. Они располагаются тонкими прослойками, обладающими определенной хрупкостью, размещеные по краям металла. Добавка в расплав определенного количества магния, обеспечивает связь серы и магния, выделяемое в виде зерен, при этом никакого нарушения пластичных параметров металла не происходит.
Основной объем никеля получают из гарниерита и соединений серы с железом. Силикатную руду регенерируют с использованием угольной пыли. Для этого процесса используют вращающиеся печи. В результате такой обработки на выходе получают железно – никелевые окатыши. Полученный продукт освобождают от серы. Затем их прокаливают и подвергают обработке раствором аммиака. Затем раствор подкисляют и из него извлекают готовый к использованию металл, для решения этой проблемы применяют электролиз.
Метод Монда. Первым делом из сульфид выделяют медно-никелевую смесь, считающейся промежуточный продуктом. На втором этапе над ним продувают углекислый газ. В результате такой обработки происходит получение тетракарбонилникеля. После обработки с помощью высокой температуры из него выделяют металл высокой чистоты.
Алюминотермический способ основан на регенерации никеля или оксида.
Практическое использование
В начале XX века большя часть добытого никеля было использовано для выработки коррозионностойкой стали. На эти цели ушло порядка 67% всего добытого никеля. 17% было задействовано на получения сплавов без использования железа. 7% было использовано для нанесения покрытий никеля. 9% применили для выпуска аккумуляторных батарей, порошковой металлургии и выпуск химреактивов.
Соединения никеля с другими металлами
![проволока из никеля]()
Никель выступает как основание для выпуска спецсплавов, в т. ч. коррозионностойких, жаропрочных и других, требуемых для ракетного и авиационного строительства. Из производят детали и узлы применяемые для силовых агрегатов. Ниже приведены краткие характеристики некоторых популярных сплавов. К ним относят следующие:
- Монель, кроме никеля в состав входят медь, марганец. Его основные отличия - его основные отличия – жаростойкость до 500 градусов, высокая стойкость к ржавлению.
- Белое золото, состоящее на 58% из золота и добавки из серебра и никеля. Иногда эти элементы заменяют на палладий.
- Нихром – соединение Ni и Cr, отличается большим электрическим сопротивлением. Этот материал нашел свое применение при серийном производстве тепловых приборов.
- Пермаллой, в его состав входят Cu, Cr и он отличается магнитной восприимчивостью.
- Сплав железа и никеля, не деформирующийся при разогреве.
Нельзя забывать и то, что к сплавам относят соединения с хромом, и многие другие.
При выплавке коррозионностойких материалов, в качестве легирующей добавки используют никель.
Никелирование
![никелевая проволока НП-1]()
Так называют нанесение покрытия на поверхность другого материала. Задача такого обеспечение защиты изделия от коррозии. Нанесение покрытия проводят в гальванической ванне. Для проведения качественной гальванической операции, применяют электролиты содержащие в своем составе соли натрия, бора, различные поверхностно – активные компоненты и глянцующие элементы. Толщина никелевого покрытия составляет до 36 мкм. Для повышения качества нанесенного покрытия допускается поверх никеля наносить слой хрома.
Существует способ нанесения никеля без применения электричества. То есть нанесение покрытия выполняют в смеси, включающей в себя соли никеля и натрия.
Никель и природа
Этот элемент, просто необходим для нормального развития и жизни биологических организмов. Но наука не очень много знает о роли никеля в жизнедеятельности организмов. Доподлинно известно, что этот элемент принимает активное участие в ферментативной деятельности у животных и растений.
Влияние на организм
В теле животных, скопление этого элемента можно обнаружить в ороговевших тканях, например в перьях.
Но, тем не менее, повышенная концентрация металла в почках, приводит к появлению эндемических заболеваний. Растения принимают уродливые формы, а у животных начинают болеть глаза. Предельная доза никеля в организме лабораторной крысы составляет 50 мг. Предельная концентрация в воздухе лежит в диапазоне от 0,0002 до 0,001 мг/м3.
Никель и физиология
Никель и его сплавы, отличаются токсичность и канцерогенностью. Этот элемент, часто провоцирует появление аллергии на металлы, которые находятся в непосредственном контакте с человеческой кожей, то есть бижутерия, часовые браслеты и пр. В начале XXI века никель был признан аллергеном года. В странах Европейского союза, введены законодательные ограничения на концентрацию никеля на продукцию, которая может контактировать с кожей человека.
В прошлом веке исследователи выявили интересный факт, оказывается поджелудочная железа довольно богата эти металлом. При введении инъекции никеля вслед за инсулином продляет действие препарат и происходит рост гликемической активности.
Никель оказывает существенное влияние на ферментативные процессы. Этот материал значительно влияет на процессы, протекающие в организме.
![]()
Данную руду (красный никелевый колчедан NiAs) в 1751 г. исследовал шведский минералог Кронштедт. Ему удалось получить зелёный окисел и путём восстановления последнего — новый металл, названный никелем.
![]()
![]()
Биологическая роль
Никель — микроэлемент, который необходим всем живым организмам. Его среднее содержание в растениях — 0,00005 %, в наземных животных — 0,000001 %, в морских — 0,00016 % массы тела.
Роль никеля в организме изучена не до конца. Известно, что он участвует в ферментативных реакциях и влияет на окислительные процессы. Он содержится в легких, печени, мышцах, поджелудочной и щитовидной железах, некоторых отделах головного мозга. Микроэлемент также накапливается в ороговевших тканях человека, животных и птиц, в том числе в волосах и перьях.
Избыточное содержание никеля в растениях приводит к уродливым формам, в организме животных — к различным глазным заболеваниям (кератоконъюнктивитам, кератитам).
Пары и пыль никеля токсичны и могут вызывать поражения кожи, легких и носоглотки, а частое вдыхание паров металла опасно появлением злокачественных новообразований.
Металл оказался похож на железо во своим свойствам
В русской литературе начала XIX в. употреблялись названия николан (Шерер, 1808 и Захаров, 1810), николь и никель (Двигубский, 1824).
Химические параметры
Атомы никеля имеют следующую электронную формулу 3d84s2. Самое стабильное его состояние — это окисление.
Никель образовывает смеси уровнем оксидирования +1, +2, +3 и +4. Смеси никеля с уровнем оксидировния +4 встречаются нечасто и отличаются неустойчивостью.
![катоды никелевые]()
Еще одно отличительное свойство металла его устойчивость к коррозии. Причём, эта устойчивость сохраняется на воздухе, воде и некоторых агрессивны средах, например, щелочах и кислотах. Это свойство обусловлено тем, что на поверхности образуется плотная оксидная пленка, которая обладает защитными свойствами. Между тем, никель смешивается со слабой смесью азотной кислоты или в нагретой сконцентрированной серной.
Никель неторопливо входит в реакцию с соляной или смесью серной кислоты. Азотная кислота в концентрированной форме, образовывает на деталях из никеля оксидный слой.
При вступлении в связь с оксидом углерода появляется ядовитое вещество под названием карбонил, он обладает следующей формулы Ni(CO)4.
Мелкий порошок отличается тем, что может загореться на воздухе. Кстати, никель горит только в порошкообразном виде. В этом процессе происходит образование двух оксидов и двух гидрооксидов. Существуют несколько солей никеля — ацетат, хлорид, нитрат и сульфат.
Соли могут быть растворены в воде. Такие смеси обладают зеленым окрасом. Сухие соли окрашены в желтые оттенки.
Никель может образовывать различные виды соединений, в т. ч., координационные и комплексные. Как пример можно рассмотреть диметилглиоксимат, который выдает красный окрас в кислой среде и применяемый при проведении качественного анализа для выявления никеля.
Смесь сульфата никеля в воде обладает зеленым окрасом.
Водяные смеси обладают в себе ионы гексаакваникеля. После добавления к смеси, в котором находятся эти ионы , аммиака, происходит образование гидрооксида. Это вещество напоминает желе зеленого цвета.
При проведении разных реакций он может образовывать сочетания с тетраэдрической и с двумерной квадратной структурой.
В качественном и количественном исследовании, проводимого для выявления никеля применяют смесь бутандиондиоксима. Еще эта смесь имеет и второе наименование реактив Чунаева. Так звали учёного, выявившего, что эта смесь помогает выявлять никель.
Физические свойства Никель Niccolum
Основные свойства Niccolum Никель — серебристо-белый металл, не тускнеет на воздухе. Имеет гранецентрированную кубическую решетку с периодом a = 0,35238 нм, пространственная группа Fm3m. В чистом виде весьма пластичен и поддается обработке давлением. Является ферромагнетиком с точкой Кюри 358 °C.
- Удельное электрическое сопротивление 0,0684 мкОм∙м.
- Коэффициент линейного теплового расширения α=13,5∙10−6 K−1 при 0 °C
- Коэффициент объёмного теплового расширения β=38—39∙10−6 K−1
- Модуль упругости 196—210 ГПа.
Изотопы Niccolum Никель
Наличие и определение изотопов Niccolum
Нахождение в природе и производство
![Производство никеля]()
Больше всего никеля содержится в глубоких слоях. В земной коре — его 0,0058%, в ультраосновных породах — 0,2 %. Если верить гипотезе, что земное ядро состоит из никелистого железа, общее содержание никеля в земле составляет примерно 3%. Никель также обнаружен в некоторых метеоритах.
В земной коре этот металл соседствует с железом и магнием, с которыми он имеет сходную валентность. В минералах магния и железа никель содержится в виде изоморфной примеси. Также существует 53 известных науке минерала никеля. Большая часть из них была образована под воздействием давления и высоких температур, например, при застывании магмы. Сульфидные руды, содержащие данный металл, имеют в своем составе медь. Некоторые руды никеля включают железо, серу, мышьяк, кобальт, магний.
Больше всего этого металла добывается на территории России. Крупные никелевые рудники также находятся в Канаде, Австралии, Новой Каледонии, Индонезии и на Кубе.
Больше всего никеля (около 80%) получают из сульфидных медно-никелевых руд, значительно меньше — из силикатных (окисленных) руд.
Интересные факты
![Никелевый порошок]()
Получение
Тугоплавкие магнезиальные руды, как правило, подвергают электроплавке на ферроникель (5—50 % Ni+Co, в зависимости от состава сырья и технологических особенностей).
Наиболее железистые — латеритовые руды перерабатывают гидрометаллургическими методами с применением аммиачно-карбонатного выщелачивания или сернокислотного автоклавного выщелачивания. В зависимости от состава сырья и применяемых технологических схем конечными продуктами этих технологий являются: закись никеля (76-90 % Ni), синтер (89 % Ni), сульфидные концентраты различного состава, а также металлические никель электролитный, никелевые порошки и кобальт.
Менее железистые — нонтронитовые руды плавят на штейн. На предприятиях, работающих по полному циклу, дальнейшая схема переработки включает конвертирование, обжиг файнштейна, электроплавку закиси никеля с получением металлического никеля. Попутно извлекаемый кобальт выпускают в виде металла и/или солей.[11] Ещё один источник никеля: в золе углей Южного Уэльса в Англии — до 78 кг никеля на тонну. Повышенное содержание никеля в некоторых каменных углях, пефтях, сланцах говорит о возможности концентрации никеля ископаемым органическим веществом. Причины этого явления пока не выяснены.
Основную массу никеля получают из гарниерита и магнитного колчедана.
- Силикатную руду восстанавливают угольной пылью во вращающихся трубчатых печах до железо-никелевых окатышей (5—8 % Ni), которые затем очищают от серы, прокаливают и обрабатывают раствором аммиака. После подкисления раствора из него электролитически получают металл.
- Карбонильный способ (метод Монда). Вначале из сульфидной руды получают медно-никелевый штейн, над которым пропускают СО под высоким давлением. Образуется легколетучий тетракарбонилникель [Ni(CO)4], термическим разложением которого выделяют особо чистый металл.
- Алюминотермический способ восстановления никеля из оксидной руды: 3NiO + 2Al = 3Ni +Al2O3
Содержание
- 1 Происхождение названия
- 2 История
- 3 Физические свойства
- 4 Химические свойства
- 5 Нахождение в природе 5.1 Месторождения никелевых руд
- 5.2 Природные изотопы никеля
-
7.1 Сплавы
Примечания
Применение
В 2015 году 67 % потребления никеля пришлось на производство нержавеющей стали, 17 % на сплавы без железа, 7 % на никелирование и 9 % на прочие применения, такие как аккумуляторы, порошковая металлургия и химические реактивы[13].
Сплавы
Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок.
- монель-металл (65—67 % Ni + 30—32 % Cu + 1 % Mn), жаростойкий до 500 °C, очень коррозионно-устойчив;
- белое золото (например, 585 пробы содержит 58,5 % золота и сплав (лигатуру) из серебра и никеля (или палладия));
- нихром, сплав никеля и хрома (60 % Ni + 40 % Cr);
- пермаллой (76 % Ni + 17 %Fe + 5 % Cu + 2 % Cr), обладает высокой магнитной восприимчивостью при очень малых потерях на гистерезис;
- инвар (65 % Fe + 35 % Ni), почти не удлиняется при нагревании;
- Кроме того, к сплавам никеля относятся никелевые и хромоникелевые стали, нейзильбер и различные сплавы сопротивления типа константана, никелина и манганина.[14]
- Никель присутствует в качестве компонента ряда нержавеющих сталей.
Никелирование
Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Проводится гальваническим способом с использованием электролитов, содержащих сульфат никеля(II), хлорид натрия, гидроксид бора, поверхностно-активные и глянцующие вещества, и растворимых никелевых анодов. Толщина получаемого никелевого слоя составляет 12—36 мкм. Устойчивость блеска поверхности может быть обеспечена последующим хромированием (толщина слоя хрома — 0,3 мкм).
Бестоковое никелирование проводится в растворе смеси хлорида никеля(II) и гипофосфита натрия в присутствии цитрата натрия:
N i C l 2 + N a H 2 P O 2 + H 2 O → N i + N a H 2 P O 3 + 2 H C l +NaH_PO_+H_O\rightarrow Ni+NaH_PO_+2HCl>>>
Процесс проводят при рН 4—6 и 95 °C[14].
Производство аккумуляторов
Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов.
Химическая технология
Во многих химико-технологических процессах в качестве катализатора используется никель Ренея.
Радиационные технологии
Нуклид 63Ni, излучающий β—частицы, имеет период полураспада 100,1 года и применяется в крайтронах, а также детекторах электронного захвата (ЭЗД) в газовой хроматографии.
Медицина
- Применяется при изготовлении брекет-систем (никелид титана).
- Протезирование.
Монетное дело
Музыкальная промышленность
Также никель используется для производства обмотки струн музыкальных инструментов.
Цены на никель
В течение 2012 года цены на никель колебались в пределах от $15 500 до $17 600 за тонну.
Золото — 19,29 г/см³

С давних времен люди покупают, продают и даже убивают за этот драгоценный металл. Да что люди, целые страны занимаются скупкой золота. Лидером государств с самыми крупными запасами золота на данный момент является Америка. И вряд ли наступит пора, когда в золоте не будет нужды.
Говорят, что деньги не растут на деревьях, но золото — растет! Небольшое количество золота можно найти в листьях эвкалипта, если тот находится на золотоносной почве.
Читайте также: