Методы производства вакцин сообщение
Обновлено: 17.05.2024
С чего все начинается
Вакцины не разрабатываются просто так, по чьему-либо желанию. Процесс инициируется, когда инфекция приобретает угрожающий характер (эпидемии или пандемии), особенно всемирного масштаба. Огромное количество накопленных статистических данных служит толчком к поиску нового препарата.
Изучение свойств патогена происходит как в условиях лаборатории (с привлечением животных или in vitro), так и путем непосредственного наблюдения за инфицированными людьми.
В процессе принимают участие одновременно несколько групп ученых, каждая из которых имеет свои задачи и методы. Таким образом, инфекционного возбудителя исследуют с максимального числа сторон.
Здесь же формируются гипотезы, каким может быть будущий препарат, – живой, инактивированный, синтетический. Важными моментами являются, например:
как будет происходить оценка иммунного ответа;
какие антигены возбудителя нужно взять;
какая питательная среда потребуется для выращивания микроорганизма;
сколько антигена надо, чтобы стимулировать формирование иммунитета у людей разных возрастов;
сколько дозировок нужно и с какой периодичностью введения, и так далее.
НА ЗАМЕТКУ! Антиген – часть инфекционного возбудителя, к которому иммунная система вырабатывает защитные антитела. Для разных антигенов (даже одного микроба) нужны разные антитела.
То есть, на этапе разработки вакцин ученые сталкиваются с огромным количеством вопросов, выдвигают и проверяют десятки и сотни гипотез, при необходимости меняют концепцию. Понятно, что в экстренных случаях такая работа ведется непрерывно, круглосуточно, и в ней задействовано в несколько раз больше исследований, чем в штатном режиме.
Доклинический этап
Когда базовые исследования закончены, и прототип препарата готов, начинается доклинический этап. Испытания проводятся на животных, параллельно отрабатывается технология производства вакцины.
Среди важных моментов доклинических испытаний можно отметить следующие:
- происходит оценка возможности вакцины формировать иммунитет;
- выявляется токсичность препарата для живого организма;
- определяется минимальная, оптимальная и максимально допустимая дозировка;
- исследуется воздействие на плод (вероятность развития аномалий и прочее);
- оценивается способность препарата влиять на образование и/или рост опухолей;
- оцениваются аллергизирующие свойства и так далее.
В процессе тестирования животным вводят вакцину в различных концентрациях и в разных состояниях организма, наблюдая и фиксируя при этом малейшие изменения. Нужно отметить, что большая часть вакцин не проходит доклинические испытания, так как не приводит к цели – иммунный ответ на введение отсутствует.
НА ЗАМЕТКУ! Для проведения доклинических исследований, как правило, берут два вида животных. Чаще всего, это – мыши и приматы. Идеальный вариант – когда в тестировании принимают участие от трех и более видов. Это дает возможность подобрать оптимально подходящую дозировку и обеспечить полную безопасность препарата.
Если доклинические испытания прошли успешно, для дальнейших испытаний нужно получить разрешение в специализированных органах. Авторы подают заявку, в которой подробно описываются проведенные исследования и тесты, обосновывается необходимость применения препарата и другие моменты. В ответ получают либо отказ, либо разрешение. При положительном решении разработка вакцины переходит в клинический этап.
Клинический этап разработки
Этот этап предполагает непосредственное участие в испытаниях людей-добровольцев. Неважно, для какого возраста разрабатывается вакцина, ее действие изучают только на здоровых взрослых людях. Клинические исследования проводятся в три фазы. Процесс разделен на стадии, что позволяет контролировать тестирование препарата, постепенно увеличивая количество людей. Это значительно снижает риски: всё что будет тестироваться массово, уже прошло испытания в узких кругах. И, конечно, такой подход позволяет прекратить тестирование на любом этапе в случае обнаружения нежелательных явлений. Именно поэтому каждая фаза имеет огромную значимость и свои цели.
Первая фаза
Проводится на совсем небольшом количестве людей (десятки людей). Её цель – подтверждение первичной безопасности для людей в принципе. Происходит исследование вакцины в действии. Ученые обращают внимание на следующие моменты:
- переносимость и побочные явления;
- особенность иммунного ответа (скорость, выраженность и другие);
- взаимодействие с другими препаратами;
- безопасность диапазона доз.
В процессе тестирования может изменяться не только дозировка, но и состав препарата. Вакцину вводят не сразу всем участникам, а поочередно, чтобы избежать массовых негативных проявлений в случае, если что-то пойдет не так.
Вторая фаза
Цель этой стадии – оценка эффективности (иммуногенности) вакцины. Во второй фазе испытаний принимает участие несколько сотен добровольцев. На данном этапе происходит еще большая отработка свойств и дозировки препарата. Тщательно фиксируются и анализируются реакции организма, определяется периодичность и сроки вакцинации, особенности транспортировки и прочие моменты.
Третья фаза
Её цель – доказать безопасность и эффективность вакцины при массовом применении в динамике, а также удостовериться, что польза вакцины компенсирует те нежелательные реакции, которые неминуемо будут выявлены (хотим уточнить, что допускаются лишь легкие реакции). Именно на третьей фазе ученые делают выводы, которые невозможны при небольшой численности испытуемых: действие вакцины изучается на тысячах человек. Анализируется частота побочных эффектов (в том числе отдаленных), продолжается определение безопасности.
После того, как все фазы клинического этапа исследований успешно пройдены, данные о них поступают в специализированные структуры. Положительное решение означает, что вакцина может быть запущена в производство; препарат регистрируют, а фирме-изготовителю выдается соответствующая лицензия.
Нужно отметить, что лицензируется не только сама вакцина, но и ее производство. Если в процесс изготовления вносятся какие-либо изменения или он не может в полной мере обеспечить качество, препарат заново проходит испытания. Вакцины выпускаются сотнями тысяч дозировок, и важно, чтобы каждая из них соответствовала ранее заявленным протоколам.
Выдача лицензии и массовый выпуск вакцины не означает, что исследования закончились. Существует еще четвертая фаза клинических исследований. Она проводится уже после того, как препарат становится доступным для людей через розничную сеть медицинский организаций. Это постмаркетинговые испытания или так называемый постклинический мониторинг. Он имеет масштабный характер, позволяют получить еще более подробную информацию о безопасности и эффективности препарата. Также на четвертой фазе оцениваются комбинации с другими препаратами и уточняются вновь открывшиеся данные и гипотезы.
Может быть и такое: вакцину зарегистрировали и начали применять, но внезапно сняли с производства. Дело в том, что даже несколько тысяч человек в некоторых случаях не могут являться абсолютным показателем безопасности. Только внедрение в массы способно в полной степени проявить те или иные качества препарата. Однако такие случаи – редкость.
Примечательно, что даже после того, как все фазы испытаний пройдены, наблюдения за действием препарата продолжают вестись постоянно в течение многих лет: ученые отслеживают влияние на организм в долгосрочном отношении, анализируют данные о динамике заболевания с момента внедрения препарата.
Как же получают сами препараты?
Непосредственное производство вакцины зависит от ее вида. В общих чертах его можно описать следующим образом.
1. Живая вакцина (ослабленная)
- Выбирают штамм возбудителя.
- Ослабляют микроорганизм.
- Размножают (культивируют) в питательной среде.
- Очищают от примесей.
- Стандартизируют (приводят к нужной концентрации, фасуют).
2. Инактивированная вакцина (убитые возбудители).
3. Рекомбинантная вакцина. Используются методы генной инженерии.
- У патогенного возбудителя берут часть генетического материала.
- Встраивают его в геном клеток, которые будут его производить (чаще всего, это – дрожжи).
- Культивируют клетки в питательной среде.
- Выделяют и очищают антиген.
- Готовят вакцину.
НА ЗАМЕТКУ! Одни из последних разработок ученых – создание вакцин на основе растительных вирусов. Их комбинируют с антигеном возбудителя болезни человека. Подобные исследования с использованием вируса табачной мозаики уже проводятся в отношении краснухи, COVID, сибирской язвы.
Сколько времени требуется для создания препарата
Длительность разработки и производства вакцин зависит от многих факторов: штамма возбудителя, антигенных свойств, того, насколько он изучен. В среднем, этапы занимают следующее количество времени:
Суммарно на разработку одной вакцины уходит примерно 10-15 лет (без мониторинга на практике после внедрения в производство).
То же происходит, если свойства, присущие семейству возбудителя, хорошо известны. Например, ежегодные мутации вируса гриппа не являются препятствием для быстрого производства новой вакцины.
Особенности контроля
Каждый этап производства вакцин жестко контролируется. Стандарты и положения, регулирующие нормы качества препаратов, изложены в сборнике – фармакопее. Она имеет юридическую силу и находится под государственным контролем.
Люди-добровольцы, которые участвуют в испытаниях, обязательно должны дать на это свое согласие на основании утвержденного этическим комитетом протокола. Непосредственно на производстве надзору подвергается каждая серия выпущенного препарата. Контролируется не только состав вакцины, но и стерильность, концентрация, требования к фасовке, упаковке и так далее.
На фоне вышесказанного утверждения противников вакцинации выглядят, по меньшей мере, смешными. А если вы запутались в современных вакцинах, раздумываете – делать прививки или нет, наши специалисты всегда придут на помощь: проконсультируют, объяснят, посоветуют.
Какие ингредиенты входят в состав вакцины?
Вакцины содержат крошечные фрагменты болезнетворного микроорганизма или программы для создания этих крошечных фрагментов. Они также содержат другие ингредиенты, необходимые для обеспечения безопасности и эффективности вакцины. Эти последние ингредиенты включены в большинство вакцин и использовались на протяжении десятилетий в миллиардах доз вакцин.
Каждый компонент вакцины служит конкретной цели, и каждый ингредиент тестируется в процессе производства. Все ингредиенты тестируются на безопасность.
Антиген
Все вакцины содержат активный компонент (антиген), который генерирует иммунный ответ, или программу для создания активного компонента. Антиген может быть небольшой частью болезнетворного микроорганизма, такой как белок или сахар, или же это может быть весь микроорганизм в ослабленной или инактивированной форме.

Консерванты
Консерванты предотвращают контаминацию вакцины после открытия флакона, если она используется более чем для одного человека. Некоторые вакцины не имеют консервантов, поскольку они хранятся в однодозовых флаконах, которые выкидываются после введения одной дозы. Наиболее широко используемым консервантом является 2-феноксиэтанол, который используется в течение многих лет в ряде вакцин и ряде продуктов по уходу за младенцами. Этот консервант безопасен для использования в вакцинах, поскольку он мало токсичен для людей.
Стабилизаторы
Стабилизаторы предотвращают химические реакции внутри вакцины и удерживают компоненты вакцины от прилипания к флакону.
Стабилизаторы могут быть сахарами (лактозой, сахарозой), аминокислотами (глицином), желатином и белками (рекомбинантным человеческим альбумином, полученным из дрожжей).

Поверхностно-активные вещества
Поверхностно-активные вещества сохраняют все ингредиенты вакцины в смешанном состоянии. Они предотвращают образование осадка и склеивание элементов, находящихся в жидкой форме вакцины. Они также часто используются в пищевых продуктах, таких как мороженое.
Примеси
Примеси представляют собой крошечные количества различных веществ, используемых во время изготовления или производства вакцин, которые не являются активными ингредиентами готовой вакцины. Вещества варьируются в зависимости от используемого производственного процесса и могут включать яичные белки, дрожжи или антибиотики. Остаточные следы этих веществ, которые могут присутствовать в вакцине, находятся в столь малых количествах, что их необходимо измерять в частях на миллион или в частях на миллиард.
Разбавители
Разбавитель – это жидкость, используемая для разбавления вакцины до правильной концентрации непосредственно перед ее использованием. Чаще всего в качестве разбавителя используется стерильная вода.
Адъюванты
Некоторые вакцины содержат также адъюванты. Адъювант улучшает иммунную реакцию на вакцину иногда путем более длительного удержания вакцины в месте инъекции или стимулирования местных иммунных клеток.
Адъювантом может быть незначительное количество алюминиевых солей (например, фосфат алюминия, гидроксид алюминия или сульфат калия-алюминия). Было продемонстрировано, что алюминий не вызывает каких-либо долговременных проблем со здоровьем, и люди регулярно потребляют алюминий во время еды и питья.
Как разрабатывают вакцины?
Наиболее часто используемые вакцины применяются уже на протяжении десятилетий, и каждый год миллионы людей получают их, не подвергаясь при этом опасности. Как и все лекарственные средства, каждая вакцина должна пройти широкомасштабное тщательное тестирование для оценки ее безопасности, прежде чем она может быть включена в программу вакцинации в странах.
Каждая разрабатываемая вакцина должна сначала пройти проверки и оценки, помогающие определить, какой антиген следует использовать, чтобы вызвать иммунную реакцию. Эта доклиническая фаза испытаний проводится без участия людей. Экспериментальные вакцины сначала тестируются на животных для оценки их безопасности и способности предотвращать болезнь.
Если вакцина вызывает иммунную реакцию, она затем тестируется в рамках клинических испытаний с участием людей, которые состоят из трех фаз.
Фаза 1
Вакцина вводится небольшому числу добровольцев, чтобы оценить ее безопасность, убедиться, что она генерирует иммунную реакцию, и определить правильную дозу. Как правило, во время этой фазы испытаний вакцины тестируются на молодых взрослых добровольцах.
Фаза 2
Затем вакцина вводится сотням добровольцев для дальнейшей оценки ее безопасности и способности генерировать иммунную реакцию. Участники этой фазы испытаний обладают теми же характеристиками (такими как возраст и пол), что и люди, для которых предназначается вакцина. Обычно на этом этапе проводится несколько испытаний для оценки разных возрастных групп и разных составов вакцины. На этом этапе в испытания обычно включается группа, не получавшая вакцину, в качестве группы сравнения для определения того, относятся ли изменения, произошедшие в вакцинированной группе участников, к вакцине или же они произошли случайно.
Фаза 3
Затем вакцина вводится тысячам добровольцев, и проводится сравнение с аналогичной группой людей, которые не получали вакцину, но получали продукт сравнения, с целью определить, эффективна ли вакцина против болезни, для защиты от которой она предназначается, и изучить ее безопасность среди гораздо большего числа людей. Большую часть времени испытания на этом этапе проводятся в разных странах и в разных местах внутри стран, с тем чтобы удостовериться в том, что полученные результаты в отношении эффективности вакцины применимы к разным группам населения.

После получения результатов всех этих клинических испытаний необходимо предпринять ряд шагов, включая проведение обзоров эффективности и безопасности для утверждения нормативных актов и политики в области общественного здравоохранения. Должностные лица в каждой стране внимательно изучают данные исследования и принимают решение о том, следует ли санкционировать использование вакцины. Вакцина должна быть признана безопасной и эффективной для широких слоев населения, прежде чем она будет утверждена и включена в национальную программу иммунизации. Уровень безопасности и эффективности вакцин чрезвычайно высок при том понимании, что они вводятся людям, которые здоровы и, в частности, не имеют той болезни, для защиты от которой они предназначаются.
После внедрения вакцины проводится постоянный мониторинг. Существуют системы для мониторинга безопасности и эффективности всех вакцин. Это позволяет ученым отслеживать воздействие вакцин и их безопасность, даже если они используются среди большого числа людей в течение длительного времени. Эти данные используются для корректировки политики в отношении использования вакцин в целях оптимизации их воздействия и для безопасного отслеживания воздействия вакцины во время ее использования.
Как только вакцина начинает применяться, необходимо проводить постоянный мониторинг для удостоверения в том, что она остается безопасной.

Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Терапевтические вакцины
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.

Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.

Среди различных микробных препаратов, применяемых для профилактики, лечения и диагностики инфекционных заболеваний большое место занимают вакцины - биопрепараты, предназначенные для создания активного искусственного иммунитета.
В качестве антигенов вакцины могут содержать убитые или живые микробные тела, либо извлеченные из них химическим путем полные антигены -глюцидо-липоидные полипептидные комплексы. В зависимости от количества антигенов различают моно-, ди-, три-, тетра- и поливакцины.
Для изготовления вакцин применяются такие штаммы микробов, которые удовлетворяют требованиям специальных инструкций по отбору, проверке и хранению культур, применяемых для изготовления вакцин. Изучение и апробация штаммов на предмет соответствия их требованиям инструкций производится Государственным контрольным институтом медицинских биологических препаратов, там же они хранятся в музее живых культур как эталонные, от них отвивают дубликаты и рассылают в сопровождении специального паспорта в институты, изготавливающие вакцины, для использования в производстве. В паспортах, сопровождающих такие штаммы, указываются основные их свойства - морфологические, культуральные, биохимические, антигенные.
Штаммы, полученные из контрольного института, используются в производстве вакцин только после проверки на местах. В производственных институтах проводится большая работа по изучению условий стабилизации свойств штаммов, предназначенных для изготовления вакцин. В настоящее время стабильность свойств культур обеспечивается хранением их в высушенном состоянии в условиях вакуума в запаянных ампулах. Бактериальные культуры, кроме того, можно хранить в пробирках на плотной питательной среде, оптимальной для данного вида микроба. Пробирки в этом случае запаивают, либо заливают пробки расплавленным воском или парафином, чтобы предохранить культуру от высыхания при длительном хранении. Штаммы, хранящиеся в лаборатории, регистрируются в специальных журналах, где записывают паспортные данные, а также результаты текущих проверок, регламентируемых инструкциями.
Требования инструкций к производственным штаммам разных видов и различных групп микроорганизмов направлены к одной цели - обеспечению малой реактогенности, полной безвредности и высокой эпидемиологической эффективности приготовленных из них вакцин. Методы определения этих свойств производственных штаммов в зависимости от того, к какому виду микробов они применяются, имеют специфические особенности, которые отражены в специальной части. В принципе иммуногенность их определяется путем выявления устойчивости животных, иммунизированных опытными вакцинами, приготовленными из этих штаммов, к заражению заведомо смертельными дозами соответствующих культур.
Вирулентность штаммов изучается путем заражения чувствительных животных, чаще всего мышей, и характеризуется заведомо смертельными, минимальными смертельными и 50 %-ными смертельными дозами культур испытуемых штаммов.
Для выявления токсичности животным вводится убитая нагреванием культура производственных штаммов.
Конкретные показатели иммуногенности, вирулентности и токсичности для разных видов микробов определяются инструкциями. Штаммы, обладающие меньшей иммуногенностью и вирулентностью или большей токсичностью, чем это установлено инструкцией, для производства вакцин не применяются.
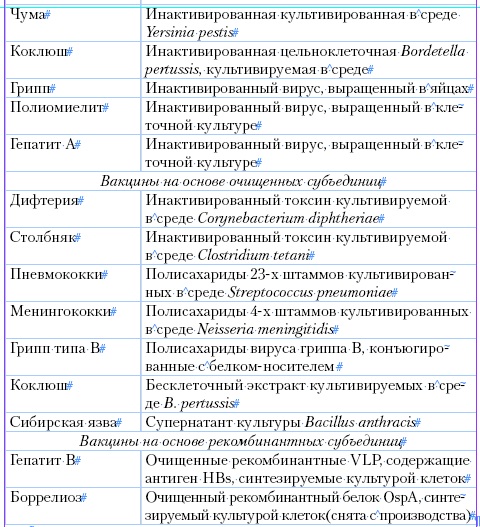
Таблица 1
Основные типы вакцин

Читайте также:

