Используя доступные информационные источники подготовьте сообщение о конкретных видах белков
Обновлено: 05.07.2024
Белки являются макроэлементами, образованными в основном из углерода, водорода, кислорода и азота. хотя некоторые также содержат серу и фосфор. Эти элементы, изучаемые биологией (и связанными с этим науками), объясняют большую часть функционирования нашего тела, как в отношении его движения, так и, например, в отношении нашего разума. Однако белки присутствуют во всех видах жизненных форм, а не только в нашем виде.
Растения синтезируют неорганические белки азота, но животные, неспособные выполнить этот процесс, вынуждены включать эти вещества в рацион. Белки образуются путем объединения нескольких аминокислот, связанных пептидными связями.
Поскольку эти биомолекулы очень важны для понимания того, на что похоже наше тело, это полезно знать некоторые из наиболее распространенных типов белков или относящиеся к нам, а также аминокислоты, которые образуются. В этой статье вы найдете краткое объяснение этих двух элементов, как аминокислот, так и белков. Начнем с первых.
Какие аминокислоты
Как мы уже видели, аминокислоты являются основой или сырьем белков , По сути, они являются сырьем, из которого состоит все наше тело: мышцы, волосы, кости, кожа и даже ткани мозга, которые производят наши мысли, эмоции и сознание.
Хотя в природе можно найти сотни аминокислот, только 20 используются в образовании белков. Они называются: белковые аминокислоты .
20 видов белковых аминокислот
Белковые аминокислоты, также называемые каноническими, сами по себе выполняют физиологические функции, как в случае глицина или глутамата, которые являются нейротрансмиттерами. Ниже вы можете найти 20 белковых нейротрансмиттеров:
1. Глутаминовая кислота
Эта аминокислота считается бензином мозга и одна из его основных функций - поглощать избыток аммиака в организме.
2. Аланина
Основная задача этой аминокислоты состоит в том, что вмешивается в метаболизм глюкозы а.
3. Аргинин
Присутствует в процессе детоксикации организма в цикле мочевины и в синтезе креатинина. Кроме того, он вмешивается в производство и высвобождение гормона роста.
4. Аспарагин
Он синтезируется из аспарагиновой кислоты, и вместе с глютамином устраняет избыток аммиака в организме и вмешивается в улучшение устойчивости к усталости.
5. Цистеин
Участвует в процессе удаления тяжелых металлов из организма и это имеет основополагающее значение для роста и здоровья волос.
6. Фенилаланин
Благодаря этой аминокислоте возможно регулирование эндорфинов, которые отвечают за чувство благополучия , Это уменьшает избыток аппетита и помогает успокоить боль.
7. Глицин
Помогает организму в создании мышечной массы , для правильного заживления, предотвращает инфекционные заболевания и участвует в правильном функционировании мозга.
8. Глютамин
Глютамин в изобилии содержится в мышцах. Эта аминокислота увеличивает функцию мозга и умственную деятельность и помочь решить проблемы импотенции. Кроме того, необходимо бороться с проблемами алкоголя.
9. Гистидин
Эта аминокислота является предшественником гистамина , Он в большом количестве содержится в гемоглобине, поэтому необходимо продуцирование как эритроцитов, так и лейкоцитов в крови, а также вмешательство в процесс роста, репарацию тканей и образование миелиновых оболочек.
10. Изолейцин
Эта аминокислота является частью генетического кода и необходим для нашей мышечной ткани и образование гемоглобина. Кроме того, это помогает регулировать уровень сахара в крови.
11. Лейцина
Как и предыдущая аминокислота, вмешивается в формирование и восстановление мышечной ткани и сотрудничает в исцелении кожи и костей. Кроме того Он действует как энергия в тренировках с большим усилием и помогает увеличить выработку гормона роста.
12. Лизин
Наряду с метионином, синтезирует аминокислоту карнитин и это важно при лечении герпеса.
13. Метионин
Важно предотвратить некоторые виды отеков , высокий уровень холестерина и выпадение волос.
14. Пролин
Он отвечает за синтез нескольких нейротрансмиттеров мозга связан с временной депрессией, а также участвует в синтезе коллагена.
15. Серин
Это аминокислота, которая участвует в обмене жиров и является предшественником фосфолипидов, которые питают нервную систему.
16. Таурин
Таурин укрепляет сердечную мышцу и предотвращает сердечные аритмии. Улучшает зрение и предотвращает дегенерацию желтого пятна.
17. Тирозин
Тирозин выделяется своей функцией нейротрансмиттера и может помочь снять беспокойство или депрессию.
18. Треонин
Необходим в процессе детоксикации и участвует в синтезе коллагена и эластина.
19. Триптофан
Триптофан является незаменимой аминокислотой, а это означает, что организм сам не может синтезировать ее и должен достигаться с помощью пищи. Он является предшественником нейротрансмиттера серотонина, связанного с состоянием психического состояния. Триптофан считается природным антидепрессантом, а также способствует сну. Это также очень здоровый компонент и легко найти в здоровой диете .
20. Валина
Как и некоторые из предыдущих аминокислот, Это важно для роста и восстановления мышечной ткани , Кроме того, это также вмешивается в регулирование аппетита.

Незаменимые и незаменимые аминокислоты
Аминокислоты можно классифицировать как незаменимые и незаменимые. Разница между ними заключается в том, что первый не может производить организм и, следовательно, должен поступать в организм с пищей. 9 незаменимых аминокислот :
- гистидин
- изолейцин
- лейцин
- лизин
- метионин
- фенилаланин
- треонин
- триптофан
- валин
Не все продукты с высоким содержанием белка содержат одинаковое количество аминокислот. Белком с самым высоким содержанием аминокислот является яйцо.
Классификация белков
Белки могут быть классифицированы по-разному , Ниже вы можете найти различные виды белка.
1. По происхождению
По происхождению одна из самых известных классификаций: животные белки и растительные белки .
1.1. Животные белки
Животные белки, как следует из названия, те, которые поступают от животных. Например, белки из яиц или свинины.
1.2. Растительные белки
Растительные белки - это те, которые поступают из овощей (бобовые, пшеничная мука, орехи и т. Д.). Например, соевые белки или арахис.
2. По своей функции
По своей функции в нашем организме , белки могут быть классифицированы на:
2.1. гормональный
Эти белки секретируются эндокринными железами. Обычно транспортируемые через кровь, гормоны действуют как химические посредники, которые передают информацию от одной клетки к другой.
2.2. Ферментативный или каталитический
Эти белки ускоряют метаболические процессы в клетках, включая функцию печени, пищеварение или превращение гликогена в глюкозу и т. Д.
2,3. структурный
Структурные белки, также известные как волокнистые белки, являются необходимыми компонентами для нашего организма. Они включают в себя коллаген, кератин и эластин. Коллаген содержится в соединительной, костной и хрящевой ткани, как и эластин. Кератин является структурной частью волос, ногтей, зубов и кожи.
2,4. оборонительный
Эти белки имеют иммунную функцию или функцию антител, сохраняя бактерии в страхе. Антитела образуются в лейкоцитах и атакуют бактерии, вирусы и другие опасные микроорганизмы.
2.5. хранение
Запасные белки хранят минеральные ионы, такие как калий или железо. Его функция важна, так как, например, хранение железа жизненно важно, чтобы избежать негативного воздействия этого вещества.
2.6. транспорт
Одной из функций белков является транспорт в нашем организме, потому что они транспортируют минералы в клетки. Например, гемоглобин транспортирует кислород из тканей в легкие.
2,7. приемники
Эти рецепторы обычно расположены вне клеток, чтобы контролировать вещества, которые входят в него. Например, ГАМКергические нейроны содержат различные белковые рецепторы в своих мембранах.
2,8. Термоусадочная
Они также известны как моторные белки. Эти белки регулируют силу и скорость сердечных или мышечных сокращений. Например, миозин.
3. По своей конформации
Конформация - это трехмерная ориентация, приобретенная характеристическими группами молекулы белка. в космосе, благодаря свободе, которую они должны повернуть.
3.1. Волокнистые белки
Они образованы полипептидными цепями, выровненными параллельно. Коллаген и кератин являются примерами. Они обладают высокой устойчивостью к порезам и нерастворимы в воде и солевых растворах. Это структурные белки.
3.2. Глобулярные белки
Полипептидные цепи, которые катятся на самих себе, что вызывает сферическую макроструктуру. Они обычно растворимы в воде и, как правило, являются транспортными белками
Катализаторы — это вещества, изменяющие скорость химической реакции или вызывающие её, но не входящие в состав продуктов реакции.
Вопрос 2. Что такое иммунитет?
Иммунитет — это способ защиты организма от действия различных веществ и организмов, вызывающих деструкцию его клеток и тканей, характеризующийся изменением функциональной активности преимущественно иммуноцитов с целью поддержания гомеостаза внутренней среды.
Вопрос 3. Какие белки вам известны? Каковы их функции?
Кератин, коллаген, эластин — строительная, структурная функция;
Гемоглобин — транспортная ф.;
Актин и миозин — сократительная, двигательная ф.;
Гормоны (инсулин, соматотропин и др.) — регуляторная ф.;
Иммуноглобулины, тромбин, фибриноген и др. — защитная ф.;
Пепсин, каталаза, трипсин — каталитическая ф.
Вопрос 4. Какие функции белков вам известны?
Белки выполняют самые разнообразные функции в клетках: определяют их структуру и форму, изменяют скорость протекания химических реакций, обеспечивают передачу химических сигналов, осуществляют разные виды клеточного движения, а также перенос веществ через мембраны и т. п.
Вопрос 5. Чем объясняется многообразие функций белков?
Многообразие функций белков объясняется разнообразием форм и состава самих белков.
Вопрос 6. Что представляют собой белки — ферменты? Приведите примеры таких белков.
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию.
Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры. Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение. Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Основные свойства ферментов:
специфичность: способность фермента действовать только на специфический субстрат, например, липазы — на жиры;
каталитическая эффективность: способность ферментативных белков ускорять биологические реакции в сотни и тысячи раз;
способность к регуляции: в каждой клетке выработка и активность ферментов определяется своеобразной цепью превращений, влияющей на способность этих белков вновь синтезироваться.
Примеры белков — ферментов: пепсин, каталаза, трипсин, амилаза, протеазы, липазы, глутаматдегидрогеназа, аланинаминотрансфераза (АЛТ), лейцинаминопептидаза (ЛАП), фруктозо — 1,6 — дисфосфат — альдолаза (ФДФ — А) и др.
Вопрос 7. Как реализуется белками защитная функция?
Защитная функция белков в организме заключается в предотвращении проникновения чужеродных веществ, которые могут нанести существенный вред организму. Если же это произошло, специализированные белки способны их обезвредить. Эти защитники называются антителами или иммуноглобулинами. Связывание их с белками возбудителей подавляет функциональную активность последних и останавливает развитие инфекции. Антитела обладают уникальным свойством: они способны отличать чужеродные белки от собственных белков организма.
Кроме того, в ответ на заражение вирусом клетка вырабатывает специальные белки — интерфероны, которые препятствуют размножению носителя инфекции.
Многие организмы используют для защиты или нападения специфические пептиды и белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. Часто эти вещества обладают ферментативной активностью (холерный токсин, коклюшный токсин) или же они могут нарушать структуру клеточных мембран (белки ядов змей и насекомых).
Вопрос 8. Что вам известно о гормонах? Есть ли среди них вещества белковой природы? Приведите примеры.
Гормоны — мельчайшие элементы, вырабатываемые нашим организмом. Это органические биологически активные вещества, которые вырабатываются собственными железами внутренней секреции организма. Поступая в кровь, связываясь с рецепторами определенных клеток, они регулируют физиологические процессы, обмен веществ.
Белкам — гормонам присуща регуляторная функция. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует содержание сахара в крови.
Примеры гормонов белковой природы (белки и полипептиды) — гормоны гипоталамуса, гормоны гипофиза (соматотропин, кортикотропин, пролактин, вазопрессин и окситоцин, гонадотропный гормон, полипептидные низкомолекулярные гормоны, адренокортикотропный гормон, кортикотропин (АКТГ)); щитовидной железы (тироксин, кальцитонин); гормон паращитовидных желез; гормоны поджелудочной железы (глюкагон и инсулин); гормон почек (эритропоэтин) и др.
Виды белков их функции в организме.
Структурные белки. Влияют на структуру самой клетки, ее форму. Всеми своими свойствами, качествами и даже функциями каждый вид тканей обязан именно структурным белкам. Кроме того, полипептиды, выполняющие эту роль, образуют волосы, ногти, раковины моллюсков, перья птиц. Они же являются определенной арматурой в теле клетки. Хрящи состоят также из этих видов белков. Примеры: тубулин, кератин, актин и другие.
Транспортные белки. Транспортные белки обеспечивают транспортировку питательных и других полезных веществ по всему организму. Например, клеточные мембраны пропускают внутрь клетки не все подряд. И даже некоторые полезные вещества туда не могут проникнуть. Транспортные белки имеют способность проникать сквозь мембраны клеток и проносить с собой эти самые вещества. Гемоглобин — переносчик кислорода и других веществ.
Рецепторные белки. Рецепторные белки наряду с транспортными белками обеспечивают проникновение полезных веществ внутрь клеток. Располагаются рецепторные белки на поверхности мембран, то есть снаружи клеток. Они связываются с поступающими к ним питательными веществами и помогают им проникать внутрь. Важность этого вида белка переоценить невозможно, так как без них внутриутробное развитие может происходить совершенно неправильно или даже полностью прекратиться.
Сократительные белки. Человек двигается благодаря сокращению мышечных тканей. Эту способность им обеспечивают сократительные белки. Как отдельные клетки, так и организм в целом приходит в движение при помощи этого вида белков. Например, миозин, актин и др.
Регуляторные белки. Организм человека ведет свою жизнедеятельность благодаря множеству различных биохимических процессов внутри него. Все эти процессы обеспечивают и регулируют регуляторные белки. Одним из них является инсулин, также половые гормоны.
Защитные белки. Находясь в окружающей среде, организм постоянно контактирует с самыми разными веществами, микроорганизмами и так далее, попадает в самые разные условия. Сохранность здоровья в таких случаях обеспечивают иммунные клетки, которые и являются защитными белками. Также к последним относят прокоагулянты, которые обеспечивают нормальную свертываемость крови. Гаммаглобулин, иммуноглобулин — антитела (защита от инфекций).
Ферменты. Еще один вид белков — ферменты. Они отвечают за правильное протекание биохимических реакций внутри клеток во всем организме. За контроль метаболизма отвечают белки — протеазы.
Вопрос 10. Почему белки называют молекулами жизни?
Более 4 млрд. лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка.
Белки — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов. С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды, разумеется!). Белки считаются основным материалом для "строительства" клеток. Учёные выяснили, что у большинства организмов белки составляют более половины их сухой массы. И разнообразие видов белков очень велико — в одной клетке такого маленького организма, как бактерия Escherichia соli насчитывается около 3 тыс. различных белков.
Вопрос 11. Используя дополнительные источники информации, найдите сведения о функциях белков ферментов различных классов. Результат оформите в виде таблицы.
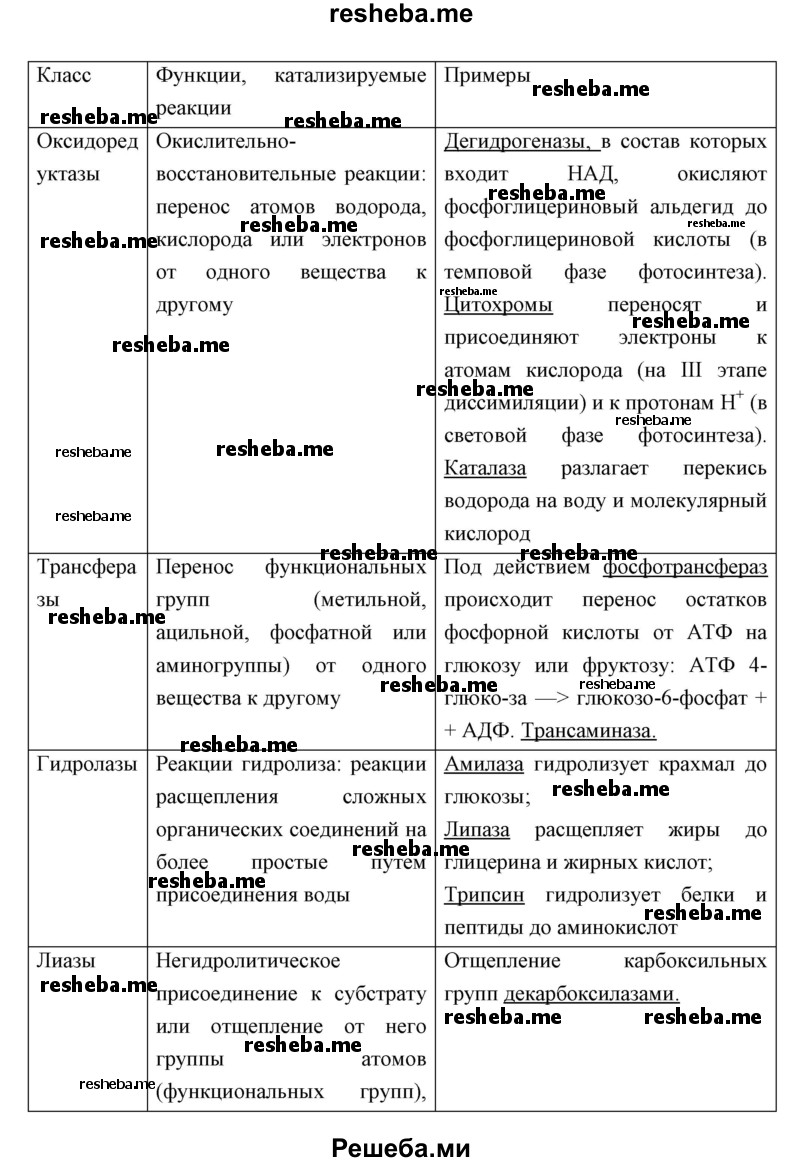
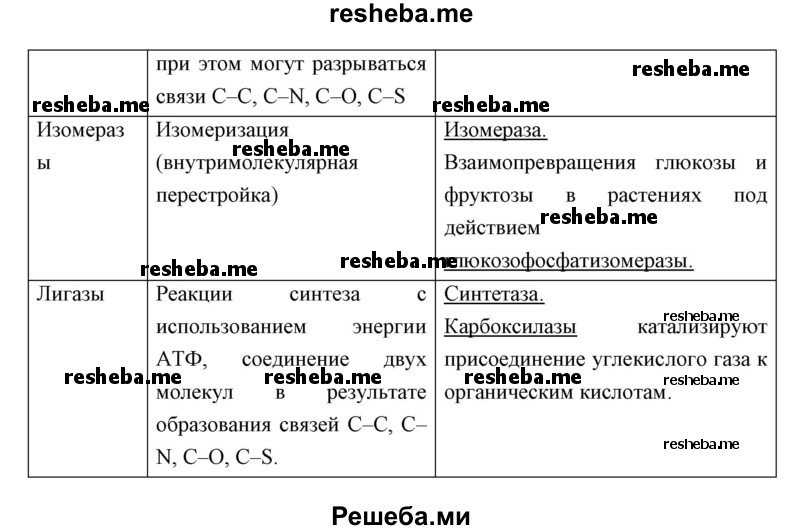
Вопрос 12. Найдите в приведённом тексте ошибки. Укажите номера предложений, в которых сделаны ошибки. Исправьте их.
1) Большое значение в строении и жизнедеятельности организмов имеют белки. 2) Это биополимеры, мономерами которых являются азотистые основания. 3) Белки входят в состав плазматической мембраны. 4) Все белки выполняют в клетке ферментативную функцию. 5) Молекулы белка несут наследственную информацию о признаках организма.6) Молекулы белка входят в состав рибосом.
Ответ. Ошибки сделаны в предложениях под номерами: 2, 4, 5.
2)Это биополимеры, мономерами которых являются аминокислоты, соединенные между собой пептидной связью.
4)Не все белки выполняют в клетке ферментативную функцию. ИЛИ…. Все белки выполняют в клетке различные функции.
5) Молекулы белка не несут наследственную информацию о признаках организма. ИЛИ…Наследственная информация о признаках организма зашифрована в нуклеиновых кислотах.
Вопрос 13. Почему в запасных тканях семян растений (эндосперме, семядолях), даже очень богатых углеводами или жирами, обязательно присутствуют белки?
Семена у растений наиболее надежно обеспечивают их размножение и распространение. В семени содержится необходимый для прорастания зародыша запас питательных веществ. Белки при необходимости используются ими для получения аминокислот и энергии. Белки являются основным строительным материалом клеток. Также белки в сухом состоянии денатурируются значительно медленнее, чем белки оводненные, инактивирование ферментов в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажненном состоянии.
Цель: показать наличие белков в биологических объектах.
Оборудование: штатив с пробирками, водяная баня, кристаллизатор со льдом, мерный стакан на 50 мл.
Реактивы: куриное яйцо, концентрированная азотная кислота, раствор аммиака, гидроксид натрия, раствор медного купороса, вода.
Ход работы:
1. Приготовьте раствор белка.
2. Ксантопротеиновая реакция. В пробирку налейте 2—3 мл раствора белка и добавьте несколько капель азотной кислоты. Соблюдайте технику безопасности при работе с химическими реагентами! Нагрейте содержимое пробирки, при этом образуется жёлтый осадок. Охладите смесь и добавьте раствор аммиака до перехода жёлтой окраски в оранжевую.
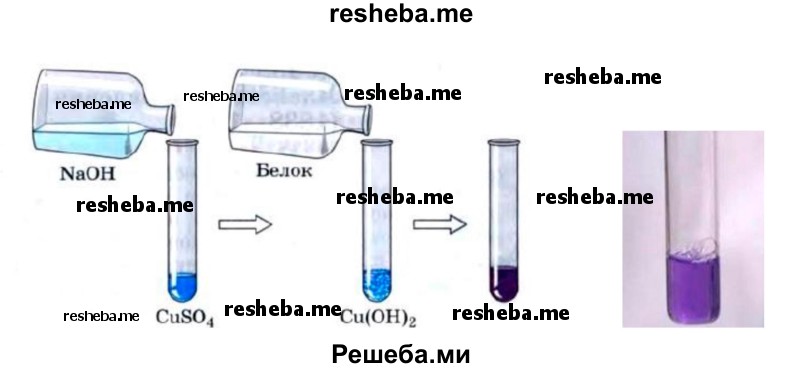
3. Биуретовая реакция. В пробирку налейте 2—3 мл раствора белка и 2—3 мл раствора гидроксида натрия, затем 1—2 мл раствора медного купороса. Появляется фиолетовое окрашивание.
4. Запишите результаты эксперимента и сделайте вывод.
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот — триптофана, фенилаланина, тирозина, содержащих в своем составе ароматическое ядро. Ряд белков при добавлении к ним концентрированной азотной кислоты при нагревании дают желтое окрашивание, которое может переходить в оранжевое в щелочной среде.
Реакция вызвана нитрованием бензольного ядра указанных циклических аминокислот и образованием нитросоединений желтого цвета.
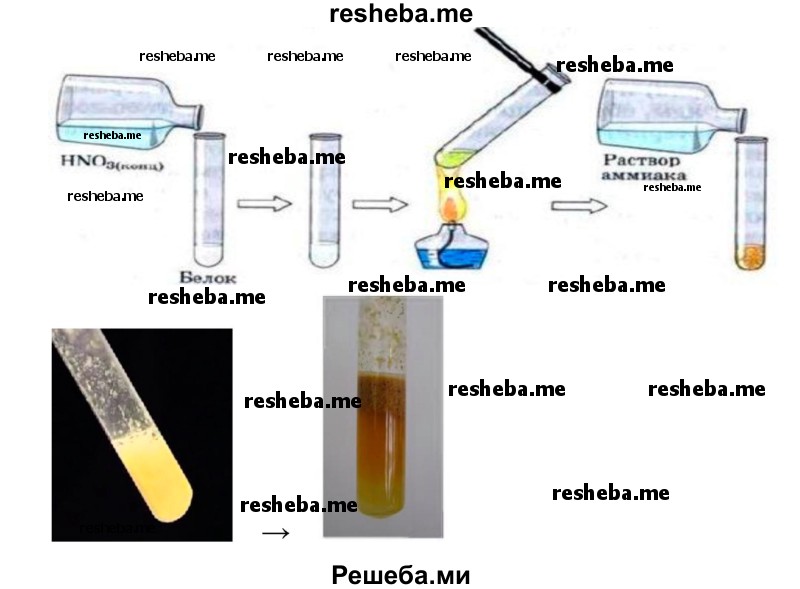
Взаимодействие с концентрированной азотной кислотой — белый осадок, нагревание — появлением желтой окраски, добавление аммиака — появление оранжевой окраски.
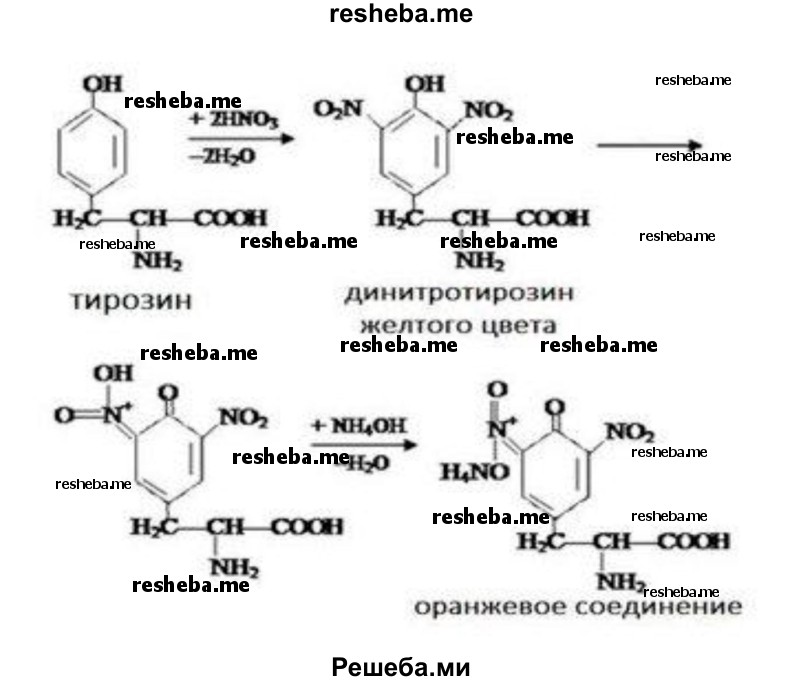
Ксантопротеиновую реакцию дают почти все белки. Ксантопротеиновая реакция обуславливает появление желтого окрашивания при попадании концентрированной азотной кислоты на кожу, ногти. Эту реакцию могут давать и более простые ароматические соединения (например, фенолы). Исключение составляют клупеин и сальмин (из группы протаминов) и желатина, в молекуле которых почти полностью отсутствуют ароматические аминокислоты.
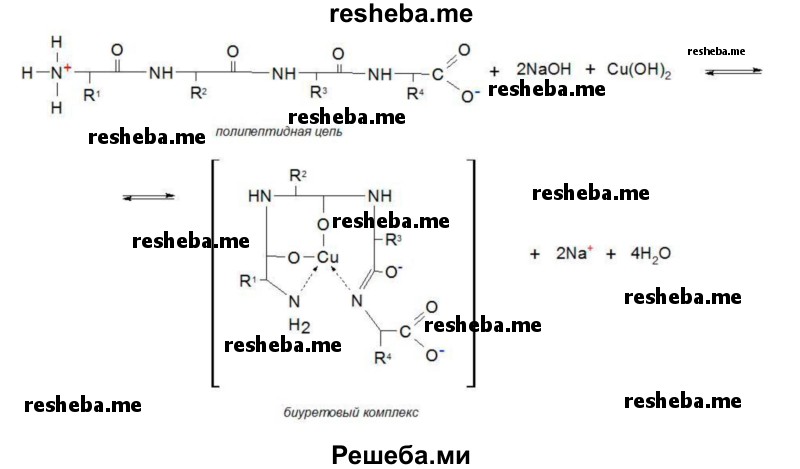
Биуретовая реакция является универсальной на пептидную связь в белках. Вещества, имеющие в своем составе не менее 2 — х пептидных связей дают эту реакцию.
Реакция состоит в том, что в щелочной среде в присутствии сернокислой меди белки и полипептиды дают сине — фиолетовое или красно — фиолетовое окрашивание в зависимости от длины пептида вследствие образования комплексных соединений меди с пептидной группой. Продукты гидролиза белков (пептоны) могут давать розовое, красное окрашивание.
Щелочная среда приводит к появлению отрицательного заряда вследствие диссоциации ОН — группы, благодаря этому кислород взаимодействует с медью с образованием солеобразной связи, а медь в свою очередь с атомами азота связана через дополнительно координационные связи за счет использования их неподеленных электронных пар. Это ведет к образованию стабильного комплекса.
Вывод: Ксантопротеиновая и биуретовая реакции — качественные реакции на белки. С помощью этих реакций можно доказать наличие белков в биологических объектах.
По теории Опарина-Холдейна жизнь на нашей планете зародилась из коацерватной капельки. Она же представляла собой молекулу белка. То есть следует вывод, что именно эти химические соединения - основа всего живого, что существует сегодня. Но что же собой представляют белковые структуры? Какую роль сегодня они играют в организме и жизни людей? Какие виды белков существуют? Попробуем разобраться.
Белки: общее понятие
С точки зрения химического строения, молекула рассматриваемого вещества представляет собой последовательность аминокислот, соединенных между собой пептидными связями.
Каждая аминокислота имеет две функциональные группы:
Именно между ними и происходит формирование связи в разных молекулах. Таким образом, пептидная связь имеет вид -СО-NH. Молекула белка может содержать сотни и тысячи таких группировок, это будет зависеть от конкретного вещества. Виды белков очень разнообразны. Среди них есть и те, которые содержат незаменимые для организма аминокислоты, а значит должны поступать в организм с пищевыми продуктами. Существуют такие разновидности, которые выполняют важные функции в мембране клетки и ее цитоплазме. Также выделяют катализаторы биологической природы - ферменты, которые тоже являются белковыми молекулами. Они широко используются и в быту человека, а не только участвуют в биохимических процессах живых существ.
Молекулярная масса рассматриваемых соединений может колебаться от нескольких десятков до миллионов. Ведь количество мономерных звеньев в большой полипептидной цепи неограниченно и зависит от типа конкретного вещества. Белок в чистом виде, в его нативной конформации, можно увидеть при рассмотрении куриного яйца в сыром виде. Светло-желтая, прозрачная густая коллоидная масса, внутри которой располагается желток - это и есть искомое вещество. То же самое сказать об обезжиренном твороге, Данный продукт также является практически чистым белком в его натуральном виде.
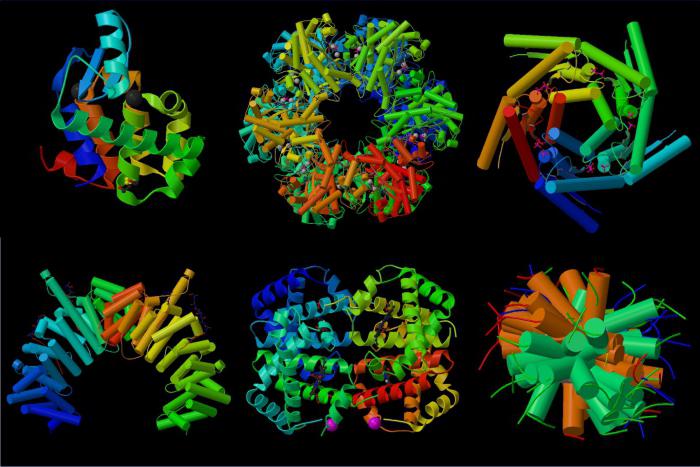
Однако не все рассматриваемые соединения имеют одинаковое пространственное строение. Всего выделяют четыре организации молекулы. Виды структур белка определяют его свойства и говорят о сложности строения. Также известно, что более пространственно запутанные молекулы подвергаются тщательной переработке в организме человека и животных.
Виды структур белка
Всего их выделяют четыре. Рассмотрим, что собой представляет каждая из них.
- Первичная. Представляет собой обычную линейную последовательность аминокислот, соединенных пептидными связями. Никаких пространственных закручиваний, спирализации нет. Количество входящих в полипептид звеньев может доходить до нескольких тысяч. Виды белков с подобной структурой - глицилаланин, инсулин, гистоны, эластин и другие.
- Вторичная. Представляет собой две полипептидные цепи, которые скручиваются в виде спирали и ориентируются по направлению друг к другу образованными витками. При этом между ними возникают водородные связи, удерживающие их вместе. Так формируется единая белковая молекула. Виды белков такого типа следующие: лизоцим, пепсин и другие.
- Третичная конформация. Представляет собой плотно упакованную и компактно собранную в клубок вторичную структуру. Здесь появляются другие типы взаимодействия, помимо водородных связей - это и ван-дер-ваальсово взаимодействие и силы электростатического притяжения, гидрофильно-гидрофобный контакт. Примеры структур - альбумин, фиброин, белок шелка и прочие.
- Четвертичная. Самая сложная структура, представляющая собой несколько полипептидных цепей, скрученных в спираль, свернутых в клубок и объединенных все вместе в глобулу. Такие примеры, как инсулин, ферритин, гемоглобин, коллаген, иллюстрируют собой как раз такую конформацию белков.
Если рассматривать все приведенные структуры молекул детально с химической точки зрения, то анализ займет много времени. Ведь на самом деле чем выше конфигурация, тем сложнее и запутаннее ее строение, тем больше типов взаимодействий наблюдается в молекуле.

Денатурация белковых молекул
Одним из самых важных химических свойств полипептидов является их способность разрушаться под влиянием определенных условий или химических агентов. Так, например, широко распространены разные виды денатурации белков. Что это за процесс? Он заключается в разрушении нативной структуры белка. То есть если изначально молекула имела третичную структуру, то после действия специальными агентами она разрушится. Однако при этом последовательность аминокислотных остатков остается в молекуле неизменной. Денатурированные белки быстро теряют свои физические и химические свойства.
Какие реагенты способны привести к процессу разрушения конформации? Таких несколько.
- Температура. При нагревании происходит постепенное разрушение четвертичной, третичной, вторичной структуры молекулы. Зрительно это можно наблюдать, например, при жарке обычного куриного яйца. Образующийся "белок" - это первичная структура полипептида альбумина, который был в сыром продукте.
- Радиация.
- Действие сильными химическими агентами: кислотами, щелочами, солями тяжелых металлов, растворителями (например, спиртами, эфирами, бензолом и прочими).
Данный процесс иногда еще называют плавлением молекулы. Виды денатурации белков зависят от агента, при действии которого она наступила. При этом в некоторых случаях имеет место процесс, обратный рассмотренному. Это ренатурация. Не все белки способны восстанавливать обратно свою структуру, однако значительная их часть может это делать. Так, химики из Австралии и Америки осуществили ренатурацию вареного куриного яйца при помощи некоторых реагентов и способа центрифугирования.
Этот процесс имеет значение для живых организмов при синтезе полипептидных цепочек рибосомами и рРНК в клетках.

Гидролиз белковой молекулы
Наравне с денатурацией, для белков характерно еще одно химическое свойство - гидролиз. Это также разрушение нативной конформации, но не до первичной структуры, а полностью до отдельных аминокислот. Важная часть пищеварения - гидролиз белка. Виды гидролиза полипептидов следующие.
- Химический. Основан на действии кислот или щелочей.
- Биологический или ферментативный.
Однако суть процесса остается неизменной и не зависит от того, какие виды гидролиза белков имеют место быть. В результате образуются аминокислоты, которые транспортируются по всем клеткам, органам и тканям. Дальнейшее их преобразование заключается в участии синтеза новых полипептидов, уже тех, что необходимы конкретному организму.
В промышленности процесс гидролиза белковых молекул используют как раз для получения нужных аминокислот.
Функции белков в организме
Различные виды белков, углеводов, жиров являются жизненно необходимыми компонентами для нормальной жизнедеятельности любой клетки. А значит и всего организма в целом. Поэтому во многом их роль объясняется высокой степенью значимости и повсеместной распространенности внутри живых существ. Можно выделить несколько основных функций полипептидных молекул.
Очевидно, что функции белков в организме человека и других живых существ очень многочисленны и немаловажны. Это еще раз подтверждает, что без рассматриваемых нами соединений невозможна жизнь на нашей планете.
Защитная функция белков
Полипептиды могут защищать от разных воздействий: химических, физических, биологических. Например, если организму угрожает опасность в виде вируса или бактерии, имеющих чужеродную природу, то иммуноглобулины (антитела) вступают с ними "в бой", выполняя защитную роль.
Если говорить о физических воздействиях, то здесь большую роль играют, например, фибрин и фибриноген, которые участвуют в свертывании крови.
Белки пищевые
Виды пищевого белка следующие:
- полноценные - те, что содержат все необходимые для организма аминокислоты;
- неполноценные - те, в которых находится неполный аминокислотный состав.
Однако для организма человека важны и те и другие. Особенно первая группа. Каждый человек, особенно в периоды интенсивного развития (детский и юношеский возраст) и полового созревания должен поддерживать постоянный уровень протеинов в себе. Ведь мы уже рассмотрели функции, которые выполняют эти удивительные молекулы, и знаем, что практически ни один процесс, ни одна биохимическая реакция внутри нас не обходится без участия полипептидов.
Именно поэтому необходимо каждый день потреблять суточную норму протеинов, которые содержатся в следующих продуктах:
- яйцо;
- молоко;
- творог;
- мясо и рыба;
- бобы;
- соя;
- фасоль;
- арахис;
- пшеница;
- овес;
- чечевица и прочие.
Если потреблять в день 0,6 г полипептида на один кг веса, то у человека никогда не будет недостатка в этих соединениях. Если же длительное время организм недополучает необходимых белков, то наступает заболевание, имеющее название аминокислотного голодания. Это приводит к сильному нарушению обмена веществ и, как следствие, многим другим недугам.
Белки в клетке
Внутри самой маленькой структурной единицы всего живого - клетки - также находятся белки. Причем выполняют они там практически все вышеперечисленные свои функции. В первую очередь формируют цитоскелет клетки, состоящий из микротрубочек, микрофиламентов. Он служит для поддержания формы, а также для транспорта внутри между органоидами. По белковым молекулам, как по каналам или рельсам, движутся различные ионы, соединения.
Немаловажна роль белков, погруженных в мембрану и находящихся на ее поверхности. Здесь они и рецепторные, и сигнальные функции выполняют, принимают участие в строительстве самой мембраны. Стоят на страже, а значит играют защитную роль. Какие виды белков в клетке можно отнести к этой группе? Примеров множество, приведем несколько.
- Актин и миозин.
- Эластин.
- Кератин.
- Коллаген.
- Тубулин.
- Гемоглобин.
- Инсулин.
- Транскобаламин.
- Трансферрин.
- Альбумин.
Всего насчитывается несколько сотен различных видов протеинов, которые постоянно передвигаются внутри каждой клетки.
Виды белков в организме
Их, конечно же, огромное разнообразие. Если же попытаться как-то разделить все существующие протеины на группы, то может получиться примерно такая классификация.
-
Глобулярные белки. Это такие, которые представлены третичной структурой, то есть плотно упакованной глобулой. Примеры таких структур следующие: иммуноглобулины, значительная часть ферментов, многие гормоны. Представляют собой строго упорядоченные нити, имеющие правильную пространственную симметрию. К данной группе относятся протеины с первичной и вторичной структурой. Например, кератин, коллаген, тропомиозин, фибриноген.
Вообще, можно взять за основу множество признаков для классификации белков, находящихся в организме. Единой пока не существует.
Ферменты
Биологические катализаторы белковой природы, которые значительно ускоряют все происходящие биохимические процессы. Нормальный обмен веществ просто невозможен без этих соединений. Все процессы синтеза и распада, сборка молекул и их репликация, трансляция и транскрипция и прочие осуществляются под воздействием специфического вида фермента. Примерами этих молекул могут служить:
- оксидоредуктазы;
- трансферазы;
- каталазы;
- гидролазы;
- изомеразы;
- лиазы и прочие.
Сегодня ферменты используются и в быту. Так, при производстве стиральных порошков часто используют так называемые энзимы - это и есть биологические катализаторы. Они улучшают качество стирки при соблюдении указанного температурного режима. Легко связываются с частицами грязи и выводят их с поверхности тканей.
Однако из-за белковой природы энзимы не переносят слишком горячую воду или соседство с щелочными или кислотными препаратами. Ведь в этом случае произойдет процесс денатурации.
Вопрос 1. Чем объясняется многообразие функций белков?
Уникальные свойства белков заложены в колоссальном разнообразии пространственного строения их молекул. Это разнообразие белков определяется огромным числом возможных сочетаний аминокислотных остатков в длинных, состоящих, как правило, из нескольких сотен остатков, полипептидных цепях белков. Как известно, в состав белков может входить 20 видов аминокислот. Белки образуют различные соединения с различными веществами. Кроме того, белки могут иметь пространственную структуру молекулы. Установлено, что белки могут иметь различные размеры и форму. Многие белки содержат в своём составе такие металлы, как железо, цинк, медь и др. Все это способствует тому, что белки выполняют множество функций.
Вопрос 3. Какую роль играют белки-гормоны?
Белки-гормоны контролирует физиологическую активность тканей и органов и всех жизненных процессов всего организма. Так, в организме человека соматотропин участвует в регуляции роста тела, инсулин поддерживает на постоянном уровне содержание глюкозы в крови.
Вопрос 4. Какую функцию выполняют белки-ферменты?
Белки-ферменты играют роль катализаторов, т. е. ускоряют химические реакции в сотни миллионов раз. Ферменты обладают строгой специфичностью по отношению к веществу, вступающему в реакцию. Каждая реакция катализируется своим ферментом.
Вопрос 5. Почему белки редко используются в качестве источника энергии?
Мономеры белков - аминокислоты — ценное сырье для построения новых белковых молекул. Поэтому полное расщепление полипептидов до неорганических веществ происходит редко. Следовательно, энергетическая функция, заключающаяся в выделении энергии при полном расщеплении, выполняется белками только в исключительных случаях, когда организм испытывает недостаток жиров или углеводов.
Среди органических веществ клетки самыми разнообразными по свойствам и выполняемым функциям являются белки , или протеины . В белках, в отличии от углеводов и липидов, кроме углерода, кислорода и водорода содержится азот, а также могут присутствовать атомы серы, фосфора и железа.
Белки — это биополимеры, мономерами в которых служат аминокислоты . В образовании всего разнообразия белков участвует \(20\) α -аминокислот. Молекулы аминокислот имеют две функциональные группы: карбоксильную (кислотную) и аминогруппу (основную).

Аминогруппа и карбоксильная группа способны взаимодействовать между собой с отщеплением воды и образованием пептидной связи CO − NH . Пептидными связями молекулы аминокислот соединяются друг с другом в длинные цепи. Число остатков аминокислот в цепи может составлять несколько сотен и даже тысяч. Такие большие молекулы называют макромолекулами.
Порядок соединения аминокислот в макромолекуле белка называют первичной структурой. Для каждого типа белка эта структура уникальна. Она определяет структуры высших уровней, свойства белка и его функции.
Полипептидная цепь сворачивается в спираль за счёт образования водородных связей между группировками атомов − NH и − CO , расположенными на разных участках макромолекулы. Эту спираль называют вторичной структурой белка.
Третичная структура белка возникает при взаимодействии радикалов аминокислот, а также за счёт дисульфидных мостиков, водородных и ионных связей. Молекула белка принимает форму глобулы (шарика).
У некоторых белков формируется четвертичная структура. Она представляет собой комплекс нескольких макромолекул, имеющих третичную структуру. Четвертичную структуру удерживают непрочные ионные и водородные связи, а также гидрофобные взаимодействия.

Белки могут соединяться с углеводами, жирами и нуклеиновыми кислотами с образованием комплексных соединений: гликопротеинов, липопротеинов, нуклеопротеинов.
Под действием внешних факторов: облучения, нагревания, некоторых химических веществ и др. — происходит нарушение пространственной структуры белковых молекул. Этот процесс называется денатурацией.
Сначала происходит разрушение четвертичной структуры, потом третичной и вторичной. Первичная структура при денатурации сохраняется, но белок утрачивает свои свойства и функции.

Разрушение первичной структуры необратимо. Оно происходит при гидролизе белка — макромолекулы распадаются на отдельные аминокислоты. Такой процесс идёт в органах пищеварения животных и в лизосомах клеток под действием гидролитических ферментов.
1. Важнейшей функцией белков является каталитическая, или ферментативная. Белки-ферменты участвуют во всех биохимических реакциях, протекающих в клетке, и повышают скорость этих реакций во много раз. Для каждой реакции существует особый фермент.
2. Белки выполняют структурную (строительную) функцию. Они входят в состав плазматических мембран, образуют соединительные ткани (эластин и коллаген), волосы и ногти (кератин).

3. Сигнальную функцию также осуществляют белки, встроенные в мембрану. Под действием внешних факторов эти белки изменяют третичную структуру, что отражается на функционировании клетки.
4. Транспортная функция белков проявляется в переносе ионов через клеточные мембраны, транспорте гемоглобином крови кислорода и углекислого газа, альбуминами плазмы — жирных кислот и т. д.
5. Двигательную функцию обеспечивают белки актин и миозин, способные сокращаться и растягиваться. Они приводят в движение реснички и жгутики одноклеточных организмов, сокращают мышцы у животных.

6. Защитная функция обеспечивается антителами иммунной системы организма, белками системы свёртывании крови (фибриногеном, протромбином и др.).
7. Регуляторную функцию выполняют белки-гормоны (инсулин, тиреотропин, соматотропин, глюкагон и др.).
8. Энергетическую функцию белки выполняют после израсходования запасов углеводов и жиров. При полном расщеплении \(1\) г белка до конечных продуктов выделяется \(17,6\) кДж энергии.
Читайте также:

