Химический элемент рутений сообщение
Обновлено: 30.06.2024
Рутений - наиболее легкий и наименее "благородный" из всех металлов платиновой группы. Является едва ли не самым "многовалентным" элементом (известно девять валентных состояний). Несмотря на более чем полувековую историю изучения, он и сегодня перед современными химиками ставит немало вопросов и проблем. Так что же представляет собой рутений как химический элемент? Для начала - небольшой экскурс в историю.
Загадочная и богатая
Название и история открытия рутения неразрывно связаны с Россией. В самом начале XΙX века мировую общественность взволновало и обеспокоило известие о том, что в Российской империи обнаружены богатейшие залежи платины. Ходили слухи, что на Урале добычу этого драгоценного металла можно было вести обыкновенной лопатой. Факт открытия богатых месторождений был вскоре подтвержден тем, что министр финансов России Е. Ф. Канкрин направил на Петербургский Монетный двор высочайший указ о чеканке монет из платины. В последующие годы было запущено в оборот около полутора миллионов монет (3,6 и 12 руб.) для производства которых затрачено 20 тонн драгоценного металла.

"Открытие" Озанна
Изучением состава уральской драгоценной руды занялся профессор Дерптско-Юрьевского (ныне Тартусского) университета Готфрид Озанн. Он пришел к выводу, что платине сопутствуют три неизвестных металла - полуран, полином и рутений - названия которым были даны самим Озанном. Кстати, третий он назвал в честь России (от латинского Ruthenia).
Спустя два десятилетия работами Озанна заинтересовался профессор химии Карл Карлович Клаусс (Казанский университет). Он добился разрешения министра финансов получить в лаборатории Монетного двора несколько фунтов остатков производства монет для проведения повторных исследований.
Казанский химический элемент рутений
Русский академик А. Е. Арбузов отмечал в своих трудах, что для открытия нового элемента в те времена химику требовались чрезвычайное трудолюбие и настойчивость, наблюдательность и проницательность, а самое главное - тонкое экспериментальное чутье. Все вышеперечисленные качества в самой высокой степени были присущи молодому Карлу Клауссу.
Исследования ученого имели и практическое значение - дополнительное извлечение чистой платины из остатков руды. Разработав собственный план эксперимента, Клаусс сплавил рудный материал с селитрой и извлек растворимые элементы: осмий, иридий, палладий. Нерастворимую часть подверг воздействию смеси концентрированных кислот ("царской водки") и перегонке. В осадке гидроокиси железа он обнаружил наличие неизвестного металла и выделил его сначала в виде сульфида, а затем - и в чистом (около 6 граммов). Профессор сохранил за элементом название, предложенное Озанном, - рутений.
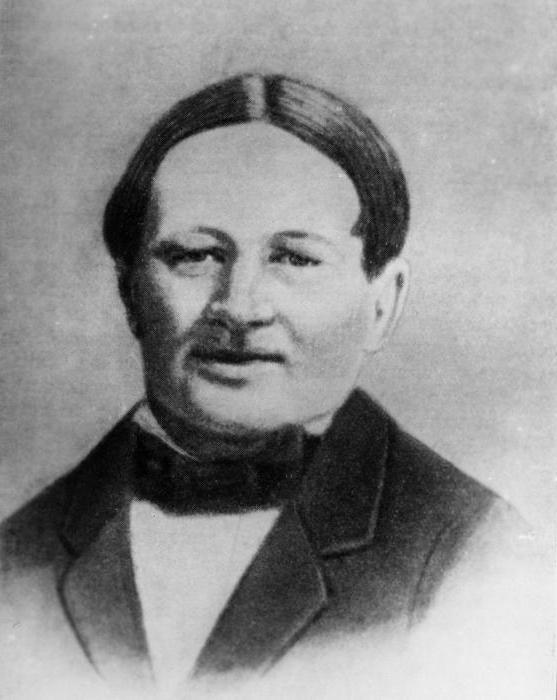
Открыть и доказать
Но как оказалось, история открытия химического элемента рутения только начиналась. После опубликования в 1844 году результатов исследования на Клаусса обрушился град критики. Выводы неизвестного казанского ученого были скептически восприняты крупнейшими химиками мира. Даже отправка образца нового элемента Берцелиусу не спасла ситуацию. По мнению шведского мэтра, рутений Клаусса являлся лишь "пробой нечистого иридия".
Только выдающиеся качества Карла Карловича как химика-аналитика и экспериментатора и серия дополнительных исследований позволили доказать ученому свою правоту. В 1846 году открытие получило официальное признание и подтверждение. За проведенную работу Клаусс был удостоен Демидовской премии Российской академии наук в размере 10 тыс. рублей. Благодаря таланту и настойчивости казанского профессора ряды платиноидов пополнил рутений - первый элемент, открытый в России (и на сегодняшний день, к сожалению отечественной химической школы, единственный).
Дальнейшие исследования
Основной проблемой изучения химических и физических свойств рутения является крайне ограниченное содержание этого металла в земной коре. Например, в отходах платинового производства (рабочем материале Клаусса) его содержание - около 1 %. Большинство ученых-химиков признают рутений крайне неблагоприятным веществом для изучения. Обилие тупиковых ситуаций часто заставляет исследователей сворачивать или приостанавливать свои работы.
Всю жизнь посвятил изучению свойств "неудобного" металла и его соединений советский ученый С. М. Старостин. Главным результатом деятельности химика являются выводы о свойствах нитрозокомплексов рутения и связанных с ними трудностях отделения чистого металла от сопутствующих урана и плутония. Что же представляет собой рутений, как химический элемент?

Физические свойства
Рутений - металл, цвет которого, в зависимости от способа получения, находится в диапазоне от серо-голубоватого до серебристо-белого. Некоторые физические характеристики химического элемента рутения позволяют считать его уникальным веществом. Наряду с высокой хрупкостью (кристаллы даже вручную легко растираются в порошок), рутений обладает чрезвычайной твердостью - 6,5 по десятибалльной минералогической шкале твердости (шкала Мооса). Едва ли не самый легкий из металлов платиновой группы. Плотность - 12,45г/см 3 . Очень тугоплавок - температура перехода в жидкое состояние - 2334 °С. При плавлении в электрической дуге наблюдается одновременное испарение металла. При высокотемпературном прокаливании на открытом воздухе элемент "улетучивается" в виде четырехокиси.
Рутений причисляют к группе сверхпроводников. Нулевое сопротивление металл демонстрирует при охлаждении до 0,47 К. Это свойство имеет огромное значение с научной и практической точек зрения. Как платиноид рутений - очень интересный драгоценный металл.
Элемент Ru
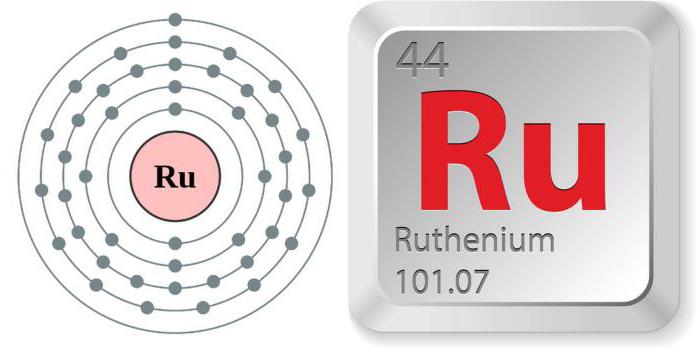
Свойства "казанского" металла во многом типичны для представителей VΙΙΙ (платиновой) группы. Рутений - химический элемент периодической таблицы с атомным номером 44, отличающийся высокой инертностью. Имеет 7 стабильных природных и 20 искусственных изотопов с массовыми числами от 92 до 113.
При нормальной температуре не подвержен окислению и коррозии, воздействию кислот и щелочей. При нагреве свыше 400 °С вступает в реакцию с хлором, при 930 °С - с кислородом. С некоторыми металлами химический элемент рутений образует устойчивые сплавы, называемые интерметаллидами.
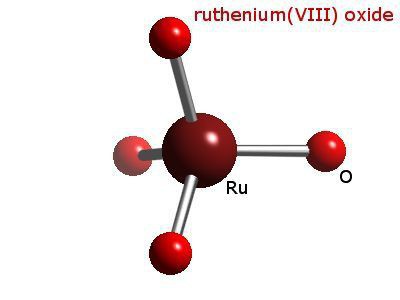
В многочисленных соединениях проявляет валентность от нуля до восьми. К наиболее важным относят двуокись и четырехокись рутения, сульфид RuS2 и фторид RuF5.
В чистом металлическом виде обладает свойствами катализатора с высокой избирательной способностью, что позволяет его использовать для синтеза самых различных органических и неорганических веществ. Служит лучшим сорбентом для водорода.
Распространение в природе
Химический элемент рутений характеризуется чрезвычайной редкостью и рассеянностью в природе. В естественной среде он образует единственный известный минерал - лаурит. Это твердое вещество в виде небольших октаэдров железно-черного цвета. Самое богатое и известное месторождение находится на платиновых россыпях острова Борнео (Калимантан). В России ведутся разработки на Среднем и Южном Урале, на Кольском полуострове, в Красноярском и Хабаровском краях.
Во всех остальных природных соединениях количество рутения не превышает 0,1 %. Следы металла обнаружены в некоторых медно-никелевых рудах и кислых магматических породах. Способностью концентрировать и накапливать рутений облают некоторые растения, среди которых выделяются представители семейства бобовых.
Общее содержание элемента в земной коре, по мнению специалистов, не превышает 5 000 тонн.

Промышленное получение
Элемент рутений считается благородным, и основным источником металла являются отвальные породы производства платины. Безусловным лидером по добыче рутения (как и платины) выступает Южно-Африканская Республика. Разработку и производство этого металла осуществляют также Россия, Канада и Зимбабве. Кстати, последняя страна занимает второе место в мире по разведанным запасам платиноидов.
Количество поставляемого на рынок рутения колеблется от 17 до 20 тонн в год. Производственный цикл получения элемента длится около 6 недель и представляет собой непрерывную цепь следующих друг за другом термохимических реакций.
Разработана технология получения рутения нейтронным облучением изотопов радиоактивного технеция. Но необходимо отметить, что выделение чистого и устойчивого металла, ввиду его химических свойств, непредсказуемости и недостаточной изученности, остается по-прежнему несбыточной мечтой.
Области применения
Хотя все свойства благородного металла у рутения присутствуют в полной мере, широкого распространения в ювелирной индустрии элемент не получил. Его используют лишь для укрепления сплавов и придания дорогим украшениям большей прочности.
По количеству потребляемого рутения секторы промышленности расположились в следующем порядке:
- Электронный.
- Электрохимический.
- Химический.
Очень востребованы каталитические свойства элемента. Его применяют при синтезе синильной и азотной кислот, при получении предельных углеводородов, глицерина и полимеризации этилена. В металлургической промышленности добавки рутения используют для увеличения антикоррозийных свойств, придания сплавам прочности, химической и механической стойкости. Радиоактивные изотопы рутения нередко помогают ученым при проведении научных исследований.
Нашли применение и многие соединения элемента в качестве хороших окислителей и красителей. В частности, хлориды используют для усиления люминесценции.

Биологическое значение
Рутений обладает способностью накапливаться в клетках живых тканей, главным образом - мышечных (единственный из металлов платиновой группы). Может провоцировать развитие аллергических реакций, оказывать негативное воздействие на слизистую оболочку глаз и верхнего дыхательного тракта.
В медицине благородный металл используют как средство для распознавания пораженных тканей. Лекарственные препараты на его основе применяют для лечения туберкулеза и различных инфекций, поражающих кожные покровы человека. По этой причине весьма перспективным выглядит использование способности рутения образовывать прочные нитрозокомплексы в борьбе с заболеваниями, связанными с избыточной концентрацией нитратов в организме человека (гипертонии, артрита, септического шока и эпилепсии).
Кто виноват?
В ответ представитель Департамента коммуникаций Росатома заявил, что все предприятия госкорпорации работали и работают в штатных режимах. Международное агентство по атомной энергетике (МАГАТЭ) в своем заключении, основываясь на данных собственного мониторинга, назвало все обвинения в адрес Российской Федерации беспочвенными.
Этот металл – самый неординарный в платиновом семействе. Он довел до отчаяния или нервного срыва не одного исследователя. Закономерно, что рутений был изучаем последним из платиноидов. Его название напрямую связано с Россией.

Что представляет собой
Рутений – это благородный металл платиновой группы. В таблице Менделеева это элемент с порядковым номером 44. Располагается компактно рядом с другими платиноидами.
Формула отсутствует: это простое вещество. Состоит из семи стабильных изотопов.
Международное обозначение – Ruthenium (Ru).
Выглядит как типичный металл: голубовато- либо светло-серый цвет дополнен ярким серебристым блеском.
Как был открыт металл
Рутений попал в сферу интересов ученых к середине 19 века, когда на Урале началась платиновая лихорадка.

Однако история оказалась сложной:
Металл назван в честь страны, где впервые был обнаружен. Так предложил первооткрыватель Готфрид Озанн. Россия заняла место в таблице Менделеева.
Ruthenia – латинизированный вариант топонима Россия. Так государство именовалось Европой до 15 века.
По другой версии, первым изучал этот химический элемент все тот же Снядецкий еще в 1809 году. Он назвал новый элемент вестием – в честь астероида Веста, открытого двумя годами ранее.
Всю жизнь посвятил изучению металла советский ученый С.М.Старостин.
Физико-химические характеристики
Рутений наделен характеристиками, свойственными другим платиноидам: повышенная твердость (6,5 по Моосу), стойкость к химическим субстанциям, включая агрессивные.
Есть отличительные признаки:
- Эффективный сорбент водорода: рутениевый кубик с ребром в 1 см способен впитать 1500 см3 водорода. Это почти вдвое больше, чем у палладия (940 см3), признанного эталоном по данной характеристике.
- Интересны свойства четырехвалентной окиси рутения. Внешне это желтые с золотистостью иголки. Даже при комнатной температуре (25°С) истаивают до жидкости, источая запах озона. Без этого компонента невозможно отделение рутения от других металлов и максимальная очистка.
Металл хрупок, легко истрирается до порошка.
Металл в природе
По распространенности рутений едва ли не самый редкий из благородных металлов: его доля в земной коре – 1х2-6%. В 200 раз больше вещества содержат метеориты.
Общая масса разведанных запасов рутения оценивается в 5 тыс. тонн.
Минерал находят по следующим маркерам:
- Коренные залежи или россыпи платиноносных пород.
- Месторождения медно-никелевых руд.
- Залежи лаурита и рутенарсенида.
Лаурит и рутенарсенид – собственные минералы рутения. Первый темный, плотный, насыщен рутением. Оба чрезвычайно редки.

Где добывается
Рутений добывают там же, где платину или платиноиды:
Главный поставщик сырья – Южно-Африканская Республика.
Ежегодный мировой показатель добычи рутения – 17-21 тонна.
Технологии получения
Где используется
Благородный металл востребован как самодостаточный элемент и компонент сплавов.

Промышленность
Главный потребитель металла.
Его забирают следующие отрасли:
- Производство электроники.
- Электрохимия.
- Химическое производство.
Эти направления используют 90% сырья.
Химики ценят металл за инертность и свойства катализатора:
- Он наделен уникальным свойством избирательности в реакциях. За это востребован при синтезировании органических и неорганических веществ.
- В паре с ним каталитическая активность платины повышается.
- Рутениевые соединения используются как суперокислители, пигменты в составе стекла, эмалей.
Без рутения как элемента сплавов не обходятся передовые отрасли:
- Из них делают узлы, контакты приборов повышенной точности для нужд радио-, электро-, аэрокосмической техники, оборонного комплекса. Для этого достаточно 1,1-4,9% рутения в сплаве.
- 0,1% рутения, добавленная к титану, кратно повышает антикоррозионные свойства последнего.
- Рутениево-платиновый симбиоз – материал для изготовления топливных систем, систем по очистке воды на космических кораблях.
- Тугоплавкий металл добавляют в сплавы при изготовлении приборов, замеряющих сверхвысокие температуры.
Чистым рутением покрывают особо важные детали, чтобы сделать их устойчивее механически, химически.
Ювелирное дело
В ювелирных изделиях применение металла двояко: как укрепляющего компонента сплава и прочного покрытия.
Изделия из сплавов с рутениевой лигатурой надежны, прочны, что важно для украшений, испытывающих повышенные нагрузки (кольца, перстни, браслеты).
Покрытие рутением создает на поверхности изделия пленку в гамме оттенков от графита до черноты.
Вместе с родием они создают элитарное чёрное золото.
Чем интересен для ученых
Рутений околдовывал многие поколения ученых. Выяснилось, что некоторые его характеристики почти копируют платиноиды родий и осмий, другие – железо.
Но и через почти двести лет после открытия элемента вопросы остаются:
Поэтому не удается пока получить стойкий чистый металл.
Эти обстоятельства только раззадоривают ученых, особенно молодежь. Они намерены приручить своенравный металл. Особо привлекательные направления – полное и экономически оптимальное извлечение элемента из минералов, шлама, ядерных отходов.
Биологическое воздействие
Как и платина, нанодозы рутения присутствуют в тканях биологических организмов (у человека это мышцы).
Металл, его соединения биологически активны. Данное свойство используют дерматологи, онкологи, фтизиатры.
Однако есть опасные для человека соединения:
- Диоксид. Весьма ядовит, вызывает рвоту, приступы удушья. Провоцирует аллергию, язвы на слизистых оболочках.
- Четырехвалентная окись. Воздействия органики (например, спирта) или нагрева выше 100°С достаточно, чтобы прогремел взрыв.
Это нужно учитывать, если в семье есть поклонники домашних химических опытов. Такие субстанции хранят в специальных емкостях.
Рутений недорог: в семействе благородных металлов цена за грамм меньше только у серебра.
К. К. Клаус назвал элемент в честь своей родины России — (латинское название России — Ruthenia). Клаус родился в городе Дерпте, который с 1704 входил в состав Российской империи (с 1893 — Юрьев, ныне — Тарту в Эстонии).
Получение
Источник рутения — остатки, образующиеся после очистки платины или Cu и Ni. Эти материалы подвергают сначала окислительному сплавлению с использованием бария Ва2О2 или натрия Na2O2. Полученный сплав растворяют в воде и обрабатывают раствор сильным окислителем — газообразным хлором.
Значительным источником рутения для его добычи является выделение его из осколков деления ядерных материалов (плутоний,уран,торий) где его содержание в отработаных ТВЭЛах достигает 250 грамм на тонну "сгоревшего" ядерного топлива.
Физические и химические свойства
Рутений — блестящий серебристый металл. По химическим свойствам — типичный кислородом воздуха при нагревании до 930 °C, не реагирует с растворами сильных минеральных кислот и щелочей. Порошкообразный рутений при нагревании реагирует с кислородом с образованием диоксида рутения RuO2. При сплавлении со многими металлами рутений образует хлором, а также при действии на K2RuO4 кислорода.
Позднее были синтезированы более простые комплексы рутения с молекулярным азотом, например, [Ru (NH3)5N2]Cl2. При переработке облученного ядерного горючего рутений обычно извлекают в виде комплексного соединения состава [Ru (NO)(NO3)3]·H2O.

Рутений — элемент восьмой группы пятого периода периодической системы химических элементов, атомный номер — 44. Простое вещество рутений — переходный металл серебристого цвета. Относится к платиновым металлам.
Содержание
- 1 История
- 1.1 Происхождение названия
- 4.1 Изотопный состав
- 4.2 Физические свойства
- 4.3 Химические свойства
- 4.3.1 Неорганические соединения
- 4.3.2 Органическая химия рутения
![Рутений]()
История
Происхождение названия
Получение
Значительным источником рутения для его добычи является выделение его из осколков деления ядерных материалов (плутоний, уран, торий), где его содержание в отработанных ТВЭЛах достигает 250 граммов на тонну отработанного ядерного топлива.
Также разработана технология получения рутения из технеция-99 с помощью нейтронного облучения молибдена.
Добыча, запасы и цена
Добыча рутения в 2009 году — 17,9 тонн, мировые запасы рутения оцениваются в 5000 тонн. Цена рутения на 27 мая 2016 года — 42 доллара за тройскую унцию (примерно 1,35 USD/г).
Физические и химические свойства
Изотопный состав
Природный рутений состоит из семи стабильных изотопов:
96 Ru (5,7 % по массе), 98 Ru (2,2 %), 99 Ru (12,8 %), 100 Ru (12,7 %), 101 Ru (13 %), 102 Ru (31,3 %) и 104 Ru (18,3 %).
Физические свойства
По тугоплавкости (Тпл= 2334 °C) рутений уступает лишь нескольким элементам — рению, осмию, молибдену, иридию, вольфраму, танталу и ниобию.
Химические свойства
Рутений — весьма инертный металл.
Неорганические соединения
Рутений не растворяется в кислотах и царской водке (смеси HCl и HNO3). Вместе с тем рутений реагирует с хлором выше 400 °C (образуется RuCl3) и со смесью щёлочи и нитрата при сплавлении (образуются рутенаты, например, Na2RuO4).
Рутений способен давать соединения, соответствующие разной степени окисления:
Соединения рутения представлены также широким спектром нитрозосоединений — содержащих группировку RuNO. Данные комплексные соединения, в особенности, нитрозонитроамины (например, [RuNO(NO2)2(NH3)2OH]) и нитрозонитрокомплексы (особенно комплексный анион [RuNO(NO2)4OH] 2− ) (жёлто-оранжевый) отличаются высокой устойчивостью и кинетической инертностью.
Тетраоксид рутения (Ru +VIII O4) по свойствам несколько напоминает тетраоксид осмия.
Органическая химия рутения
Рутений образует ряд металлоорганических соединений и является активным катализатором.
Применение
- Небольшая добавка рутения (0,1 %) увеличивает коррозионную стойкость титана.
- В сплаве с платиной используется для изготовления чрезвычайно износостойких электрических контактов.
- Диоксид рутения и рутенаты висмута используются в толстоплёночных резисторах. Эти два применения в электронике потребляют порядка 50 % производимого рутения.
- Катализатор для многих химических реакций. Очень важное место рутения как катализатора в системах очистки воды орбитальных станций.
- Рутений красный ru en применяется как конкурентный антагонист для исследования ионных каналов (CatSper1, TASK,RyR1, RyR2, RyR3, TRPM6, TRPM8, TRPV1, TRPV2, TRPV3, TRPV4, TRPV5, TRPV6,TRPA1, mCa1, mCa2, CALHM1).
Уникальна также способность рутения к каталитическому связыванию атмосферного азота при комнатной температуре. Открытие, сделанное экспериментальным путём исследователями из университета Миннесоты в 2018 году, демонстрирует то, что химический элемент рутений является четвёртым химическим элементом, обладающим уникальными магнитными свойствами при комнатной температуре. До последнего времени людям были известны лишь три стабильных магнитных элемента, железо (Fe), кобальт (Cо), никель (Ni) и, отчасти, гадолиний (Gd), который теряет магнитные свойства при температуре выше 8 градусов Цельсия. Обнаружение нового магнитного материала может привести к разработке новых типов датчиков, устройств хранения, обработки информации и массы других электронных и электромеханических устройств. Помимо традиционных технологий, в которых используются магнитные свойства материалов, появление нового магнитного материала может сыграть важную роль для дальнейшего развития ряда новых направлений, таких, как спинтроника. Этому будет благоприятствовать то, что технологии выращивания тонких плёнок и создания наноструктур уже дошли до того уровня, который позволяет производить материалы, имеющие уникальные свойства, которыми не обладают эти же материалы естественного происхождения.
Рутений и его сплавы находят применение в качестве жаропрочных конструкционных материалов в аэрокосмической технике, и до 1500 °C по прочности превосходят лучшие сплавы молибдена и вольфрама (имея преимущество также в высокой стойкости к окислению).
На Чемпионате мира по футболу в России в 2018 г. перед началом финального матча сборных Хорватии и Франции главный трофей мундиаля — Кубок ФИФА — был вынесен на поле в специальном кейсе ручной работы, замок и застёжки которого выполнены из рутения.
Физиологическое действие и биологическая роль
Рутений, по всей видимости, является микроэлементом. Он является единственным платиновым металлом, который обнаруживается в составе живых организмов (по некоторым данным — ещё и платина). Концентрируется в основном в мышечной ткани. Высший оксид рутения крайне ядовит и, будучи сильным окислителем, может вызвать возгорание пожароопасных веществ.
![Ruthenium crystals.jpg]()
Серебристый металлРутений / Ruthenium (Ru), 44
2,2 (шкала Полинга)
(300 K) 117,0 Вт/(м·К)
Содержание
История
Открыт профессором Казанского университета Карлом Клаусом в 1844 году. Клаус выделил его из уральской платиновой руды в чистом виде и указал на сходство между триадами рутений — родий — палладий и осмий — иридий — платина.
Происхождение названия
Первооткрыватель элемента К. К. Клаус назвал рутений в честь России [2] (Ruthenia — латинское название Руси, а в поздней латыни — России [3] ).
Получение
Также разработана технология получения рутения из технеция-99 с помощью нейтронного облучения [4]
Физические и химические свойства
Физические свойства
По тугоплавкости (Тпл 2334 °C [1] ) рутений уступает лишь нескольким элементам — рению, осмию, вольфраму, танталу.
Химические свойства
Рутений весьма инертный металл.
Неорганические соединения
Рутений не растворяется в кислотах и царской водке (смеси HCl и HNO3). Вместе с тем рутений реагирует с хлором выше 400 °C (образуется RuCl3) и со смесью щелочи и нитрата при сплавлении (образуются рутенаты, например Na2RuO4).
Рутений способен давать соединения, соответствующие разной степени окисления:
Соединения рутения представлены также широким спектром нитрозосоединений — содержащих группировку RuNO. Данные комплексные соединения, в особенности, нитрозамины (например, [RuNO(NO2)2(NH3)2OH]) и нитрозонитрокомплексы (особенно комплексный анион [RuNO(NO2)4OH] 2− ) отличаются высокой устойчивостью и кинетической инертностью.
Тетраоксид рутения (Ru +VIII O4) по свойствам несколько напоминает тетраоксид осмия.
Органическая химия рутения
Рутений образует ряд металлоорганических соединений и является активным катализатором.
Применение
- Небольшая добавка рутения (0,1 %) увеличивает коррозионную стойкость титана.
- В сплаве с платиной используется для изготовления чрезвычайно износостойких электрических контактов. для многих химических реакций. Очень важное место рутения как катализатора в системах очистки воды орбитальных станций.
Уникальна также способность рутения к каталитическому связыванию атмосферного азота при комнатной температуре.
Рутений и его сплавы находят применение в качестве жаропрочных конструкционных материалов в аэрокосмической технике, и до 1500 °C по прочности превосходят лучшие сплавы молибдена и вольфрама (имея преимущество также в высокой стойкости к окислению).
Оксид рутения изучался [5] как материал для производства суперконденсаторов электроэнергии с удельной электрической ёмкостью свыше 700 фарад/грамм.
Физиологическое действие
Согласно замыслу одного из участников Википедии, на этом месте должен располагаться специальный раздел.
Вы можете помочь проекту, написав этот раздел.Является единственным платиновым металлом, который обнаруживается в составе живых организмов (по некоторым данным — ещё и платина). Концентрируется в основном в мышечной ткани. Высший оксид рутения крайне ядовит и, будучи сильным окислителем, может вызвать возгорание пожароопасных веществ.
См. также
Примечания
- ↑ 1234Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1995. — Т. 4. — С. 285-286. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8
- ↑Популярная библиотека химических элементов. Рутений
- ↑Ruthenia — Wiktionary
- ↑История науки и техники
- ↑ А. И. Беляков. Электрохимические суперконденсаторы: текущее состояние и проблемы развития Электрохимическая энергетика. 2006 г. Т. 6, № 3. С.146-149
Ссылки
- Химические элементы
- Соединения рутения
- Металлы платиновой группы
- Рутений
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Рутений" в других словарях:
РУТЕНИЙ — Металл, находящийся в платиновой руде. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. РУТЕНИЙ новолатинск. Мало исследованный метал, сопровождающий платину. Объяснение 25000 иностранных слов, вошедших в… … Словарь иностранных слов русского языка
РУТЕНИЙ — (Ruthenium), Ru, химический элемент VIII группы периодической системы, атомный номер 44, атомная масса 101,07; относится к платиновым металлам. Открыт русским химиком К.К. Клаусом в 1884 … Современная энциклопедия
РУТЕНИЙ — (лат. Ruthenium) Ru, химический элемент VIII группы периодической системы Менделеева, атомный номер 44, атомная масса 101,07, относится к платиновым металлам. Название от позднелат. Ruthenia Россия (открыт К. К. Клаусом). Плотность 12,37… … Большой Энциклопедический словарь
РУТЕНИЙ — (символ Ru), серебристо белый ПЕРЕХОДНЫЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ, впервые открыт в 1827 г. Встречается в ПЛАТИНОВЫХ рудах. Используется в качестве КАТАЛИЗАТОРА, а также в электрических контактах в сплаве с другими платиновыми металлами; еще… … Научно-технический энциклопедический словарь
Рутений — Ru (от cp. век. лат. Ruthenia Pоссия * a. ruthenium; н. Ruthenium; ф. ruthenium; и. rutenio), хим. элемент VIII группы периодич. системы Mенделеева, ат. н. 44, ат. м. 101,07 относится к платиновым металлам. B природе 7 стабильных изотопов … Геологическая энциклопедия
РУТЕНИЙ — [тэ], рутения, мн. нет, муж. (от новолат. ruthenus русский) (хим.). Химический элемент, серый, хрупкий тугоплавкий металл, встречаемый в природе вместе с платиной и идущий на изготовление волосков для ламп накаливания. Толковый словарь Ушакова. Д … Толковый словарь Ушакова
РУТЕНИЙ — муж. один из металлов, отделяемых от платины. Толковый словарь Даля. В.И. Даль. 1863 1866 … Толковый словарь Даля
РУТЕНИЙ — (Ruthenium), Ru, хим. элемент VIII группы периодич … Физическая энциклопедия
рутений — сущ., кол во синонимов: 4 • металл (86) • минерал (5627) • платиноид (8) • … Словарь синонимов
Рутений — (Ruthenium), Ru, химический элемент VIII группы периодической системы, атомный номер 44, атомная масса 101,07; относится к платиновым металлам. Открыт русским химиком К.К. Клаусом в 1884. … Иллюстрированный энциклопедический словарь
Читайте также:



