Биоинженерные части тела сообщение
Обновлено: 17.05.2024
Содержание
Современное состояние
Идея об искусственном выращивании человеческих органов появилась в середине XX века, с того момента, как людям начали пересаживать органы доноров. Даже при возможности пересаживать большинство органов пациентам, в настоящее время очень остро стоит вопрос донорства. Большое количество пациентов умирают, не дождавшись своего органа. Искусственное выращивание органов в теории может спасти миллионы человеческих жизней. Некоторые успехи в этом направлении уже достигнуты с помощью методов регенеративной медицины.
Эмбриоиды
Эмбриоиды или эмбриональные тельца представляют собой трёхмерные агрегаты клеток, где представлены клетки всех трёх зародышевых листков, необходимых для образования органов и тканей организма. В условиях лаборатории их можно получить различными способами культивирования из недифференцированных ИПСК. Формирование эмбриональных телец является обычным методом, используемым для дифференциации ИПСК в различные клеточные линии.
Органоиды сердечно-сосудистой ткани
Культивируя эмбриоиды на коллаген-конъюгированных гидрогелях с жесткостью, подобной жесткости сердечной мышечной ткани Шкуматову с соавторам исследования. удалось получить кардиоваскулярные органоиды, способные к сокращению. Этим они показали, что важную роль в дифференцировке клеток может играть жесткость межклеточного матрикса. Необходимость создания комфортных для культивируемых клеток механических напряжений, путём регуляции жесткости материала подложек для культивации была отмечена и в ряде других работ. Новые технологии позволили синхронизировать сокращения клеток сердечного органоида.
Органоиды печени
Такебе с соавт. создали воспроизводимый метод широкомасштабного выращивания васкуляризированных органоидов печени человека полностью из индуцированных плюрипотентных стволовых клеток (ИПСК) и продемонстрировали их функциональные возможности для применения в качестве трансплантата для лечения людей.
Органоиды слюнных и слезных желез
Группа исследователей из Токийского университета наук и корпорации Organ Technologies Inc во главе с профессором Такаси Цудзи (Takashi Tsuji) продемонстрировала функциональную регенерацию подчелюстных слюнных желез из биоинженерных зародышей слюнной железы после их ортотопической (с удалением дефектной железы) трансплантации, с целью восстановительной терапии путём замены органа мышам, у которых был смоделирован дефект слюнных желез. Созданный биоинженерный зародыш развился в зрелую железу путём формирования гроздевидных отростков с мышечным эпителием и иннервацией. Он производил и выделял слюну в ответ на вкусовую стимуляцию цитратом, восстанавливал процесс глотания пищи, защищал ротовую полость от бактериальной инфекции. Эта же группа успешно провела ортотопическую трансплантацию биоинженерных зародышей слезных желез мышам с моделью имитирующей повреждение эпителия роговицы, вызванное дисфункцией слезной железы. В условиях in vivo [ чего? ] биоинженерные зародыши дали начало слезным железам способным выполнять физиологические функции, включая образование слезы, в ответ на нервную стимуляцию, и защиту глазной поверхности.
Органоиды почек
Разработаны технологии для выращивания из плюрипотентных клеток органоидов почки, которые можно использовать для моделирования болезней почек и скрининга лекарств для их лечения, а в будущем для подсадки пациентам миниатюрных почек, созданных из их собственных ИПСК. Разработана стратегия трансплантации такого органоида, позволяющая ему выводить выделяемую им мочу в мочевой пузырь.
Органоиды поджелудочной железы
Органоиды тимуса
Важную роль в генерации новых Т-клеток играет тимус. Эта железа очень активна в начале жизни, но отмирает при достижении совершеннолетия в процессе, известном как инволюция тимуса, в результате чего происходит понижение иммунитета у пожилых людей. Подсадка в организм старых людей органоидов тимуса могла бы помочь им бороться с рядом старческих заболеваний. Надежды в этом плане вселяют эксперименты по выращиванию органоидов тимуса и их трансплантации бестимусным мышам. Выяснилось, что органоиды тимуса не только способны прижиться но и могут эффективно способствовать восстановлению функции тимуса у его получателей. Органоиды тимуса в будущем позволят производить в биореакторах модифицированные Т-клетки для целенаправленной борьбы с онкологическими заболеваниями.
Органоиды легочной ткани
Воздействуя на сигнальные пути ИПСК человека удалось получить органоиды лёгких человека состоящие из эпителиальных и мезенхимальных компартментов лёгких, со структурными особенностями характерными для легочных тканей. Модификация этого метода позволяет выращивать органоиды легочной ткани в биореакторе и использовать их для изучения легочных заболеваний.
Органоиды сетчатки глаза
Разработаны 3-D органоиды глазного яблока и сетчатки глаза с фоторецепторными клетками: палочками и колбочками. Это позволит в будущем разработать методы лечения таких заболеваний глаз как дегенерация сетчатки .
Органоиды сенсорного эпителия внутреннего уха
Аналогичная технология была использована для разработки способов получения органоидов сенсорного эпителия внутреннего уха, что в будущем позволит бороться с глухотой.
Органоиды простаты
Органоиды простаты были получены путём направленной дифференцировки ЭСК. Отмечается, что решающее значение для образования эпителиальных клеток простаты, имеет время экспозиции факторам WNT10B/Fgf10 выполняющих ключевую роль для образования простаты, также как и в период внутриутробного развития.
Церебральные органоиды
С целью моделирования и исследования in vitro человеческого головного мозга и его заболеваний была создана трёхмерная культура органоидов клеток головного мозга, полученных из плюрипотентных стволовых клеток. Церебральные органоиды (англ. Cerebral organoid) могут быть использованы для изучения нейруляции и других процессов нейрогенеза, как простые модели сложных тканей мозга для изучения влияния токсинов и лекарств на ткани мозга путём их безопасного и экономичного первоначального скрининга, а также для получения образцов для ксенотрансплантации.
Эпителиальные энтероиды, колоноиды и холангиоиды
При моделировании эпитеалиальных органов проблемой является разнообразие источников эпителиальных тканей, крайняя чувствительность пролиферативной активности эпителиальных клеток к внешним изменениям, а также ассоциированные с эпителиально-мезенхимальным переходом особенности, характерные исключительно для эпителиальных тканей. Поскольку форма таких тканей в основном представляет собой стенку, ее восстановление связано с многослойной организацией и функционалом (перистальтика, нервная регуляция). Данные особенности тканевой морфологии обобщают биологические проблемы, возникающие при поиске новых эффективных методов восстановительной и регенеративной хирургии стенок полых эпителиальных органов (пищевод, желудок, кишечник), а также трубчатых структур (желчный проток, мочеточник). Исследованию кишечника человека помогут органоиды полученные из эпителиальных клеток тонкой и толстой кишки. С их помощью можно изучать стволовые клетки кишечника и механизмы нарушения физиологических функций желудочно-кишечного тракта, а также создавать опухолевые органоиды для изучения раковых заболеваний и скрининга лекарственных препаратов.
Сфероиды волосяных фолликулов
Техника выращивания клеток в виде сфероидов в висячей капле была использована для культивации клеток сосочкового слоя волосяных фолликулов человека. Было показано, что при выращивании этих клеток в виде сфероидов, когда клетки растут как бы в более естественном трёхмерном окружении и взаимодействуют друг с другом, они способны заново индуцировать образование волосяных фолликулов в коже человека.
Биоинженерная мышца
Хрящевые и мышечные ткани для операций по реконструкции
Тканевые имплантаты, выращенные в лаборатории из собственных мышечных и эпителиальных клеток девочек-пациенток, которым требовалась операции по реконструкции вагины, после пластической операции не только успешно прижились и функционировали.
Создана подложка и специальный инкубатор для выращивания человеческого пищевода из клеток пациента. Эта разработка в перспективе позволит сохранить жизнь новорожденным, родившимся без значительной части пищевода.
Преодоление иммунного отторжения органов
3D-биопечать
Роль самоорганизации тканей
Роль межклеточного матрикса
Разработан протез трахеи, который на 95 % состоит из тканей пациента, что позволяет избежать отторжения органа. Каркасом для протеза стала кость, выращенная из тканей надкостницы. Внутренняя поверхность органа создавалась из стволовых клеток и собственной слизистой пациента. Биореактором, в котором новая трахея созревала в течение шести месяцев, послужили ткани грудной стенки больного. В результате инкубации в протезе сформировалась собственная сосудистая система.

Бионические протезы позволяют людям, оставшимся без ноги или руки, жить полноценной жизнью. Но по факту ими пользуются лишь 10% людей, лишившихся конечностей. Могут ли бионические протезы в будущем сделать из нас киборгов? И почему этого еще не произошло?
Как устроены бионические протезы?
Бионическим считается протез, который частично или полностью заменяет утраченный орган и выполняет его функции. Важно: к бионическим не относят косметические протезы, которые просто создают видимость руки или ноги. Например, рука, которая не двигается, а просто висит — это косметический протез. А если она может сгибаться и двигать пальцами — бионический.
Самые простые бионические протезы — механические: они сгибаются и разгибаются за счет оставшихся мышц. В более сложных используют датчики, которые реагируют на нервные импульсы и воспроизводят более сложные движения — даже мелкую моторику. Наконец, сейчас появились протезы, которые соединены с мозгом, и отвечают на его сигналы напрямую, минуя мышцы.
Но обо всем по порядку.
Эволюция бионических протезов
Первые протезы появились более 3 тыс. лет назад, в Древнем Египте. Это были деревянные пальцы, которые защищали от мозолей при ходьбе в сандалиях.
В XVI веке немецкий рыцарь Готфрид носил железную руку, чьи пальцы сгибались при нажатии кнопки на ладони. Пишут, что с ее помощью он мог даже писать пером.
В XVIII—XIX веках в Викторианской Англии носили механические устройства, которые приводились в движение с помощью рычагов и гибких тросов. Протезы становились более функциональными — у них больше подвижных суставов — и эстетичными: их форма все больше похожа на настоящие конечности. Некоторые даже украшали чеканкой или гравировкой.
В XX веке протезы делают тяговыми: чтобы согнуть или разогнуть конечность, нужно потянуть за рычаг. На смену дереву и железу приходят облегченные металлы и пластик. В итоге протезы становятся легкими — исчезает дисбаланс между травмированной частью тела и здоровой. Пластиковые модели еще и выглядели максимально реалистично, помогая обладателю справляться со стеснением при ношении протеза.
Первую бионическую руку в современном понимании этого слова сделали в 1993 году для Джона Кэмпбелла. Она приводилась в движение за счет датчиков, подсоединенных к мозгу и спрятанных под кепкой.
В 2007-м канадская Touch Bionics представила i-limb — первый широко доступный бионический протез. Эта рука весила всего 25 кг, обладала тонкими пальцами и открывала больше возможностей для мелкой моторики: от работы с мышкой до завязывания шнурков. Протез крепится на гильзе, легко закручивается и откручивается.
В 2010-м компания BeBionic представила на Международном конгрессе по протезированию и ортопедии в Лейпциге первый серийный протез. А первый широко доступный — Symbionic Leg — выпустила в 2011-м исландская Össur. В 2013 году она дополнила модель микропроцессорным управлением: теперь протез подстраивался под походку своего владельца.
Основанная в 1971 году, Össur стала одним из лидеров рынка, скупив с 2000 года 16 крупнейших производителей и стартапов. В 2019-м ее капитализация составила более $450 млн.
Следующим этапом стали протезы, управляемые при помощи мозга. В 2015 году Агентство перспективных исследовательских проектов в области обороны США (DARPA) испытала такой во время полета на авиасимуляторе F-35: им управляла парализованная женщина с помощью механических рук.
В 2018 году появились первые протезы для глаза — Argus II. Он помогает частично восстановить зрение за счет электростимуляции оставшихся клеток.
Современные протезы используют разработки робототехники, умеют имитировать индивидуальные жесты, передавать тактильные ощущения. Наконец, экзоскелеты — это переходный этап: они не заменяют утраченные органы, а дополняют, расширяя возможности человека. С их помощью люди без физподготовки могут поднимать тяжести, а парализованные — двигаться.
Сколько стоят бионические протезы (и почему так дорого)
По данным исследовательской компании Grand View Research, объём мирового рынка роботизированных протезов в 2016 году составлял $790,8 млн. Прогноз на 2025-й — до $1,75 млрд. Рынок растет вслед за развитием технологий, а также — количеством ампутаций и их спонсированием за счет НКО.
По данным американской аналитической компании Frost & Sullivan, средняя цена современных усовершенствованных протезов варьируется от $5 тыс. до $50 тыс.
Протез Bebionic стоит более $10 тыс., i-limb — от $60 тыс. до $120 тыс., бионический глаз Argus II — около $150 тыс.
В России бионическая рука обойдется от 100 тыс. до 1,5 млн руб.
Пока протезы так и не стали массовыми, а их разработки обходятся достаточно дорого, объединяя инженеров, биологов, медиков. При этом создаются протезы каждый раз индивидуально: гильза, к которой крепится бионическая рука или нога должна идеально подходить по форме и размеру. Иногда для этого приходится делать несколько моделей, а на тренировки и реабилитацию уходят недели.
В большинстве случаев протезы оплачивает страховая компания или государство — как в России. Но для этого нужно пройти много инстанций и медкомиссию, и выбор моделей будет очень узким.
Самые-самые: руки из Lego, ноги для спортсменов и супермоделей
В последние годы бионические протезы выполняют не только свою основную функцию — они стали чем-то большим: образом жизни, увлечением и даже модным аксессуаром.
Джейсон Барнс — барабанщик, который при помощи протезов рук играет на ударных быстрее, чем обычные люди
Искусственное создание живых тканей, органов и даже целых организмов на протяжении всей истории человечества было предметом мифов, легенд и фантастических историй, и не давало покоя человеческому воображению.
Оглавление статьи:
- Кожа и внутренний каркас скелета
- Внутренние органы и системы организма
- Сердечно-сосудистая и кровеносная система
- Железы внутренней секреции
- Органы сенсорного восприятия
- Мозг и сложные элементы нервной системы
- Заключительная часть исследования
В настоящее время в мире активно ведутся работы по выращиванию практически любых тканей и органов человеческого тела. Некоторые из них уже находятся в клиническом использовании, другие - еще на испытаниях и в разработке.
В предыдущей статье на эту тему мы коротко рассказал вам про основные технологии Биоинжиниринга. Теперь давайте перейдем от теории к практике и вместе посмотрим на то, чего удалось достичь биоинженерам за последние пять лет.
Кожа, мышцы и внутренний каркас скелета
Сегодня ученые сосредоточилась на клеточном и генном уровнях, открывающих поразительные для современного состояния медицины перспективы. Существуют убедительные опыты, доказавшие возможность выращивания на базе стволовых клеток тканей костного мозга, печени, поджелудочной железы хрящевых образований.
В 2015 году группа биотехнологов из Массачусетской общей больницы в Бостоне , которые создали первую в мире искусственную бионическую конечность крысы, вырастив ее мускулы, суставы и сосуды из стволовых клеток.
Создана так называемая "мускульная" ткань, реагирующая на сигналы поступающие от нерва. Это стало возможным благодаря нервно-мышечному соединению, выращенному из клеток мышечной ткани и нейрональных клеток.
Эта ткань потенциально может быть использована для фармакокинетических анализов, для создания привода мышц биороботов и биопротезов.
Выращенная биоинженерная мышца оказалась способна к развитию, регенерации и смогла прижиться после трансплантации её животному.
Разработана технология получения мышц из ИПСК, которые можно неограниченно размножать культивацией, что позволит выращивать мышечную ткань в больших количествах.
В 2016 году ученые из медицинского центра Рочестерского университета (США) обнаружили стволовые клетки, которые могут реконструировать кости лицевого отдела черепа и черепную коробку мышей. Исследование опубликовано в "Nature Communications".
В 2016 году команда австралийских инженеров и хирургов разработала устройство для тонкой трехмерной биопечати, которое позволяет создавать персонифицированные хрящевые импланты из стволовых клеток непосредственно во время операции. Результаты работы опубликованы в журнале "Biofabrication".
В 2016 году международная группа ученых под руководством Рамиллы Шах предложила новейшую разработку – технологию гиперэластичных костей. Гиперэластичные кости состоят из такого минерала как гидроксиапатит.
В данном случае речь идет о гиперэластичных биочернилах. Из них печатаются костные импланты любой формы и размера.
В 2016 году биологи из института RIKEN (Япония) вырастили из стволовых клеток полноценную кожную ткань, которую успешно имплантировали в тело мыши.
В 2016 году в журнале " Biofabrication" учёные из Испании рассказали о новом 3D-принтере, печатающем кожу, полностью идентичную человеческой за короткие сроки. Данное изобретение незаменимо в трансплантологии, при обширных ожогах, в косметологии.
Метод печати кожи, разработанный специалистами из Испании уникален и тем, что за столь короткое время с его помощью можно напечатать необходимый для пересадки фрагмент кожи для конкретного человека.
В 2017 году ученые провели эксперимент по выращивания клеток в виде сфероидов в висячей капле. Она была использована для культивации клеток, которые способны заново индуцировать образование волосяных фолликулов в коже человека.
В 2017 году в Китае детям с врожденным дефектом уха пересадили 3D-печатные уши.
В 2018 году ученые из Института регенеративной медицины в Уэйк Форесте создали Систему печати интегрированных тканей и органов.
По сути, это инновационный 3D-биопринтер, способный производить новые органические ткани для трансплантации, которые ничем не будут отличаться от реальных.
Для доказательства работоспособности своего изобретения ученые напечатали часть челюстной кости, мышцу, а также различные хрящевые структуры, в том числе и удивительно пропорциональное человеческое ухо.
В 2019 году ученые из Сеченовского университета совместно с коллегами из Института фотонных технологий ФНИЦ "Кристаллография и фотоника" создали инновационный биопринтер BioDrop , который произведет переворот в регенеративной медицине.
В частности, он даёт возможность в разы повысить качество таких сверхчувствительных биоматериалов, как барабанная перепонка.
Когда врачи исчерпывают все варианты лечения больных, они обращаются к новому направлению под названием биоинженерия. Профильные ученые применяют принципы инженерии в биологических системах, что открывает возможность для создания новых человеческих тканей, органов, крови и даже роговой оболочки глаза. Предлагаем обзор наиболее примечательных достижений последних лет.
Изготовление небольших фрагментов искусственной кожи, которые вживляются пациенту или используются в испытаниях на токсичность, стало возможно довольно давно. Клетки человеческой кожи выращиваются в лаборатории, а затем помещаются в коллагеновый каркас. В 2011 году в Институте инженерии и биотехнологии имени Фраунгофера представили систему, способную быстро производить двухслойные модели искусственной кожи. Производительность их тканевой фабрики позволяла делать 5000 пластов кожного покрова в месяц.

Кожа
Изготовление небольших фрагментов искусственной кожи, которые вживляются пациенту или используются в испытаниях на токсичность, стало возможно довольно давно. Клетки человеческой кожи выращиваются в лаборатории, а затем помещаются в коллагеновый каркас. В 2011 году в Институте инженерии и биотехнологии имени Фраунгофера представили систему, способную быстро производить двухслойные модели искусственной кожи. Производительность их тканевой фабрики позволяла делать 5000 пластов кожного покрова в месяц.
Воспроизводство трехмерных биологических структур, особенно сложного человеческого уха, является для специалистов биоинженерии серьезным вызовом. Группа ученых Принстонского университета, возглавляемая доцентом кафедры механической и авиакосмической техники Майклом Макалпайном (Michael McAlpine), использовала технологию трехмерной печати для изготовления функционирующего уха из клеток теленка и материалов для электронных приборов. Представленное в мае 2013 года ухо это не простая замена обычного органа: оно способно ловить радиочастоты за пределами диапазона, доступного нормальному человеческому уху.
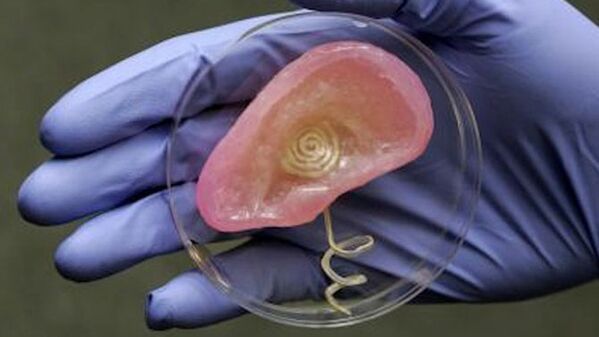
Ухо
Воспроизводство трехмерных биологических структур, особенно сложного человеческого уха, является для специалистов биоинженерии серьезным вызовом. Группа ученых Принстонского университета, возглавляемая доцентом кафедры механической и авиакосмической техники Майклом Макалпайном (Michael McAlpine), использовала технологию трехмерной печати для изготовления функционирующего уха из клеток теленка и материалов для электронных приборов. Представленное в мае 2013 года ухо это не простая замена обычного органа: оно способно ловить радиочастоты за пределами диапазона, доступного нормальному человеческому уху.
Возможность создания в лабораторных условиях кровеносных сосудов из собственных клеток пациента позволит повысить эффективность лечения сердечно-сосудистых, почечных заболеваний и диабета. В 2011 году руководитель базирующейся в Калифорнии компании по созданию искусственных тканей Cytograft Tissue Engineering заявил об успешном проведении исследования, в рамках которого трем пациентам, страдающим от почечных заболеваний в острой стадии, вживлялись созданные в лаборатории при помощи биоинженерии кровеносные сосуды. Восемь месяцев спустя вживленные сосуды по-прежнему работали исправно, помогая проводить диализ. После этого в текущем месяце группе специалистов Массачусетского госпиталя удалось превратить взрослые клетки сосудистой ткани в первоначальное состояние, напоминающее стволовые клетки. Они сумели создать функционирующие длительное время кровеносные сосуды в живой мыши.
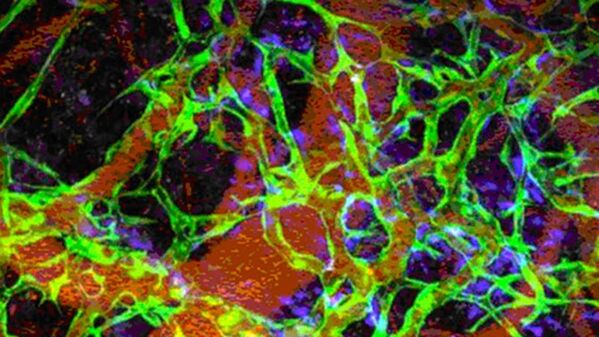
Кровеносные сосуды
Возможность создания в лабораторных условиях кровеносных сосудов из собственных клеток пациента позволит повысить эффективность лечения сердечно-сосудистых, почечных заболеваний и диабета. В 2011 году руководитель базирующейся в Калифорнии компании по созданию искусственных тканей Cytograft Tissue Engineering заявил об успешном проведении исследования, в рамках которого трем пациентам, страдающим от почечных заболеваний в острой стадии, вживлялись созданные в лаборатории при помощи биоинженерии кровеносные сосуды. Восемь месяцев спустя вживленные сосуды по-прежнему работали исправно, помогая проводить диализ. После этого в текущем месяце группе специалистов Массачусетского госпиталя удалось превратить взрослые клетки сосудистой ткани в первоначальное состояние, напоминающее стволовые клетки. Они сумели создать функционирующие длительное время кровеносные сосуды в живой мыши.
Искусственные аппараты, стимулирующие сердечную деятельность, начали имплантировать хирургическим путем с 1980-х годов. Однако никакое устройство не способно заменить человеческое сердце лучше, чем здоровый живой орган. Ведь человеческое сердце делает за один год 35 миллионов сокращений. Благодаря недавним достижениям ученым удалось увеличить количество биологического материала в искусственных аппаратах сердца. В мае французская компания Carmat подготовила для испытаний искусственное устройство, изготовленное с использованием ткани коровьего сердца. Хирург Харальд Отт (Harald Ott) и группа работающих с ним в Массачусетском госпитале специалистов трудятся над искусственным биоинженерным каркасом сердца, а исследователи из Массачусетского технологического института недавно смогли напечатать функционирующую сердечную ткань из клеток грызунов.
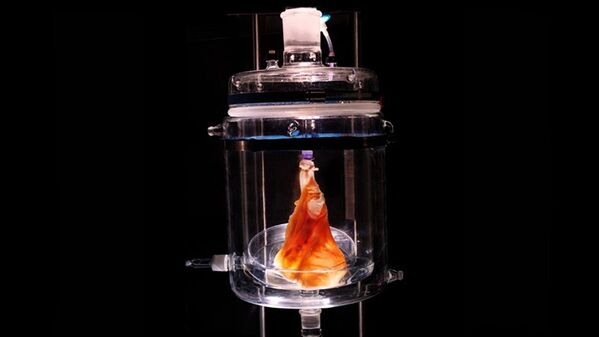
Сердце
Искусственные аппараты, стимулирующие сердечную деятельность, начали имплантировать хирургическим путем с 1980-х годов. Однако никакое устройство не способно заменить человеческое сердце лучше, чем здоровый живой орган. Ведь человеческое сердце делает за один год 35 миллионов сокращений. Благодаря недавним достижениям ученым удалось увеличить количество биологического материала в искусственных аппаратах сердца. В мае французская компания Carmat подготовила для испытаний искусственное устройство, изготовленное с использованием ткани коровьего сердца. Хирург Харальд Отт (Harald Ott) и группа работающих с ним в Массачусетском госпитале специалистов трудятся над искусственным биоинженерным каркасом сердца, а исследователи из Массачусетского технологического института недавно смогли напечатать функционирующую сердечную ткань из клеток грызунов.
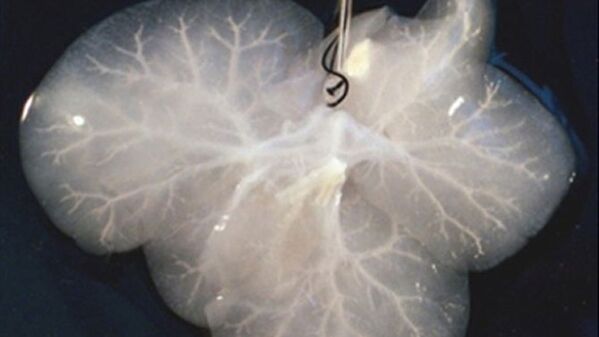
Печень
В апреле после длившейся девять часов операции в детском госпитале штата Иллинойс в городе Пеория 32-месячная Ханна Уоррен (Hannah Warren) стала самой юной пациенткой, которому хирурги вживили орган, созданный при помощи биоинженерии. Хирурги создали для нее дыхательное горло при помощи ее же клеток костного мозга. Она родилась без трахеи, и нуждалась в операции, которая позволила бы ей дышать, есть, пить и разговаривать. Компании Harvard Bioscience удалось создать каркас с заданными параметрами и биореактор для проведения экспериментов. К сожалению, Ханна умерла 7 июля в связи с осложнениями после сделанной ей ранее операции на пищеводе. Несмотря на высокий уровень рисков, специалисты биоинженерии заявляют, что продолжат свои исследования.
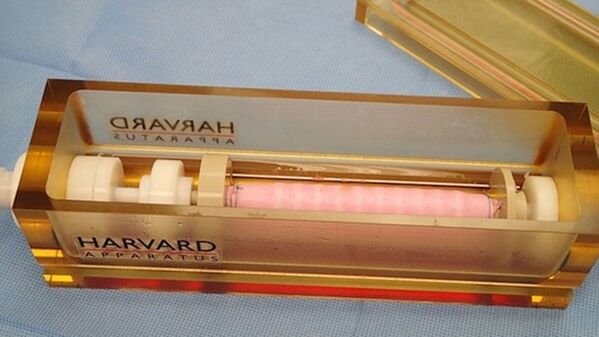
Трахея
В апреле после длившейся девять часов операции в детском госпитале штата Иллинойс в городе Пеория 32-месячная Ханна Уоррен (Hannah Warren) стала самой юной пациенткой, которому хирурги вживили орган, созданный при помощи биоинженерии. Хирурги создали для нее дыхательное горло при помощи ее же клеток костного мозга. Она родилась без трахеи, и нуждалась в операции, которая позволила бы ей дышать, есть, пить и разговаривать. Компании Harvard Bioscience удалось создать каркас с заданными параметрами и биореактор для проведения экспериментов. К сожалению, Ханна умерла 7 июля в связи с осложнениями после сделанной ей ранее операции на пищеводе. Несмотря на высокий уровень рисков, специалисты биоинженерии заявляют, что продолжат свои исследования.
© Фото : Cornell University Межпозвоночные диски
Когда смещенный или поврежденный диск вызывает хроническую боль в спине, возможности по лечению весьма ограничены. В худшем случае пациенты подвергаются хирургической операции, в процессе которой позвонки связываются друг с другом, приводя к ограничению подвижности пациента. Несколько лет назад в качестве альтернативы появились искусственные диски, однако в процессе использования они изнашиваются. В 2011 году группа специалистов Корнелльского университета при помощи биоинженерии создала импланты на основе геля и коллагена с вживленными клетками крысы, которые затем были успешно пересажены в позвоночники крыс. Этим летом специалисты биоинженерии из Университета Дьюка продвинулись еще дальше: они изобрели такой гель, который, по их мнению, позволит восстановить ткань после внедрения в междисковое пространство

Межпозвоночные диски
Когда смещенный или поврежденный диск вызывает хроническую боль в спине, возможности по лечению весьма ограничены. В худшем случае пациенты подвергаются хирургической операции, в процессе которой позвонки связываются друг с другом, приводя к ограничению подвижности пациента. Несколько лет назад в качестве альтернативы появились искусственные диски, однако в процессе использования они изнашиваются. В 2011 году группа специалистов Корнелльского университета при помощи биоинженерии создала импланты на основе геля и коллагена с вживленными клетками крысы, которые затем были успешно пересажены в позвоночники крыс. Этим летом специалисты биоинженерии из Университета Дьюка продвинулись еще дальше: они изобрели такой гель, который, по их мнению, позволит восстановить ткань после внедрения в междисковое пространство
© Фото : EPFL Кишечник

Кишечник
Согласно данным Центра по контролю и профилактике болезней, один из 10 взрослых американцев будет иметь хроническое заболевание почек той или иной степени тяжести. В настоящее время от хронической почечной недостаточности в США страдают около 600000 пациентов. Большинству из них делают диализ, но лишь небольшой части удается получить транспланты. В настоящее время специалисты Калифорнийского университета в Сан-Франциско работают над созданием сложной искусственной почки, выполненной из клеток человеческой почки и силиконовых нанофильтров. Почка приводится в действие при помощи кровяного давления. Испытания данного устройства, разработкой которого руководит нефролог Калифорнийского университета Уильям Фисселл (William Fissell) и профессор биоинженерии Шуво Рой (Shuvo Roy), планируется начать в 2017 году.

Почка
Согласно данным Центра по контролю и профилактике болезней, один из 10 взрослых американцев будет иметь хроническое заболевание почек той или иной степени тяжести. В настоящее время от хронической почечной недостаточности в США страдают около 600000 пациентов. Большинству из них делают диализ, но лишь небольшой части удается получить транспланты. В настоящее время специалисты Калифорнийского университета в Сан-Франциско работают над созданием сложной искусственной почки, выполненной из клеток человеческой почки и силиконовых нанофильтров. Почка приводится в действие при помощи кровяного давления. Испытания данного устройства, разработкой которого руководит нефролог Калифорнийского университета Уильям Фисселл (William Fissell) и профессор биоинженерии Шуво Рой (Shuvo Roy), планируется начать в 2017 году.
Читайте также:

