Адиабатный процесс в природе сообщение
Обновлено: 02.07.2024
Исследование теплоемкости газа. Использование адиабатного процесса в природе и технике. Применение первого начала термодинамики к изопроцессам. Снижение температуры приточного воздуха за счет испарения. Рассмотрение двигателя с внешним подводом теплоты.
| Рубрика | Физика и энергетика |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 22.10.2014 |
| Размер файла | 4,3 M |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Реферат по дисциплине:
Студентка группы №80-13
Содержание
1. Приминение адиабатного процесса в технике
1.1 Применение первого начала термодинамики к изопроцессам
1.2 Использование адиабатного процесса испарения для снижения температуры приточного воздуха
1.3 Адиабатный двигатель с внешним подводом теплоты (двигатель внешнего сгорания, двигатель Стирлинга
2. Применение адиабатного процесса в природе
Введение
Адиабатимческий, или адиабамтный процемсс -- термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой \ с окружающим пространством. Серьёзное исследование адиабатических процессов началось в XVIII веке.
Адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянно. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л.Д. Ландау) называли адиабатическими только обратимые адиабатические процессы.
Обратимый адиабатический процесс для идеального газа описывается уравнением Пуассона. Линия, изображающая адиабатный процесс на термодинамической диаграмме, называется адиабатой Пуассона. Примером необратимого адиабатического процесса может быть распространение ударной волны в газе. Такой процесс описывается ударной адиабатой. Адиабатическими можно считать процессы в целом ряде явлений природы. Так же такие процессы получили ряд применений в технике.
Адиабатные процессы широко используются в технике. Они играют немалую роль в природе.
1. Приминение адиобатного процесса в технике
Процесс в теплоизолированной системе называют адиабатным.
При адиабатном процессе Q = 0 и согласно закону (1) изменение внутренней энергии происходит только за счет совершения работы:
Конечно, нельзя окружить систему оболочкой, абсолютно исключающей теплообмен. Но в ряде случаев реальные процессы очень близки к адиабатным. Существуют оболочки, обладающие малой теплопроводностью, например двойные стенки с вакуумом между ними. Так изготовляются термосы.
Процесс можно считать адиабатным даже без теплоизолирующей оболочки, если он происходит достаточно быстро, т. е. так, чтобы за время процесса не происходило заметного теплообмена между системой и окружающими телами.
Согласно выражению () при совершении над системой положительной работы, например при сжатии газа, внутренняя энергия его увеличивается; газ нагревается. Наоборот, при расширении газ сам совершает положительную работу (А' > 0), но А 0 и дA >0, так как газ расширяется. При изобарном сжатии направление процесса меняется на противоположное и теперь тепло отводится от системы, т.е. дQ 0, dU 0. Работу над газом совершают внешние силы, внутренняя энергия (а, значит, и температура) газа повышается. Реализовать адибатический процесс можно, если проводить его либо при хорошей теплоизоляции от окружающей среды, либо быстро за короткое время, при котором теплообмен будет мал.
-- Изменение внутренней энергии
-- Работа внешних сил
-- Работа совершаемая системой
1.2 Использование адиабатного процесса испарения для снижения температуры приточного воздуха [1]
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление р - температура Т (в р, Т-диаграмме). При температурах ниже критической Ткэта область ограничена кривыми сублимации (возгонки) / и парообразования II. Это означает, что при любом давлении ниже критического рк существует температура Т, определяемая кривой сублимации или парообразования, выше которой вещество становится газообразным. В состояниях на кривой 1 (ниже тройной точки Tp)газ находится в равновесии с твёрдым веществом (твёрдой фазой), а на кривой II (между тройной и критической точкой К.) - с жидкой фазой. Газ в этих состояниях обычно называют паром вещества.
При температурах ниже Тк можно сконденсировать газ. - перевести его в др. агрегатное состояние (твёрдое или жидкое). При этом фазовое превращение газа в жидкость или твёрдое тело происходит скачкообразно: весьма малое изменение давления приводит к конечному изменению ряда свойств вещества (например, плотности, теплоёмкости и др.). Процессы конденсации газа имеют важное техническое значение.
При Т > Тк граница газообразной области условна, поскольку при этих температурах фазовые превращения не происходят. В ряде случаев за условную границу между газом. и жидкостью при сверхкритических температурах и давлениях принимают критическую изохору вещества (кривую постоянной плотности или удельного объёма), в непосредственной близости от которой свойства вещества изменяются, хотя и не скачком, но особенно быстро. В связи с тем что область газового состояния очень обширна, свойства газов при изменении температуры и давления могут меняться в широких пределах. С другой стороны, при высоких давлениях вещество, которое при сверхкритических температурах можно считать газом, обладает огромной плотностью (например, в центре некоторых звёзд ~10 9 г/см 3 ). В зависимости от условий в широких пределах изменяются и др. свойства газов - теплопроводность, вязкость и т. д. Сжижение газов
Сжижение газов - переход вещества из газообразного состояния в жидкое.
Оно достигается охлаждением их ниже критической температуры (Тк ) и последующей конденсацией в результате отвода теплоты парообразования (конденсации). Охлаждение газа ниже ТК необходимо для достижения области температур, при которых газ может сконденсироваться в жидкость (при Т > ТК жидкость существовать не может). Впервые газ (аммиак) был сжижен в 1792 (голландский физик М. ван Марум[2]). Хлор был получен в жидком состоянии в 1823 (М.Фарадей[3]), кислород -- в 1877 (швейцарский учёный Р. Пикте[4] и- французский учёный Л.П. Кальете[5]), азот и окись углерода -- в 1883 (З.Ф. Врублевский и К. Ольшевский[6]) водород -- в 1898 (Дж. Дьюар[7]), гелий -- в 1908 (Х. Камерлинг-Оннес[8]).
Изобара^1--2соответствует охлаждению газа до начала конденсации, изотерма 2--0 -- конденсации газа. Площадь ниже 1--2--0 эквивалентна количеству теплоты, которое не обходимо отвести от газа при его сжижении, а площадь внутри контура 1--2--0--3 (1--3-- изотермическое сжатие газа, 3--0 --адиабатическое его расширение) характеризует термодинамически минимальную работу Lmin, необходимую для сжижения газа. Lmin = T0(SГ -- SЖ) -- (JГ - JЖ), где T0 -- температура окружающей среды; SГ, SЖ -- энтропии газа и жидкости; JГ, JЖ -- теплосодержания (энтальпии) газа и жидкости.
1.3 Адиабатный двигатель с внешним подводом теплоты (двигатель внешнего сгорания, двигатель Стирлинга) [9]
Двигатель может быть применен как:
· криоохладитель - в энергетике для обеспечения сверхпроводимости, в медицине для сохранения органов, в пищевой промышленности для заморозки продуктов;
· двигатель для экологически чистого транспорта, работающего на тепловых аккумуляторах, изотопах, термохимической реакции или экологически чистом топливе;
· двигатель для транспортных средств, работающих на альтернативных видах топлива (сжатый природный газ, сжиженный нефтяной газ, криогенное топливо);
· двигатель для надводных судов;
· анаэробный двигатель для подводных и космических кораблей, для подводных и космических добывающих комплексов для извлечения полезных искомых из донных отложений и океанических россыпей, для добычи Гелия-3 из лунного грунта;
· двигатель для энергосберегающих когенерационных технологий, вырабатывающих тепловую и электрическую энергию с уменьшенным удельным КПД энергетических установок;
· привод для систем и установок для рационального использования энергоресурсов и комплексного использования вторичных энергоресурсов;
· привод для систем комплексного совместного использования традиционной энергетики и возобновляемых источников энергии;
· привод для энергетических установок, обеспечивающих прямое преобразование солнечного излучения в электроэнергию:
v привод для систем более эффективных и экологически чистых технологий использования геотермальных источников энергии;
v привод для производства электроэнергии и тепла на органическом топливе;
v холодильник для бытовых и промышленных холодильников и кондиционеров
v двигатель для высотной винтовой авиации, в т.ч. для долгих (месяцы, годы) полетов, и т.д
Прорывной проект по созданию двигателя с внешним подводом теплоты (двигателя Стирлинга[10]) четвертого поколения, на базе которого можно создать более эффективные во всех отношениях силовые установки, имеет принципиальное отличие от выпускающихся аналогичных двигателей. Уникальность представленной концепции заключается в том, что новый двигатель будет иметь несколько принципиальных усовершенствований, которые позволят создаваемому двигателю занять лидирующие позиции в двигателестроении.
Двигатель с внешним подводом теплоты давно востребован на рынке, но до сих пор в России серийно не выпускается, причина нет достойных разработанных конструкций, позволяющих вкладывать в них деньги. Попытки некоторых компаний разработать свой вариант двигателя не находили претворения по причине классического (автомобильного) подхода к решению проблем двигателя. Нестандартный подход к решению технических проблем показал, что эти решения существуют и они кардинально повышают эффективность двигателя.
Разработка АДВПТ достаточно наукоемкая, плагиаторам быстро повторить (скопировать) разработку не получится. Двигатель будет пользоваться огромным спросом, т.к. он решает массу задач, которые трудно решить существующими методами, он имеет характеристики значительно лучшие, чем продукт аналогичного назначения, имеющийся на рынке, его показатели недоступны для конкурирующих образцов. В свете его стратегического характера, его цена может быть очень высокой, что даст высокую маржу и возможность развивать другие конструкции. Длинный жизненный цикл позволит получать доход с услуг по обслуживанию, модернизации, ремонту двигателей. Двигатель очень перспективен для применения в разных областях народного хозяйства, что дает высокую степень системной инновационности, позволит создать технологическое дифференцирование на рынке и диверсифицированный портфель инновационных продуктов и услуг, т.е. позволит иметь различные варианты и номенклатуру исполнения для различных применений, что в свою очередь позволит уменьшить инновационные риски. Это идеальный проект для инвестирования, который позволит многие годы извлекать из него высокую прибыль и стать лидером в отрасли. адиабатный процесс газ двигатель
Финансовый риск производства двигателей с внешним подводом теплоты в условиях дефицита энергетических ресурсов минимальный, т.к. сделать неработоспособный двигатель с предлагаемым бесшатунным преобразователем движения практически невозможно. К тому же, любой успешный бизнес связан с продажей трех вещей - того, что делается, того, как это делается, и акций фирмы. В техническом плане риски незначительны, т.к. существует множество решений для обхода появляющихся трудностей.
2. Применение адиабатного процесса в природе
Число подобных примеров можно увеличить практически неограниченно. Все они говорят о том, что процессы в природе имеют определенную направленность, никак не отраженную в первом законе термодинамики. Все процессы в природе протекают только в одном определенном направлении. В обратном направлении самопроизвольно они протекать не могут. Все процессы в природе необратимы, и самые трагические из них старение и смерть организмов. Уточним понятие необратимого процесса. Необратимым процессом может быть назван такой процесс, обратный которому может протекать только как одно из звеньев более сложного процесса. Так, в примере с маятником можно вновь увеличить амплитуду колебаний маятника, подтолкнув его рукой. Но это увеличение амплитуды возникает не само собой, а становится возможным в результате более сложного процесса, включающего толчок рукой. Можно в принципе перевести теплоту от холодного тела к горячему, но для этого нужна холодильная установка, потребляющая энергию, и т. д.
Математически необратимость механических процессов выражается в том, что уравнения движения макроскопических тел изменяются с изменением знака времени. Они, как говорят, не инвариантны при преобразовании t -t. Ускорение не меняет знака при t-t.Силы, зависящие от расстояний, также не меняют знака. Знак при замене t на -t меняется у скорости. Именно поэтому при совершении работы силами трения, зависящими от скорости, кинетическая энергия тела необратимо переходит во внутреннюю. Хорошей иллюстрацией необратимости явлений в природе служит просмотр кинофильма в обратном направлении. Например, падение хрустальной вазы со стола будет выглядеть следующим образом. Лежащие на полу осколки вазы устремляются друг к другу и, соединяясь, образуют целую вазу. Затем ваза возносится вверх и вот уже спокойно стоит на столе. То, что мы видим на экране, могло бы происходить в действительности, если бы процессы можно было обратить. Нелепость происходящего проистекает из того, что мы привыкли к определенной направленности процессов и не допускаем возможности их обратного течения. А ведь такой процесс, как восстановление вазы из осколков, не противоречит ни закону сохранения энергии, ни законам механики, ни вообще каким-либо законам, кроме второго закона термодинамики.
Процессы в природе необратимы. Наиболее типичными необратимыми процессами являются:
1)переход теплоты, от горячего тела к холодному;
2)переход механической энергии во внутреннюю.
Заключение [11]
Адиабатный процесс -- это процесс, происходящий без теплообмена системы с окружающей средой, т.е. Q = 0. Первый закон термодинамики имеет вид:
ДU+A=0?A=?ДU.
Это значит, что при адиабатном процессе система может выполнять работу над внешними телами только за счет убыли своей внутренней энергии. Если А > 0, то ДU = -A 0.
Таким образом, при адиабатном расширении газ совершает работу и сам охлаждается. Наоборот, при адиабатном сжатии А 1 -- показатель адиабаты (или коэффициент Пуассона). Это уравнение называется уравнением адиабаты или уравнением Пуассона.
Адиабатное изменение состояния газа можно выразить графически. График этого процесса называют адиабатой. При одних и тех же начальных условиях (p0, V0) при адиабатном расширении давление газа уменьшается быстрее, чем при изотермическом (рис. 2), так как падение давления вызвано не только увеличением объема (как при изотермическом расширении), но и понижением температуры. Поэтому адиабата идет ниже изотермы и газ при адиабатном расширении совершает меньшую работу, чем при изотермическом расширении.
При быстром сжатии (расширении) теплообмен произойти не успевает и процессы можно рассматривать как адиабатные (неравновесные). Поэтому любой газ при быстром сжатии нагревается (например, нагревание насоса при накачивании велосипедной шины). При сильном и быстром сжатии воздуха температура может повыситься настолько, что при наличии в воздухе паров бензина они воспламеняются. Это используется в дизельных двигателях для зажигания горючей смеси. Этим объясняется необходимость специального охлаждения мощных компрессоров.
Охлаждение воздуха при адиабатном расширении вызывает образование облаков.
Приложение
Совершение над газом работы на элементарном участке
Ван Марум Мартин (20.03.1750-26.12.1837) -- нидерландский физик и ботаник. Родился в Делфте. Окончил Гронингенский университет (1773). В 1776 -- 80 был врачом в Гарлеме, с 1783 -- директором кабинета любителей физики и естествознания (впоследствии музей Тейлора в Гарлеме).
Майкл Фарадемй (22 сентября 1791, Лондон --25 августа 1867, Лондон) -- английский физик-экспериментатор ихимик. Член Лондонского королевского общества (1824) и множества других научных организаций, в том числе иностранный почётный член Петербургской академии наук (1830).
Рауль Пикте (4 апреля 1846- 27 июля 1929) -- швейцарский физик. Первым получил жидкий азот.
Врублевский Сигизмунд Флорентий Антонович (28 октября 1845, Гродно -- 16 апреля 1888,Краков) -- польский физик и химик, профессор Ягеллонского университета в Кракове, в 1883 году совместно с К. Ольшевским впервые получил в измеримых количествах жидкий кислород.
Ольшевский Кароль (29.I.1846 - 24.III.1915) -- польский физик и химик, член Польской (Краковской) АН (1888). Родился в Бронишове Тарновском. Учился в Ягеллонском ун-те в Кракове, окончил Гейдельбергский ун-т (1872). С 1876 -- профессор Ягеллонского Краковского ун-та.
Джеймс Дьюар (20 сентября 1842, Кинкардин-он-Форт, Шотландия -- 27 марта 1923, Лондон) -- шотландский физик и химик.
В 1861 г. Окончил Эдинбургский университет. В 1867--1869 гг. стажировался в Боннском университете у Ф. А. Кекуле. С 1869 г. работал в Ветеринарном колледже Эдинбурга. В 1875--1923 гг.-- профессор Кембриджского университета, в 1877--1923 гг. -- лондонского Королевского института. Президент Лондонского химического общества с 1897 по 1899 г.
Хейке Камерлинг-Оннес (21 сентября 1853, Гронинген -- 21 февраля 1926, Лейден) -- голландскийфизик и химик, лауреат Нобелевской премии по физике 1913 года.
Ромберт Стимрлинг (25 октября 1790, Клог Фарм, Шотландия -- 6 июня 1878, Галстон, Шотландия) -- шотландский священник, изобретатель двигателя Стирлинга.

Среди различных явлений, происходящих с газами, важную роль играет адиабатный процесс. Он широко используется в технике и часто встречается в Природе. Рассмотрим его суть более подробно.
Адиабатный процесс
При изучении законов газовых процессов (изопроцессов) для изменения внутренней энергии газа используется обмен теплом с внешними источниками. Например, в изохорическом процессе, когда объем газа не меняется, увеличение внутренней его энергии возможно за счет внешнего нагрева. Обмен теплом также происходит и в изобарическом и изотермическом процессах.
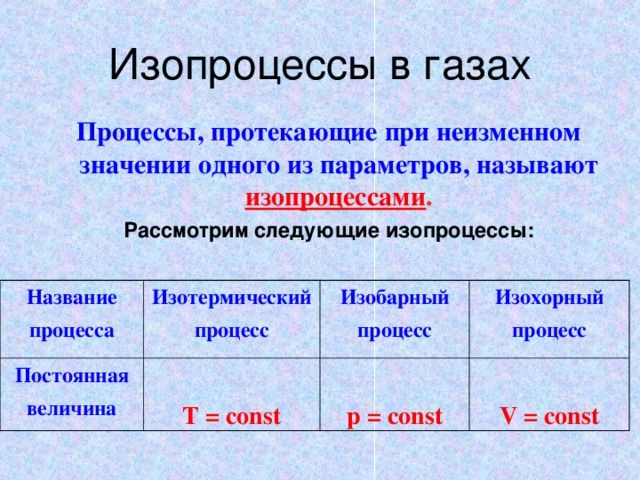
Рис. 1. Три изопроцесса в газах.
Однако, состояние газа и его внутренняя энергия могут меняться и без теплового обмена с внешними источниками. Такой процесс, для которого количество подведенного тепла равно нулю ($Q=0$), называется адиабатным.
Для того, чтобы газовый процесс был приближен к адиабатному в реальных условиях, существует два способа (и их комбинация). Во-первых, можно окружить систему толстой теплоизолирующей оболочкой, сильно замедляющей обмен теплом. Во-вторых, процесс можно проводить очень быстро, при этом теплообмен просто не успеет произойти.
На первый взгляд, может показаться, что если к системе не подводится тепло, то она не может совершать работу. Однако, это не так. Согласно Первому Закону термодинамики, изменение внутренней энергии системы равно сумме работы внешних сил и количества тепла переданного системе:
А это значит, что в адиабатном процессе совершение работы возможно. Но вся эта работа будет произведена за счет изменения внутренней энергии газа.
График адиабаты
Характеристикой внутренней энергии газа является его температура. То есть, если в адиабатном процессе производится работа, то это происходит с обязательным изменением температуры. Например, если работа положительна, и внешние силы сжимают газ, то его температура увеличится, газ нагреется.
Отсюда следует, что давление газа при сжатии в адиабатном процессе будет расти быстрее, чем в изотермическом. В адиабатном процессе давление будет повышаться не только за счет уменьшения объема, но и за счет увеличения температуры. То есть, график адиабаты в координатах $p-V$ внешне будет похож на график изотермы, но пройдет более круто.

Рис. 2. Aдиабата и изотерма в pV.
Можно вывести математические уравнения данных процессов:
Параметр $\gamma$ в формуле адиабатного процесса называется показателем адиабаты. Для реальных газов в нормальных условиях показатели адиабаты несколько больше единицы, и равны:
Газ
Показатель
Фактически, изотерму можно представить адиабатой, с показателем адиабаты $\gamma=1$.
Адиабатные процессы в Природе и технике
Поскольку при быстром сжатии и расширении газа теплообмен очень невелик, адиабатные процессы широко используются в технике, и играют большую роль в атмосферных явлениях в Природе.
Например, в двигателях внутреннего сгорания горючая смесь после впуска в цилиндр в течение короткого времени сжимается, а затем, после воспламенения смеси в течении короткого времени расширяется. Таким образом, такты сжатия и рабочего хода в двигателях являются хорошими примерами адиабатного процесса.
Значительный нагрев газа при адиабатном процессе используется в дизельных двигателях. В этих двигателях нет систем для поджигания сжатой топливовоздушной смеси. В дизеле происходит сжатие атмосферного воздуха, сильнее, чем в бензиновом карбюраторном двигателе. А в конце сжатия топливо впрыскивается в цилиндр с помощью специальной форсунки. В этот момент воздух имеет температуру, достаточную для самовоспламенения впрыснутой горючей смеси, температура сгоревшей топливовоздушной смеси резко возрастает, смесь расширяется, толкая поршень и совершая полезную работу.
Природные адиабатные процессы играют значительную роль в формировании погоды. Нагретые массы воздуха быстро поднимаются вверх и расширяются. В результате их температура падает ниже точки росы, и влага, содержащаяся в воздухе, конденсируется в облака. Однако, при снижении снова происходит адиабатное сжатие, температура повышается, и облачные капли у нижней границы облаков снова превращаются в пар.
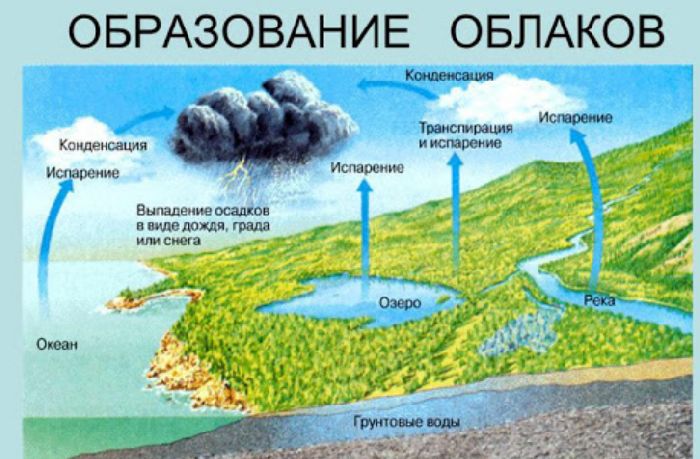
Рис. 3. Образование облаков.
Что мы узнали?
Адиабатный процесс – это газовый процесс, при котором не происходит теплообмена с внешней средой. Работа при адиабатном процессе может быть совершена только за счет изменения внутренней энергии. На графике $p-V$ график адиабаты похож на график изотермы, но пройдет более круто.
Адиабатный или адиабатический процесс — медленно протекающий процесс при отсутствии обмена тепловой энергией с окружающей средой.
Этапы открытия
Уравнение процесса
Адиабатный процесс происходит при одновременном изменении всех трех параметров газообразного вещества V, p, Т. Зависимость данных величин друг от друга представлено формулой Клапейрона-Менделеева. В дополнении для описания процесса применяют уравнение Пуассона, в котором отражена зависимость параметров давления и объема газа. Применяя первый принцип термодинамики к адиабатному процессу идеального газа, можно вывести следующее уравнение:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Исключая из формулы выражение \(dT\) по уравнению Клапейрона-Менделеева, получается следующее соотношение:
\(dT=\frac\left(pdV+V dp \right)\)
В итоге получается уравнение:
Согласно уравнению Майера:
Необходимо подставить эту формулу, а также поделить числитель и знаменатель дроби перед скобками на \(CV\) и обозначить \(CP/CV\) — \(\gamma\)
Из чего следует:
\(V dp + \gamma pdV=0\)
Почленно поделив уравнение на произведение \(pV\) , можно вывести следующую формулу:
Если данную формулу проинтегрировать, то в результате получится следующее соотношение:
\(\ln p+\gamma \ln V=\ln C\)
Где С представляет собой постоянную интегрирования.
Если пропотенциировать последнюю формулу, то в итоге получается уравнение Пуссона
Следует отметить, что \(\gamma\) определяется природой газообразного вещества. К примеру, для воздуха \(\gamma=1,42.\)
Как провести процесс, что необходимо
Адиабатный процесс представляет собой термодинамический процесс, для которого необходима теплоизолированная система и полное отсутствие теплообмена с окружающей средой. Во время практического опыта \(Q\;=\;0\) . Исходя из первого закона термодинамики, вся выполненная работа расходуется, чтобы изменить внутреннюю энергию системы:
В условиях реальности подобных результатов достичь практически невозможно. Это связано с отсутствием идеальных изоляторов тепла. Однако существуют способы приблизиться к подобным условиям. К примеру, с помощью применения оболочек с низкими показателями теплопроводности, функционирующих по принципу термоса. Также при достаточно высокой скорости осуществления адиабатного процесса обмен теплом между системой и окружающей средой будет длиться в течение непродолжительного времени, поэтому им можно пренебречь.
Как определить работу газа в адиабатном процессе
Во время опыта можно определить следующие характеристики:
Согласно первому принципу термодинамики, адиабатный процесс в таком случае будет записан следующим образом:
\(\delta Q+\delta A=0\)
Из данного уравнения можно сделать вывод, что:
Таким образом, особенностью адиабатного процесса является выполнение работы исключительно за счет внутренней энергии системы.
В условиях идеального газа формула приобретает следующий вид:
Таким образом, наблюдается снижение температуры газа по причине его работы, направленной против внешних сил, в условиях адиабатного процесса. При этом, если работа выполняется над газообразным веществом, его температура будет повышаться.
Применение адиабатного процесса в машинах
К процессам адиабатного сжатия и расширения газообразных веществ относят также сгущение и разрежение звуковых волн, которые наблюдаются в газах. Скорость звука достаточно велика и в воздухе составляет 340 метров в секунду. Поэтому при таких адиабатических процессах корректно пренебречь теплообменом, ввиду слишком короткого промежутка времени его протекания.
Подобный принцип применим в некоторых тепловых агрегатах. Кроме того, наблюдать адиабатическое сжатие воздуха и, как следствие, повышение его температуры можно при накачивании велосипедной камеры с помощью ручного насоса.
Путем быстрого сжатия газообразного вещества получают в результате возрастание внутренней энергии, которая соответствует величине выполненной работы. В итоге такого процесса температура газа повышается. Данное явление послужило основой инженерного решения, при котором топливная смесь самовозгорается в дизельных моторах.
В обратной ситуации, когда газ сам выполняет определенную работу, стремительно расширяясь, показатели внутренней энергии падают, температурные характеристики газообразного вещества также снижаются. Данное свойство используют для сжижения газов. Адиабатный процесс проявляется так же, как взрыв, плавление предохранителя при коротком замыкании.
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам

Описание презентации по отдельным слайдам:

АДИАБАТНЫЕ ПРОЦЕССЫ В АТМОСФЕРЕ

Когда часть воздуха в атмосфере поднимается то, попадая в область более низкого давления, она начинает расширяться. Это расширение часто можно считать адиабатным так как за время подъема теплообмен между поднимающейся массой воздуха, которая достаточно велика по объему, и окружающей средой просто не успевает произойти. Адиабатным по аналогичной причине можно считать и сжатие опускающихся воздушных масс

Теория адиабатных процессов основывается на уравнении первого закона термодинамики в форме: ∆U=Aвнеш Из этого уравнения видно, если Авнеш>0 внутренняя энергия газа увеличивается так как при этом ∆U>0 и поэтому газ нагревается, с учётом формулы Aвнеш=-р внеш∆U следует что происходит адиабатное сжатие газа . И наоборот, при адиабатном расширении газа когда Авнеш
Краткое описание документа:
С точки зрения термодинамики, суть адиабатического процесса заключается в отсутствии теплообмена между объектом и окружающим пространством. Это частный случай политропной реакции, потому что при нем газовая теплоемкость всегда равна нулю. Следовательно, подобная величина является постоянной.
История открытия
Ряд экспериментов, проведенных в начале XIX столетия, доказали существование атмосферного давления. Так, немецкий инженер Герике сконструировал магдебургские полушария. Из сферы выкачивался воздух, после чего они с трудом разъединялись — воздух давил на них.
Пример еще одного исследования, целью какого является изучение такого явления — опыт Роберта Бойля. Физик доказал, что если трубка запаяна с короткого конца, а в длинный налита ртуть, последняя не поднимется до верха. Ведь воздушными потоками уравновешивается давящая сила.

Дальтон опубликовал доклад, где называется особенность сгущения идеального газа. При нем выделяется тепло.
Обобщил накопившиеся знания Пуассон. По его мнению, температура при адиабатической реакции непостоянная, а, значит, закону Бойля — Мариотта необходима поправка — физик обозначил ее, как коэффициент k и выразил через соотношение теплоемкостей.
Важные нюансы
Термодинамический процесс в общем случае включает в себя теплообмен, работу, совершаемую системой и изменение внутренней энергии. Адиабатный по причине отсутствия обмена теплом сводится к последним двум.
Поэтому для него первое уравнение термодинамики приобретает вид: Δ U = - A. Приняты указанные обозначения:

- Δ U — преобразование внутренней мощности.
- A — прилагаемые внешней средой усилия.
Энтропия (S) не меняется в результате теплопередачи. Этот постулат описывается уравнением ΔS = ΔT=0. Здесь T — температура.
А также для расчетов используется такая величина, как адиабата идеального газа. Она обозначается буквой γ и вычисляется следующим образом: γ = C1/C2 (соотношение теплоемкостей).
Может подобный параметр выражаться и как количество степеней свободы. То есть γ = i + 2/ i.
Описание основных циклов
Физиками предлагается указанное определение процесса Карно: это идеальная цикличность, обеспечивающая работу тепловой машины с максимальным КПД. Наибольший и наименьший уровень разогрева совпадает с аналогичными показателями для рабочего устройства.
Среди условий для достижения нужного коэффициента полезного действия физики называют обратимость реакции, значит, следует исключить теплообмен между телами. Соответственно, преобразование тепла происходит лишь изотермически.

Обратный переход рабочего двигателя в исходную точку невозможен. Дело в том, что вся энергия затратится на восстановление изначального положения.
Работа четырехтактной двигательной системы осуществляется по схеме Отто, включающую в себя впуск, сжатие, рабочий вход и выпуск. Второй, третий и четвертый этапы считаются адиабатическими.
Прилагаемые в конце усилия равны разности мощности, с которой давят на газ и силы, затраченной на сжимание. Последнее повторяется до 7 раз (применяемая смесь зажигается принудительно).
Особенность адиабатической реакции заключается в невозможности теплообмена между окружающим пространством и объектом. С ее помощью можно объяснить, каким принципам подчиняется работа двигателя с четырьмя тактами и устройство с высокой отдачей.
Читайте также:

