Сочинение про радий по химии
Обновлено: 04.07.2024
Радий в природе и его свойства.
Несмотря на сравнительно малое время жизни по сравнению с возрастом Земли (около пяти миллиардов лет), некоторые изотопы радия, хотя и в очень малых количествах, встречаются в природе. Происходит это благодаря существованию в природе трех радиоактивных рядов, в которых изотопы радия непрерывно образуются при распаде долгоживущих (так называемых материнских) радионуклидов: урана-238 (из него получается 226 Ra), урана-235 (он дает 223 Ra, t1/2 = 11,4 суток) и тория-232 (дает 228 Ra и 224 Ra, t1/2 = 3,7 суток). Очевидно, что чем меньше период полураспада данного радионуклида, тем меньше его содержание в минералах, даже самый долгоживущий, 226 Ra, содержится в земной коре в количестве всего одной десятимиллиардной доли процента, обычно в тех же породах, в которых содержится уран.
Чистый радий – блестящий серебристо-белый металл, быстро тускнеющий на воздухе из-за образования на его поверхности оксида и нитрида. С водой реагирует более энергично, чем барий, выделяя водород. Плавится радий при 969° С, кипит при 1507° С, плотность – около 6 г/см 3 . Любые физические и химические свойства радия изучать трудно из-за его очень высокой радиоактивности. Радий непрерывно выделяет теплоту, и если нет условий для теплоотвода, металл быстро нагревается и может даже расплавиться. Продукт распада радия – радиоактивный газ радон. Радий вместе с продуктами своего распада излучает все три вида радиации – a-, b- и g-лучи. Из-за высокой радиоактивности радий и его соединения светятся в темноте, его бесцветные соли быстро желтеют, а затем приобретают коричневую, вплоть до черной, окраску; их водные растворы разлагают воду, выделяя из нее водород и кислород.
Если не считать сильной радиоактивности, химические свойства радия и его соединений мало отличаются от аналогичных свойств бария. Как и у бария, легко растворимы хлорид, бромид, иодид, нитрат радия, а фторид, карбонат и сульфат почти нерастворимы. Гидроксид Ra(OH)2 – сильная щелочь.
В поисках новых радиоактивных элементов.

Используя этот метод, Кюри начала тестировать одно вещество за другим – все, которые она только могла достать, одолжить в химических лабораториях, выпросить в минералогических музеях (она не только аккуратно возвратила образцы владельцам, но и выразила им благодарность в своей публикации). Из всех веществ, не содержащих уран, активность проявили только соединения тория.
Неожиданными оказались количественные результаты измерений. Так, взятый у Муассана металлический уран (он был получен восстановлением оксида углем и содержал примесь углерода) дал ток 23–24 пА; природный монацит (смешанный фосфат редких земель и тория) – 5 пА; чрезвычайно редкий минерал самарскит (смесь оксидов редкоземельных элементов, U, Fe, Nb, Ta и Ti) – 11 пА; черный торит ThSiO4 (обычно содержит примесь урана) – 14 пА, а прозрачные оранжевые кристаллы оранжита (невыветренный силикат тория) – 20 пА; черный оксид урана U2O5 – 27 пА; урановая смоляная руда (урановая смолка) из разных источников (она образует минералы уранинит или настуран примерного состава UO2) – от 16 до 83 пА; желтый минерал отенит Ca(UO2)2(PO4)2·(10–12)H2O – 27 пА; редкий природный минерал хальколит (торбернит) красивого зеленого цвета Cu(UO2)2(PO4)2·(8–12)H2O – 52 пА; желтый минерал карнотит K2(UO2)2V2O8·3H2O – 62 пА.
Все известные элементы были уже изучены и не обладали нужным свойством. Химический анализ радиоактивных минералов соответствовал их формуле, это означало, что нового элемента в этих минералах исключительно мало, поэтому этот элемент (возможно, не он один) быть очень активным! Как только стало ясно, что в урановых и ториевых рудах содержится неизвестное вещество с очень высокой радиоактивностью, началась работа по его выделению. Завершилась она выдающимся открытием новых химических элементов – полония и радия.
Стало ясно, что в урановой смолке присутствует неизвестный радиоактивный элемент (или несколько элементов). Тщательный химический анализ этого вещества привел в 1898 к открытию нового радиоактивного элемента – полония.
В первом исследовании урановой смолки супруги Кюри упустили важное обстоятельство. Оказалось, что если из азотнокислого раствора осадить сульфат бария (потом его перевели в растворимый хлорид), он обнаруживает радиоактивность. Стало очевидным, что это еще один радиоактивный элемент – на этот раз аналог не висмута, а бария. Для того чтобы сконцентрировать этот элемент, был использован метод многократной перекристаллизации – тот самый, с помощью которого были разделены очень близкие по свойствам редкоземельные элементы. В данном случае он был основан на разной растворимости солей бария и радия. Так, в 100 г воды при 20° С растворяется 35,7 г хлорида бария, а хлорида радия – почти в два раза меньше, поэтому если из раствора выделить в осадок 1/3 хлорида бария, то хлорида радия выделится 2/3. По этому методу (он называется фракционной кристаллизацией) раствор хлоридов частично выпаривают до образования кристаллов, в которых доля радия выше, чем в растворе. Эти кристаллы снова растворяют и повторяют все сначала. Таким образом, доля радия в выпадающих кристаллах постепенно растет. Раствор, обедненный радием, не выбрасывают, а подвергают дробной кристаллизации. Кроме бария и радия (и урана) исходный минерал содержал довольно много свинца, кремния, тантала, протактиния, железа, тория, актиния, полония, и все эти элементы следовало предварительно отделить от бария (с ничтожной примесью радия). Этот метод требует очень большого числа операций, но другого способа выделить новый элемент не было. На каждой стадии соответствующую фракцию с помощью электрометра проверяли на радиоактивность и таким образом контролировали степень обогащения.
Постепенно супруги Кюри (с помощью Бемона) получили препарат бария, который был в 60 раз активнее, чем чистый уран, после еще нескольких перекристаллизаций – уже в 900 раз более активный, Но опыты пришлось прекратить: последняя, самая активная, фракция была такой маленькой, что дальше работать с ней было уже невозможно – для выделения нового элемента нужны были не граммы, и даже не килограммы руды, а тонны.
С этой радиоактивностью не все было в порядке. Так, 13 июля 1899 П.Кюри отметил в лабораторном журнале непонятный факт – препарат сульфата радия, активность которого в начале года составляла от 150 до 200 единиц, в середине июля показывал уже 600. На той же странице – аналогичная запись М.Кюри – карбонат радия с активностью 1200 вдруг через полгода показал активность 3000. Объяснить это супруги не могли, лишь впоследствии из работ Резерфорда стало известно, что из радия образуются другие короткоживущие радиоактивные элементы, так что только a-активность радия должна примерно через три недели увеличиться вчетверо. Но при одном условии: препарат должен находиться в закрытом сосуде, так как первый продукт превращения радия – газообразный радон.
Как выяснилось, и 100 кг было мало. Урановую смолку добывали в Богемии (латинизированное название Чехии), вблизи знаменитых шахт Иоахимсталя (ныне – город в Чехии Яхимов). Урановую руду сплавляли с содой при доступе воздуха. Плав обрабатывали сначала водой – уран при этом переходил в раствор в виде карбонатного комплекса, затем разбавленной серной кислотой – получался сульфатный комплекс урана. Соединения урана использовали для производства дорогого богемского уранового стекла и глазури по фарфору. Остаток руды после извлечения урана, который содержал весь радий, выбрасывали, и постепенно скопились целые горы отходов, которые сваливали в ближайшем сосновом лесу. Супруги Кюри в конечном счете получили не 100 кг, а более 10 тонн.
Выделение радия.
Работа предстояла огромная – химическая переработка (вручную) многих тонн материала; она заняла четыре года. Вначале остатки кипятили с большим избытком концентрированного раствора соды – при этом содержащиеся в них не растворимые ни в воде, ни в кислотах сульфаты бария и радия (и частично кальция) переходили в карбонаты: Ba(Ra)SO4 + Na2CO3 ® Ba(Ra)CO3 + Na2SO4. Раствор Na2SO4 сливали, а осадок карбонатов бария и радия уже легко растворялся в разбавленной соляной кислоте: Ba(Ra)CO3 + 2HCl ® Ba(Ra)Cl2 + CO2 + H2O. Раствор отфильтровывали от примесей и добавлением серной кислоты из него снова выделяли сульфаты кальция, бария и радия – их получалось от 10 до 20 кг из тонны исходного вещества. Затем весь цикл повторяли, пока не получались чистые соли бария и радия (примерно 8 кг из тонны), отделенные от более растворимого кальция. Использовали и другие химические приемы, необходимые для отделения радия от следов других радиоактивных элементов. Так, свинец, висмут и сопровождающий его полоний осаждали сероводородом в виде нерастворимых сульфидов. Актиний осаждался вместе с железом, алюминием и редкоземельными элементами с помощью раствора аммиака. Затем методом дробной кристаллизации выделяли все более чистую соль радия. По мере увеличения доли радия выпадающие вначале бесцветные кристаллы со временем под действием собственного излучения желтели, затем становились оранжевыми или розовыми, а после растворения снова дали бесцветный раствор.
Сама Кюри много лет спустя призналась, что не уверена, проявила ли бы она такую настойчивость, если бы знала, как мало радия содержится в руде и какая титаническая работа предстоит для получения хотя бы мизерного его количества. Для работы директор Школы выделил им старый сарай с застекленной крышей, где раньше была прозекторская. По подсчетам австрийского физика Стефана Мейера (1872–1950) М.Кюри пришлось переработать вручную свыше 11 тонн отходов, неудивительно, что к вечеру она буквально падала от усталости. Тем не менее, впоследствии она признавалась, что именно в этом сарае провела свои лучшие и счастливейшие годы.
Затем появились помощники и работа пошла быстрее.Весной 1902, после переработки тонны урановых отходов, масса радия (в виде RaCl2) достигла 0,1 г. Позднее подсчитали, что тонна урановой смолки теоретически содержит 0,17 г радия в виде хлорида. Таким образом, потери оказались сравнительно невелики, если учесть колоссальный объем работы в неподходящих условиях и исключительно малое содержание радия в руде: 34 миллионные доли процента. Это и позволило В.Маяковскому написать известные строчки:
та же добыча радия.
единого слова ради,
Чистота препарата была подтверждена Демарсе с помощью спектрального анализа. Полученного вещества было достаточно, чтобы определить атомную массу радия традиционным методом: точную навеску RaCl2 растворяли, осаждали нитратом серебра нерастворимый AgCl, который высушивали и взвешивали. Получилось 225 – именно это значение стояло на месте предполагаемого, еще не открытого элемента в таблице, помещенной Менделеевым в первом издании своего учебника Основы химии.
По мере увеличения количества добытого радия стало возможным более подробно исследовать его свойства, а также свойства его соединений. Оказалось, что под влиянием собственного излучения как сами бесцветные соединения радия, так и стеклянные сосуды, в которых они хранятся, со временем темнеют. Все соединения радия в темноте испускают голубоватое свечение (светятся возбужденные атомы азота).
Пьер и Мария Кюри обнаружили потемнение стекла под влиянием излучения радия (сейчас стекла для очков тонируются тоже с помощью радиации). Немецкий физик Ф.О.Гизель обнаружил, что лучи радия окрашивают и природные кристаллы каменной соли (NaCl) и плавикового шпата (CaF2). Он же показал, что RaBr2 окрашивает пламя в карминовый цвет (как стронций), а в спектре радия есть линии в красной, сине-зеленой и фиолетовой областях спектра.
В 1910 М.Кюри и Дебьерн впервые получили металлический радий. Они использовали метод, примененный ранее для выделения бария. Для этого водный раствор RaCl2 был подвергнут электролизу с ртутным катодом и платино-иридиевым анодом. Образовавшуюся на катоде амальгаму радия нагревали в потоке водорода, постепенно повышая температуру до 700° С (почти до плавления радия), чтобы отогнать ртуть (она кипит при 357° С).
Отказ супругов Кюри на извлечение материальных выгод из своего открытия открыл дорогу к получению и применению радия для ученых всех стран. Начали выходить специальные журналы, посвященные радию и радиоактивности. В 1913 осуществилась мечта Пьера Кюри – в Париже был организован Институт радия. Руководителем одной из двух его лабораторий была Мария Кюри. В том же году был основан Национальный институт радия в США. Еще раньше, в 1910, Институт радия открылся в Вене, его директором был назначен Стефан Мейер. В 1913 лаборатория по радиоактивности открылась в Варшаве. В 1932 при активной помощи сестры Марии Брониславы был создан варшавский Институт радия (ныне – Онкологический институт имени Марии Склодовской-Кюри). В 1922 Радиевый институт был основан в Петрограде; его директором стал В.И.Вернадский (1863–1945). За год до этого в нашей стране первые препараты радия из отечественной ферганской руды получили радиохимик Виталий Григорьевич Хлопин (в будущем – академик и директор Института) и физикохимик и металлург Иван Яковлевич Башилов (1892–1953), предложивший технологию извлечения радия, урана и ванадия (эти элементы содержатся в минерале карнотите).
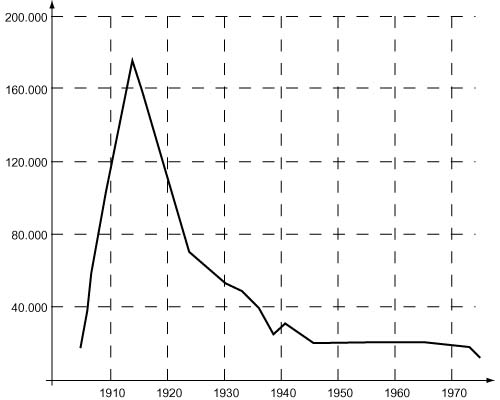
Цена на радий начала стремительно расти и вскоре значительно превысила стоимость алмазов (в середине 1910-х – почти 180 тыс. долл. за грамм). При тогдашней цене золота (35 долл. за унцию) 1 г радия стоил столько же, сколько 160 кг золота.
Резкое подорожание радия в начале века было связано также с тем, что в конце 1903 австрийское правительство наложило эмбарго на вывоз из Иоахимсталя как самой урановой руды, так и остатков от ее переработки и вскоре само построило там завод по добыче радия. К 1910 на нем получили уже 13 граммов радия, и до 1922 этот завод оставался европейским лидером по производству радия. Огромная цена радия стимулировала поиск его руд и добычу на всех континентах. В 1920–1930-е один за другим открывались новые предприятия по переработке урановых руд и добыче радия – как на своем сырье, так и на привозном. Завод в Ножане, организованный еще Пьером Кюри, работал на разнообразном сырье: урановую смолку ввозили из Венгрии, Швеции, Канады и Колорадо, отенит добывался в самой Франции, а также привозился из Португалии, хальколит – из Богемии, карнотит – из Португалии и Юты (США), а торианит (содержащий уран ThO2) – даже из Цейлона. Добывали торианит и в Японии. В Лондоне перерабатывали руду, добываемую на шахтах юго-западной оконечности Англии (полуостров Корнуолл), часть этой руды перевозили также на переработку во Францию. На заводе близ Стокгольма радий добывали из собственных урансодержащих сланцев и урановой смолки из Норвегии (которая в 1905 стала независимой). В Австралии радий получали из руд, найденных в южных пустынях.
Россия включилась в гонку в 1910, переработку вела частная компания в Фергане, хотя руда оказалась довольно бедной. Во время войны работа прекратилась, но после революции был построен уже государственный завод на Каме, а в 1931 – еще один в Москве. Есть и позорные страницы в отечественной истории радия. Еще в 1930-е малограмотный горнорабочий И.Г.Прохоров начал рассказывать и писать в высокие партийные инстанции о своей мифической встрече в 1914 в Восточной Сибири с Марией Кюри, которая якобы лично подтвердила наличие богатых радиево-урановых месторождений в Минусинском уезде Енисейской губернии. Этот рассказ (вошедший даже в серьезные научные сборники) впоследствии был использован органами госбезопасности СССР для массовых репрессий против советских геологов в 1949 под предлогом сокрытия ими радиево-урановых месторождений.
Но вскоре радиевая промышленность США пришла в упадок: с 1921 начали разрабатываться месторождения в Бельгийском Конго (провинция Катанга), и в 1922 в Бельгии заработал завод близ Антверпена. Африканская руда оказалась очень богатой: она содержала в среднем 50% оксида урана, и если для получения 1 грамма радия в США надо было переработать 300–400 тонн карнотитовой руды, то заводу в Бельгии для того же требовалось всего 10 тонн. С 1922 по 1933 там было выделено 326 г радия. Пик добычи пришелся на конец 1920-х – 60 г радия в год. Но и бельгийцам пришлось сократить производство ввиду сильной конкуренции со стороны Канады. Руду там добывали с 1932 на побережье Большого Медвежьего озера, добыча радия в 1938 достигла 75 г. Данные за последующие годы были засекречены, так как отражали добычу нового стратегического сырья – урана, известно только, что производство радия в Канаде продолжалось до 1954, а в Бельгии – до 1960. С 1930-х весь рынок радия был под контролем бельгийских и канадских компаний. В небольшом количестве радий производили также в Англии, Франции, СССР. В Чехословакии его добывали (в Яхимове) вплоть до 1937.
Общее количество добытого радия увеличивалось быстрыми темпами. Если к 1916 во всем мире было получено 48 г радия, то через 10 лет его было уже 340 г. Постепенное накопление мировых запасов радия, который практически не расходуется (за 10 лет его количество уменьшается за счет распада менее чем на 0,5%), привело к быстрому снижению цены более чем вдвое к началу 1920-х, а затем еще в несколько раз в последующие десятилетия.
Тем не менее, радий оставался очень дорогим элементом. В настоящее время радия накоплено около 3 кг, и больше его практически не добывают. Более того, при переработке урановых руд радий считается вредным побочным продуктом, требующим безопасного захоронения!
Применение радия.
Сейчас радий находит лишь ограниченное применение и для этого его накопленных запасов более чем достаточно. В медицине радий иногда используют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта. Радий используют и как источник радона для приготовления радоновых ванн. Радий можно использовать и в компактных источниках нейтронов, для этого небольшие его количества помещают в ампулу вместе с бериллием, под действием альфа-излучения (ядер гелия) из бериллия выбиваются нейтроны: 9 Be + 4 He ® 12 C + 1 n. Однако сейчас есть множество более дешевых радионуклидов с нужными свойствами, которые получают на ускорителях или ядерных реакторах, например, 60 Co (с периодом полураспада t1/2 = 5,3 года), 137 Cs (t1/2 = 30,2 года), 182 Ta (t1/2 = 115 сут), 192 Ir (t1/2 = 74 сут), 198 Au (t1/2 = 2,7 сут). В приборах постоянного свечения радий также заменяют теперь тритием (t1/2 = 12,3 года) или 147 Pm (t1/2 = 2,6 года).
Радий сильно токсичен; допустимая его концентрация в воздухе исчезающе мала – не более 10 мг/км 3 или 10 –11 г/м 3 . При такой концентрации в 1 м 3 происходит чуть больше двух распадов атомов радия в секунду. Работа с радием и его препаратами, как и с другими радиоактивными веществами, требует строгого соблюдения защитных мер.
По названию этого химического элемента названо явление радиоактивности. Радий – самый радиоактивный металл на планете. Однако ему нашли применение ученые, геологи и врачи.

Что представляет собой
Радий – это химический элемент таблицы Д.И. Менделеева №88.
Металл цвета серебра – продукт многоступенчатого распада урана-238:
- В темноте радий испускает голубоватый свет. По этой характеристике его легко отличить от других элементов.
- В честь него назван феномен радиоактивности.
Радиоактивность измеряется в кюри (Ки). 1 Ки – это 37 миллиардов распадов ежесекундно.
Международное обозначение и формула элемента – Radium (Ra).
Как был открыт
Открытие радия (1898 год) – заслуга Марии Кюри:
В тонне урановой смолки, которую перерабатывали супруги Кюри, было 0,1 г радия.
- Первые образцы стали самым дорогим веществом на планете: цена 1 г радия превосходила стоимость двух центнеров золота.
Попутно Мария открыла элемент, который назвала полонием – в честь своей родной страны Польши.

Отопление радием-камин 21 века. Французская карточка 1910 года
За открытие радия Марии Склодовской-Кюри присудили в 1911 году Нобелевскую премию.
Название восходит к латинскому radius – луч. Так радиоактивный элемент назвали за постоянную светимость.
Ра – верховный бог Солнца у древних египтян.
Физико-химические характеристики
Химические свойства этого щелочноземельного металла сходны с барием, но проявляются интенсивнее:
- Реакция с водой сопровождается образованием водорода.
- На воздухе радий тускнеет, покрываясь оксидно-нитридным слоем.
- Образует самые прочные (из щелочноземельных металлов) соединения с органическими кислотами.

Главное свойство вещества – радиоактивность:
Благодаря радиоактивности радий, его соединения отсвечивают в темноте.
| Свойства атома | |
|---|---|
| Название, символ, номер | Ра́дий / Radium (Ra), 88 |
| Атомная масса (молярная масса) | 226,0254 а. е. м. (г/моль) |
| Электронная конфигурация | [Rn] 7s2 |
| Химические свойства | |
| Радиус иона | (+2e) 143 пм |
| Электроотрицательность | 0,9 (шкала Полинга) |
| Электродный потенциал | Ra←Ra2+ −2,916 В |
| Степени окисления | 2 |
| Энергия ионизации (первый электрон) | 1-й 509,3 (5,2785) кДж/моль (эВ) 2-й 979,0 (10,147) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | (при к.т.) 5,5 г/см³ |
| Температура плавления | 1233 K |
| Температура кипения | 2010 K |
| Уд. теплота плавления | 8,5 кДж/моль |
| Уд. теплота испарения | 113 кДж/моль |
| Молярная теплоёмкость | 29,3 Дж/(K·моль) |
| Молярный объём | 45,0 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,148 |
| Прочие характеристики | |
| Теплопроводность | (300 K) (18,6) Вт/(м·К) |
| Номер CAS | 7440-14-4 |
Нахождение в природе
Радий – рассеянный элемент, микроконцентрации обнаружены в различных объектах.

Радиоактивный элемент Радия
Элемент распределен по биосфере неравномерно:
- Главный источник металла – урановая руда.
- Радий всегда содержат руды тория.
- Вымываясь оттуда, попадает в воду, нефтяные, газоносные пласты. Найден во вторичных минералах свинца.
Тонна урана из урановой руды содержит 0,34 г радия. Тонна земной коры – 1 мкг.
За более чем 120 лет – со времени открытия – на Земле удалось получить полтора кг вещества.
Все природные изотопы радия сведены в таблицу:
| Изотоп | Историческое название | Семейство | Период полураспада | Тип распада | Дочерний изотоп (историческое название) |
|---|---|---|---|---|---|
| Радий-223 | актиний Х (AcX) | ряд урана-235 | 11,435 дня | α | радон-219 (актинон, An) |
| Радий-224 | торий Х (ThX) | ряд тория-232 | 3,66 дня | α | радон-220 (торон, Tn) |
| Радий-226 | радий (Ra) | ряд урана-238 | 1602 года | α | радон-222 (радон, Rn) |
| Радий-228 | мезоторий I (MsTh1) | ряд тория-232 | 5,75 года | β | актиний-228 (мезоторий II, MsTh2) |
Технология получения
- Радий выделяют из урановой руды, получение металла базируется на электролизе. Рабочим материалом выступают растворенный хлорид радия и ртуть как катод.
- Второй способ получения – из природных вод, которые выщелачивают радий из минералов с ураном в составе.
Производство относится к вредным: требуются специальные средства защиты, соблюдение правил техники безопасности.
Где используется
Использовать новое вещество начали сразу. Супруги Кюри не запатентовали продукт, считая его всеобщим достоянием. Предприимчивые граждане воспользовались этим.
Бум продержался двадцать лет, пока не была доказана опасность увлечения веществом.
Промышленность
Радий был микрокомпонентом светящейся краски. Ею снабжали циферблаты армейских компасов, часов, авиационных, морских приборов. В 1970-х радий заменили менее агрессивным тритием.

Советский армейский компас. Жёлтая краска содержит радий
Сферы применения единичны:
- В сплаве с бериллием – производитель альфа-частиц в радиево-бериллиевых накопителях нейтронов.
- Светящиеся составы (с сульфидом цинка).
- Маркер качества литья, сварных швов.
- Нейтрализация электростатических зарядов.
Применение вещества ограничивается главным недостатком – радиоактивностью.
Другие сферы
- Геологи применяют радиевые изотопы для определения возраста минералов, осадочных пород.
- Для геохимиков это индикатор движения океанской воды и концентрации урана.
- Ювелиры облучают радием драгоценные камни для улучшения цвета.
- Для медицины радий – источник газа радона (его добавляют в лечебные ванны). Кратковременное облучение радием – метод борьбы с онкологией.
Биологическое воздействие
Радий проникает в живые организмы:
- В растительном мире его больше в стволах деревьев.
- Организм животных и человека получает его с водой, пищей.
- Четыре пятых поступившего радия оседает в костях.
- Концентрация вещества определяется пищевым рационом и районом проживания.
По стандартам РФ, кубический метр воздуха не должен содержать более 0,000001 мкг радия.
Нанодозы вещества полезны, превышение чревато онкологией. Поэтому критически важно видеть барьер, после которого достоинства материала становятся недостатками.
Радий как химический аналог щелочных и щёлочноземельных породообразующих элементов, из которых состоят полевые шпаты. История его открытия, получения и применения. Физические и химические свойства элемента. Его биологическая роль и влияние на организм.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 11.02.2013 |
| Размер файла | 52,7 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
химический элемент радий
Радий -- элемент главной подгруппы второй группы, седьмого периода периодической системы химических элементов Д.И. Менделеева, с атомным номером 88. Обозначается символом Ra (лат. Radium).
Простое вещество радий (CAS-номер: 7440-14-4) -- блестящий щёлочноземельный металл серебристо-белого цвета, быстро тускнеющий на воздухе. Обладает высокой химической активностью. Радиоактивен; наиболее устойчив нуклид 226Ra (период полураспада около 1600 лет).
В России радий впервые был получен в экспериментах известного советского радиохимика В.Г. Хлопина.
В 1918 году на базе Государственного рентгеновского института было организовано Радиевое отделение.
Это отделение в 1922 году получило статус отдельного научного института.
Одной из задач Радиевого института были исследования радиоактивных элементов, в первую очередь -- радия.
Директором нового института стал В.И. Вернадский, его заместителем -- В.Г. Хлопин, физический отдел института возглавил Л.В. Мысовский [3].
Многие радионуклиды, возникающие при радиоактивном распаде радия, до того, как была выполнена их химическая идентификация, получили наименования вида радий А, радий B, радий C и т.д. Хотя сейчас известно, что они представляют собой изотопы других химических элементов, их исторически сложившиеся названия по традиции иногда используются:
2. Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время -- более столетия -- во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки, из которой супруги Кюри получили радий, содержит лишь около 0,0001 г радия-226. Весь природный радий является радиогенным -- возникает при распаде урана-238, урана-235 или тория-232; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468·109 лет)/(1602 года)=2,789·106. Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия или 1,02 мкг/т (кларк в земной коре).
Все природные изотопы радия сведены в таблицу:
Геохимия радия во многом определяется особенностями миграции и концентрации урана, а также химическими свойствами самого радия -- активного щёлочноземельного металла. Среди процессов, способствующих концентрированию радия, следует указать в первую очередь на формирование на небольших глубинах геохимических барьеров, в которых концентрируется радий. Такими барьерами могут быть, например, сульфатные барьеры в зоне окисления. Поднимающиеся снизу хлоридные сероводородные радийсодержащие воды в зоне окисления становятся сульфатными, радий осаждается с BaSO4 и CaSО4, где он становится практически нерастворимым постоянным источником радона. Из-за высокой миграционной способности урана и способности его к концентрированию, формируются многие типы урановых рудообразований в гидротермах, углях, битумах, углистых сланцах, песчаниках, торфяниках, фосфоритах, бурых железняках, глинах с костными остатками рыб (литофациями). При сжигании углей зола и шлаки обогащаются 226Ra. Также содержание радия повышено в фосфатных породах.
В результате распада урана и тория и выщелачивания из вмещающих пород в нефти постоянно образуются радионуклиды радия. В статическом состоянии нефть находится в природных ловушках, обмена радием между нефтью и подпирающими ее водами нет (кроме зоны контакта вода-нефть) и в результате имеется избыток радия в нефти.
При разработке месторождения пластовые и закачиваемые воды интенсивно поступают в нефтяные пласты, поверхность раздела вода-нефть резко увеличивается и в результате радий уходит в поток фильтрующихся вод. При повышенном содержании сульфат-ионов растворенные в воде радий и барий осаждаются в виде радиобарита Ва(Ra)SО4, который выпадает на поверхности труб, арматуры, резервуаров. Типичная объёмная активность поступающей на поверхность водонефтяной смеси по 226Rа и 228Rа может быть порядка 10 Бк/л (соответствует жидким радиоактивным отходам).
Основная масса радия находится в рассеянном состоянии в горных породах.
Радий -- химический аналог щелочных и щёлочноземельных породообразующих элементов, из которых состоят полевые шпаты, составляющие половину массы земной коры. Калиевые полевые шпаты -- главные породообразующие минералы кислых магматических пород -- гранитов, сиенитов, гранодиоритов и др.
Радий распадается на радон, уносящийся по порам и микротрещинкам и вымывающийся с грунтовыми водами. В природе иногда встречаются молодые радиевые минералы, не содержащие уран, например радиобарит и радиокальцит, при кристаллизации которых из растворов, обогащённых радием (в непосредственной близости от легкорастворимых вторичных урановых минералов), радий сокристаллизуется с барием и кальцием благодаря изоморфизму.
3. Получение радия
Получить чистый радий в начале ХХ в. стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало ХХ в. в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
4. Физические и химические свойства радия. ПрименениеРадий при нормальных условиях представляет собой блестящий белый металл, на воздухе темнеет (вероятно, вследствие образования нитрида радия). Реагирует с водой. Ведёт себя подобно барию и стронцию, но более химически активен. Обычная степень окисления -- +2. Гидроксид радия Ra(OH)2 -- сильное, коррозионное основание.
В настоящее время радий иногда используют в компактных источниках нейтронов, для этого небольшие его количества сплавляются с бериллием. Под действием альфа-излучения (ядер гелия-4) из бериллия выбиваются нейтроны:
9Be + 4He > 12C + 1n.
В медицине радий используют как источник радона для приготовления радоновых ванн (хотя в настоящее время их полезность оспаривается). Кроме того, радий применяют для кратковременного облучения при лечении злокачественных заболеваний кожи, слизистой оболочки носа, мочеполового тракта.
Однако в настоящее время существует множество более подходящих для этих целей радионуклидов с нужными свойствами, которые получают на ускорителях или в ядерных реакторах, например, 60Co (T1/2 = 5,3 года), 137Cs (T1/2 = 30,2 года), 182Ta (T1/2 = 115 сут.), 192Ir (T1/2 = 74 сут.), 198Au (T1/2 = 2,7 сут.) и т. д.
Отопление радием: камин 21 века. Французская карточка 1910 года
До 70-х годов XX века радий часто использовался для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных и морских приборов, специальных часов и других приборов), однако сейчас его обычно заменяют менее опасными изотопами: тритием (T1/2 = 12,3 года) или 147Pm (T1/2 = 2,6 года). Опасность таких приборов состоит в том, что они не содержали предупреждающей маркировки, выявить их можно только дозиметрами.
5. Биологическая роль
Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию -- около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон -- газообразный радиоактивный продукт распада радия.
Преждевременная смерть Марии Кюри произошла вследствие хронического отравления радием, так как в то время опасность облучения ещё не была осознана.
6. Интересные факты
В начале века, после своего открытия, радий считался полезным и включался в состав многих продуктов и бытовых предметов: хлеб, шоколад, питьевая вода, зубная паста, пудры и кремы для лица, краска циферблатов наручных часов, средство для повышения тонуса и потенции.
Подобные документы
Изучение истории открытия и развития производства радия. Исследование его физических и химических свойств, соединений. Технология получения радия из отходов переработки урановых руд. Методы разделения радия и бария. Действие элемента на организм человека.
курсовая работа [59,2 K], добавлен 08.03.2015
Общая характеристика элементов І группы, их химические и физические свойства, история открытия и особенности способов получения. Литий и его соединения. Закономерности в строении атомов щелочных металлов. Правила хранения некоторых элементов этой группы.
презентация [1,2 M], добавлен 30.11.2012
Кальций как один из самых распространенных элементов на Земле, его главные физические и химические свойства, история открытия и исследований. Нахождение элемента в природе, сферы его практического применения. Существующие соединения и биологическая роль.
контрольная работа [818,8 K], добавлен 26.01.2014
Характеристика брома как химического элемента. История открытия, нахождение в природе. Физические и химические свойства этого вещества, его взаимодействие с металлами. Получение брома и его применение в медицине. Биологическая роль его в организме.
презентация [2,0 M], добавлен 16.02.2014
История открытия кислорода. Нахождение элемента в таблице Менделеева, его вхождение в состав других веществ и живых организмов, распространенность в природе. Физические и химические свойства кислорода. Способы получения и области применения элемента.

Французские ученые Пьер и Мария Кюри обнаружили, что отходы, остающиеся после выделения урана из урановой руды (урановая смолка, добывавшаяся в городе Иоахимсталь, Чехия), более радиоактивны, чем чистый уран. Из этих отходов супруги Кюри после нескольких лет интенсивной работы выделили два сильно радиоактивных элемента: полоний и радий
| Вложение | Размер |
|---|---|
| radiy1.docx | 28.07 КБ |
Предварительный просмотр:
Муниципальное казённое общеобразовательное учреждение
Брединская СОШ №4
Ученик 11-ого класса
- Историческая справка
- Нахождение в природе
- Получение
- Физические свойства
- Химические свойства
- Применение
- Биологическая роль
- Изотопы
В России радий впервые был получен в экспериментах известного советского радиохимика В. Г. Хлопина. В 1918 году на базе Государственного рентгеновского института было организовано Радиевое отделение, которое в 1922 году получило статус отдельного научного института. Одной из задач Радиевого института были исследования радиоактивных элементов, в первую очередь — радия. Директором нового института стал В. И. Вернадский, его заместителем — В. Г. Хлопин, физический отдел института возглавил Л. В. Мысовский[3].
Нахождение в природе
Радий довольно редок. За прошедшее с момента его открытия время — более столетия — во всём мире удалось добыть всего только 1,5 кг чистого радия. Одна тонна урановой смолки , из которой супруги Кюри получили радий, содержит лишь около 0,1 г радия-226 . Весь природный радий является радиогенным — возникает при распаде урана-238 , урана-235 или тория-232 ; из четырёх найденных в природе наиболее распространённым и долгоживущим изотопом (период полураспада 1602 года) является радий-226, входящий в радиоактивный ряд урана-238. В равновесии отношение содержания урана-238 и радия-226 в руде равно отношению их периодов полураспада: (4,468 ⋅ 10 9 лет)/(1602 года)=2,789 ⋅ 10 6 . Таким образом, на каждые три миллиона атомов урана в природе приходится лишь один атом радия; кларковое число радия (содержание в земной коре) составляет ~1 мкг/т.
Геохимия радия во многом определяется особенностями миграции и концентрации урана, а также химическими свойствами самого радия — активного щёлочноземельного металла. Среди процессов, способствующих концентрированию радия, следует указать в первую очередь на формирование на небольших глубинах геохимических барьеров, в которых концентрируется радий. Такими барьерами могут быть, например, сульфатные барьеры в зоне окисления. Поднимающиеся снизу хлоридные сероводородные радийсодержащие воды в зоне окисления становятся сульфатными, сульфат радия соосаждается с BaSO 4 и CaSО 4 , где он становится практически нерастворимым постоянным источником радона. Из-за высокой миграционной способности урана и способности его к концентрированию формируются многие типы урановых рудообразований в гидротермах, углях, битумах, углистых сланцах, песчаниках, торфяниках, фосфоритах, бурых железняках, глинах с костными остатками рыб (литофациями). При сжигании углей зола и шлаки обогащаются 226 Ra. Также содержание радия повышено в фосфатных породах.
В результате распада урана и тория и выщелачивания из вмещающих пород в нефти постоянно образуются радионуклиды радия. В статическом состоянии нефть находится в природных ловушках, обмена радием между нефтью и подпирающими её водами нет (кроме зоны контакта вода—нефть) и в результате имеется избыток радия в нефти. При разработке месторождения пластовые и закачиваемые воды интенсивно поступают в нефтяные пласты, поверхность раздела вода—нефть резко увеличивается, и в результате радий уходит в поток фильтрующихся вод. При повышенном содержании сульфат-ионов растворенные в воде радий и барий осаждаются в виде радиобарита Ва(Ra)SО 4 , который выпадает на поверхности труб, арматуры, резервуаров. Типичная объёмная активность поступающей на поверхность водонефтяной смеси по 226 Rа и 228 Rа может быть порядка 10 Бк/л (соответствует жидким радиоактивным отходам).
Получить чистый радий в начале XX века стоило огромного труда. Мария Кюри трудилась 12 лет, чтобы получить крупинку чистого радия. Чтобы получить всего 1 г чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. Поэтому на начало XX века в мире не было более дорогого металла. За 1 г радия нужно было заплатить больше 200 кг золота.
Обычно радий добывается из урановых руд. В рудах, достаточно старых для установления векового радиоактивного равновесия в ряду урана-238, на тонну урана приходится 333 миллиграмма радия-226.
Радий - серебристо-белый металл, светится в темноте. Кристаллическая решетка металлического радия кубическая. Температура плавления - 969°C, температура кипения - 1507°C, плотность - 5,5-6,0 г/см3. Ядра Ra-226 испускают альфа-частицы с энергией 4,777МэВ и гамма-кванты с энергией 0,188 МэВ. За счет этого 1 г Ra выделяет 550 Дж/ч теплоты и металл быстро нагревается. В процессе распада радия образуется радиоактивный газ радон:
Читайте также:

