Сочинение про алюминий по химии 9 класс
Обновлено: 07.07.2024
§ 16. Алюминий
Строение и свойства атомов. Алюминий Аl — элемент главной подгруппы III группы (IIIA группы) 3-го периода Периодической системы Д. И. Менделеева.
Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдаёт при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия — бора радиус атома меньше (у бора он равен 0,080 нм, у алюминия — 0,143 нм).
Кроме того, у атома алюминия появляется один промежуточный восьмиэлектронный слой (2ё; 8ё; Зё), который препятствует притяжению внешних электронов к ядру. Поэтому у атомов алюминия восстановительные свойства выражены гораздо сильнее, чем у атомов бора, который проявляет неметаллические свойства.
Почти во всех своих соединениях алюминий имеет степень окисления +3.
Алюминий — простое вещество. Серебристо-белый лёгкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами лёгкие и прочные сплавы.
Алюминий — очень активный металл. В ряду напряжений он находится сразу же после щелочных и щёлочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой плёнкой оксида, которая защищает металл от воздействия с компонентами воздуха и воды.
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем:
Эту реакцию вы наблюдаете при горении бенгальских огней и фейерверков.
Алюминий, как и все металлы, легко реагирует с неметаллами, особенно в порошкообразном состоянии. Для того чтобы началась реакция, необходимо первоначальное нагревание (за исключением реакций с галогенами — хлором и бромом), зато потом все реакции алюминия с неметаллами идут очень бурно и сопровождаются выделением большого количества теплоты:
Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:
А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Как вы уже знаете, оксид и гидроксид алюминия обладают амфотерными свойствами. Алюминий растворяется в водных растворах щелочей, образуя соли — алюминаты, которые называют комплексными1:
1 При взаимодействии гидроксида и оксида алюминия с растворами щелочей также образуются комплексные соли, например Na[Al(OH)4].
Алюминий широко используют в металлургии для получения металлов — хрома, марганца, ванадия, титана, циркония из их оксидов. Как вы помните, этот способ носит название алюминотермии. На практике часто применяют термит — смесь Fe3O4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты:
Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, поэтому этот процесс используют для сварки стальных изделий.
Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно. Алюминий можно получить электролизом — разложением расплава его оксида Аl2O3 на составные части с помощью электрического тока. Но температура плавления оксида алюминия около 2050 °С, поэтому для проведения электролиза необходимы большие затраты энергии.
Технически доступным металлом алюминий стал после того, как в 1886 г. американский и французский учёные Ч. Холл и П. Эру установили, что оксид алюминия хорошо растворяется в расплавленном при 1000 °С криолите, формула которого Na3AlF6, с образованием электропроводного расплава. Расплав оксида алюминия в криолите подвергают электролизу в специальных установках (рис. 63) на алюминиевых заводах.
Рис. 63.
Схема электролизной установки для получения алюминия:
1 — электролит — расплавленный криолит с добавками фторидов кальция и алюминия (для снижения температуры плавления) и оксид алюминия (добавляют периодически); 2 — угольный катод; 3 — угольный анод; 4 — корка из застывшего оксида алюминия, защищающая расплавленный алюминий от окисления; 5 — стальная ванна; 6 — патрубок для отбора расплавленного алюминия
Мировое производство алюминия постоянно увеличивается. В настоящее время он оттеснил на третье и последующие места медь и другие цветные металлы и стал вторым по значению металлом продолжающегося железного века.
Алюминий почти втрое легче стали и устойчив к коррозии, поэтому выгоднее стали в тех областях применения, где требуются эти свойства (рис. 64).
Рис. 64.
Основные области применения алюминия и его сплавов
Соединения алюминия. В природе алюминий встречается только в виде соединений и по распространённости в земной коре занимает первое место среди металлов и третье — среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет около 9% (по массе).
Укажем важнейшие природные соединения алюминия.
Алюмосиликаты. Эти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щёлочноземельных металлов. Они и составляют основную массу земной коры. В частности, алюмосиликаты входят в состав полевых шпатов — наиболее распространённых минералов и глин.
Боксит (рис. 65, а) — горная порода, из которой получают алюминий, содержит оксид алюминия Аl2O3.
Рис. 65.
Природные соединения алюминия:
а — боксит; б — корунд; в — рубин; г — сапфир
Корунд (рис. 65, б) — минерал состава Аl2O3, обладает очень высокой твёрдостью, его мелкозернистая разновидность, содержащая примеси, — наждак — применяется как абразивный (шлифовочный) материал.
Эту же формулу имеет и другое природное соединение — глинозём.
Хорошо известны прозрачные, окрашенные примесями кристаллы корунда: красные — рубины (рис. 65, в) и синие — сапфиры (рис. 65, г), которые используют как драгоценные камни. В настоящее время их получают искусственно и используют не только в ювелирном деле, но и для технических целей, например для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Оксид алюминия Аl2O3 — белое вещество с очень высокой температурой плавления. Может быть получен разложением при нагревании соответствующего ему гидроксида алюминия:
Гидроксид алюминия Аl(OН)3 выпадает в виде белого студенистого осадка при действии щелочей на растворы солей алюминия (рис. 66), например:
АlСl3(изб) + 3NaOH = Аl(ОН)3↓ + 3NaCl.
Рис. 66.
Получение гидроксида алюминия реакцией обмена из растворимой соли алюминия
Как амфотерный гидроксид, он легко растворяется в щелочах и кислотах (рис. 67):
Аl(ОН)3 + NаОН(изб) = Na[Al(OH)4],
Аl(ОН)3 + 3HN03 = Al(NO3)3 + 3H2O.
Рис. 67.
Химические свойства гидроксида алюминия:
а — взаимодействие с щёлочью; б — взаимодействие с кислотой
Лабораторный опыт № 16
Получение гидроксида алюминия и исследование его свойств
Урок № 14 в теме “Металлы”, по учебнику О.С.
Габриеляна “Химия, 9 класс”, составлен в
соответствии с образовательной программой с
использованием субъектного опыта учащихся, на
основе технологии личностно-ориентированного
обучения И.С. Якиманской.
Задачей учителя является полное раскрытие
возможностей и способностей каждого ученика,
развитие его неповторимой индивидуальности. В
каждом ребёнке существует потребность в
актуализации своих интеллектуальных,
коммуникативных, художественных и физических
способностей. Важно побудить и поддержать
стремление учащихся к проявлению и развитию
своих природных и социально приобретённых
возможностей. В том числе и в познании химии.
Основой моей педагогической деятельности
является личностно-ориентированное обучение
химии. Процесс обучения строится на принципах:
самоактуализации, индивидуальной личностной
направленности, выбора, творчества и успеха,
доверия и педагогической поддержки учащихся.
Все эти принципы легли в основу урока
“Алюминий: химический элемент и простое
вещество” в 9 классе. Это урок новых знаний с
элементами исследовательской работы. Метод
обучения – проблемный. Основные формы: беседа,
самостоятельная работа, лабораторная работа,
химический эксперимент. В ходе урока мною
использованы методы: диалога, рефлексивные,
создания ситуации выбора и успеха.
На начальном этапе изучения нового материала
актуализирован субъективный опыт учащихся. Это
позволяет судить не только об уровне усвоения
предыдущего материала, но и формировать новые
знания и умения в развитии.
Большое место в ходе урока занимает химический
эксперимент. Он проводится как учителем, так и
учащимися. Этот метод позволяет реально увидеть
решение поставленной в ходе урока проблемы (на
данном уроке – активный ли металл алюминий).
На уроке для учащихся постоянно создаются
ситуации выбора учебных заданий и форм их
выполнения, подбора инструментария.
Цели: создать условия для:
исследования учащимися физических и химических
свойств алюминия;
развивать представления о переходных
химических элементах, умения и навыки
самостоятельной и групповой деятельности;
воспитания культуры работы с химическими
реактивами, соблюдения правил техники
безопасности.
Понятия: химический знак “Аl”, химический
элемент, простое вещество, электронная оболочка,
степень окисления, переходный элемент,
амфотерные соединения.
Оборудование: Периодическая система
химических элементов Д.И.Менделеева, коллекция
“Алюминий и его сплавы”, алюминий: фольга,
проволока, порошок, растворы соляной кислоты и
гидроксида натрия, таблицы “Относительная
твёрдость металлов”, “Плотность металлов”,
“Температура плавления металлов”,
“Относительная теплопроводность и
электрическая проводимость металлов”.
Тип урока: изучение нового материала
Оргформа: урок-исследование
ХОД УРОКА
І. Организационный этап.
ІІ. Изучение нового материала.
1. Погружение в тему урока.
Формулировка темы урока осуществляется с
помощью выполнения задания с опорой на ранее
приобретённые знания и собственные наблюдения
Учитель: – Мы продолжаем изучение большой и
важной темы “Металлы”. Сегодня нам предстоит
познакомиться с металлом хорошо знакомым вам с
детства. Послушайте легенду.
“Однажды к римскому императору Тиберию пришёл
незнакомец. В дар императору он принёс
изготовленную им чашу из блестящего, как серебро,
но чрезвычайно лёгкого металла. Мастер поведал,
что получил этот металл из “глинистой земли”. Но
император, боясь, что обесценятся его золото и
серебро, велел отрубить мастеру голову, а его
мастерскую разрушить”.
О каком металле идёт речь?
(Ответ: об алюминии)
Учитель: – Таким образом, тема нашего урока:
“Алюминий – химический элемент и простое
вещество”.
2. Актуализация и обогащение
субъективного опыта учащихся.
Учитель: – С чего мы начинаем изучение
химического элемента?
Учащийся: – С характеристики его положения в
Периодической системе Д.И.Менделеева.
Учитель: – Сейчас вам предлагается
осуществить данную задачу, а именно дать
характеристику алюминию по положению его в
Периодической системе химических элементов
Д.И.Менделеева.
Учащимся предлагается самостоятельно
выполнить данное задание в тетрадях. Данное
задание может быть выполнено полностью
самостоятельно и оценено высоким баллом, либо с
использованием “помогалочки”.
Приложение №1
План – характеристика химического
элемента.
Задания
Часть А. на “3”
Закончите уравнения реакции.
Назови продукты реакции.
Al + Br2
Al + H2SO4 (p-p)
Часть В. на “4”
Осуществите превращения:
Al Al2 O3 Al Cl3
Al AlCl3 Al2 (SO4)3
Назовите продукты реакций.
Часть С. на “5”
Что является веществом Х в реакциях:
Al + X Al (OH)3
Al + X Al2 O3
Проверка проводится сразу после выполнения
заданий по готовым ответам на доске.
ІV. Подведение итогов урока. Рефлексия.
1. Над какой темой мы сегодня работали?
2. Что нового вы узнали об алюминии?
3. Решили ли мы проблему об активности алюминия?
4. Какими путями решали эту проблему?
5. К каким выводам пришли?
6. Оцените свою работу на уроке:
– материал усвоен (на всех этапах урока “4”,
“5”)
– материал усвоен недостаточно (оценки “3”, “4”)
V. Домашнее задание.
1, группа “А”: § 13 до стр.60.
2, группа “В”: § 13 до стр.60; Вопросы 1,2,3 на стр. 62.
3, группа “С”: § 13 до стр.60; используя материал
сегодняшнего урока, составьте цепочку
превращений алюминия и его соединений.
Ответ
Алюминий – легкий, прочный и пластичный металл.
Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк.
Алюминий без преувеличений можно назвать металлом будущего – возможности и темпы развития человечества напрямую зависят от развития алюминиевой отрасли.
Интенсивный рост мирового населения предполагает строительство новых дорог и зданий, а также производство транспорта в объеме, достаточном для перевозки ежегодно увеличивающегося количества пассажиров.
Все это возможно только с применением алюминия.
Сказка о двуличном Алюминии
Жил да был на свете хитрец-наглец по имени Алюминий. Его владения находились между двумя могущественными королевствами. Одним королевством правил молодой жизнерадостный король Натрий. Все в его королевстве было голубым: чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые люди. Работалось и жилось в королевстве легко, свободно, радостно. А это вызывало сильную зависть у правительницы другого королевства – Серы. Она вся пожелтела от зависти и злобы, порой даже начинала плавиться от внутреннего жара или гореть лиловым пламенем. Наконец ее терпение лопнуло после одного пышного празднества, устроенного Натрием в честь рождения сына, и Сера объявила войну Натрию.
И грянул бой (демонстрация реакции нейтрализации). Войска Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты. А Алюминий со своим войском все выгадывал удобную позицию: если побеждало войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы, он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом уничтожить негодяя и предателя.
Алюминий увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре два копья с силой вонзились в его безвольное тело.
Сказка – ложь, да в ней намек,
Элементам всем урок.
Коль металл ты – не стесняйся,
В бой с кислотами бросайся.
Пусть погибнешь ты в бою –
Славу я тебе пою!
Быть опасно амфотерным,
Лучше быть семейству верным,
А не то, как Алюминий,
Ты в бою бесславно сгинешь.

фармацевтической промышленности для упаковки продуктов и препаратов.

Написать молекулярные и ионные уравнения между гидроксидом алюминия и серной кислоты , гидроксидом натрия и сульфатом алюминия?
Написать молекулярные и ионные уравнения между гидроксидом алюминия и серной кислоты , гидроксидом натрия и сульфатом алюминия.

Написать 5 уравнений характерных для алюминия и натрия?
Написать 5 уравнений характерных для алюминия и натрия.

Как написать формулу навеска алюминия?
Как написать формулу навеска алюминия?

Оксиды алюминия, химические свойства написать уравнения реакций?
Оксиды алюминия, химические свойства написать уравнения реакций.

Алюминий карбид + вода = метан и алюминий гидроксид написать уравнение?
Алюминий карбид + вода = метан и алюминий гидроксид написать уравнение.

Написать уравнение реакции расставить коэфициенты, сульфид алюминия + оксид водорода равняется гидроксид алюминия + сероводород помогите пожалуйста?
Написать уравнение реакции расставить коэфициенты, сульфид алюминия + оксид водорода равняется гидроксид алюминия + сероводород помогите пожалуйста.

Написать примеры, прошу очень срочнооо оксид алюминия + кислота оклид алюминия + щелочь оксид алюминия + соль оксид алюминия + вода?
Написать примеры, прошу очень срочнооо оксид алюминия + кислота оклид алюминия + щелочь оксид алюминия + соль оксид алюминия + вода.

Алюминий + кислород = оксид алюминия?
Алюминий + кислород = оксид алюминия.
СКОЛЬКО ГРАММ ОКСИДА ПОЛУЧИТСЯ ПРИ СГОРАНИИ 5.
4 ГРАММ АЛЮМИНИЯ.
И В КОНЦЕ НА ЛИСТЕ НАПИСАНО В СКОБКАХ (10.

Написать формулы оксидов натрия : оксид кальция, оксид алюминия?
Написать формулы оксидов натрия : оксид кальция, оксид алюминия.

Написать уравнения всех возможных реакций между алюминий гидроксидом и сульфатной кислотой?
Написать уравнения всех возможных реакций между алюминий гидроксидом и сульфатной кислотой.

2NaI + 2H₂O (электролиз р - ра) = 2NaOH + I₂ + H₂ NaNO₃ + H₂SO₄(конц. ) = NaHSO₄ + HNO₃↑.

Образование зеленого налета на медных предметах - это химическое явление : 2Cu + H₂O + CO₂ + O₂ = (CuOH)₂CO₃ образуется карбонат гидроксомеди (II) - входит в состав патины.

Реакция есть на фотографии.

1s ^ 2 / 2s ^ 2 2p ^ 6 / 3s ^ 2 3p ^ 6.

Горькая вода из - за магния и, возможно, калия. А натрий соленый.

Na2SO4 + Ba(NO3)2 = 2NaNO3 + BaSO4 ; m(Na2SO4) = w * m(р - ра) = 0, 142 * 200 = 28, 4 г ; M(Na2SO4) = 142 г / моль ; n(Na2SO4) = m / M = 28, 4 / 142 = 0, 2 моль ; n(BaSO4) = n(Na2SO4) = 0, 2 моль (по уравнению реакции) ; M(BaSO4) = 233 г / моль ; m(B..

Не растворяется Вода может насыщаться кислородом, но это не раствор. То есть при попадании кислорода в воду не происходит диссоциации.

С⁺²О + S⁰⇒CS₂⁻² + C⁺⁴O₂ С⁺² - 2e⁻⇒C⁺⁴ S⁰ + 2e⁻⇒S₂⁻² С⁺² восстановитель S⁰ окислитель 2СО + 2S = CS₂ + CO₂.

Немного другое решение. Смотрите, что Вам понятнее.

R - CH2 - OH + [O] = R - COOH n(спирта) = 7. 4 / М n(кислоты) = 8. 8 / М + 16( + 1 кислород) - 2( - 2 водорода ) n(спирта) = n(кислоты) 7. 4 / М = 8. 8 / М + 16 - 2 7. 4М + 118. 4 - 14. 8 = 8. 8 103. 6 = 1. 4М значит М = 74 т. Е. спирт бут..
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.

Одним из распространённых элементов планеты является алюминий. Физические и химические свойства алюминия применяются в промышленности. Все, что необходимо знать, про этот металл вы найдете в нашей статье.
Строение атома
Алюминий – это 13 элемент периодической таблицы. Он находится в третьем периоде, III группе, главной подгруппе.
Свойства и применение алюминия связаны с его электронным строением. Атом алюминия имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, располагающихся на трёх энергетических уровнях. Электронная конфигурация атома – 1s 2 2s 2 2p 6 3s 2 3p 1 .
На внешнем энергетическом уровне находится три электрона, которые определяют постоянную валентность III. В реакциях с веществами алюминий переходит в возбуждённое состояние и способен отдавать все три электрона, образуя ковалентные связи. Как и другие активные металлы, алюминий является мощным восстановителем.
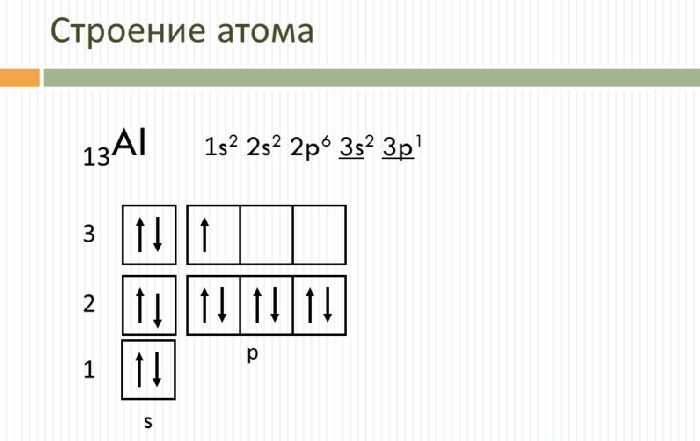
Рис. 1. Строение атома алюминия.
Алюминий – амфотерный металл, образующий амфотерные оксиды и гидроксиды. В зависимости от условий соединения проявляют кислотные или основные свойства.
Физическое описание
- лёгкостью (плотность 2,7 г/см 3 );
- серебристо-серым цветом;
- высокой электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Из металла делают жестяные ёмкости, фольгу, проволоку, сплавы. Алюминий используют при изготовлении микросхем, зеркал, композитных материалов.

Рис. 2. Жестяные ёмкости.
Алюминий – парамагнетик. Металл притягивается магнитом только в присутствии магнитного поля.
Химические свойства
На воздухе алюминий быстро окисляется, покрываясь оксидной плёнкой. Она защищает металл от коррозии, а также препятствует взаимодействию с концентрированными кислотами (азотной, серной).
При обычных условиях реакции с алюминием возможны только после удаления оксидной плёнки. Большинство реакций протекают при высоких температурах.
Основные химические свойства элемента описаны в таблице.
Реакция
Описание
Уравнение
Горит при высоких температурах с выделением тепла
Взаимодействует с серой при температуре выше 200°С, с фосфором – при 500°С, с азотом – при 800°С, с углеродом – при 2000°С
Реагирует при обычных условиях, с йодом – при нагревании в присутствии катализатора (воды)
Реагирует с разбавленными кислотами при обычных условиях, с концентрированными – при нагревании
Реагирует с водными растворами щелочей и при сплавлении
Вытесняет менее активные металлы
Алюминий не реагирует непосредственно с водородом. Реакция с водой возможна после снятия оксидной плёнки.

Рис. 3. Реакция алюминия с водой.
Что мы узнали?
Алюминий – амфотерный активный металл с постоянной валентностью. Обладает небольшой плотностью, высокой электропроводностью, пластичностью. Притягивается магнитом только в присутствии магнитного поля. Алюминий реагирует с кислородом, образуя защитную плёнку, которая препятствует реакциям с водой, концентрированными азотной и серной кислотами. При нагревании взаимодействует с неметаллами и концентрированными кислотами, при обычных условиях – с галогенами и разбавленными кислотами. В оксидах вытесняет менее активные металлы. Не реагирует с водородом.
Читайте также:

