Сочинение на тему щелочноземельные металлы и их гидроксиды
Обновлено: 05.07.2024
Щелочноземельные металлы представляют собой элементы, которые относятся ко второй группе периодической таблицы. Сюда можно отнести такие вещества, как кальций, магний, барий, бериллий, стронций и радий. Название этой группы свидетельствует о том, что в воде они дают щелочную реакцию.
Щелочные и щелочноземельные металлы, а точнее их соли, широко распространены в природе. Они представлены минералами. Исключением является радий, который считается довольно редким элементом.
Все вышеперечисленные металлы имеют некоторые общие качества, которые и позволили объединить их в одну группу.
Щелочноземельные металлы и их физические свойства
Практически все эти элементы представляют собой твердые вещества сероватого цвета (по крайне мере, при нормальных условиях и комнатной температуре). Кстати, физические свойства щелочных металлов немного отличаются — эти вещества хотя и довольно стойкие, но легко поддаются воздействию.
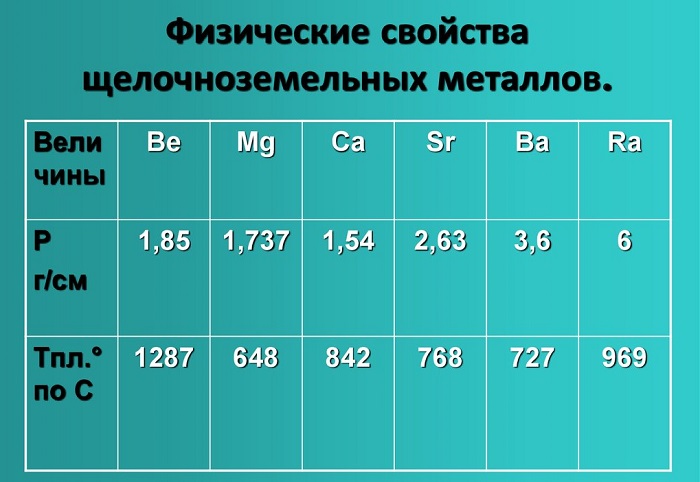
Интересно, что с порядковым номером в таблице растет и такой показатель металла, как плотность. Например, в этой группе наименьшим показателем обладает кальций, в то время как радий по плотности сходен с железом.
Щелочноземельные металлы: химические свойства
Для начала стоит отметить, что химическая активность возрастает согласно порядковому номеру таблицы Менделеева. Например, бериллий является довольно стойким элементом. В реакцию с кислородом и галогенами вступает лишь при сильном нагревании. То же касается и магния. А вот кальций способен медленно окисляться уже при комнатной температуре. Остальные три представителя группы (радий, барий и стронций) быстро реагируют с кислородом воздуха уже при комнатной температуре. Именно поэтому хранят эти элементы, покрывая слоем керосина.
Активность оксидов и гидроксидов этих металлов возрастает по той же схеме. Например, гидроксид бериллия не растворяется в воде и считается амфотерным веществом, а гидроксид бария считается довольно сильной щелочью.
Щелочноземельные металлы и их краткая характеристика
Бериллий представляет собой стойкий металл светло-серого цвета, обладающий высокой токсичностью. Впервые элемент был обнаружен еще в 1798 году химиком Вокленом. В природе существует несколько минералов бериллия, из которых самыми известными считаются следующие: берилл, фенакит, даналит и хризоберилл. Кстати, некоторые изотопы бериллия обладают высокой радиоактивностью.
Интересно, что некоторые формы берилла являются ценными ювелирными камнями. Сюда можно отнести изумруд, аквамарин и гелиодор.
Бериллий используют для изготовления некоторых сплавов, ракетного топлива. В ядерной энергетике этот элемент применяют для замедления нейтронов.
Кальций является одним из самых известных щелочноземельных металлов. В чистом виде он представляет собой мягкое вещество белого цвета с серебристым оттенком. Впервые чистый кальций был выделен в 1808 году. В природе этот элемент присутствует в форме таких минералов, как мрамор, известняк и гипс. Кальций широко применяется в современных технологиях. Его используют как химический источник топлива, а также в качестве огнеустойчивого материала. Ни для кого не секрет, что соединения кальция используются при производстве строительных материалов и лекарственных средств.
Этот элемент также содержится в каждом живом организме. В основном, он отвечает за работу двигательного аппарата.
Магний представляет собой легкий и достаточно ковкий металл с характерным сероватым цветом. В чистом виде был выделен в 1808 году, но его соли стали известными намного раньше. В природных условиях магний содержится в таких минералах, как магнезит, доломит, карналлит, кизерит. Кстати, соль магния обеспечивает жесткость воды. Огромное количество соединений этого вещества можно найти в морской воде.
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
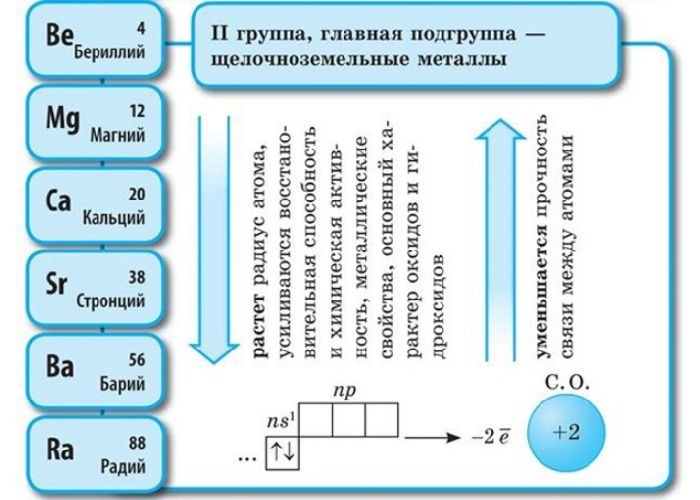
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS 2 :

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
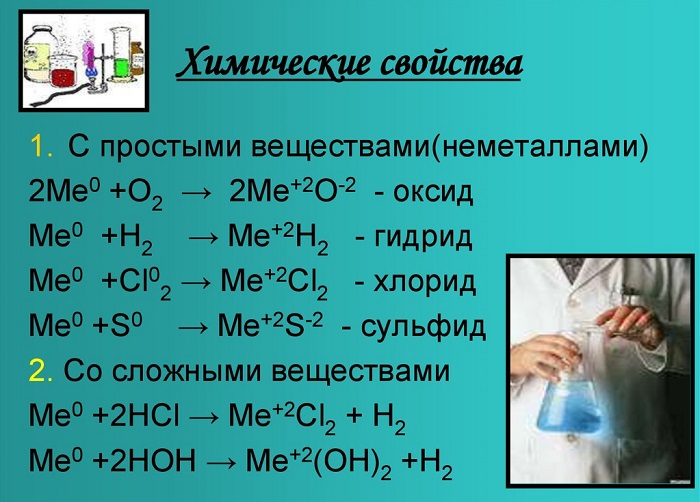
С кислородом образуют реакцию горения и оксид:
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2 — хлорид бериллия;
Ca + Br2 = CaBr2 — бромид кальция;
Sr + H2 = SrH2 — гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Sr — насыщенный красный;
Ba - светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
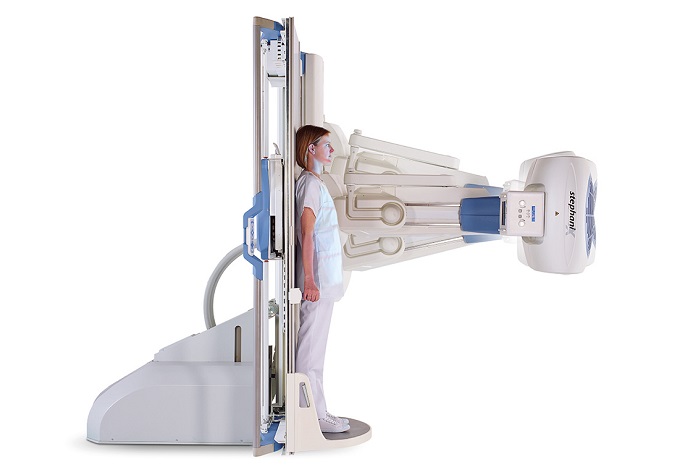
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
Важнейшие параметры элементов IIA группы приведены в таблице:
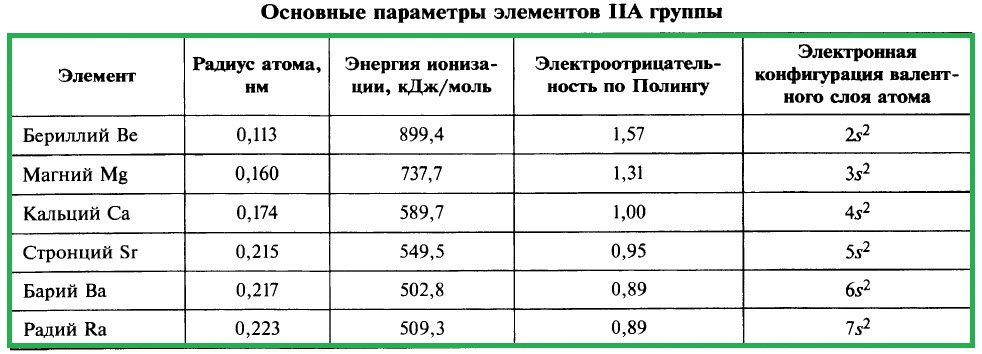
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:

Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях:

При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:
При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.

Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды:

При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления):

При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
В системе периодических элементов щелочноземельные металлы занимают отдельный столбик, второй слева. Иногда их так и называют — элементы второй группы.
Почему эта группа металлов получила название щелочноземельные?
Оказывается, в древние времена землями назывались те соединения, которые плохо растворялись в воде. А так как при взаимодействии оксидов стронция, кальция и бария с водой образовывалась щелочь, то такие оксиды назвали щелочными землями, а металлы, соответственно, щелочноземельными.

Щелочноземельные металлы горят разным по цвету пламенем: так, например, пламя кальция и радия красного цвета, магния — насыщенно-белого, а стронция — малинового, бария — зеленого, бериллия — белого
Какие элементы входят в группу щелочноземельных металлов?
В список металлов этой группы входят бериллий, магний, кальций, стронций, барий и радий.
Все щелочноземельные металлы обладают общими характеристиками:
- Все металлы белого цвета с блестящей поверхностью.
- В отличие от щелочных металлов, они более твердые и ножом не режутся (исключение составляет стронций, который можно разрезать ножом).
- При контакте с воздухом они окисляются и теряют блеск.
- По сравнению со щелочными металлами активность щелочноземельных гораздо ниже.
- У металлов этой группы два валентных электрона, которые они легко теряют.
- Все щелочноземельные металлы (кроме бериллия) довольно активны по отношению к воде: из ее молекулы они вытесняют водород и образуют гидроксиды. При этом магний реагирует только на кипящую воду.
Нахождение в природе
Наиболее распространенным из щелочноземельных металлов является кальций. Остальные элементы этой группы располагаются в порядке уменьшения их количества на Земле следующим образом: магний, барий, стронций, бериллий и радий.
Читайте также:

