Значение адсорбционных процессов для жизнедеятельности реферат
Обновлено: 17.05.2024
Процесс самопроизвольного концентрирования газов или растворенных веществ на поверхности раздела фаз называют адсорбцией. В зависимости от природы контактирующих фаз различают адсорбцию на границах: газ - твердое тело, газ – жидкость, жидкость - твердое тело и жидкость - жидкость.
Еще в 1785 г русский ученый Т.Е. Ловиц открыл способность угля поглощать растворенное вещество. С тех пор изучению явлений адсорбции было посвящено много работ, среди которых первостепенное значение имеют работы русских ученых: академика Н.Д.Зелинского, предложившего уголь в качестве универсального средства защиты от газообразных отравляющих веществ; М.С.Цвета, разработавшего хроматографический метод разделения веществ по их адсорбционной способности; академика К.К. Гедройца, создавшего учение о поглотительной способности почв; академика М.М. Думанского, разработавшего методику получения активных адсорбентов. Очень много для разработки теории и практики адсорбции сделали зарубежные ученые Гиббс, Ленгмюр, Фрейндлих, Поляни, Бранауэр и др.
Адсорбция является следствием снижения ненасыщенности молекулярных, атомных или ионных сил на поверхности раздела фаз и обусловлена накоплением вещества, снижающего свободную поверхностную энергию. Адсорбция – процесс самопроизвольный, т.к. в результате процесса адсорбции происходит уменьшение свободной поверхностной энергии, а по второму закону термодинамики такие процессы являются самопроизвольными.
Вещества, которые адсорбируются, называют адсорбатами (иногда - адсорбтивами), а вещества, которые адсорбируют на своей поверхности - адсорбентами.
В зависимости от характера сил, действующих между частицами (молекулы, атомы, ионы) адсорбата и адсорбента, различают физическую или ван-дер-ваальсову адсорбцию и химическую или хемосорбцию.
Природу адсорбции можно установить, исследовав её кинетику и энергетику. Действительно, физическая адсорбция происходит под влиянием относительно слабых межмолекулярных сил сцепления (сил Ван-дер-Ваальса) и по своей природе аналогична процессам конденсации паров адсорбата, теплота её близка к теплотам конденсации и составляет 10 - 50 кДж/моль. Поэтому при увеличении температуры физическая адсорбция уменьшается.
Хемосорбция связана с перекрыванием электронных орбиталей частиц адсорбата и адсорбента, т.е. вызывается их химическим взаимодействием, не приводящим, однако, к образованию объемной фазы. Теплота хемосорбции соизмерима с теплотами химических реакций и составляет обычно 60 - 600 кДж/моль. Химическая адсорбция с увеличением температуры увеличивается.
Адсорбция представляет собой обратимый процесс. Процесс, обратный адсорбции, называется десорбцией.
Различают молекулярную и ионную хемосорбцию в зависимости от того, что адсорбируется – молекулы или ионы вещества. В свою очередь, ионная адсорбция делится на обменную и адсорбцию потенциалопределяющих ионов.
Обменная адсорбция. Обменная адсорбция протекает на границе твердое тело / раствор электролита и состоит в том, что адсорбент и раствор обмениваются между собой катионами или анионами в эквивалентных количествах, благодаря чему принцип электронейтральности раствора электролита и адсорбента остается ненарушенным.
Основными факторами обменной адсорбции, определяющими ее специфичность, являются: наличие двойного электрического слоя на поверхности твердого адсорбента, валентность, величина радиуса и степень гидратации ионов раствора электролита.
Обменная адсорбция протекает несколько медленнее, чем обычная.
Для уяснения процесса обменной адсорбции можно рассмотреть процесс образования двойного электрического слоя при взаимодействии частицы хлористого серебра с раствором хлорида калия. Ионы хлора, сталкиваясь с частицами [AgCl]n будут соединяться с ионами серебра, образуя прочно удерживаемый слой С1- ионов, тем самым заряжая поверхность частицы. Такие ионы получили название потенциалопределяющих, а т.к. присоединившиеся С1 - -ионы увеличивают свою концентрацию, т.е. адсорбируются на поверхности, то такой вид адсорбции называется адсорбцией потенциалопределяющих ионов.
Адсорбированные С1 - -ионы заряжают частицу отрицательно, и под действием электростатических сил притяжения будет увеличиваться количество К + -ионов, прилегающих к поверхности частицы. Другими словами, будет происходить адсорбция противоионов под действием электростатических сил. Так как К + -ионы могут быть заменены другими ионами такого же знака, взаимодействующими с частицей лишь электростатически, такие ионы называются обменными, адсорбция их - обменной.
Таким образом, обменная адсорбция происходит в процессе обмена ионов двойного электрического слоя адсорбента и ионов раствора. Схематически это можно представить следующими уравнениями:
Адсорбент - ½Н + + Na + + Cl - à Адсорбент - ½Na + + H + +Cl -
Адсорбент + ½OH - + Na + + Cl - à Адсорбент + ½Cl - + Na + + OH -
Из приведенной схемы видно, что в ходе адсорбции ионов может изменяться рН среды (в раствор переходят H + или OH - ионы), раствор приобретает кислую или щелочную реакцию, такой вид адсорбции называется гидролитический.
Так как обменная адсорбция является химической, то обмен ионов происходит в строго эквивалентных соотношениях.
Обменные ионы на твердой поверхности обладают определенной величиной и знаком заряда, поэтому, чтобы не нарушался двойной электрический слой (ДЭС), обменными ионами из раствора, могут быть только ионы одного и того же знака. При этом не должна изменяться и величина заряда поверхности. Таким образом, обменная адсорбция может быть только анионообменной или катионообменной.
Явления обменной адсорбции играют важную роль в процессах, происходящих в почвах. Обменным комплексом почв является почвенный поглощающий комплекс (ППК), состоящий из коллоидных частиц, заряженных отрицательно. Обменными ионами почвы являются катионы. Важнейшие свойства почвы: водопроницаемость, влагоемкость, набухаемость, структура, рН почвенного раствора и др. – определяются составом адсорбированных ионов. Например, почвы, содержащие в составе обменных катионов значительное количество ионов натрия, приобретают особые, так называемые, “солонцовые свойства”. Они отличаются высокой дисперсностью, плотным сложением, высокой щелочностью, повышенной набухаемостью и вязкостью, малой водопроницаемостью. Эти почвы трудно обрабатываются и, несмотря на большой запас питательных веществ, мало плодородны. Если же в состав обменных катионов почвы входят преимущественно ионы кальция, то такие почвы обладают хорошей структурой, малой распыленностью, хорошей водо- и воздухопроницаемостью. Эти почвы относятся к наиболее плодородным. Примером почв с большим содержанием обменного кальция и прекрасными физико-химическими свойствами являются черноземные почвы.
Ионообменные процессы в почвах можно представить следующей схемой:
[ППК] - 2Na + + Са 2+ + SO4 2- = [ППК] - Cа 2+ + Na2SO4
Б.П. Никольский и Е.Н. Гапон предложили уравнение, описывающее обменную адсорбцию:
Здесь g1 и g2 – количество г-моль (г-экв) адсорбированных и десорбированных ионов единицей массы адсорбента, а1 и а2 – активности обменивающихся ионов в растворе при равновесии; z1 и z2 – заряд ионов, К – константа данного адсорбционного процесса.
Явление адсорбции находит широкое применение в промышленности и сельском хозяйстве. Так, на активированном угле производят адсорбционную очистку (рафинирование) сиропа сахарозы. Именно силы адсорбции удерживают ионы минеральных удобрений (К + , РО4 -3 и т.п.) и молекулы (мочевины) в почве. Адсорбция мочевины физическая, молекулы её слабо удерживаются почвой. Поэтому мочевину, чтобы её не вынесло весенним паводком, вносят обычно весной. Калийные удобрения можно вносить в почву и осенью, так как адсорбция ионов К + вызывается химическими силами (ионные связи) и она прочная.
В общем случае адсорбция является функцией давления Р (для газов) или концентрации С (для жидких растворов) и температуры, т.е. изображается плоскостью в координатах Г = f(C,T). Обычно один из параметров поддерживают постоянным и адсорбцию графически изображают в виде кривых.
Количественная зависимость, устанавливаемая между адсорбентом и адсорбтивом при постоянной температуре в виде уравнения или кривой, называется изотермой адсорбции.
Cуществует несколько типов изотерм адсорбции - простейшими уравнениями для описания адсорбции являются уравнение Фрейндлиха и уравнение Ленгмюра.
Изотерма адсорбции по Фрейндлиху. Адсорбция растворенного вещества на твердой поверхности подчиняется определенной закономерности, согласно которой концентрация адсорбированного вещества возрастает не пропорционально его концентрации в растворе, а значительно медленнее, и пропорциональна корню n-ой степени из концентрации раствора. Эта зависимость при постоянной температуре может быть представлена следующем уравнением:
Х/m = К С 1/ n
где Х – количество (моль) вещества, адсорбированного m г адсорбента: С- равновесная концентрация; К и 1/n – эмпирические константы, характерные для данных адсорбента и адсорбата, значение 1/n колеблется между 0,1 – 0,7. Данное уравнение известно под названием изотермы адсорбции и имеет вид параболы.
Для графического построения изотермы адсорбции по Фрейндлиху на оси абсцисс откладывается равновесная концентрация в ммоль/л, а на оси ординат – величина адсорбции на единицу поверхности Х/m в ммоль/грамм. На рисунке 7 показано графическое изображение уравнения Фрейндлиха.
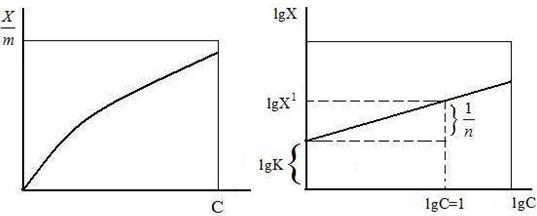 |
Рис. 7. Изотерма адсорбции по Фрейндлиху Рис.8. Графическое определение постоянных адсорбции уравнения Фрейндлиха
Логарифмируя данное уравнение, можно найти значения постоянных К и 1/n:
lg X/m = lg K + 1/n lg C
Если на абсциссе отложить величину lg C, а на ординате – величину lg X/m, то мы получаем прямую, отсекающую на оси ординат отрезок, равный lgК, а тангенс угла наклона этой прямой к абсциссе дает значение 1/n.
Графически значение 1/n находят следующим образом: из точки lgС = 1 восстанавливают перпендикуляр к прямой. Из точки пересечения опускают перпендикуляр на ось ординат – точка lgХ 1
1/n будет равна разности (lgХ 1 - lgК), где lgХ 1 –ординаты точки, абсцисса которой lgС1 = 1 (рис. 8). Уравнение Фрейндлиха находит широкое применение, но имеет и ряд недостатков, т.к. применимо только в области средних концентраций.
Изотерма адсорбции по Ленгмюру. В 1917 году Ленгмюр предложил более удобное уравнение адсорбции, которое выведено им на основании молекулярно-кинетической теории газов.
Изотерма адсорбции по Ленгмюру является уравнением гиперболы и может быть представлена в виде:
где Г – величина адсорбции на единицу поверхности; Г¥ - предельное количество вещества, адсорбированного единицей поверхности при полном насыщении поверхности; С – равновесная концентрация. В уравнении Ленгмюра также имеются две константы - Г¥ и К. Графическое изображение изотермы адсорбции Ленгмюра представлено на рисунке 9.
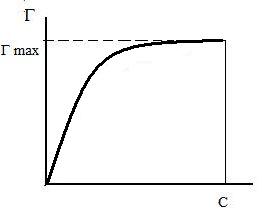 | 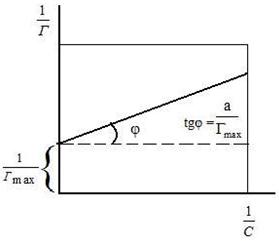 |
Рис. 9. Изотерма адсорбции по Ленгмюру Рис.10. Графическое определение постоянных адсорбции уравнения Ленгмюра
Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Молекулы адсорбата поглощаются лишь на отдельных точках поверхности адсорбента. Эти точки – активные центры – обладают остаточными валентностями и способны связывать только одну молекулу адсорбата. Заполнение всех активных центров соответствует насыщению поверхности. Таким образом, насыщенный адсорбционный слой мономолекулярен, т.е. только один слой молекул связан силами молекулярного сцепления с поверхностью. На твердой поверхности при постоянной температуре устанавливается подвижное равновесие между молекулами, адсорбирующимися на поверхности, и молекулами, отрывающимися от поверхности. Концентрация адсорбата на момент установления динамического адсорбционного равновесия называется равновесной. Следовательно, активные центры удерживают адсорбированные молекулы только в течение определенного промежутка времени.
Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Однако адсорбция может быть и многослойной, тогда уравнение изотермы адсорбции Ленгмюра становится неприменимой, более точными являются так называемые S-образные изотермы БЭТ (по фамилиям ученых Браунер, Эммет, Теллер), одна из которых представлена на рисунке 11. Изотерме адсорбции Ленгмюра соответствует только нижняя часть (ОА) кривой. S-образные изотермы и соответствующие им уравнения особенно часто используются для случаев адсорбции паров на твердых поверхностях.
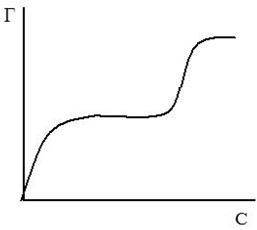 |
Рис.11. S-образная изотерма БЭТ
Практическое значение явлений адсорбции. Явления адсорбции находят широкое применение в промышленности, технике, биологии, медицине, ветеринарии. Так, например, с адсорбционными процессами мы встречаемся в химической и пищевой промышленности при сахароварении, очистке соков и вин, при ректификации спирта, в текстильной промышленности при крашении тканей.
Среди различных адсорбентов одно из первых мест занимает уголь. Древесный, костяной, кровяной и другие сорта углей получили широкое распространение как адсорбенты в самых различных областях.
Адсорбция широко используется в медицине с лечебными целями. Адсорбенты способны связывать многие ядовитые вещества, поэтому многие коллоиды применяют в качестве противоядий. Так, например, коллоидное железо употребляется при мышьяковом отравлении. Для этих же целей употребляются различные мелко растертые порошки, чаще всего животный и древесный уголь.
Явления адсорбции имеют большое биологическое значение. В организме имеется огромное количество поверхностей, на которых идут адсорбционные процессы. Это, во-первых, поверхности раздела между организмом и средой, затем поверхности стенок сосудов, разнообразнейшие мембраны, поверхности клеток, поверхности ядер, поверхности вакуолей и, наконец, поверхности коллоидных частиц протоплазмы. На всех этих поверхностях в процессе обмена веществ могут адсорбироваться различные вещества.
Если для высших организмов поверхность раздела между организмом и средой адсорбционной роли почти не играет, то для организмов, живущих в воде, особенно для низших организмов, эта поверхность имеет весьма существенное значение в процессах питания и проникновения пищевых веществ.
По исследованием Траубе поверхностно-активные вещества легко проникают в клетку, а пищевые вещества, как правило, поверхностно-активны. Поэтому, первым этапом усвоения, является адсорбция питательных веществ, после чего начинается процесс химического превращения.
Процессы обмена веществ в организме осуществляются посредством разнообразных специфических катализаторов-ферментов, являющихся коллоидами. Первые стадии действия фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. Явления адсорбции широко распространены в жидкостях и тканях организма. Такие важные жизненные процессы как, питание, дыхание, выделение и другие процессы жизнедеятельности организма сопровождаются многообразными явлениями адсорбции.
Таким образом, если учесть огромнейшие величины поверхностей раздела у высших организмов и адсорбционные возможности этих поверхностей, то будет понятно все то значение, которое имеет адсорбция в процессах жизнедеятельности.
Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела - адсорбента.
Адсорбция газов на твердых поверхностях используется в некоторых отраслях пищевой промышленности, а именно масложировой (например, в производстве маргарина) и в бродильной (например, в производстве дрожжей) для очистки технологических газовых потоков с целью предотвращения выбросов вредных веществ в атмосферу. Поглощение паров воды происходит на пористых веществах, которые выполняют роль твердого адсорбента. Подобные процессы наблюдаются в отношении сахара, соли и сухарей.
Содержание
Введение
. Классификация процесса, основные определения
.1 Основные понятия процесса адсорбции
.2 Основные промышленные адсорбенты и их свойства
.3 Изотерма адсорбции
. Закономерности процесса адсорбции
.1 Теории адсорбции
.2 Адсорбция на границе раствор - пар
.3 Адсорбция на границе твердое тело - газ
.4 Адсорбция на границе твердое тело - раствор
.4.1 Молекулярная адсорбция из растворов
.4.2 Адсорбция из растворов электролитов
. Оборудование, реализующее процесс адсорбции
.1 Адсорбция с неподвижным слоем адсорбента
.2 Адсорбция силикагелем
.3 Гиперсорбция
.4 Адсорбция в кипящем (псевдоожиженном) слое
.5 Расчет адсорберов периодического действия
.6 Расчет адсорберов непрерывного действия
Заключение
Список использованной литературы
Прикрепленные файлы: 1 файл
Курсовая работа.doc
по дисциплине: Процессы и аппараты химической технологии
. Классификация процесса, основные определения
.1 Основные понятия процесса адсорбции
.2 Основные промышленные адсорбенты и их свойства
.3 Изотерма адсорбции
. Закономерности процесса адсорбции
.1 Теории адсорбции
.2 Адсорбция на границе раствор - пар
.3 Адсорбция на границе твердое тело - газ
.4 Адсорбция на границе твердое тело - раствор
.4.1 Молекулярная адсорбция из растворов
.4.2 Адсорбция из растворов электролитов
. Оборудование, реализующее процесс адсорбции
.1 Адсорбция с неподвижным слоем адсорбента
.2 Адсорбция силикагелем
.4 Адсорбция в кипящем ( псевдоожиженном) слое
.5 Расчет адсорберов периодического действия
.6 Расчет адсорберов непрерывного действия
Список использованной литературы
Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела - адсорбента.
Явление адсорбции известно очень давно. Такие природные материалы, как песок и почва, использовали для очистки воды еще на заре человеческого общества. В конце XVIII века К. Шееле и одновременно Фонтана обнаружили способность свежепрокаленного древесного угля поглощать различные газы в объемах, в несколько раз превышающих его собственный объем. Вскоре выяснилось, что величина поглощенного объема зависит от типа угля и природы газа. Т.Е. Ловиц в 1785 году открыл явление адсорбции углем в жидкой среде, подробно исследовал его и предложил использовать уголь для очистки фармацевтических препаратов, спирта, вина, органических соединений. Ловиц показал, что древесный уголь способен быстро очищать испорченную воду и делать ее пригодной для питья. И сейчас основным действующим началом фильтров для воды служат углеродные материалы, конечно более современные, чем природные угли. Адсорбция отравляющих веществ из воздуха была использована Н.Д. Зелинским при создании противогаза во время первой мировой войны.
Адсорбция газов на твердых поверхностях используется в некоторых отраслях пищевой промышленности, а именно масложировой (например, в производстве маргарина) и в бродильной (например, в производстве дрожжей) для очистки технологических газовых потоков с целью предотвращения выбросов вредных веществ в атмосферу. Поглощение паров воды происходит на пористых веществах, которые выполняют роль твердого адсорбента. Подобные процессы наблюдаются в отношении сахара, соли и сухарей. Адсорбционный способ регулирования газового состава хранилищ скоропортящихся продуктов позволяет в несколько раз сократить потери и увеличить сроки хранения. Адсорбция различных пищевых кислот, лимонной в частности, снижает по сравнению с водой поверхностное натяжение большинства прохладительных напитков. Адсорбция веществ на поверхности раздела жидкость - газ способствует устойчивости пен. Подобный процесс имеет место в бродильной промышленности при производстве дрожжей и некоторых других полупродуктов. Усиление смачивания водой различных поверхностей широко используется в промышленности в качестве сопутствующего процесса при мойке оборудования, подготовке сырья, обработке полуфабрикатов и т.д. Адсорбция на границе твердое тело - жидкость широко применяется при очистке жидкостей (например, диффузионного сока при производстве сахара, растительных масел и соков) от примесей.
Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и твердого тела можно было бы рассчитать изотерму адсорбции, не проводя экспериментальных исследований. Поэтому попыткам описать экспериментальные изотермы с помощью различных теоретических уравнений, которым соответствуют определенные модели адсорбции, посвящено огромное количество работ. Если теоретическое уравнение изотермы адсорбции хорошо воспроизводит экспериментальные данные, то можно рассчитать неизвестные величины адсорбции при разных условиях (р и Т) и определить различные геометрические параметры твердых тел. Рассмотрим лишь немногие, наиболее распространенные теоретические уравнения изотерм адсорбции.
1. Классификация процесса, основные определения
1.1 Основные понятия процесса адсорбции
Адсорбцией называется самопроизвольно протекающий диффузионный процесс взаимодействия двух фаз - твердого тела - адсорбента и газа, пара или растворенного вещества - адсорбтива, происходящий поглощением газа, пара или растворенного вещества поверхностью твердого тела.
Поглощение газов, паров и растворенных веществ твердыми телами обычно сопровождается процессами проникновения поглощаемого вещества в твердое тело (абсорбцией), капиллярной конденсацией и химическими реакциями (хемосорбцией), что весьма затрудняет изучение собственно адсорбции. Поэтому поглощение газов, паров и растворенных веществ твердыми телами обычно рассматривается как общий процесс сорбции.
Адсорбция всегда сопровождается выделением тепла. В большинстве случаев тепловой эффект адсорбции по своей величине приближается к теплоте конденсации поглощаемого газа или пара.
Адсорбцию подразделяют на два вида: физическую и химическую. Физическая адсорбция в основном обусловлена поверхностными вандервальсовыми силами, которые проявляются на расстояниях, значительно превышающих размеры адсорбируемых молекул, поэтому на поверхности адсорбента обычно удерживаются несколько слоев молекул адсорбата.
При химической адсорбции поглощаемое вещество вступает в химическое взаимодействие с адсорбентом с образованием на его поверхности обычных химических соединений.
Силы притяжения возникают на поверхности адсорбента благодаря тому, что силовое поле поверхностных атомов и молекул не уравновешено силами взаимодействия соседних частиц. По физической природе силы взаимодействия молекул поглощаемого вещества и адсорбента относятся в основном к дисперсионным, возникающим благодаря перемещению электронов в сближающихся молекулах. В ряде случаев адсорбции большое значение имеют электростатические и индукционные силы, а также водородные связи. Поэтому адсорбция является самопроизвольным процессом, течение которого сопровождается уменьшением свободной энергии и энтропии системы.
Процессы адсорбции избирательны и обратимы. Процесс, обратный адсорбции, называют десорбцией, которую используют для выделения поглощенных веществ и регенерации адсорбента.
Наиболее рационально применять адсорбцию для обработки смесей с низкой концентрацией извлекаемых веществ.
Статическая и динамическая активность адсорбентов.
Основной характеристикой адсорбента является его активность, определяемая весовым количеством вещества, поглощенного единицей объема или веса поглотителя.
Различают активность статическую и динамическую.
Статическая активность адсорбента характеризуется максимальным количеством вещества, адсорбированного к моменту достижения равновесия весовой или объемной единицей адсорбента при данной температуре и концентрации адсорбируемого вещества в газо-воздушной смеси.
Динамическая активность является характеристикой адсорбента при протекании паровоздушной смеси через слой адсорбента до момента проскока адсорбируемого газа.
Если газовая смесь проходит через слой адсорбента, то в начальный период процесса адсорбтив полностью извлекается из газовой смеси. По истечении определенного промежутка времени в газовой смеси, уходящей из поглотителя, начинают появляться заметные, все возрастающие количества адсорбтива (проскок), и к концу процесса концентрация уходящего газа становится равной начальной концентрации паровоздушной смеси.
В адсорберах промышленного типа с активированным углем динамическая активность составляет 85-95% от статической, а в случае применения силикагеля динамическая активность оказывается меньше статической на 60-70%.
Селективные свойства адсорбентов.
В процессах адсорбции, так же как и в процессах абсорбции, поглощающие вещества (адсорбенты обладают селективными свойствами по отношению к поглощаемым газам и парам. Иными словами, применение адсорбционных процессов в качестве метода разделения газовых смесей основано на том, что газовая смесь, приведенная в соприкосновение с адсорбентом, освобождается лишь от одного компонента, в то время как другие оказываются непоглощенными.
Если в процессах абсорбции селективные качества процесса определялись растворимостью или нерастворимостью газа в поглощающей жидкости, то в процессах адсорбции критерием селективных качеств является статическая активность адсорбента.
Из смеси газов, приведенных в соприкосновение с адсорбентом, в первую очередь и в значительно большем количестве поглощается газ или пар того вещества, которое имеет более высокую температуру кипения. В большинстве случаев температура кипения поглощаемого газа (например, паров бензола) сильно отличается от температуры кипения инертного газа (например, воздуха) и присутствие инертного газа почти не оказывает влияния на ход процесса. В данном случае поглощение бензола из паровоздушной смеси с парциальной упругостью паров бензола р протекает точно так же, как и поглощение чистых паров бензола, имеющих то же давление.
Разделение адсорбционным методом смеси газов, компоненты которой имеют близко лежащие температуры кипения, предоставляет большие трудности или практически невозможно.
1.2 Основные промышленные адсорбенты и их свойства
Основными промышленными адсорбентами являются пористые тела, обладающие большим объемом микропор. Свойства адсорбентов определяются природой материала, из которого они изготовлены, и пористой внутренней структурой.
В промышленных адсорбентах основное количество поглощенного вещества сорбируется на стенках микропор (r своей поглотительной, или адсорбционной способностью, определяемой максимально возможной концентрацией адсорбтива в единице массы или объема адсорбента, его пористой структуры, природы поглощаемого вещества, его концентрации, температуры, а для газов и паров - от их парциального давления. Максимально возможную при данных условиях поглотительную способность адсорбента условно называют равновесной активностью.
По химическому составу все адсорбенты можно разделить на углеродные и неуглеродные. К углеродным адсорбентам относятся активные (активированные угли), углеродные волокнистые материалы, а также некоторые виды твердого топлива. Неуглеродные адсорбенты включают в себя силикагели, активный оксид алюминия, алюмагели, цеолиты и глинистые породы.
Активные угли, состоящие из множества беспорядочно расположенных микрокристаллов графита, обычно используют для поглощения органических веществ в процессах очистки и разделения жидкостей и газов (паров). Эти адсорбенты получают сухой перегонкой ряда углеродсодержащих веществ (древесины, каменного угля, костей животных, косточек плодов и др.). После этого уголь активируют, например прокаливают его при температуре 850-900о С, что приводит к освобождению пор от смолистых веществ и образованию новых микропор. Активацию проводят также экстрагированием смол из пор органическими растворителями, окислением кислородом воздуха и др. Более однородная структура углей получается при их активации химическими методами: путем их обработки горячими растворами солей (сульфатами, нитратами и др.) или минеральными кислотами (серной, азотной и др.)
Качество активированных углей зависит от свойств исходных углеродсодержащих материалов и от условий активации. Характеристикой степени активации активированного угля является обгар, т. е. сгоревшая часть угля, выраженная в процентах от количества исходного материала.
Активированный уголь применяется при адсорбции либо в виде зерен величиной от 1 до 7 мм, либо в виде порошка. Зерна и порошок получают путем измельчения и классификации. Удельная активная поверхность активных углей выражается величиной от 600 до 1700 м2 на один грамм. Применяются активированные угли главным образом для поглощения паров органических жидкостей, находящихся в газовых смесях, и для очистки различных растворов от примесей.
Серьезным недостатком этих углей является горючесть, и применять их можно при температурах не выше 200°. Для уменьшения горючести к ним подмешивают силикагель, однако такая добавка приводит к понижению активности адсорбента, поэтому активированные угли с добавкой к ним силикагеля практически применяют сравнительно редко.
Силикагелем называют продукт обезвоживания геля кремневой кислоты, получаемого действием серной или соляной кислот или растворов кислых солей на раствор силиката натрия. Выпавший гель кремневой кислоты после промывки высушивается при температуре 115-130° до влажности 5-7%.
Силикагель отличается однородностью пор как по величине, так и распределению. Применяется силикагель в виде зерен диаметром от 0,2 до 7 мм главным образом для поглощения паров воды, т. е. для сушки газов. Удельная активная поверхность силикагеля выражается величиной порядка 600 м2 на один грамм.
К достоинствам силикагелей относятся их негорючесть и большая механическая прочность. Недостатком относится резкое снижение поглотительной способности по отношению к парам органических веществ в присутствии влаги.
По сорбционным свойствам к силикагелю близко примыкают алюмагели, получаемые термической обработкой гидроксида алюминия при температурах 600-1000оС. Поры полученного сорбента имеют диаметр 1-3 нм, удельную поверхность 2·10 5 - 4·10 5 м2/кг; насыпная плотность такого сорбента 1600 кг/м3. Алюмагели используют для осушки газов, очистки водных растворов и минеральных масел.
Цеолиты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами, содержащими оксиды щелочных щелочноземельных металлов. Эти адсорбенты отличаются регулярной структурой пор, размеры которых соизмеримы с размерами поглощаемых молекул. Особенность цеолитов состоит в том, что адсорбционные поверхности соединены между собой окнами определенного диаметра, через которые могут проникать только молекулы меньшего размера. На этом основано разделение смесей с разными по размеру молекулами, что послужило причиной называть цеолиты молекулярными ситами.
Для разделения газовых смесей применяют цеолиты в виде шариков или гранул размером от 1 до 5 мм, а для разделения жидких смесей - в виде мелкозернистого порошка.
Понятие адсорбции. Автоадсорбция. Адсорбент и адсорбат. Абсолютная и Гиббсовская адсорбция. Единицы измерения адсорбции. Зависимость величины адсорбции от концентрации, давления и температуры. Изотерма, изобара, изопикна, изостера адсорбции
Адсорбция - процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемом фазы.
Адсорбция может наблюдаться в многокомпонентных системах и при перераспределении в поверхностный слой уходит тот компонент, который сильнее понижает поверхностное натяжение. В однокомпонентной системе при формировании поверхностного слоя происходит изменение его структуры - уплотнение, которое называется автоадсорбцией .
В общем случае адсорбция может происходить не только благодаря стремлению поверхностной энергии к уменьшению, но и за счет химической реакции компонентов с поверхностью вещества. В этом случае поверхностная энергия может даже увеличиваться на фоне снижения энергии всей системы.
Вещество, на поверхности которого происходит адсорбция, называется адсорбентом , а вещество, которое перераспределяется – адсорбатом .
Обратный процесс перехода вещества с поверхности в объем фазы - десорбция.
В зависимости от агрегатного состояния фаз различают адсорбцию газа на твердых адсорбентах, твердое тело – жидкость, жидкость - жидкость, жидкость - газ. Для количественного описания адсорбции применяют две величины: первая измеряется числом молей или граммами, приходящимися на единицу поверхности или массы адсорбента:
А = m 1 / m 2 - абсолютная адсорбция, А = ni / S .
Величина, определяемая избытком вещества в поверхностном слое, также отнесенным к единице площади поверхности или массы адсорбента, называется Гиббсовской или относительной адсорбцией (Г).

Адсорбция зависит от концентрации компонентов и температуры.
А = f ( c , T ) - жидкость;
А = f ( P , T ) - газ
Различают следующие виды зависимостей:
| 1. Изотерма (рис. 8) | 2. Изобара | 3. Изостера |
| А =fT (c) | А =fP (T) | c=fA (T) |
| A=fT (P) | A=fC (T) | P=fA (T) |
Фундаментальное уравнение Гиббса. Определение Гиббсовской адсорбции. Адсорбционное уравнение Гиббса
Считаем V поверхности раздела = 0.

dU = TdS + s dS +

Проинтегрировав, получим: U = TS + sS +
Полный дифференциал от этого уравнения:
dU = TdS + SdT + s dS + + Sd s + .
Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:

SdT + Sd s + = 0.

Предположим, что T = const:
Разделив правую и левую часть на поверхность S , получим фундаментальное адсорбционное уравнение Гиббса :
; ;

.
Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.

.
Известно, что , , (где , - равновесный и стандартный химический потенциал компонента i ; lnai - логарифм активности i –го компонента). Тогда уравнение Гиббса будет выглядеть так

Активность связана с концентрацией: с = × а . Предположим, что = 1 (при с ® 0). Тогда

- для жидкости и газа

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. d m= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:

Из этих уравнений следует, что зная зависимость = f (С) (где С - концентрация растворенного вещества), можно рассчитать изотерму адсорбции, пользуясь адсорбционным уравнением Гиббса. Схема графического расчета показана на рис. 2.2.2.1: Тангенс угла наклона соответствует значениям производных в этих точках.
Зная эти производныеуравнения Гиббса, можно рассчитать значение Г , что позволяет построить зависимость Г = f (С) . Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R . Так как величина R отнесена к молю вещества, а s - к единице площади, то Г = [моль/ единица площади]. Если s выразить в [Дж/м 2 ], то R нужно подставлять: R = 8,314 Дж/моль×К.
Поверхностная активность. Поверхностно-активные и поверхностно-инактивные вещества. Анализ уравнения Гиббса. ПАВ. Эффект Ребиндера. Правило Дюкло-Траубе

В уравнении Гиббса влияние природы вещества на адсорбцию отражается производной. Эта производная определяет и знак гиббсовской адсорбции, и может служить характеристикой вещества при адсорбции. Чтобы исключить влияние концентрации на производную берут ее предельные значения, т.е. при стремлении концентрации к нулю. Эту величину Ребиндер назвал поверхностной активностью .

;
g = [Дж×м/моль] = [Н×м 2 /моль]; [эрг см/моль] = [Гиббс].

Уравнение показывает, что чем сильнее снижается = f ( c ) с увеличением концентрации, тем больше поверхностная активность этого вещества.
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции .
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f ( C ) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.

1. 2 0 : g >0 Þ с увеличением концентрации поверхностное натяжение на границе раздела фаз убывает и вещество поверхностно-активно .

1. 2 / RT .
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Муниципальное бюджетное общеобразовательное учреждение
Итоговый проект
ученик 9 класса.
Руководитель:
Сергеева Вера Николаевна,
2017-2018 учебный год
1. Актуальность работы.
2. Объект исследования.
5. Задачи исследования.
6. Методы исследования.
8. Практическая значимость исследования.
II. Основное содержание работы
1.1. Понятие адсорбция. Первые исторические сведения о процессе.
1.2. Виды адсорбции: физическая и химическая и их механизм.
1.3. Особенность процессов адсорбции.
1.4. Адсорбенты: их структура и применение.
1.5. Активированный уголь - его получение.
1.6. Практическое значение адсорбции.
2. Экспериментальная часть.
2.1. Учебно-исследовательский эксперимент “ Поглощение запаха различными адсорбентами”.
2.2. Учебно-исследовательский эксперимент “Обесцвечивание раствора йода различными адсорбентами ”.
2.3. Учебно-исследовательский эксперимент “ Обесцвечивание раствора бриллиантового зеленого различными адсорбентами”.
2.4. Учебно-исследовательский эксперимент “ Обесцвечивание раствора мандаринного сока различными адсорбентами”.
2.5. Учебно-исследовательский эксперимент “Обесцвечивание раствора свекольного сока различными адсорбентами ”.
2.6. Выводы по результатам экспериментов.
III. Выводы по работе
IV. Источники
1. Актуальность работы. Я считаю, что на данный момент эта тема имеет большое значение как в деятельности человека, так и в его жизни. Так как загрязнение окружающей среды очень пагубно влияет на природу, тем самым воздействуя на человека.
2. Объект исследования. Объектом моего исследования стал такой процесс как “ Адсорбция” и различные адсорбенты.
3.Гипотеза. Адсорбент спасает жизнь человека: очищая воду, воздух, желудочно-кишечный тракт при отравлениях, а также выбросы в окружающую среду с химических предприятий, очистных сооружений. Используемые человеком различные адсорбенты обладают различными адсорбционными свойствами.
4.Цель исследования. Целью моего исследования является изучение процесса “Адсорбция”, её характеристик и свойств различных адсорбентов.
5. Задачи исследования. Изучить сущность процесса адсорбции, ее классификацию, механизм; сравнить вещества, обладающие высокой адсорбционной способностью; ознакомиться с использованием данного явления в быту и промышленности; изучить свойства отдельных адсорбентов.
6. Методы исследования.
а). Библиографический анализ литературы и материалов сети интернета.
г). Сравнительный анализ.
д). Проведение лабораторного опыта.
е). Проведение учебно-исследовательского эксперимента.
ж). Анализ полученных результатов эксперимента.
з). Компьютерное моделирование.
7. Теоретическая значимость исследования.
Теоретические знания, приобретенные мною при работе над проектом, могут пригодиться на уроках химии, биологии, ОБЖ, при поступлении в высшие учебные заведения, связанные с химией и биологией, также могут пригодиться при службе в армии.
8. Практическая значимость исследования. Значимость исследовательской работы состоит в том, что она может быть использована для повышения образовательного уровня школьников, при изучении предметов химии, биологии, ОБЖ и подготовки к экзаменам при изучении темы адсорбция.
II. Основное содержание работы
1.1. Понятие адсорбция. Первые исторические сведения о процессе.
Адсо́рбция - (от лат. ad — на, при и sorbeo — поглощаю), поглощение газов, паров или жидкостей поверхностным слоем твердого тела (адсорбента) или жидкости.
Создатель изотермы адсорбции Ленгмюра и крупный исследователь в физико-химии поверхностным явлениям.
Родился 31 января 1881 г., Нью-Йорк, США.
Умер 16 августа 1957 г. (76 лет),
Награды: Нобелевская премия по химии.
В 1915 году русский учёный Николай Дмитриевич Зелинский разработал первый фильтрующий угольный противогаз (Приложение 2) , который в 1916 году был принят на вооружение войсками Антанты. В качестве основного сорбирующего материала в нем впервые в истории использовался активированный уголь.
1.2. Виды адсорбции: физическая и химическая и их механизм. Адсорбция бывает 2-х видов: химическая и физическая.
Химическая адсорбция (так называемая хемосорбция). Хемосорбция представляет собой процесс поглощения поверхностью жидкого или твердого тела веществ из окружающей среды, сопровождающийся образованием химических соединений. При хемосорбции выделяется значительное количество теплоты. Обычно теплоты хемосорбции лежат в пределах 80 – 125 кДж/моль. Взаимодействие кислорода с металлами (окисление). При химической адсорбции молекула адсорбированного вещества реагирует химическими связями на поверхности адсорбента.
Физической адсорбции адсорбированные молекулы остаются стабильными, сохраняя свою индивидуальность. Адсорбированный слой связан с поверхностью слабыми межатомными связями. Теплота физической адсорбции, как правило, невелика и редко превосходит несколько десятков кДж/моль (~ 40 кДж/моль).
Процесс физической адсорбции обратим, относится к не активируемым, протекает очень быстро, как только молекулы адсорбента окажутся на поверхности твердого или жидкого тела.
1.3. Особенность процессов адсорбции.
Особенностью процессов адсорбции являются: избирательность и обратимость. Благодаря этой особенности процесса возможно поглощение из паро-газовых смесей или растворов одного или нескольких компонентов, а затем в других условиях, десорбирование их, т. е. выделение нужного компонента из твердой фазы в более или менее чистом виде.
1.4. Адсорбенты: их структура и применение.
Адсорбент должен обладать следующими основными свойствами:
2).отсутствием каталитической активности и химической инертностью к компонентам разделяемой смеси;
4).достаточной механической прочностью;
5).линейностью изотермы адсорбции;
Адсорбенты применяют в противогазах, в качестве носителей катализаторов, для очистки газов, спиртов, масел, при переработке нефти, в медицине для поглощения газов и ядов.
Адсорбент, используемый в промышленности - это адсорбент с высокоразвитой поверхностью.
Адсорбция лежит в основе клинического анализа крови на СОЭ (Скорость Осаждения Эритроцитов). Так, при инфекционных заболеваниях в крови происходит обменная адсорбция: вместо ионов электролитов поверхность эритроцитов занимают молекулы белков. При этом заряд эритроцитов понижается и они быстрее объединяются и оседают.
Адсорбционная терапия применяется для удаления токсинов и вредных веществ из пищеварительного тракта. Такие адсорбенты, как гидроксид алюминия, оксид магния, фосфат алюминия, входят в состав препаратов алмагель, фосфалюгель. (Приложение 3)
Характерной особенностью твердых поверхностей является их пористость (отношение суммарного объема пор к общему объему адсорбента). Природа поверхности адсорбента, размеры и форма его пор влияют на адсорбцию, изменяют ее характеристики, т.е. механизм адсорбции.
Особенности адсорбции на поверхности твердых тел. Твердые поверхности в качестве адсорбентов используются для адсорбции газов или жидкостей, а адсорбционные процессы при этом протекают на границе раздела твердое тело - газ и твердое тело — жидкость. Твердые адсорбенты имеют поры различного размера.
1.5. Активированный уголь - его получение.
Активированный уголь – это максимально естественное и простое средство для очищения организма. ( Приложение 4) Пористое вещество, которое получают из различных углеродосодержащих материалов органического происхождения: древесного угля , каменноугольного кокса , нефтяного кокса, скорлупы кокосовых орехов и других материалов. Содержит огромное количество пор и поэтому имеет очень большую удельную поверхность на единицу массы, вследствие чего обладает высокой адсорбционной способностью. В зависимости от технологии изготовления, 1 грамм активированного угля может иметь поверхность от 500 до 1500 м². Применяют в медицине и промышленности для очистки, разделения и извлечения различных веществ.
1.6. Практическое значение адсорбции.
Применение адсорбции для поглощения паров или газообразных веществ используется чаще всего для очистки воздуха. При этом сохраняют свое значение те же закономерности, которые были найдены для адсорбции из жидкой фазы, в частности зависимость между степенью адсорбции и диэлектрической проницаемостью. Так, вещества, поглощенные полярным адсорбентом, легко можно вытеснить парами воды или спирта.
Области применения адсорбции непрерывно расширяются, возникают новые технологические операции, основанные на адсорбции, В последние годы в результате разработки более совершенной аппаратуры и улучшения качества сорбентов созданы адсорбционные установки для облагораживания бензиновых фракций с целью получения моторных топлив с повышенным октановым числом. Эти установки по экономичности не только не уступают абсорбционным или ректификационным установкам, но в ряде случаев превосходят их.
При помощи различных твёрдых адсорбентов производится улавливание ценных паров и газов, осветление растворов в производстве сахаров, глюкозы, многих формацевтических препаратов, нефтепродуктов.
Адсорбцией извлекают малые количества веществ, растворенных в больших объёмах жидкости. Используются при крашении волокон, при обогащении полезных ископаемых. Ионообменная адсорбция нашла широкое применение в пищевой промышленности.
Адсорбцию из жидких растворов широко используют как метод очистки сточных вод для обезвреживания их от веществ, растворенных как в виде молекул, так и в виде ионов: красителей, пестицидов, гербицидов, фенолов, кислот, щелочей, солей, ПАВ и многих других.
Адсорбционные явления лежат в основе процессов крашения, стирки, хроматографии, гетерогенного катализа.
Использование различных адсорбентов при промышленном производстве пищевых продуктов позволяет осветлять растительные масла, вина, пиво; отбеливать сахарный сок.
В медицине − при лечении желудочных заболеваний, различного рода токсических отравлениях также активно протекают десорбционные процессы. Вкусовые ощущения человека связаны с адсорбцией пищевых веществ на определенных участках языка.
При помощи ионообменной адсорбции питаются растения, восстанавливается плодородие почв вносимыми удобрениями, умягчается и опресняется соленая вода, формируются вторичные рудные месторождения.
Адсорбенты применяют в:
1. противогазах ; (Приложение 5)
2. в качестве носителей катализаторов; (Приложение 5)
3. для очистки газов, спиртов, масел, бензина; (Приложение 5)
4. для разделения спиртов ; (Приложение 5)
5. при переработке нефти ; (Приложение 5)
6. в медицине для поглощения газов и ядов . (Приложение 5)
2. Экспериментальная часть.
Все стаканы и пробирки пронумерованы от 1 до 3. Под №1 находится адсорбент Активированный уголь; под №2 – Полисорб МП (кремния диаксид коллоидный); под №3 – Энтеросгель (Полиметилсилоксана полигидрат). (Приложение 6)
2.1. Учебно-исследовательский эксперимент “ Поглощение запаха различными адсорбентами”.
Этот эксперимент был сделан для того, чтобы проверить, какие адсорбенты (которые можно купить в обычной аптеке) лучше справятся с устранением едкого запаха аммиака. В пронумерованные пробирки я распределил адсорбенты и залил аммиак. Но для того, чтобы это вещество не улетучилось, я закупорил горлышки пробирок ваткой. После определял, где запах уменьшился. Этот эксперимент показал, что лучшим устранителем запаха аммиака является активированный уголь (Приложение 7).
2.2. Учебно-исследовательский эксперимент “Обесцвечивание раствора йода различными адсорбентами ”.
Для этого эксперимента мне понадобилось: пронумерованные стаканчики; выбранные мной адсорбенты и раствор йода. С начала я сделал р-р йода и разлил по стаканчикам. После погрузил адсорбенты и через полчаса наблюдал, что раствор в стаканчике №1 обесцветился, №2 - почти не изменился, №3 - чуть потускнел (Приложение 8). Лучшим адсорбентом вновь стал активированный уголь.
2.3. Учебно-исследовательский эксперимент “ Обесцвечивание раствора бриллиантового зеленого различными адсорбентами”.
В 3-м опыте я проверил действие адсорбентов на раствор бриллиантового зелёного. В первый и последующие стаканчики я погрузил адсорбенты. После 30 минут я наблюдал, что р-р с активированным углём почти полностью потерял цвет. Во втором же и третьем стаканчике цвет р-ра лишь немного потускнел (Приложение 9). Снова активированный уголь показал лучшие адсорбирующие свойства.
2.4. Учебно-исследовательский эксперимент “ Обесцвечивание раствора мандаринного сока различными адсорбентами”.
Для этого эксперимента мне понадобилось: пронумерованные стаканчики; различные адсорбенты и мандаринный сок. Для начала я выжал из мандарина сок и разместил по стаканчикам. После погрузил адсорбенты и через полчаса наблюдал, что сок в первом стаканчике обесцветился, во втором почти не изменил цвет, в третьем стал менее ярким (Приложение 10). Я вновь убедился, что активированный уголь - лучший адсорбент.
2.5. Учебно-исследовательский эксперимент “Обесцвечивание раствора свекольного сока различными адсорбентами ”.
2.6. Выводы по результатам экспериментов.
При проведении учебно-исследовательских экспериментов я удостоверился, что лучшим адсорбентом является Активированный уголь.
Читайте также:

