Вторичный нефротический синдром у детей реферат
Обновлено: 05.07.2024
Нефротический синдром у детей – это комплекс симптомов и лабораторных показателей или же болезнь, которая проявляется периферическими или генерализованными отеками (в крайней форме это асцит и анасарка). Что касается лабораторных данных при этом диагнозе, фиксируют протеинурию больше 2,5 г/сут или более 50 мг/кг/сут, гипоальбуминемию (менее 40 г/л), гипопротеинемию, гиперлипидемию, диспротеинемию и липидурию.
Осложнения нефторического синдрома у детей
Что провоцирует / Причины Нефротического синдрома у детей:
В 10 случаях из 100 нефротический синдром у детей – вторичный, то есть вызван определенной причиной (часто это системное заболевание). К НС у детей могут привести такие болезни:
- амилоидоз
- синдроме Альпорта
- геморрагический васкулит
- тромбоз почечной вены
- тромботическая микроангиопатия
Нефротический синдром довольно часто является проявлением первичного гломерулонефрита. Также исследователи говорят о врожденном нефротическом синдроме и семейном НС.
Важно знать, что нефротический синдром у детей может быть и вторичным. Он сопровождает ряд болезней, при которых у ребенка поражены почки:
- ревматоидный артрит
- геморрагический васкулит
- системная красная волчанка
- сахарный диабет
- микроскопический полиангиит и другие
Патогенез (что происходит?) во время Нефротического синдрома у детей:

При нефротическом синдроме развивается гипопротеинемия, потому что с мочой из организма выводятся белки, в основном альбумины (нарушается проницаемость гломерулярного фильтра). Гипопротеинемия становится причиной снижения онкотического давления плазмы. По этой причине жидкость не полностью возвращается в сосудистое русло, начинает задерживаться в тканях. Этим объясняется появление у больного ребенка нефротических отеков. Также важно состояние лимфатических капилляров, поскольку гипергидратация ткани приводит к компенсаторному усилению лимфооттока, вместе с лимфой удаляются тканевые белки. Это приводит к снижению снижает онкотического давления межтканевой жидкости. Данный механизм может до определенного предела препятствовать развитию отека при гипопротеинемии.
Четкая зависимость между уровнем гипопротеинемии и степенью отеков не найдена. Отеки у ребенка могут не появляться, даже если в крови снижен уровень альбуминов. Объяснение может быть во включении компенсаторных механизмов. Если НС у ребенка развивается при первичном гломерулонефрите, его называют идеопатическим нефротическим синдромом. Морфологические изменения заключаются в минимальных, фокально-сегментарном гломерулосклерозе и т.д. При нефротическом синдроме с минимальными изменениями, который обозначается сокращенно как НСМИ, гломерулярная базальная мембрана проницаема преимущественно для низкомолекулярных белковых молекул, потому протеинурия имеет выборочный характер.
Симптомы Нефротического синдрома у детей:
Для нефротического синдрома у детей характерны отеки. Сначала они появляются на лице, потом на веках, далее могут возникнуть в области поясницы и на ногах. Также среди характерных симптомов отмечают бледность кожи, олигурию, связанную с гиповолемией, гиперальдостеронизмом, поражением канальцев. Для НС у детей типичен вторичный гиперальдостеронизм, что становится причиной задержки натрия в детском организме. Это ведет, в свою очередь, к задержке воды, хотя отмечают в крови гипонатриемию.
Неполный нефротический синдром – форма, при которой нет отеков. Смешанный нефротический синдром диагностируют при сочетании НС с гематурией и гипертензией.
Диагностика Нефротического синдрома у детей:
Нефротический синдром диагностируют, если у ребенка отеки и протеинурия, которую можно обнаружить, сдав анализ мочи. Причины заболевания можно выяснить, тщательно собрав анамнез. Если же причину выявить оказывается непросто, могут провести биопсию почек и/или серологические тесты. Диагностическое значение имеет содержание в моче, собранной за сутки, 3 грамм белка. Также по анализу мочи определяют, что в ней есть эритроциты и цилиндры. Исходно присутствует липидурия – в канальцевых клетках есть свободный жир – если нефротический синдром спровоцирован патологией клубочков.
Для выяснения тяжести и осложнений врачи могут назначить дополнительные тесты. Концентрации креатинина и азота изменяются в зависимости от степени нарушения почечной функции. Содержание альбумина часто менее 25 г/л.
Идиопатический нефротический синдром у детей представлен часто с минимальными изменениями (это было описано выше). Обычно его диагностируют без проведения биопсии, исключения составляют случаи, когда организм не реагирует на пробный курс ГКС (глюкокортикоидов).
Лечение Нефротического синдрома у детей:
В качестве патогенетического лечения нефротического синдрома у детей применяют иммуносупрессивную терапию. Выбирают традиционные, неселективные препараты:
- цитостатики
- глюкокортикоиды
- антиметаболиты
Применяют и селективные иммунодепрессанты:
При иммуносупрессивном лечении ГН применяют такие глюкокортикоиды:
- преднизолон
- преднизол
- медопред
- солу-медрол
- метипред
Нефротический синдром делят на 2 вида в зависимости от реакции на гормональную терапию:
- гормоно(стероидо)чувствительный
- гормоно(стероидо)резистентный
Если у ребенка диагностировали первичный НС, то терапия преднизолоном поможет, заболевание выйдет на стадию ремиссии. Если же на курс препаратов реакции нет, улучшений не наступает, то нужны другие подходы.
Для лечения применяют три режима ГК терапии:
- постоянный пероральный прием преднизолона в дозировке 1–2 мг/кг (делят на 2-4 приема) – назначается сразу после диагностики НС
- альтернативный режим приема (поддерживающая терапия)
суточная доза преднизолона принимается день через день, что поддерживает клинический эффект, но снижает побочные явления.
Среди побочных явлений, возникающих от приема преднизолона:
- эйфория
- повышение аппетита
- психоз
- ожирение
- отеки
- стрии
- миопатия
- гирсутиз
- атрофия кожи
- стероидный диабет
- повышение артериального давления
- и множество других
- пульс-терапия метилпреднизолоном (для достижения очень высоких концентраций ГК в плазме). Внутривенно капельно вводят на протяжении 20-40 минут примерно 30 мг/кг МП один раз за 2 суток.
Цитостатические препараты
Цитостатики могут вызвать такие побочные явления:
- лейкопения
- тошнота и рвота
- недостаточность гонад
- геморрагический цистит
- легочный фиброз
- гепатопатия и пр.
Селективные иммунодепрессанты
Применяются такие препараты циклоспорина А:
- сандимун неорал
- сандимун
- биорал
- экорал
Врачи перед назначением таких препаратов должны назначить биопсию почки. Необходим постоянный контроль уровня креатинина в крови и концентрации препарата.
Для лечения могут применяться такие препараты:
- мофетила микофенолат (селсепт)
- такролимус
Они являются новыми селективными иммуносупрессантами. При выявлении стероидорезистентности проводят нефробиопсию.
Принципы лечения первичного ФСГС
Изначально лечение ФСГС осуществляется как терапия идиопатического НС. При соответствующем лечении ПЗ происходит ремиссия, что является хорошим прогностическим признаком. Примерно у 95% процентов больных жизнь сохраняется в течение 10 лет. Когда удается достичь стойкой ремиссии НС, терапия осуществляется как при НСМИ. Но если устанавливается гормонорезистентность, необходимо осуществление нефробиопсии. И только на данном этапе происходит лечение у детей собственно ФСГС, поскольку ранее терапии подвергался идиопатический НС (без морфологического уточнения).
Терапия ФСГС имеет своей целью достижение ремиссии и улучшение прогноза. В случае, если этого не удается достичь, единственной возможностью замедления развития ХПН является снижение протеинурии.
Если показатели протеинурии менее 2 г/сут, в 90% возможна 10-летняя выживаемость больных, тогда как при уровне 2,5–5,0 – лишь около 45%. Если же уровень белка равен или более 14 г/сут, без заместительной терапии больные могут прожить не более 6 лет.
Принципы лечения мезангиопролиферативного гломерулонефрита (МзПГН)
Первоначально терапия МзПГН, проявляющегося в виде НС, аналогична лечению идиопатического НС.
Не существует единого способа излечения МзПГН (IgA-нефропатии). Поскольку больные часто являются гормонорезистентными, чаще всего врач назначает цитостатики (в частности, циклофосфамид) и преднизолон, применяя те же схемы. Что и при терапии ФСГС.
Общие рекомендации лечения больных с МзПГН
1. Важнейшее условие правильного и эффективного лечения – осуществление биопсии почки.
2. При быстро развивающейся почечной недостаточности, прогрессирующем нефротическом синдроме, васкулите и нефрите с полулуниями необходимо лечение с помощью кортикостероидов без цитостатиков или в комплексе с ними.
3. Эффективность лечения МзПГН повышается при санировании очагов хронической инфекции. Их уничтожение позволяет сделать рецидивы болезни более редкими. Кроме того, желательна аглиадиновая диета, которая способствует снижению и даже обратному развитию симптомов при целиакии.
4. Для того чтобы у больного ребенка как можно дольше не развивалась почечная недостаточность, необходим строгий контроль гипертензии. Показано ренопротективное лечение с применением блокаторов рецепторов ангиотензина II первого типа в сочетании с диуретиками, а также ингибиторов ангиотензинпревращающего фермента.
Принципы терапии МГН у детей
Прежде всего, больным деткам с нормальной работой почек и при отсутствии нефторического синдрома иммуносупрессивная терапия лечащим врачом не назначается. Но все же они должны постоянно наблюдаться у врача.
Если развивается артериальная гипертензия и обнаружена протеинурия более 1 г/сут, их коррекция проводится с помощью ингибиторов ангиотензинпревращающего фермента. Для нормализации гиперлипидемии показана диета.
Если МГН манифестирует в виде НС или болезнь достигла поздней стадии развития, терапия аналогична лечению идиопатического НС. Если наблюдаются частые рецидивы нефторического синдрома, больной ребенок гормонозависим или резистентен, терапия усиливается с помощью МП, хлорамбуцила или ЦиА (схемы C. Ponticelli, de Santo и др.). Применение комбинаций ЦС и глюкокортикостероидов в дальнейшем приводит к более редким рецидивам. Однако монотерапия ГК так же эффективна для достижения стихания симптомов, как и комбинированный прием указанных препаратов.
МГН, по мнению исследователя C. Ponticelli, – потенциально излечимая болезнь. И это необходимо учитывать при выборе путей лечения заболевания.
Как видно, иммуносупрессивная терапия – основа патогенетического лечения ИНС. Но не менее важны диета, режим, Помимо иммуносупрессивной терапии, не менее важное значение имеют диетические и режимные мероприятия, оздоровление очагов инфекции, лечение побочных недугов, устранение возможных аллергенов и т.п. Но решающим условием достижения стойких долгосрочных ремиссий, которые улучшаю прогноз заболевания, являются ранняя диагностика, назначение, доза и терапия глюкокортикоидами.
Профилактика Нефротического синдрома у детей:
Для профилактики нефротического синдрома следует вовремя лечить инфекционные болезни, не затягивать с походом к врачу. Все рекомендации вашего лечащего врача нужно неукоснительно соблюдать. Если некоторые для вас непонятны или непонятна причина их назначения, лучше переспросить у врача, а не проводить самостоятельную отмену препаратов или уменьшение доз.
Одевайте ребенка по погоде, чтобы не было перегреваний и переохлаждений. Обязательно купите термометр и повесьте за окно, чтобы точно знать температуру на улице, а не надеяться на информацию на погодных сайтах. Во время обострения сезонных аллергий вовремя давайте ребенку антигистаминные препараты (перед приемом нужно проконсультироваться к врачу). По возможности изолируйте ребенка от аллергенов.
К каким докторам следует обращаться если у Вас Нефротический синдром у детей:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Нефротического синдрома у детей, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Нефротический синдром может быть также вторичным проявлением многих поражений почечных клубочков: мембранозная нефропатия, мезангиокапиллярный, постинфекционный и волчаночный гломерулонефрит, геморрагический васкулит. Вторичный нефротический синдром следует подозревать у больных старше 8 лет при наличии артериальной гипертонии, гематурии, нарушения функции почек, внепочечных симптомов (сыпь, артралгия и др.) или низкого уровня комплемента в крови.
В некоторых регионах мира ведущими причинами нефротического синдрома являются малярия и шистосомоз. Вызывают нефротический синдром вирусы гепатита В и С, филярии, возбудитель проказы и ВИЧ.
Нефротический синдром сопутствует злокачественным опухолям, особенно у взрослых. У больных с солидными опухолями (например раком легкого, желудка или кишечника) почечная патология часто напоминает мембранозную нефропатию. По видимому, в этих случаях в почках откладываются комплексы опухолевых антигенов со специфическими антителами. При лимфомах, особенно лимфоме Ходжкина, поражение почек чаще всего напоминает болезнь минимальных изменений. Предполагается, что продуцируемый лимфомой лимфокин увеличивает проницаемость стенки клубочковых капилляров. Нефротический синдром возможен и до обнаружения опухоли, но исчезает при ее регрecce и возобновляется при рецидиве.
К развитию нефротического синдрома приводит также многочисленные лекарственные средства и химические вещества. Гистологическая картина почек в этих случаях может напоминать мембранозную нефропатию (пенициллин, каптоприл, препараты золота, НПВС, соединения ртути), болезнь минимальных изменений (пробенецид, этосуксимид, метимазол, литий) или мезангиокапиллярный гломерулонефрит (прокаинамид, хлорпропамид, фенитоин, триметадион, параметадион).
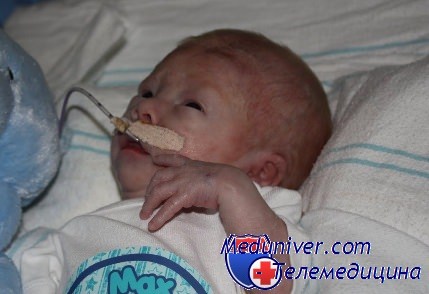
Врожденный нефротический синдром у детей
При развитии нефротического синдрома у детей первых 3 мес. жизни он считается врожденным. Чаще всего наблюдается врожденный нефротический синдром финского типа — аутосомно-рецессивное заболевание, наиболее распространенное среди потомков выходцев из Скандинавии (частота 1:8000). В его основе лежит мутация расположенного на хромосоме 19 гена NPHS1, который кодирует белок нефрин (важнейший компонент фильтрационных щелей между ножками подоцитов). Считается, что нефрин определяет нормальную функцию фильтрационного барьера в почечных клубочках. Гистологически синдром характеризуется в основном расширением проксимальных канальцев, пролиферацией клеток мезангия и склерозом клубочков.
У грудных детей обнаруживаются массивная протеинурия (которую можно определить и внутриутробно по повышению уровня а-фетопротеина) и отеки. Плацента увеличена. Больные часто рождаются недоношенными с респираторным дистрессом и расхождением швов черепа. Отеки сохраняются, часто возникают инфекционные заболевания, и к 5-летнему возрасту больные обычно погибают от почечной недостаточности. Кортикостероиды и иммуносупрессивные средства неэффективны.
Уменьшить протеинурию и улучшить состояние больных можно с помощью ингибиторов АПФ, индометацина и односторонней нефрэктомии. Однако в этих случаях чаще выполняют двустороннюю нефрэктомию с последующим постоянным диализом и активными диетическими мерами. В конце концов требуется трансплантация почки. В семьях, где имелись или имеются больные с врожденным нефротическим синдромом финского типа, для пренатальной диагностики определяют уровень а-фетопротеина в амниотической жидкости. Диагноз можно подтвердить данными анализа ДНК.
Другие причины врожденного нефротического синдрома включают врожденные инфекции, такие как сифилис, токсоплазмоз, краснуха и ЦМВ-инфекция, а также ВИЧ и вирус гепатита В. Поражение почек в этих случаях выражено слабее, чем при врожденном нефротическом синдроме финского типа, и излечение основного заболевания смягчает или устраняет почечную патологию.
У небольшого числа больных с врожденным нефротическим синдромом наблюдается диффузный мезангиальный склероз с прогрессирующим склерозом мезангия клубочков и быстрым ухудшением функции почек. Терминальная стадия почечной недостаточности развивается за несколько месяцев или лет. Диффузный мезангиальный склероз может быть как отдельным заболеванием, так и проявлением синдрома Дени-Дрэша (сочетание нефробластомы с мужским псевдогермафродитизмом). В основе этого синдрома лежит мутация гена опухоли Вильмса (WT1) на хромосоме 11.
Нефротический синдром у детей — это симптомокомплекс, который клинически проявляется отеками и снижением диуреза. Лабораторные признаки патологии — протеинурия, гиперлипидемия, гипоальбуминемия и диспротеинемия. Синдром развивается при первичных гломерулопатиях, аутоиммунных, онкогематологических и сердечно-сосудистых заболеваниях. Для диагностики проводят анализы крови и мочи, биопсию почки, ЭхоКГ и ЭКГ. Лечение включает длительные курсы иммуносупрессорной терапии (глюкокортикоиды, алкилирующие агенты, ингибиторы кальциневрина) в комбинации с нефропротекторными, гипотензивными и мочегонными препаратами.
МКБ-10

Общие сведения
Распространенность нефротического синдрома составляет 12-16 случаев на 100 тыс. детского населения. Ежегодно нефрологи выявляют от 2 до 7 новых случаев заболевания на 100 тысяч пациентов младше 18 лет. Патология не относится к самостоятельным нозологическим единицам, а представляет собой один из синдромов почечных или внепочечных болезней. Актуальность этой проблемы в педиатрической практике обусловлена сложностью терапии и частыми случаями резистентности к лекарствам.

Причины
У детей чаще выявляются первичные формы нефротического синдрома, вызванные поражением клубочкового аппарата почек. В 85% морфологическим субстратом является болезнь минимальных изменений, до 5-7% составляет фокально-сегментарный гломерулосклероз, 4-6% отводится мезангиопролиферативному гломерулонефриту. Вторичный вариант заболевания имеет несколько этиологических факторов:
- Аутоиммунные процессы. Они сопровождаются образованием иммунных комплексов и провоспалительных цитокинов, которые откладываются в почечных капиллярах, нарушая работу фильтрационной системы органа. У детей причиной могут послужить системные васкулиты, системная красная волчанка, синдром Шегрена.
- Злокачественные опухоли. Почечные поражения возникают при лимфоме Ходжкина и неходжкинских новообразованиях, которые зачастую встречаются в детском возрасте. Среди менее распространенных онкологических факторов выделяют множественную миелому, солидные опухоли.
- Токсические повреждения почек. Нефротический синдром возможен при длительном и бесконтрольном приеме ребенком нестероидных противовоспалительных средств и некоторых антибиотиков. Поражение почек также наблюдается при отравлении солями тяжелых металлов, ядами змей и перепончатокрылых насекомых.
- Нарушения почечного кровотока. Повышенная секреция белка в мочу происходит при структурных повреждениях почечных клубочков на фоне тотальной ишемии. Она может быть вызвана тромбозом почечной вены, серповидно-клеточной анемией, злокачественной гипертензией.
- Врожденные гломерулопатии. У детей встречается синдром Альпорта, для которого характерны мутации коллагеновых волокон в базальных мембранах клубочков. Реже диагностируется болезнь Фабри, когда нефропатия связана с нарушениями метаболизма сфинголипидов.
Патогенез
Повышенная потеря белков с мочой снижает онкотический показатель крови. Как следствие, жидкость по градиенту давления начинает перемещаться из сосудистого русла в ткани. Таким образом формируются массивные нефротические отеки. Их интенсивность зависит от степени белковых потерь и активности компенсаторных механизмов. В 10% случаев отечный синдром развивается вследствие первичной задержки натрия в организме.
Симптомы
Для патологии типично острое начало, связь с перенесенной инфекцией, переохлаждением, вакцинацией или обострением хронической соматической болезни. Сначала ребенок жалуется на общую слабость, недомогание, сонливость и заторможенность. Реже беспокоят головные и абдоминальные боли, тошнота, снижение аппетита. У девочек-подростков бывают нарушения менструального цикла.
Основное проявление нефротического синдрома — отеки. Вначале они возникают на лице (утром) и на голенях (вечером, после длительной ходьбы), а затем постепенно распространяются по всему телу. Первоначально они мягкие, расположены симметрично, кожа над ними теплая и сухая. Параллельно с этим снижается количество суточной мочи. Периферические отеки дополняются полостными — асцитом, гидроперикардом, гидротораксом, что ухудшает состояние ребенка.
Осложнения
Негативные последствия нефротического синдрома вызваны потерей альбуминов, которые в норме выполняют ряд физиологических функций. Потеря иммуноглобулинов ухудшает иммунную защиту организма, что проявляется частыми респираторными инфекциями, рецидивирующими тонзиллитами и синуситами. Снижение количества трансферрина (переносчика железа) приводит к рефрактерной железодефицитной анемии.
Значимым осложнением для детей младшего возраста является потеря витамин-Д-связывающего белка. В результате формируется рахитоподобный синдром, нарушается минерализация и рост костей скелета. В редких случаях развивается повышенная кровоточивость из-за дефицита прокоагулянтов. При стероидорезистентном варианте болезнь в течение 5-10 лет прогрессирует до терминальной ХПН.
Диагностика
При физикальном осмотре детский нефролог обращает внимание на симметричность и расположение отеков, проводит аускультацию сердца и легких, определяет признаки асцита и увеличения печени. Симптомы не дают возможности установить клинический диагноз, поэтому врач назначает полное обследование. Составляющие диагностического комплекса:
- Анализ мочи. Патогномоничными признаками нефротического синдрома являются протеинурия более 50 мг/кг/сутки, соотношение протеин/креатинин более 2 и экскреция альбумина свыше 40мг/м 2 /час. Для исключения эритроцитурии и лейкоцитурии показан анализ по Нечипоренко. Функцию почек оценивают с помощью пробы Реберга.
- Анализ крови. При биохимическом исследовании выявляют уровень альбумина сыворотки менее 30 г/л, повышение уровня холестерина и триглицеридов, увеличение показателя креатинина. Уровни натрия и кальция крови снижаются, а калий может быть повышен. В коагулограмме наблюдается повышение фибриногена.
- ЭхоКГ. Ультразвуковая визуализация необходима для обнаружения гидроперикарда, морфометрических изменений крупных сосудов вследствие отеков. Также рекомендована ЭКГ, которая позволяет вовремя заметить нарушения ритма и проводимости, связанные с электролитными нарушениями.
- Биопсия почки. Пункционный забор материала выполняется при нефротическом синдроме у младенцев до 1 года и подростков старше 12 лет, а также при неэффективности стандартной медикаментозной терапии. Биоптаты подвергают световой, электронной и иммунофлюоресцентной микроскопии.
Лечение нефротического синдрома у детей
Дети с острым нефротическим синдромом подлежат обязательной госпитализации на 2-3 недели. Двигательная активность при этом не ограничивается и соответствует самочувствию больного. В диете необходимо поддерживать высокий уровень белков, а подросткам с массивными отеками рекомендовано снизить потребление поваренной соли. При выраженных потерях протеинов назначается коррекция гомеостаза коллоидными и кристаллоидными растворами.
Основу патогенетического лечения детей с нефротическим синдромом составляет иммуносупрессивная терапия с применением глюкокортикоидов. Препараты уменьшают образование и поступление в патологический очаг воспалительных клеток, угнетают секрецию медиаторов воспаления, приостанавливают формирование токсических иммунных комплексов. Терапия глюкокортикоидами проводится в 3-х режимах:
- Постоянный. Показан в начале лечения, чтобы быстро достичь фазы ремиссии. Гормоны принимаются перорально в первой половине дня в суточной дозировке 1-2 мг/кг.
- Альтернирующий. Назначается после достижения ремиссии. Стандартные дозы глюкокортикоидов используются через день, чтобы сохранить клинический эффект, но снизить риски побочных реакций.
- Пульс-терапия. Применяется при тяжелом течении нефротического синдрома. Гормоны вводятся внутривенно капельно, чтобы в короткие сроки достичь высоких концентраций лекарства в крови.
При развитии тяжелых побочных эффектов на гормональные препараты или стероидорезистентном варианте заболевания переходят на другие виды иммуносупрессоров. В детской нефрологии наилучший результат показывают ингибиторы кальциневрина, алкилирующие агенты, некоторые моноклональные антитела к лимфоцитам. Они могут вызывать нефротоксичность, поэтому во время лечения врачи контролируют уровень СКФ.
Для устранения массивных отеков проводится терапия петлевыми диуретиками в возрастных дозировках. С целью ликвидации рефрактерных полостных отеков назначаются комбинации петлевых и тиазидных мочегонных. В качестве гипотензивных и нефропротекторных средств у детей лучше всего работают ингибиторы АПФ и блокаторы рецепторов ангиотензина. Коррекцию остеопении производят препаратами витамина Д.
Прогноз и профилактика
У детей с хорошим ответом на стероидную терапию в 95% наблюдается полное выздоровление без снижения функции почек. Менее благоприятный прогноз при стероидорезистентности, поскольку у таких пациентов высокий риск формирования хронической почечной недостаточности. Однако, своевременное применение иммуносупрессоров и нефропротекторов позволяет замедлить патологический процесс.
Первичная профилактика включает рациональное назначение лекарств, раннюю диагностику и терапию аутоиммунных процессов, избегание контактов с нефротоксическими веществами. Вторичная профилактика предполагает курсы гормональной терапии при обострении основной патологии либо в случае интеркуррентного заболевания. Это необходимо для предупреждения рецидивов нефротического синдрома.
4. Нефротический синдром у детей: определение и принципы терапии/ С.В. Бельмер, А.В. Малкоч// Лечащий врач. — 2004.
Нефротический синдром у детей проявляется в виде отеков и снижения диуреза. Патология развивается на фоне заболеваний сердца, сосудов, онкогематологических и аутоиммунных болезней. Нефротический синдром сложно поддается лечению из-за частых случаев резистентности к медикаментам.

Причины развития нефротического синдрома у детей
У детей чаще всего диагностируют первичную форму нефротического синдрома, которая возникает из-за поражения клубочкового аппарата почек. Нефротический синдром возникает при пиелонефрите, гломерулонефрите.
Причины развития вторичного нефротического синдрома:
- аутоиммунные патологии — синдром Шегрена, системные васкулиты, системная красная волчанка;
- злокачественные новообразования — лимфома Ходжкина, множественная миелома;
- токсическое поражение почек, вызванное бесконтрольным приемом нестероидных противовоспалительных препаратов, некоторых антибиотиков, отравлением ядом змей и насекомых, солями тяжелых металлов;
- нарушение почечного кровотока при тромбозе почечной вены, злокачественной гипертензии, серповидно-клеточной анемии;
- абсцесс легких, септический эндокардит, бронхоэктазам;
- туберкулез, малярия, врожденный сифилис;
- врожденные гломерулопатии при синдроме Альпорта, болезни Фабри.
Клинические проявления
Для нефротического синдрома характерно острое начало. Чаще всего характерные симптомы появляются после переохлаждения, вакцинации, инфекционных патологий, при обострении хронических болезней. Начальные признаки — слабость, сонливость, головная боль, тошнота, отсутствие аппетита, дискомфорт в абдоминальной области. У девочек в подростковом возрасте нарушается менструальный цикл.
Один из основных симптомов — отечность. Сначала утром отекает лицо, а к вечеру голени. Постепенно отеки распространяются по всему телу. Изначально отеки мягкие, симметричные, кожные покровы над ними сухие и теплые. Второй признак — уменьшение суточного количества мочи. Дополнительные проявления — сухость во рту, жажда, понос, вздутие живота, судороги, парестезия. Кожа бледная, сухая и шелушится, волосы и ногти ломкие.
Помимо внешних отеков, возникают и полостные — асцит, гидроторакс, гидроперикард. Что негативно отражается на состоянии ребенка.
Методы диагностики
При появлении признаков нефротического синдрома необходимо обратиться к детскому нефрологу. Диагностика начинается со сбора анамнеза и осмотра.
Врач отмечает сухую, холодную кожу, обложенность языка, отечность, увеличение объема живота. При прослушивании тона сердца приглушенные, перкуторный звук укорочен, дыхание ослабленное, слышны мелкопузырчатые хрипы.
Диагностический комплекс включает:
- Общий, биохимический анализ мочи. Суточная протеинурия более 50 мг/кг, соотношение протеина и креатинина более двух единиц, экскреция альбумина превышает 40 мг на кв. м в час. Плотность мочи повышена, в урине много лейкоцитов, цилиндров, присутствуют кристаллы холестерина, капель жира.
- Дополнительно назначают анализ мочи по Нечипоренко.
- Пробы Реберга проводят для оценки функций почек.
- Биохимический анализ крови. Показатели альбумина, натрия и кальция снижены, уровень холестерина, триглицеридов, креатинина, калия повышен.
- Общий анализ крови. Повышена СОЭ, количество эозинофилов, тромбоцитов. Незначительно снижены показатели гемоглобина, эритроцитов.
- Коагулограмма. Высокий уровень фибриногена.
- ЭхоКГ, ЭКГ. Назначают для выявления гидроперикарда, нарушения сердечного ритма.
- УЗИ почек, УЗДГ почечных сосудов, нефросцинтиграфия.
- Биопсия почек. Пункцию делают детям до года и подросткам старше 12 лет. Полученный биоматериал отправляют на иммунофлюоресцентную, электронную и световую микроскопию.

Методы лечения
При выявлении нефротического синдрома ребенка госпитализируют на 15–20 дней. Назначают медикаментозное лечение и диету.
Группы препаратов для лечения нефротического синдрома:
- коллоидные и кристаллоидные растворы;
- глюкокортикостероиды;
- ингибиторы кальциневрина;
- диуретики;
- ингибиторы АПФ, блокаторы рецепторов ангиотензина;
- препараты витамина D.
Показано питание с высоким содержанием белка — 1,3–1,5 г/кг. Необходимо употреблять полноценные и легкоусвояемые белки — нежирное мясо и рыба, творог, яичный белок. Пищу готовят без соли, из рациона исключают все продукты, которые содержат большое количество соли. Но раз в неделю нужно употреблять 3–4 г соли для предотвращения осложнений бессолевой диеты. Ограничить следует количество сахара. В список запрещенных продуктов входит лук, чеснок, редька.
При хорошей восприимчивости к стероидам выздоровление наблюдается у 95% детей с нефротическим синдромом, функции почек не нарушены. При непереносимости гормональных препаратов велика вероятность развития хронической почечной недостаточности.
Чем опасен нефротический синдром?
При длительном течении болезни уменьшается количество альбуминов. Это приводит к ослаблению иммунитета — ребенок часто болеет респираторными инфекциями, страдает от рецидивирующего синусита, тонзиллита. Из-за снижения уровня трансферрина развивается железодефицитная анемия.
Для маленьких детей опасно снижение уровня белка, который связывает витамин D. Нарушается рост костей, снижается минерализация костной ткани. Иногда при нефротическом синдроме наблюдается дефицит прокоагулянтов, что приводит к повышенной кровоточивости.
Редко нефротический синдром может стать причиной отека мозга, гиповолемического шока.
Первичная профилактика нефротического синдрома заключается в соблюдении правил приема лекарств, раннем выявлении и лечении аутоиммунных патологий, избегании контактов в нефротоксическими веществами. Вторичная профилактика — это курсы стероидной терапии при обострении заболевания.
Читайте также:

