Вода как реагент и как среда для химического процесса реферат
Обновлено: 05.07.2024
Министерство сельского хозяйства Ставропольского края
ФГБОУ ВО СТАВРОПОЛЬСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
Факультет среднего профессионального образования
По учебной дисциплине: УПВ 02У. Химия
На тему: Вода, как реагент и среда для химического процесса.
Выполнил: обучающийся 1 курса
Пехтелев Андрей Кириллович
Преподаватель УМО ФСПО СтГАУ
Паспорт индивидуального проекта
Направление, в рамках которого проводится работа по проекту: естественнонаучное направление
Учебная дисциплина: УПВ 02У. Химия
Сведения об авторе: Студент ФСПО 1 курса группы ЭЛиАСХ-9-2 Пехтелев Андрей Кириллович
Сведения о руководителе: преподаватель УМО ФСПОСтГАУ Соломонова Виктория Александровна
Цель: Изучить воду, как реагент и ее применение в химических процессах.
Задачи: расширить понятия о воде.
Вопросы проекта: Узнать, как можно использовать воду в химических процессах и о её более широком применении в жизни.
Аннотация: Вода — это жидкость без вкуса, запаха, цвета, которая входит в состав всех живых существ .
Итоговый продукт: Презентация
Форма защиты проекта: Очная
выполнения проекта по дисциплине Химия
Пехтелев Андрей Кириллович
Руководитель: преподаватель УМО ФСПО СтГАУ
2. Физические свойства воды………………………………………………6
3. Свойства и параметры газа Брауна…………………………………. 7
4. Способы получения газа Брауна ………………………………………. 8
5. ПРАВИЛА ИСПОЛЬЗОВАНИЯ………………………………………..9
6. Преимущества электролизера…………………………………………. 10
8. Применение газа Брауна………………………………………………. 11
Вода (оксид водорода, гидроксид водорода) — бинарное неорганическое соединение с химической формулой H2O: молекула воды состоит из двух атомов водорода и одного —кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твердом состоянии называются льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде кристаллов (на гидрофильных поверхностях).
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энегрии, возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Всего на Земле около 1400 млн км³ воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн км²). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озёрах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты.
Физические свойства воды
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте и диметилсульфоксиду). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода[19]. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования[19]. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °C, а замерзала при −100 °C[20].
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель.
Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
Свойства и параметры газа Брауна
Газ Брауна - самый экологически чистый природный газ на земле с самой высокой скоростью сгорания во вселенной.
Газ Брауна , который часто обозначают как HHO или гремучий газ - это 2 части газообразного водорода, и одна часть кислорода в определенном объеме.
Удельная теплота такого газа равна 13 кДж/л и температура плавления с выше 2000 0 с.
Обычные кислород и водород, реализуемые в торговой сети или полученные обычными электролизерами, поставляются в виде O2 и H2. То есть, молекулы обоих газов имеют по два атома. Это более устойчивое состояние этих газов, чем когда отдельные атомы отделены (заряженные ионы) и каждый атом существует по отдельности.
Проблема с H2 и O2 как с горючими газами, в том, что до того, как они начнут реагировать, чтобы превратиться в H2O, они должны быть разложены на атомы H и O .Требуемая на это энергия составляет большую часть из той, которую Вы получите при их взаимодействии для получения H2O.
Что делает газ Брауна уникальным, и наиболее ценным, так это то, что он существует не в молекулярной форме H2 и O2 молекул. Здесь они в одноатомном состоянии (один атом на молекулу). В этом состоянии, когда водород сгорит (прореагирует с кислородом), энергии будет возвращено в 3.8 раза больше
Способы получения газа Брауна
Мы знаем, чтобы получить газ Брауна нужно разделить воду на кислород и водород. Это можно сделать подав электрический ток через воду. Самый простой способ – просто взять 2 провода, подать на них электричество и окунуть в воду.
Но это не безопасно, и поэтому можно собрать закрытый электролизер из корпуса, пластин нержавеющей стали и резиновых прокладок для лучшей герметизации. Для работы электролизера будет достаточно 1,5-4 вольта постоянного тока, но при увеличении габарит можно увеличивать мощность подачи тока.
Заправлять такой прибор можно водой из под крана, щелочным раствором, но лучше всего 15% раствором KOH. Каустическая сода увеличит выход газа в 2-3 раза.
1л воды при реакции выдает 1868л горючего газа, а такая конструкция с примерными размерами 10см на 20см может выдавать до 1л газа в мин, а также генерирует любое давление, которое может выдержать конструкция.
ПРАВИЛА ИСПОЛЬЗОВАНИЯ
Преимущества электролизера
Электролизер - это миниатюрная энергоустановка, которая добывает конечный продукт сразу и не имеет больших габаритов по сравнению с заводами и предприятиями, а может храниться даже на столе.
Известно, что в двигателях внутреннего сгорания переработка топлива происходит неэффективно. В лучшем случае, сгорает только 40% топлива – дорогого и вредного для окружающей среды бензина или дизеля. Оставшиеся 60% успешно догорают в выхлопной трубе.
Применение газа Брауна
Газ Брауна можно использовать как горючее почти во всех сферах энергетики: от мини резаков до ракет.
Возьмем в пример автомобиль. Для сжигания бензина, дизеля и других видов топлива нужен окислитель, который подается отдельно и нуждается в смешивании, а в электролизере выдается и топливо и окислитель одновременно.
В машинах есть карбюратор - устройство для смешивания топлива и воздуха в правильных пропорциях, чтобы горение или детонация проходили максимально эффективно, но в электролизере мы получаем готовую смесь в идеальном соотношении, что на много практичнее, проще и экологически чище.
Газ Брауна в данном случае можно использовать, как добавочное топливо вместе с привычным нам горючим, а можно и перейти полностью на использование данного газа без посторонних элементов.
Вода и экология
Автомобильные выбросы загрязняют окружающую среду. У неисправной машины выхлоп канцерогенных веществ увеличивается в 3-4 раза. Все это поднимается в атмосферу, вызывая катаклизмы.
Выбросы стоят на первом месте по загрязнению атмосферных слоев. Это вызывает глобальное потепление, становится причиной кислотных дождей.
Газовые выхлопы стали причиной подтопления стран Запада в 2002 году. Были затоплены Франция, Германия, Чехословакия, Италия. Вызвали засуху и смог на территории центральной России.
Горячий воздух выхлопов, встречаясь с воздушными потоками Гольфстрима, нагревает атмосферу, что вызывает обильные осадки и подтопления.
Газ Брауна это совершенное топливо для наших транспортных средств. На выхлопе получается кислород и водяной пар (как и в случае топливных баков), однако кислород здесь берется из воды, используемой для получения газа. Поэтому при сжигании газа Брауна в атмосферу поступает дополнительный кислород. С этой точки зрения вода представляет собой идеальное топливо для автомобилей будущего.
В заключение могу сказать, что вода – это спасение человечества от энергетического кризиса, решение одних из глобальных проблем по загрязнению окружающей среды и уменьшение экономических проблем в энергосфере, связанных с недостатком полезных ископаемых на Земле.
Самая распространенная жидкость на нашей планете и самое дешевое топливо. В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озёра — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %
Следовательно можно сделать вывод: вода – будущее энергетики на Земле и эту сферу нужно развивать.
Вода́ (оксид водорода) — бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (нагидрофильных поверхностях).
Содержание работы
Введение
Структура молекул воды
Химические свойства воды
Файлы: 1 файл
Химия.реферат.docx
Вятский Государственный Гуманитарный Университет
Реферат по дисциплине :
Выполнила студентка I курса
Учебной группы ЭПБ – 11
Мисюкевич Дарья Анатольевна
к.п.н Даровских Л.В.
- Введение
- Структура молекул воды
- Химические свойства воды
Вода́ (оксид водорода) — бинар ное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом, снегом или инеем, а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (нагидрофильных пов ерхностях).
Около 71 % поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 361,13 млн км. На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % на ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть в реках, озёрах и болотах, и 0,001 % в облаках (образуются из взвешенных в воздухе частиц льда и жидкой воды). Бо́льшая часть земной воды — солёная, и она непригодна для сельского хозяйства и питья. Доля пресной составляет около 2,5 %, причём 98,8 % этой воды находится в ледниках и грунтовых водах. Менее 0,3 % всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003 %) находится в живых организмах.
Является хорошим сильнополярным раствор ителем. В природных условиях всегда содержит растворённые вещества (соли,газы)
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Является важнейшим веществом для всех живых существ на планете Земля.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества. Вода – самое удивительное соединение на Земле.
2.Внутренняя структура молекул воды
Вода (оксид водорода) H2O − простейшее устойчивое соединение водорода с кислородом. Молекулярная масса воды 18,0160, на водород приходится 11,19 % по массе, а на кислород – 88,81 %.
Восемь электронов внешнего электронного слоя атома кислорода образуют четыре электронные пары, из которых 2 создают ковалентные связи О−Н, а две другие представляют собой неподеленные электронные пары.
С современных позиций строения атома электронное облако молекулы воды имеет вид усеченного четырехлопастного винта, который может быть размещен в неправильном кубе (неправильный тетраэдр). Атом кислорода оказывается при этом в центре, а два атома водорода − в противоположных
углах одной из граней куба. Угол между ними составляет 104°31'. Два из восьми электронов атома кислорода расположены около ядра, два других связаны с атомами водорода, а две неподеленные пары электронов образуют ветви, расположенные в противоположном направлении по отношению к электронным облакам водородов. Таким образом, электронное облако молекулы воды имеет вид
четырех лепестков, направленных к вершинам неправильного тетраэдра. В двух вершинах одной грани находятся электронные пары, осуществляющие связь О—Н, а в двух вершинах противоположной грани находятся неподеленные электронные пары атома кислорода .Электронное облако в молекуле воды смещается к атому кислорода, так как он имеет большую электроотрицательность. Вследствие этого вблизи ядер атомов водорода создается избыток положительного заряда. Поэтому молекула воды полярна. Полярные молекулы характеризуются электрическим моментом диполя, который влияет на свойства веществ, состоящих из таких молекул. Электрический момент диполя представляет собой произведение одного из зарядов на расстояние между центрами положительного и отрицательного заряда. Расстояние между ними составляет 0,9568 Å. Для воды электрический момент диполя p = el равен 6*10-28 Кл-м или 1,8 дебая (1,8 * 10-18 ед. СГСЭ).Благодаря большому значению электрического момента диполя между молекулами воды проявляется сильное взаимодействие за счет образования водородных связей между атомом кислорода одной молекулы воды и атомом водорода другой. Водородная связь возникает в результате внедрения очень малого по мразмерам положительно поляризованного атома водорода одной молекулы в электронную оболочку отрицательно поляризованного атома кислорода другой молекулы воды. Длина водородной связи О . Н изменяется в пределах от 1,76 А. Энергия ее составляет 17—33 кДж/моль.
Возникновение водородной связи объясняется свойством атома водорода взаимодействовать с сильно электроотрицательным элементом, например с кислородом другой молекул воды. Такая особенность водородного атома обусловливается тем, что, отдавая свой единственный электрон на образование ковалентной связи с кислородом, он остается в виде ядра очень малого размера, почти лишенного электронной, оболочки. Поэтому он не испытывает отталкивания от электронной оболочки кислорода другой молекулы воды, а, наоборот, притягивается ею, и может вступить с нею во взаимодействие. Следует отметить, что согласно принятым представлениям водородную связь нельзя рассматривать как чисто электростатическую. Согласно методу молекулярных орбиталей водородная связь образуется за счет дисперсионных сил, ковалентной связи и электростатического взаимодействия.
Каждая молекула воды может образовать четыре водородных связи: две возникают при взаимодействии неподеленных электронных пар атома кислорода с атомами водорода соседних молекул воды и две дают атомы водорода, взаимодействующие с атомами Существованием водородных связей объясняется аномально высокая температура плавления воды по сравнению с водородными соединениями аналогов кислорода (H2S, H2Se, H2Te). Водородные связи и донорно-акцепторные взаимодействия способствуют возникновению высокой упорядоченности внутренней структуры в жидкой воде. Водородные связи обусловливают высокое внутреннее давление, которое и способствует появлению у воды некоторых особых свойств
3.Химические свойства воды
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Её иногда рассматривают, как амфолит — и кислоту и основание одновременно (катионH+ анион OH−). В отсутствие посторонних веществ в воде одинакова концентрация гидроксид-ионов и ионов водорода (или ионов гидроксония), pKa ≈ 16.
Вода — химически активное вещество. Сильно полярные молекулы воды сольватируют ионы и молекулы, образуют гидраты и кристаллоги драты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
- Вода реагирует при комнатной температуре:
- С активными металлами (натрий, к алий, кальций, барий и др.)
(при низких температурах)
- С солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз:
- С ангидридами и галогенангидридами карбоновых и неорганических кислот
- С активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т. д.)
- С карбидами, нитридами, фосфид ами, силицидами, гидридами акт ивных металлов (кальция, натрия, лития и др.)
- Со многими солями, образуя гидраты
- С боранами, силанами
- С кетенами, недоокисью углерода
- С фторидами благородных газов
Вода реагирует при нагревании:
Вода реагирует в присутствии катализатора:
- с амидами, эфирами карбоновых кислот
- с ацетиленом и другими алкинами
- с алкенами
- с нитрилами
Для одних и тех же атомов водорода и кислорода вода не является постоянной формой нахождения. Растения в процессе фотосинтеза разлагают воду . выделяя кислород в атмосферу. Разложение воды происходит в условиях биосферы и при процессах химического выветривания минералов. К числу наиболее распространенных среди них относятся силикаты . Их изменения в условиях биосферы можно выразить реакцией:
2Ca [Al2Si2O8] + 6 H2O = Al4 [Si4 O15] (OH) 4 + 2Ca2+ + 4OH-
Выветривание других силикатов ,а также сульфидов , карбонатов, сульфатов тоже идет с разложением воды.
Существенное влияние на растворимость минералов оказывает широко распространенная в биосфере углекислота. Однако в её присутствии продолжается разложение воды:
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.

Молекула воды состоит из двух атомов водорода и одного - кислорода, которые соединены между собой ковалентной связью. Вода, не является питательным веществом, но она жизненно необходима, как стабилизатор температуры тела, переносчик питательных веществ и пищеварительных отходов, реагент и реакционная среда в ряде химических превращений. Кроме того, вода формирует органолептические показатели продукта.Молекула воды (H2O) состоит из двух атомов водорода (H1) и одного атома кислорода (O16). Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород - 88,81%. Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине. Благодаря чему, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот. Каждая молекула воды может участвовать максимум в четырех водородных связях: два атома водорода - каждый в одной, а атом кислорода - в двух; в таком состоянии молекулы находятся в кристалле льда.Вода, H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая); плотность 1 г/см3 (при 3,98 градусах), тпл=0 градусов, ткип=100 градусов. Вода - это единственное вещество в природе, которое в земных условиях существует во всех трех агрегатных состояниях: - жидком - вода Вернадский писал: "Вода стоит особняком в истории нашей планеты.1) Вода реагирует со многими металлами с выделением водорода: 2Na 2H2O = H2 2NAOH (бурно) 2) Вода реагирует с неметаллами, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре: C H2O = H2 CO (при сильном нагревании) 3) Вода реагирует со многими оксидами неметаллов: SO2 H2O = H2SO3 4) Вода реагирует с оксидами металлов: CAO H2O = Ca(OH)2 гидроксид кальция (гашеная известь)Аммиачная вода - образуется при контакте сырого коксового газа с водой, который концентрируется вследствие охлаждения газа или специально впрыскивается в него для вымывания NH3. Вода на Земле находится в постоянном круговороте, и убыль ее в одном звене сразу же восполняется за счет поступления из другого. Под действием солнечных лучей вода испаряется с поверхности океана и суши и поступает в атмосферу, причем испарение с поверхности суши осуществляется, как реками и водоемами, так почвой, растениями. Попадая в почву, вода частично впитывается в нее, пополняя запасы почвенной влаги и подземных вод, частично стекает по поверхности в реки и водоемы почвенная влага частично переходит в растения, которые испаряют ее в атмосферу, и частично стекает в реки, только с меньшей скоростью. Реки, питающиеся водой из поверхностных ручьев и подземных вод, несут воду в Мировой океан, восполняя ее убыль.Почти 3/4 поверхности земного шара покрыты водой, образующей океаны, моря, реки и озера. Много воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах. В недрах земли также находится вода, пропитывающая почву и горные породы. Морская вода содержит 3,5% (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль). Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой.Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными - аномальными свойствами, присущими только ей, ее Величеству - Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми. Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. В результате удельный вес льда становится меньше воды и лед плавает.Роль воды в нынешней науке и технике очень велика. В термоядерных реакторах для задержки нейтронов применяется тяжелая или сверхтяжелая вода (D2O, T2O соответственно; D - дейтерий, Т - тритий; это изотопы водорода). Бурное развитие всех отраслей промышленности может повлечь за собой недостаток пресной воды. Чтобы изготовить 1 кг бумаги, требуется 100 л воды; чтобы вырастить корову требуется 100 л в сутки. На производство одной тонны металла идет 500 тонн воды, на производство одной тонны капрона в 7-8 раз больше.Вода является незаменимым веществом для всего живого на земле. Считают, что вода самое простое вещество на Земле. Покрывает 70% поверхности Земли и является средой обитания большого количества представителей флоры и фауны. На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и

Роль воды в химических реакциях.Вода как растворитель.Свойства воды. Уникальность воды.

Роль воды в химических реакциях
Выполнила: Ефимчик Алеся
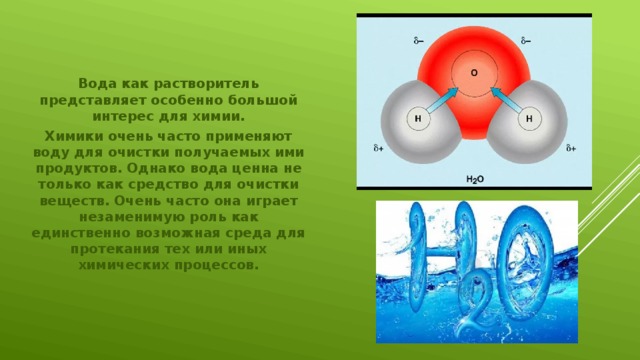
Вода как растворитель представляет особенно большой интерес для химии.
Химики очень часто применяют воду для очистки получаемых ими продуктов. Однако вода ценна не только как средство для очистки веществ. Очень часто она играет незаменимую роль как единственно возможная среда для протекания тех или иных химических процессов.

Вода отличается ещё одним важным свойством: она сама способна соединяться с очень многими веществами, быть активным участником различных химических процессов.Вода способна соединяться с простыми веществами как металлами, так и неметаллами.
Вода вступает в реакции и со многими сложными веществами. Мы здесь укажем только несколько примеров этих реакций, приводящих к образованию очень важных в химической промышленности веществ — оснований (или гидроокисей) и кислот.


Вода- уникальное химическое вещество, роль которого в химических реакциях трудно переоценить.
По отношению к воде как растворителю все вещества условно делят на следующие группы:
- - растворимые (в 100г воды растворяется более 1г вещества);
- - малорастворимые ( в 100 г воды растворяется от 0,01 до 1г вещества)
Растворение – это не просто физический процесс – результат диффузии. При растворении веществ в воде происходит их химическое взаимодействие с ней – гидратация. Результатом такого взаимодействия является образование растворов.
Водные растворы – это гомогенные системы, состоящие из молекул воды, частиц растворенного вещества и продуктов их взаимодействия.
Молекулы окруженные оболочкой из молекул воды называют гидратированными. Это результат процесса гидратации – взаимодействия воды с молекулами растворяемого вещества.

Косвенным доказательством гидратации как химического процесса является существование твердых кристаллогидратов. Наиболее известными кристаллогидратами являются медный купорос, гипс и кристаллическая сода.
Значительна роль воды для транспортировки вещества в сферу реакции.
Не менее значима роль воды как участника химических реакций, как реагента.

Взаимодействие ацетилена с водой было известно до М.Г. Кучерова:
HC ≡ CH + H2O → CH3 – CH
С водой при обычных условиях энергично реагируют щелочные и щелочноземельные металлы, При этом образуется щелочь и водород:
Читайте также:

