Влияние генов на предрасположенность к артериальной гипертонии реферат
Обновлено: 02.07.2024
Проведен анализ особенностей аллельного полиморфизма Т-786С просмотра гена еNOS при формировании артериальной гипертензии (АГ) в условиях действия хронического стресса (ХС). В качестве объекта влияния ХС обследовали 141 машиниста магистральных локомотивов (ММЛ), у которых длительность действия стресса ассоциировалась с частотой и тяжестью АГ. У 61 ММЛ с АГ и 50 без АГ определяли соотношение генотипов Т-786С просмотра гена еNOS. Получили следующее соотношение генотипов: в группе с АГ генотип ТТ встречался в 16,4 % случаев, генотип ТС – в 50,8 %, СС – в 32,8 %; в группе ММЛ без АГ соотношение составило 48, 46 и 6 % соответственно. Следовательно, у ММЛ с АГ более чем в 5 раз чаще встречается генотип СС, что определяет низкую продукцию оксида азота эндотелием сосудов и способствует повышению влияния вазоконстрикторных факторов. Оценка риска развития АГ у ММЛ показала, что при гомозиготном варианте СС риск статистически значимо выше (OR = 7,6 (2,12–27,6), р(F) C polymorphism in the endothelial nitric oxide synthase gene and smoking for an enhanced risk for coronary spasm / M. Nakayama, M. Yoshimura, T. Sakamoto, Y. Shimasaki, S. Nakamura, T. Ito, K. Abe, M. Yamamuro, Y. Miyamoto, Y. Saito, K. Nakao, H. Yasue, H. Ogawa // Pharmacogenetics. – 2003. – Vol. 13, № 11. – P. 683–8.
12. Taddei S. Endothelial dysfunction in essential hypertension: clinical implications / S. Taddei, A. Salvetti // J. hypertens. – 2002. – Vol. 20. – P. 1671–1676.
13. The T-786C and Glu 298Asp polymorphisms of the endothelial nitric oxide gene affect the forearm blood flow responses of Caucasian hypertensive patients / G. P. Rossi, S. Taddei, A. Virdis, M. Cavallin, L. Ghiadoni, S. Favilla, D. Versari, I. Sudano, A.S. Pessina, A. Salvetti // J. Am. Coll. Cardiol. – 2003. – Vol. 41, № 6. – P. 938–945.
14. Three endothelial nitric oxide (NOS3) gene polymorphismsin hypertensive and normotensive individuals: meta-analysis of 53 studies reveals evidence of publication bias / T.V. Pereira, M. Rudnicki, B. M. Cheung, L. Baum, Y. Yamada, P. S. Oliveira, A. C. Pereira // J. hypertens. – 2007. – Vol. 25, № 9. – P. 1763–1774.
15. Worldwide prevalence of hypertension: a systematic review / P.M. Kearney, M. Whelton, K. Reynolds, P.K. Whelton, J. He // J. hypertens. – 2004. – Vol. 22, № 1. – P. 11–19.
Артериальная гипертензия (АГ) является одним из наиболее распространенных заболеваний в мире [9]. Гипертония диагностирована у 37–55 млн жителей Европы [15]. АГ выступает основным сердечно-сосудистым фактором риска развития ишемического инсульта, ишемической болезни сердца, причиной увеличения общей смертности населения [1]. Многообразие патогенетических механизмов, участвующих в развитии АГ, и обусловливает полиморфность ее клинической картины. Наряду с нейрогуморальной, ренальной и другими концепциями патогенетических механизмов АГ, важное место отводится генетическим факторам [2, 7]. С позиций генетики данная патология характеризуется клинико-генеалогической неоднородностью, мультифакториальностью проявлений и наследования. Вместе с тем использование молекулярно-генетических методов, направленных на выявление и оценку генетического риска, прогнозирование осложнений заболевания является перпективным для дальнейшего изучения влияния генов-кандидатов на прогрессирование АГ.
При АГ изменяется морфофункциональное состояние стенки артерии, главным образом за счет развития эндотелиальной дисфункции (ЭД) [3, 4, 5]. ЭД связана с нарушением баланса медиаторов, обеспечивающих сосудистый тонус, в первую очередь, со снижением биодоступности оксида азота (NO). Это конкурентное подавление и снижение активности эндотелиальной NO-синтазы за счет эндогенного L-аргинина, который используется в неокислительной аргиназной реакции. Другой механизм развития ЭД – инактивация NO за счет увеличения продукции активных форм кислорода, таких как супероксид-анионы и др. [6]. Независимо от диаметра просвета и площади поперечного сечения стенки сосуда происходит утолщение комплекса интима-медиа (КИМ). В крупных артериях наблюдается увеличение образования коллагена и уменьшение содержания эластина в медии, что сопровождается снижением эластических свойств [1, 2].
В связи с этим интерес вызывает изучение генетических детерминант ЭД у больных АГ. Одним из генов, роль которого в развитии АГ и поражении органов-мишеней широко обсуждается, является ген эндотелиальной NO-синтазы (eNOS) [4, 14, 13]. Значение этого гена подтверждается экспериментальным исследованием: у мышей с разрушенным геном eNOS отмечали более высокие цифры АД, чем в контрольной серии [2, 3, 7].
Целью работы явилось изучение роли полиморфизма Т-786С промотора гена eNOS в развитии АГ в условиях действия хронического стресса (ХС).
Материалы и методы исследования
В качестве объекта, подверженного воздействию ХС, обследовали 141 машиниста магистральных локомотивов (ММЛ). Сформировано 5 групп ММЛ в зависимости от возраста и стажа работы ( СР). При этом СР выступал в качестве меры длительности воздействия ХС. 1 группу составили 28 ММЛ после окончания техникума, возраст 19,12 ± 0,89 (СР до 1 года); 2 группу – 28 ММЛ, возраст 27,54 ± 1,18 (СР 5–7 лет); 3 группу – 29 человек, возраст 37,41 ± 1,09 (СР 14–17 лет); 4 группу – 28 ММЛ, возраст 46,37 ± 1,06 (СР 21–24 года) и 5 группу – 28 человек, возраст 56,51 ± 1,02 (СР 30–34 года).
Толщину КИМ измеряли на ультразвуковом допплеровском аппарате VІVІD-3, компании GE (США), в режиме триплексного сканирования, датчиком 7 МГц. Измерение проводили в области задней стенки общей сонной артерии (ОСА) на расстоянии 1 см от ее бифуркации.
Cодержание ЭТ-1 определяли иммуноферментным методом в сыворотке крови с использованием реагентов фирмы DRG (США).
Исследовали полиморфизм T-786C промотора гена эндотелиальной NO-синтазы. Ген, кодирующий eNOS, находится в хромосоме 7q35–36 и состоит из 26 экзонов [11]. Промотор гена eNOS содержит несколько доменов, то есть, может регулироваться рядом факторов транскрипции [9, 11]. На сегодня описан полиморфизм гена eNOS в 11 местах, 8 из которых изучены в качестве возможных факторов риска сердечно-сосудистых заболеваний [8, 10].
Результаты исследования и их обсуждение
Результаты среднесуточного мониторирования АД (СМАД) показали, что уже начальный период действия стрессоров сопровождается ростом цифр АД у ММЛ. При этом отмечается тенденция к увеличению количества ММЛ с АГ в зависимости от стажа работы (рис. 1).
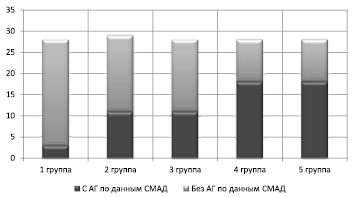
Рис. 1. Распределение обследованных ММЛ в зависимости от длительности воздействия ХС и наличия/отсутствия признаков АГ
Длительность влияния стрессоров определяло тяжесть формирующейся АГ: с увеличением сроков действия ХС усиливалась степень тяжесть АГ, в первую очередь это происходило за счет сокращения количества ММЛ с нормальными значениями АД (рис. 2).
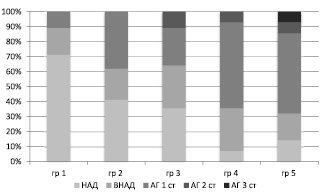
Рис. 2. Степень тяжести АГ у ММЛ в зависимости от длительности действия ХС: НАД – нормальное АД; ВНАД – высокое нормальное АД
Генетические факторы занимают особое место в процессах ремоделирования сосудистой стенки, так как их влияние может реализовываться при участии как гемодинамических, так и нейрогуморальных механизмов. Для оценки роли генетических факторов в развитии АГ в условиях действия ХС машинисты были разделены на две группы. В первую группу вошел 61 ММЛ с различной степенью тяжести АГ. Вторую группу – контрольный контингент (КК) – составили 50 ММЛ с нормальными цифрами АД.
Результаты генетических исследований Т-786С промотора гена eNOS у ММЛ с АГ показали следующее соотношение генотипов: ТТ – 16,4 %, ТС – 50,8 % и СС – 32,8 %. В группе КК это соотношение составило 48; 46 и 6 % (рис. 3). Наблюдаемое распределение частоты выявляемости генотипов и аллелей гена eNOS в группе обследованных ММЛ с наличием АГ и в группе КК соответствовало равновесию Харди – Вайнберга.
Таким образом, в группе ММЛ с АГ примерно в 5,5 раза чаще, чем в группе КК, выявляли гомозиготы с генотипом СС промотора гена eNOS (соответственно 32,8 и 6,0 %, p(F) Примечания: р
Изучение ассоциации с артериальной гипертензией однонуклеотидных полиморфзмов в генах, функционирующих в основных путях регуляции артериального давления среди больных гипертонической болезнью. Ассоциация генов с гестационной гипертензией и преэклампсией.
| Рубрика | Медицина |
| Вид | автореферат |
| Язык | русский |
| Дата добавления | 31.03.2018 |
| Размер файла | 41,9 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
диссертации на соискание ученой степени
кандидата медицинских наук
Генетическая гетерогенность наследственной предрасположенности к гипертонической болезни
Перевезенцев Олег Александрович
Научный руководитель:
кандидат медицинских наук,
профессор Ситников Владимир Фёдорович
Официальные оппоненты:
доктор медицинских наук,
профессор Петрин Александр Николаевич
доктор медицинских наук,
профессор Асанов Али Юрьевич
Ведущая организация:
Научно-исследовательский институт физико-химической медицины Федерального агенства по здравоохранению и социальному развитию.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д. 1
Учёный секретарь диссертационного совета
доктор медицинских наук, профессор Хамаганова И.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы.
Сердечно-сосудистые заболевания являются бичом современной цивилизации и одной из основных причин смертности взрослого трудоспособного населения [WHO Expert Committee on Hypertension Control, 1996]. Важное место в группе сердечно-сосудистых патологий занимает гипертоническая болезнь, которая приводит к повреждению различных органов и снижает качество и продолжительность жизни [The sixth report of the Joint National Committee on defection, evaluation, and treatment of high blood pressure, 1997]. Данное обстоятельство обусловливает высокую актуальность изучения генетических основ предрасположенности к гипертонической болезни, поскольку позволит развить профилактику и лечение этого заболевания на принципиально новой основе.
Установление роли тех или иных наследственных факторов в значении риска ЭАГ можно сделать путём сравнительного исследования их взаимосвязи с различными формами артериальной гипертензии на выборках больных из одной популяции. При этом важным является изучение генов, представляющих основные звенья системы регуляции АД: ренин-ангиотезин-альдостероновой системы (РААС), система вазодилатации, системы симпатоадреналовой регуляции АД, а также системы транспорта липопротеидов низкой плотности. Существенной представляется пока ещё недостаточно изученная проблема возникновения ЭАГ в раннем возрасте. Ранний дебют болезни при детской и подростковой ЭАГ наиболее достоверно связан с генетическими причинами, так как роль факторов внешней среды, предрасполагающих к развитию ЭАГ у взрослых (гиподинамия, курение, алкоголизация и т.п.) в детском возрасте малозначительна [Eisenmann JC et al., 2009]. Выяснение роли генетических факторов возникновения ЭАГ у подростков и детей является исключительно важным для разработки терапии ЭАГ и профилактики развития болезни в семьях больных.
Другой важной задачей работы мы считали изучение роли генетических факторов в развитии ЭАГ у беременных женщин, что связано с возможностью трансформации ЭАГ беременных в преэклампсию и эклампсию, угрожающих жизни матери и плода [Homuth V, Dechend R, 2009].
В соответствие со сказанным, были сформулированы следующие цели и задачи исследования.
Цель и задачи работы
Целью данной работы является сравнительное изучение роли ряда генов в наследственной предрасположенности к развитию ЭАГ среди больных гипертонической болезнью различных возрастных групп и у беременных с гестационной артериальной гипертензией.
Для выполнения этой цели были поставлены следующие задачи
1) Провести сравнительное изучение ассоциации с артериальной гипертензией однонуклеотидных полиморфзмов (ОНП) в генах, функционирующих в основных путях регуляции артериального давления (AGT, ACE, ADRB2, NOS3 и APOE) среди взрослых, а также детей и подростков, больных гипертонической болезнью.
2) Изучить ассоциацию изучаемых генов с гестационной артериальной гипертензией и синдромом преэклампсии-эклампсии.
3) Изучить совместное влияние сочетаний исследуемых генов на риск возникновения указанных выше форм гипертонической болезни.
Научная новизна. Впервые проведено сравнительное исследование роли различных генов генетической предрасположенности в развитии ЭАГ в группах больных гипертонической болезнью в детском, подростковом возрасте и у взрослых, а также с изолированной гестационной артериальной гипертензией. Показана ассоциация симпатоадреналовой формы ЭАГ как у детей, так и у взрослых больных, с ОНП в гене ADRB2, который функционирует в симпатоадреналовой системе. ЭАГ среди взрослых больных ассоциирована также с ОНП в гене АСЕ, функционирующим в системе РААС. Показано различие профилей ассоциации исследованных генов при гестационной артериальной гипертензии и синдроме преэклампсии-эклампсии. Впервые выявлено генетическое взаимодействие ОНП некоторых изученных генов при ряде форм ЭАГ и показано значение такого взаимодействия для риска гипертонической болезни и дифференцировки ее форм. Впервые в связи с риском ЭАГ исследован полиморфизм PI22M-PI22Q в гене APOE. В совокупности, получены новые данные о генетических причинах предрасположенности к ЭАГ и показано различие генетических профилей ассоциации вариантов генов с тремя формами гипертонической болезни.
Практическая значимость работы. Полученные результаты по ассоциации вариантов генов с гипертензией могут быть использованы для разработки способов диагностики предрасположенности к этому заболеванию.
Обнаруженная генетическая гетерогенность наследственных факторов предрасположенности к различным формам гипертонической болезни позволяет использовать генетический анализ для идентификации различных форм гипертонической болезни на доклинической и ранней клинической стадии заболевания, что важно для определения тактики лечения, прогнозирования и реабилитации пациентов. Генетическая диагностика, основанная на различии генетических профилей определённых форм гипертонической болезни, позволит начинать лечебно-профилактические мероприятия в максимально ранние сроки, что улучшит качество лечения, а также позволит определять риск развития болезни в семьях больных.
Положения, выносимые на защиту.
1. У взрослых больных с ЭАГ (возраст от 21 до 55 лет) ассоциированы полиморфные варианты ID ACE, Arg16Gly ADRB2 и T-786C NOS3.
2. Генотипы полиморфизмов ID ACE и Arg16Gly ADRB2 сопряжены у взрослых больных с ЭАГ.
3.С синдромом преэклапсии-эклампсии ассоциирован вариант M235T гена AGT.
4.C изолированной гестационной артериальной гипертензией ассоциированы варианты ID ACE и Arg16Gly ADRB2. При начале заболевания до периода беременности ассоциации с изученными полиморфизмами не наблюдается.
5.С ЭАГ у детей и подростков ассоциирован полиморфный вариант Arg16Gly гена ADRB2.
Публикации. По теме диссертации опубликовано 6 печатных научных работы, в том числе 2 статьи в научных журналах, рекомендованных ВАК, 3 тезиса докладов в материалах отечественных научно-практических конференций, 1 тезис в материалах зарубежной научно-практической конференции.
Структура и объём диссертации. Диссертационная работа состоит из введения, 4 глав, включающих в себя обзор литературы, описание материалов и методов исследования, их результатов и обсуждения, а также, заключения, выводов и списка литературы. Работа изложена на 168 страницах машинописного текста, содержит 87 таблиц и 7 рисунков. Список использованной литературы включает 6 отечественных и 164 зарубежных источника.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Генетические полиморфизмы четырёх выбранных генов изучались методом электрофореза в агарозном и полиакриламидном гелях с последующим документированием результатов для последующей статистической обработки.
В ходе работы проводились следующие процедуры: выделение ДНК, амплификация участков интереса изучаемых генов, проверка качества проведённой амплификации, собственно электрофоретический анализ амплифицированных продуктов и результирующая документация.
Для электрофоретического анализа исследуемых фрагментов ДНК применялись три метода в зависимости от гена: конформационный анализ однонитевой ДНК - т.н. SSCP, электрофорез в агарозном геле и электрофорез в полиакриламидном геле с предварительной обработкой фрагментов ДНК соответствующими эндонуклеазами (рестриктазами).
Основой статистической обработки в данной работе был ч2- анализ четырёхпольных таблиц распределения гено-и гаплотипов в норме и контроле. В качестве порога уровня значимости был выбран стандартный уровень P=0.05 (5%). В необходимых случаях использовали точный критерий Фишера. Вычисляли отношение шансов OR, характеризующее риск заболевания. Анализ сопряжённости проводили методом построения девятипольных таблиц сопряжённости вариантов генотипов (таблиц кросс-табуляции) определённых полиморфизмов с последующим ч2-анализом. В качестве порога уровня значимости был выбран стандартный уровень P=0.05 (5%).
Статистические расчёты были выполнены с помощью компьютерной программы STATISTICA 6.0
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Эссенциальная артериальная гипертензия взрослых
Анализ частот аллельных вариантов отдельных полиморфизмов
Проведенный анализ частот генотипов отдельных полиморфизмов относительно их ассоциации с ЭАГ у взрослых показал, что с данной формой ЭАГ ассоциированы варианты Arg16Gly гена ADRB2, ID гена ACE и T-786T гена NOS3 (таблицы 1-3).
Таблица 1 Значения отношения шансов (OR) и соответствующих доверительных интервалов (CI) при сравнении частот генотипов по полиморфизму ID в гене ACE среди взрослых пациентов с ЭАГ и в контрольной выборке
Общая информация об исследовании
Гипертония (повышенное давление) – часто встречающееся заболевание, на которое многие до пожилого возраста не обращают внимания. Однако уже в среднем возрасте оно может привести к значительным нарушениям здоровья из-за повышенной нагрузки на сердечно-сосудистую систему. Неконтролируемое высокое кровяное давление увеличивает риск серьезных проблем со здоровьем, в том числе инфарктов и инсультов. Многочисленными исследованиями доказано, что уровень артериального давления зависит как от генетики, так и от факторов внешней среды. Именно на фоне генетической предрасположенности к гипертонии внешние факторы оказывают наиболее значимое влияние на развитие заболевания.
Среди множества патогенетических механизмов, которые могут привести к артериальной гипертонии, ведущми являются те, которые опосредуют свое влияние через ренин-ангиотензин-альдостероновую систему (РААС). Она может воздействовать на сердечно-сосудистую систему не только путем вазоконстрикции и задержки воды и натрия, но и вследствие трофических эффектов и влияния на функцию эндотелия.
Ренин действует на ангиотензиноген (кодируется геном AGT) и превращает его в ангиотензин-1. Далее ангиотензин-1 подвергается воздействию ангиотензин-превращающего фермента и образуется биологически активный ангиотензин-2, который оказывает эффекты, направленные на повышение или поддержание артериального давления. Этот белок действует через ангиотензиновые рецепторы клеток. Существует два вида рецепторов: ангиотензиновый рецептор 1 (кодируется геном AGTR1) и ангиотензиновый рецептор-2 (кодируется геном AGTR2). Связываясь с ними, ангиотензин-2 реализует свои многочисленные функции. Таким образом, ангиотензин-2 играет важную роль в патогенезе артериальной гипертензии, воздействуя на гладкую мускулатуру сосудов, вызывая их спазм, увеличивая периферическое сопротивление, кроме того, он вызывает гипертрофию левого желудочка при гипертонии.
На сегодняшний день установлены прогностически неблагоприятные аллели генов ренин-ангиотензиновой системы. Изменения гена ангиотензиногена (AGT C521T и AGT T704C) повышают содержание ангиотензиногена в крови, что, в свою очередь, может приводить к повышению уровня ангиотензина.
С изменением гена AGT связано развитие гипертонической болезни с ранним началом, а для беременных женщин она опасна гипертонией и преэклампсией. На фоне гормональной заместительной терапии нарушение в гене повышает риск гипертонии и инфаркта миокарда.
При изменениях в генах ангиотензиновых рецепторов (AGTR1 (А1166С) и AGTR2 (G1675A) отмечается их повышенная чувствительность к ангиотензину-2, что проявляется его основными кардиоваскулярными эффектами и реализуется в патогенезе артериальной гипертонии и ее осложнений. При чрезмерной активности ренин-ангиотензиновой системы очевидна польза от ее блокирования на разных уровнях. На этом основано использования препаратов, способных ингибировать активность данной системы.
Работа ренин-ангиотензиновой системы тесно связана с электролитами. Они поддерживают гомеостаз, что необходимо для регуляции сердечной функции, баланса жидкости и многих других процессов. Ангиотензин-2 является основным регулятором синтеза альдостерона, который приводит к усилению реабсорбции натрия в почечных канальцах. Генетический маркер CYP11B2 (C(-344)T) (ген альдостерон-синтазы) связан с повышением продукции альдостерона, артериальной гипертонией, инфарктом миокарда.
Определенное значение в развитии артериальной гипертонии также имеют генетические факторы, отвечающие за внутриклеточный транспорт ионов: ген ADD1 (G1378T) кодирует белок альфа-аддуцин, который участвует в транспорте ионов натрия в клетках почечных канальцев.
G-белок, кодированный геном GNB3, опосредует передачу внутрь клеток сигналов, контролирующих тонус сосудов и пролиферацию многих типов клеток. Изменение активности G-белка ассоциировано с сужением сосудов и гипертонией, гипертрофией левого желудочка. Многими работами подтверждена связь генетического маркера GNB3 C825T с развитием инсулинорезистентности и ожирения.
В комплексный анализ также включено исследование гена NOS3 (эндотелиальная синтаза азота). NO-синтаза 3-го типа – вещество, уровень которого влияет на расширение сосудов и тромбообразование. Посредством молекулярно-генетического исследования данного фермента можно своевременно диагностировать гипертоническую болезнь любого типа в любом возрасте
Таким образом, генетический анализ, оценивающий риск развития гипертонии, включает в себя исследование 9 генетических маркеров, которые позволяют выявить нарушение регуляции кровяного давления, активности работы сердечной мышцы и ее кровоснабжения, синтеза альдостерона, баланса электролитов, дифференцировки лимфоцитов и фибробластов, тонуса стенок сосудов.
Генетическая предрасположенность к гипертонии может не проявляться, поэтому лечебные мероприятия иногда требуются позднее, но наблюдение у врача и частый контроль за артериальным давлением при изменениях по исследуемым маркерам необходимы.
Наличие артериальной гипертензии у близких родственников является достоверным фактором риска развития артериальной гипертензии. Особенно высокий риск имеется у родственников первой степени родства (например, отца и сына).
По мере уменьшения степени родства снижается и степень генетического риска. Чем меньше возраст пациента, в котором у него возникла артериальная гипертензия, тем выше риск заболевания у членов его семьи. Наследственная предрасположенность особенно ярко проявляется в пубертатном, молодом и зрелом возрасте. У лиц старше 70 лет генетический риск развития заболевания значительно уменьшается и практически приближается к общепопуляционному.
Наследственная предрасположенность к развитию заболевания реализуется под воздействием средовых факторов, но признание роли внешних факторов в повышении заболеваемости артериальной гипертонией не уменьшает важной роли генетических факторов риска.
Профилактическое генетическое обследование при отсутствии классических факторов риска будет полезным для всех, так как генетические факторы, приводящие к повышенному артериальному давлению, достаточно распространены.
Одной из наиболее социально значимых патологий, ассоциированных с мутациями ядерного генома человека, является гипертония. Идентификация генов, ассоциированных с данным заболеванием, обеспечит механизм классификации гипертонических фенотипов, позволит создать диагностические маркеры для отдельных пациентов и семей, которые подвергаются наибольшему риску таких осложнений, как атеросклероз, инсульт, ишемическая болезнь сердца инфаркт миокарда. Это будет способствовать созданию новых фармакогенетических препаратов для лечения и предотвращения развития АГ и сопутствующих заболеваний.
Артериальная гипертензия (АГ) – это совокупность состояний, которым сопутствует длительное повышение гидростатического давления в артериях большого круга кровообращения. Артериальная гипертензия является самым распространенным заболеванием среди взрослого населения развитых стран мира. В России повышенный уровень артериального давления встречается у 39,2 % мужчин и 41,1 %, женщин, а у 12–15 % людей развивается стойкая артериальная гипертензия.
Различают первичную (эссенциальную) гипертензию, или гипертоническую болезнь (ГБ), и вторичную (симптоматическую). При этом среди всех артериальных гипертензий на долю гипертонической болезни приходится до 90–95 %.
Эссенциальная гипертензия – мультифакторное заболевание, в основе которого лежит генетический полигенный структурный дефект, обусловливающий высокую активность прессорных механизмов длительного действия.
Выделяют три основных этиологических фактора риска развития эссенциальной АГ:
- адаптационный;
- внешний средовой;
- семейная полигенная предрасположенность (около 30 % генетических факторов ассоциированы с функционированием ренин-ангиотензиновой системы).
Гипертензия лежит в основе таких тяжелых заболеваний, как инфаркт миокарда и острое нарушение мозгового кровообращения (в России ежегодно регистрируется до 400 000 случаев инсульта), а также может вызывать стойкие поражения различных органов-мишеней, приводя к хроническим заболеваниям почек, глаз, сердца и головного мозга. Продолжительность жизни пациентов среднего возраста, страдающих артериальной гипертензией, не превышает 20–30 лет, а при высоком риске – 10 лет, поэтому для улучшения качества и продолжительности жизни необходимы ранняя диагностика и своевременно начатое лечение. При этом наибольшую актуальность приобретает выявление генетических полиморфизмов в генах ключевых факторов регуляции сердечно-сосудистой системы, в первую очередь ассоциированных с функционированием ренин-ангиотензиновой системы (РАС). Ангиотензиноген – важнейший компонент ренин-ангиотензиновой системы, предшественник ангиотензина II – основного эффекторного пептида. Ангиотензинпревращающий фермент (АСЕ) гидролизует ангиотензин I, превращая его в ангиотензин II. Полиморфизмы ангиотензиногена и АСЕ играют ключевую роль в формировании артериальной гипертензии. Установлены также другие полиморфные аллели генов, отвечающие за внутриклеточный транспорт ионов, регуляцию синтеза альдостерона и тонус гладкой мускулатуры.
- гипертоническая болезнь,
- диабетическая нефропатия,
- ишемический инсульт,
- ишемическая болезнь сердца (ИБС);
- инфаркт миокарда;
- преэклампсия
- нарушения плацентарной функции;
- нарушения микроциркуляции и сосудистого тонуса;
- подбор лекарственных препаратов при гипертонии;
- курение.
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА.
Мутация ангиотензиногена: AGT Thr174Met; AGT Met235Thr
Ангиотензиноген является предшественником вазоактивных гормонов ангиотензина I и II. Генетические вариации гена ангиотензиногена (AGT) могут существенно влиять на концентрацию белка в плазме, а соответственно и на уровень других компонентов ренин-ангиотензин-альдостероновой системы. Наиболее значимые с клинической точки зрения варианты гена AGT обусловлены точечными нуклеотидными полиморфизмами, приводящими к аминокислотным заменам в 174 и 235 кодонах гена -T174M (rs4762) и M235T (rs699) соответственно. Они детерминируют повышенный уровень экспрессии ангиотензиногена, что расценивается как фактор, риска развития артериальной гипертонии. Частота встречаемости неблагоприятных вариантов 174M и 235T в европеоидных популяциях составляет 10-15 % и 15-20 % соответственно.
Показания к назначению: гипертоническая болезнь, гипертония беременных, преэклампсия, гормонозаместительная терапия, кардиоваскулярные заболевания, в том числе ИБС, инфаркт миокарда.
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Мутация рецептора 1-го и 2-го типов ангиотензиногена-2: AGTR1 A1166C; AGTR2 G1675A
Ген AGTR1 кодирует один из четырех основных рецепторов ангиотензина II, расположенных вэндотелии сосудов и опосредующих все основные сердечно-сосудистые эффекты ангиотензина II.Основная биологическая роль этого гена, как и других компонентов ренин-ангиотензин-альдостероновой системы, заключается в регуляции кровяного давления. Наибольшее клиническоезначение имеет полиморфизм, локализованный в 3’-нетранслирующем регионе гена, приводящий к замене в 1166 позиции A>С (rs5186). Распространенность минорного варианта С упредставителей европеоидных популяций составляет 30 %-40%. В крупном исследовании, проведенном в Англии (2579 здоровых английских мужчин (56.1+/-3.5 лет), период наблюдения составлял 10,1 лет) было показано, что присутствие в генотипе аллеля С (AGTR1 1166СС генотип) было достоверно связано с увеличением риска развития сердечно-сосудистых осложнений (развитие инфаркта миокарда, ангиопластика/стентирование) вне зависимости от уровня АД, однако более информативным анализ указанного варианта будет при одновременном исследовании других генов ренин-ангиотензин-альдостеронового каскада.
Показания к назначению: гипертония, диабетическая нефропатия, кардиоваскулярные заболевания, в том числе ИБС, инфаркт миокарда.
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Полиморфизм цитохрома 11b2 CYP11B2 (C-344T)
Показания к назначению: гипертония, кардиоваскулярные заболевания, в том числе инфаркт миокарда.
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Полиморфизм гуанин связывающего протеина GNB3 (С825Т)
GNB3 - это гетеротримерный гуанин нуклеотид-связывающих белков (G белков), который интегрирует сигналы между рецепторами и эффекторными белками, состоит из альфа-, бета-, гамма-субъединиц. Полипептид бета-3 G-белка – это бета-глобула гетеротримерного G-белка, который передает сигнал от рецепторов к внутриклеточным эффекторным белкам. Настоящий полиморфизм связан с тем, что сигналы перестают поступать в ядро и нарушается гуморальная регуляция роста и метаболизма жировой ткани, повышается агрегационная активность тромбоцитов и развивается вазоконстрикция. СС-генотип – норма, СТ – появление в гене одного патологического аллеля (Т-аллель) приводит к повышению риска ожирения, особенно у женщин менопаузального возраста. ТТ- риск развития ожирения в период беременности и менопаузы очень высок. Это следует учесть и использовать при назначении рекомендаций по распорядку дня и по диете: больше физических нагрузок (плавание очень подходит женщинам данных возрастных периодов) и низкокалорийная сбалансированная диета (желательно применение контрастной диеты).
Показания к назначению: гипертоническая болезнь, ожирение
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Полиморфизм альфа-аддуцина ADD1 (G1378T)
Альфа-аддуцин стимулирует сборка спектрин-актиновых сетей в цитоскелете клеточной мембраны. Белок был найден в большинстве тканей, в частности белок регулирует внутриклеточную передачу сигнала в клетках почечных канальцев. Замещение триптофана на глицин в аминокислоте номер 460 (полиморфизм Gly460Trp) альфа-субъединицы белка цитоскелета аддуцина увеличивает почечную реабсорбцию натрия и может быть вовлечено в патофизиологию гипертонической болезни, поэтому, полиморфизм G460W ассоциирован с солезависимой гипертонией.
Показания к назначению: гипертоническая болезнь
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Полиморфизм эндотелиальной синтазы окиси азота 3: NOS3 (C-786T); NOS3 (G894C)
Показания к назначению: гипертония, кардиоваскулярные заболевания, в том числе инфаркт миокарда.
Биологический материал для анализа : цельная кровь, стабилизированная ЭДТА
Читайте также:

