Влияние антибиотикотерапии на дисбиоз животных реферат
Обновлено: 04.07.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Диcбактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Дисбактериоз, или дисбиоз – это качественное и количественное изменение микрофлоры в организме. Для него характерно увеличение или резкое уменьшение бактерий, снижение их разнообразия. Дисбактериоз может возникнуть на любом участке, где присутствуют бактерии, включая кожу, влагалище, ротовую полость и т.д.
Микрофлора играет важную роль в поддержании работы иммунной системы, но существует и обратная связь – при серьезном снижении иммунитета возникает дисбактериоз.
Причины появления дисбактериоза
В кишечнике человека присутствует от 70 до 80% клеток иммунной системы. Поэтому любая нестабильность кишечной микрофлоры может нарушить естественные защитные механизмы организма, настроенные против болезней и недомоганий.
Дисбактериоз кишечника связан не только с кишечными расстройствами, но и с множеством других состояний, на первый взгляд не относящихся к пищеварению, – кожными проблемами (акне, экзема), неврологическими расстройствами и т.д.
Среди причин развития дисбактериоза отмечают:
- Увеличение числа болезнетворных бактерий и дрожжевых грибов (например, кандида) и недостаток полезных микроорганизмов.
- Проникновение микроорганизмов, в норме находящихся в толстом отделе кишечника, в тонкий кишечник. Это происходит при хронических заболеваниях, характеризующихся поражением слизистой оболочки желудочно-кишечного тракта (болезнь Крона или неспецифический язвенный колит).
- К другим факторам врачи относят генетическую предрасположенность, несбалансированное питание с низким содержанием клетчатки, но с высоким содержанием сахара и обработанных продуктов, физический и психологический стресс, чрезмерное потребление алкоголя, частое применение антибактериальных препаратов и средств от изжоги, плохую гигиену полости рта.
- Дисбактериоз у практически здоровых лиц:
- возрастной дисбактериоз – изменения микрофлоры у людей пожилого возраста;
- сезонный дисбактериоз – изменения микрофлоры в холодное время года;
- нутритивный дисбактериоз – связанный с несбалансированным питанием;
- профессиональный дисбактериоз – при различных профессиональных вредностях.
- Дисбактериоз, сопровождающий различные заболевания органов пищеварения (желудка, поджелудочной железы, печени и желчевыводящих путей, кишечника, при синдроме мальабсорбции (нарушенном всасывании питательных веществ)).
- Дисбактериоз при других заболеваниях:
- инфекционных,
- иммунодефицитных,
- при гипо- и авитаминозах (уменьшенном поступлении в организм или плохой усвояемости необходимых витаминов),
- при интоксикациях и воздействии на организм человека радионуклидов (радиоактивных изотопов, которые можно встретить в местах с повышенным радиационным фоном, в ограниченном количестве и под строгим контролем они используются для диагностики и лечения некоторых заболеваний).
- Лекарственный дисбактериоз. Возникает вследствие приема антибиотиков, иммунодепрессантов, антацидов, антисекреторных, слабительных средств, химиотерапии и других лекарственных препаратов.
- Стрессорный дисбактериоз. Возникает как результат длительного эмоционального или физического стресса.
- Бессимптомная форма дисбактериоза.
- Локальная, или местная форма дисбактериоза. Наблюдается при развитии локального воспалительного процесса в кишечнике (у больного появляются симптомы колита или энтерита – воспалительных заболеваний толстого или тонкого кишечника).
- Распространенная форма дисбактериоза. Проявляется выраженными нарушениями пищеварения.
- 1-я степень тяжести;
- 2-я степень тяжести;
- 3-я степень тяжести;
- 4-я степень тяжести.
- самопроизвольно быстро проходящая диарея у больных, получающих антибиотики;
- среднетяжелая диарея у пациентов после нерационального применения антибактериальных препаратов;
- псевдомембранозный колит;
- диарея, связанная с лечением метотрексатом и другими противоопухолевыми химиотерапевтическими средствами;
- неспецифические воспалительные заболевания кишечника (болезнь Крона или неспецифический язвенный колит);
- непроходимость или стеноз толстой кишки;
- некоторые случаи синдрома внезапной детской смерти.
- оптимизация собственно этиотропной терапии;
- применение пробиотиков;
- применение пребиотиков;
- применение синбиотиков.
- Татаро монгольское иго исторический факт или вымысел реферат
- Способы активации мышления реферат
- Реферат действие радиации на человека группы критических органов лучевая болезнь
- Реферат на тему обеспечение безопасности перевозок организованных групп детей автобусами
- Биотическая концепция устойчивого развития реферат по бжд
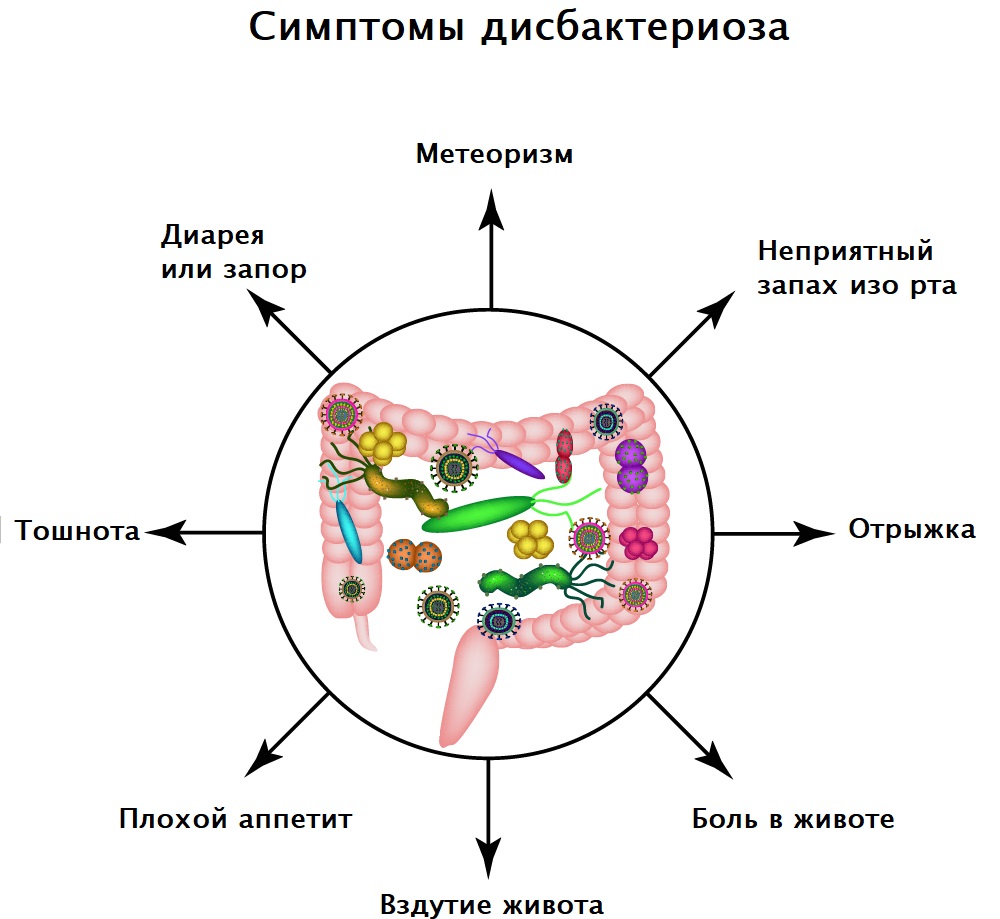
Симптомы дисбактериоза зависят от формы и степени тяжести течения заболевания. Пациенты могут предъявлять жалобы на расстройство желудка, тошноту, диарею или запор, повышенное газообразование и вздутие живота, снижение аппетита, необъяснимую усталость и проблемы с концентрацией внимания, неприятный запах изо рта, высыпания на коже.
Диагностика заболевания
При постановке диагноза врач обращает внимание на жалобы, симптомы заболевания и результаты осмотра. Но для оценки степени тяжести дисбактериоза обычно требуются лабораторные и инструментальные обследования.
-
Клинический анализ крови с развернутой лейкоцитарной формулой.
Одно из основных лабораторных исследований для количественной и качественной оценки всех классов форменных элементов крови. Включает цитологическое исследование мазка крови для подсчета процентного содержания разновидностей лейкоцитов и определение скорости оседания эритроцитов.
Дисбактериозы ( дисбиозы ) при антибиотикотерапии. Аллергизирующее действие антибиотиков. Иммунодепрессивные эффекты антибиотиков.
Дисбактериозы (дисбиозы) обычно развиваются после применения антибиотиков широкого спектра, подавляющих жизнь многих бактерий, в том числе и непатогенных. Б результате конкурентный баланс в микробных ценозах резко нарушается, что даёт устойчивым видам возможность колонизировать свободные участки. Этими химиорезистентными бактериями обычно являются условно-патогенные виды. Их чрезмерное размножение может приводить к развитию вторичных эндогенных инфекций. Наиболее часто наблюдают дисбактериозы кишечника, вызванные приёмом тетрациклинов внутрь. Для профилактики этого осложнения следует назначать препараты узкого спектра, контролировать вероятность избыточного роста грибов и широко использовать эубиотики.

Аллергизирующее действие антибиотиков
Применение антибиотиков может вызывать аллергические реакции, их спектр варьирует от различных кожных высыпаний до анафилактического шока. Наиболее выраженным аллергизирующим действием обладают природные антибиотики, особенно пенициллимы. В значительной степени это связано с широким распространением грибов-продуцентов в окружающей среде и высокой сенсибилизирующей активностью их продуктов. В подобных ситуациях применение антибиотиков играет роль введения разрешающей дозы для развития аллергической реакции. Степень её проявления прямо пропорциональна степени сенсибилизации организма.
Иммунодепрессивные эффекты антибиотиков
Многие антибиотики способны снижать функциональную активность защитных факторов организма. Во многом эти свойства обусловлены цитостатическим эффектом препаратов на иммунокомпетентные клетки. Поскольку эукариотические клетки практически лишены специфичных мишеней для ЛС, это действие носит неспецифический характер и направлено на самые различные клеточные популяции. Среди применяемых антибиотиков наиболее выраженным иммунодепрессивным эффектом обладают препараты, способные подавлять функции органов кроветворения, например левомицетин. Особо следует упомянуть антибиотик циклоспорин, первоначально разработанный как противогрибковое средство, но проявивший выраженное ингибирующее действие на развитие клеточных цитотоксических реакций. Это свойство побудило использовать его при пересадках органов в качестве препарата, подавляющего отторжение трансплантата.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Первый антибиотик, пенициллин, появился еще в начале прошлого века. Он стал настоящим спасением для огромного количества людей, особенно во вторую мировую войну – ведь в те времена практически не существовало эффективных лекарств. Но уже тогда было очевидно, что открытое Александром Флемингом вещество действует не только на патогенные микроорганизмы – оно потенциально опасно и для организма пациента. Впоследствии появились новые формы пенициллина (более чистые и безопасные в сравнении с начальной версией), а также другие антибиотики – цефалоспорины, макролиды, тетрациклины, аминогликозиды, левомицетины, линкозамиды и т.д. Только рисков меньше не стало. Да, антибиотики не убивают нас в прямом смысле этого слова, но их длительный и бесконтрольный прием способен нанести немалый урон здоровью. Начинается же всё с того, что страдает полезная микрофлора кишечника, она попросту гибнет.
Воздействие антибиотиков на микрофлору
Антибиотики незаменимы при терапии большого количества серьезных заболеваний дыхательных путей, ЛОР-органов, мочеполовой системы, инфекционных заболеваний кишечника. Поэтому вряд ли стоит ожидать, что в медицинской практике откажутся от их использования – да это и не нужно! Но, поскольку эти вещества не обладают избирательным действием, уничтожая как возбудителей болезней, так и полезные бактерии, их побочное действие зачастую не менее выражено, чем лечебный эффект. К большому нашему сожалению.
Наиболее частым побочным эффектом считается нарушение пищеварения. Возникает расстройство стула и так называемая антибиотик-ассоциированная диарея (ААД). Частота ее появления напрямую зависит от класса принимаемых препаратов и варьирует в пределах 30%. Развитие ААД напрямую проистекает из дисбактериоза, возникающего по причине уничтожения полезной кишечной микрофлоры. Вследствие этого организм человека остается без своих природных помощников, которые способствуют усвоению нами полезных веществ, принимают участие в синтезе витаминов, регулируют стул и улучшают перистальтику кишечника. Одной из основных мишеней антибиотиков становятся лакто— и бифидобактерии, которые в больших количествах гибнут от таких препаратов. Вместо них начинают разрастаться колонии условно-патогенных микроорганизмов, выделяющих продукты своей жизнедеятельности – токсины. При этом, кроме проявлений ААД, возникают боли в животе и ряд других неприятных симптомов. Нередки в таких случаях и колиты.
Серьезно начинает страдать метаболическая функция кишечника, точнее населяющей ее микрофлоры. Плохо перевариваются углеводы, что приводит к плохой их усвояемости организмом. Нарушается процесс расщепления клетчатки до КЦЖК – короткоцепочечных жирных кислот. В результате клетки кишечника начинают испытывать недостаток питания, ухудшается трофика ее слизистой оболочки. Также нарушается всасываемость воды и метаболизм желчных кислот. Поскольку последние активно стимулируют выработку секреции кишечника, возникает секреторная диарея.
Есть ли альтернатива антибиотикам?
Во многих из них – например, девясиле, солодке и толокнянке – содержатся гликозиды. Многие из этих органических соединений (их еще называют теоловыми гликозидами или фитонцидами) по своему действию подобны антибиотикам. Их использование доказало свою эффективность в борьбе с вредными микроорганизмами, однако при этом отсутствуют побочные явления, не говоря уже о привыкании и осложнениях. Специалисты рекомендуют: если лечение вашего заболевания в острой форме невозможно без синтетических антибиотиков, то при хроническом его течении применяйте природные антибиотики. Согласовав, конечно, этот вопрос с лечащим врачом, потому что лекарственные препараты тоже не следует принимать бесконтрольно. Кроме названных растений настоящим кладезем фитонцидов являются лук и чеснок, хрен и клюква, яблоки, цитрусовые и кизил. В чесноке еще имеется вещество аллин. Взаимодействуя с пищевыми ферментами, оно превращается в аллицин, которое известно своими выраженными бактерицидными свойствами.
Пробиотики – лучшая защита микрофлоры
Нормофлорины Л, Б, Д
Как можно нормализовать микрофлору кишечника, ставшую жертвой традиционной антибиотикотерапии? Этот вопрос более чем актуален сегодня для большого количества людей, однако ответ на него один – здесь могут помочь только пробиотики. Так называются специальные средства, способные не только поддержать и восстановить нормальную кишечную микрофлору, но и заселить кишечник такой микрофлорой. Уникальность и преимущество пробиотиков в том, что в своем составе они содержат живые штаммы полезных бактерий. При заселении ими кишечника условно-патогенная флора вынуждена сдавать свои позиции. В результате система пищеварения восстанавливается до своего здорового состояния, предшествовавшего курсу приема антибиотиков.
Помимо восстановления нормальной работы кишечника и улучшения пищеварения пробиотики участвуют в укреплении местного и общего иммунитета, синтезируют столь необходимые нам витамины как группы В и К. Все эти жизненно важные процессы происходят благодаря активной работе лакто- и бифидобактерий, которые находятся в составе пробиотических комплексов. Упреждая ваши возможные сомнения, отметим: применение пробиотиков в качестве восстановительного средства после антибиотикотерапии абсолютно безопасно. Что же касается эффективности, то судить о ней можно на примере биокомплексов, известных как Нормофлорины. Это специальные натуральные препараты, выпускаемые в жидкой форме, представляющие собой смесь лактобактерий и бифидобактерий с продуктами их жизнедеятельности – витаминами и минеральными веществами, антимикробными нутриентами и органическими кислотами. Помимо всего Нормофлорины содержат очень ценный ингредиент – дисахарид лактитол, служащий превосходным питанием для собственной микрофлоры человека, тем самым стимулируя ее рост и развитие.
Первым из отечественных ученых, кто серьезно исследовал влияние пробиотиков на восстановление микрофлоры, был И.И. Мечников. Свою работу он строил на основе наблюдений за молочнокислой палочкой, придя к отличным результатам. Впрочем, пробиотиками не обязательно являются только бактерии. К ним могут относиться и другие простейшие. Скажем, дрожжевые грибки.
Когда пробиотики особенно эффективны?
Антибиотики применяются врачами самых разных специальностей, причем в ряде случаев специалисты не имеют достаточных знаний по вопросам применения противомикробных препаратов. Существенно шире стал и спектр заболеваний, при которых применяют эту группу лек
Антибиотики применяются врачами самых разных специальностей, причем в ряде случаев специалисты не имеют достаточных знаний по вопросам применения противомикробных препаратов. Существенно шире стал и спектр заболеваний, при которых применяют эту группу лекарственных средств.
Огромное количество антибиотиков используется животноводством. Так, по данным H. L. DuPont и J. H. Steele (1987) около 45% антибиотиков в США потребляется именно этой сферой.
В 1999 году по данным, опубликованным Европейской федерацией здоровья животных (FEDESA), ежегодный расход антибиотиков во всем ЕС, включая Швейцарию, составил в целом 13 200 т. При этом медицина потребляет 8 500 т, а ветеринария — 3 900 т, 800 из которых (6% всего потребления антибиотиков) назначались в виде так называемых кормовых антибиотиков (стимуляторов роста животных).
Американская ассоциация общественного здоровья (APHA), принимая во внимание постоянно растущую антибиотикорезистентность основных возбудителей заболеваний у человека, призвала Управление по контролю за пищевыми продуктами и лекарственными средствами США (FDA) запретить применение семи классов антибиотиков в сельском хозяйстве в качестве стимуляторов роста и лечения животных. Такое решение обусловлено нарушением стандартов безопасности, провозглашенных FDA. В соответствии с рекомендациями FDA препараты, имеющие высокую важность при лечении заболеваний людей, не подлежат широкому использованию в сельском хозяйстве. Тем не менее, антибиотики семи классов, в том числе важнейших для человека, таких как пенициллины и тетрациклины, широко применяются при лечении животных. Около 70% антибиотиков используются ежегодно при кормлении крупного рогатого скота и домашней птицы с целью стимуляции роста и для профилактики заболеваний, опасность возникновения которых обусловлена большими скоплениями животных и негигиеничными условиями содержания. Более половины антибиотиков относятся или близки к тем же классам препаратов, которые используются у человека, что сопровождается риском потери этих препаратов для лечения заболеваний людей [1].
Большое число ошибок в назначении антибиотиков характерно при лечении острых респираторных инфекций у детей (Таточенко В. К., 2002), острого тонзиллофарингита (Козлов С. Н. и соавт., 2001, 2002), острых кишечных инфекций (Захаренко С. М. и соавт., 2002, 2006), острого синусита, инфекций мочевыводящих путей (Ершов Г. В. и соавт., 2001), инфекций кожи и мягких тканей (Рафальский Б. В. и соавт., 2004), внебольничной пневмонии и др.
Основной причиной пристального внимания к проблеме необоснованного применения антибиотиков является драматической рост резистентности микроорганизмов к антимикробным препаратам. Именно этот аспект остается приоритетным для Всемирной организации здравоохранения [3, 4] и государственных систем здравоохранения во всех странах.
Вместе с тем существует и еще одна важнейшая сторона проблемы применения АМП — необоснованное негативное воздействие на микробиоценозы человека.
Позиция FDA и ФЦМБЛС (Федеральный центр мониторинга безопасности лекарственных средств), отражающая точку зрения американских, российских и европейских специалистов по антимикробной терапии, однозначна:
«Все классы антибиотиков широкого спектра действия в той или иной степени угнетают нормальную микрофлору толстого кишечника, что может привести к избыточному росту Clostridium difficile, последующему высвобождению токсинов А и В и развитию антибиотик-ассоциированной диареи (ААД).
Негативное воздействие АМП на микробиоценозы человека в целом и кишечника в частности связано с несколькими механизмами: прямым подавляющим действием на нормофлору, опосредованными эффектами и влиянием компонентов препарата (не самого антибиотика).
Именно ААД составляет до 20–45% всех внутрибольничных диарей [9]. Частота развития этого состояния зависит от применявшегося антибиотика и составляет для амоксициллина/клавуланата 10–25%, цефиксима — 15–20%, ампициллина и клиндамицина — 5–10%, фторхинолонов — 1–2%, ко-тримоксазола — около 1%.
ААД является полиэтиологичным состоянием, которое обусловлено в 15–30% случаев C. difficile, а при развитии колита — 50–75% и псевдомембранозного колита — до 90%. CD-инфекция может протекать в разных клинических формах [10]:
Основное значение в патогенезе этих состояний имеет активация продукции C. difficile ряда токсинов — токсина А (TcdA), больше имеющего свойство энтеротоксина; токсина В (TcB), являющегося цитотоксином; бинарного токсина (ADP-ribosyltransferase toxin), сходного с токсинами C. spiroforme и C. perfringens; токсина TcdB-1470, обладающего цитотоксической активностью и сходного с TcsL-токсином C. sordellii [11].
Штаммы C. difficile продуцируют токсины А и В в лог-фазу роста вегетирующих форм [12–14], активность синтеза токсинов в значительной мере зависит от факторов окружающей среды.
Несмотря на разработанные схемы лечения CD-ассоциированной диареи частота рецидивов при использовании метронидазола и ванкомицина составляет от 5–16% до 50% [15–17]. При этом риск развития рецидива сохраняется в течение 30 суток после назначения антимикробного препарата, явившегося причиной первого эпизода заболевания.
Обсуждая проблему оптимизации этиотропной терапии, следует помнить не только о необходимости назначения АМП строго по показаниям, выборе оптимальных разовых, суточных и курсовых доз, определении адекватной длительности терапии, но и использовании врачами современных знаний о фармакокинетике антибиотиков (всасывание, экскреция/выведение, распределение и метаболизм).
При парентеральном назначении большинство АМП не создает высокие концентрации в просвете кишечника, а следовательно, в наименьшей степени негативно действует на нормофлору этого эпитопа. Но основная масса антимикробных препаратов потребляется в амбулаторных условиях, и основным способом назначения этих препаратов служит энтеральный прием. Т. е. создаются предпосылки для более выраженного воздействия на кишечную микрофлору, особенно верхних отделов желудочно-кишечного тракта. Вместе с тем между препаратами существуют значимые различия в скорости и месте всасывания из просвета кишечника. Некоторые из них относятся к невсасывающимся, создающим достаточно высокие концентрации на всем протяжении желудочно-кишечного тракта (ванкомицин, неомицин, полимиксин М, рифаксимин). Часть препаратов характеризуется замедленным (тетрациклин, хлорамфеникол) или ограниченным всасыванием (ампициллин). Другие АМП создают повышенные концентрации в кишечнике за счет секреции с желчью или желудочным соком (фторхинолоны, нитрофураны, метронидазол, доксициклин). Знание врачом этих особенностей позволяет выбирать не только наиболее эффективный в конкретной клинической ситуации препарат, но и определять наиболее безопасный путь его введения.
Существуют ли основания для совместного применения антимикробных препаратов и пробиотиков.
Залогом успешного одновременного применения антибиотика и пробиотика является субпороговая (субэффективная) концентрация АМП в желудочно-кишечном тракте и/или определенная устойчивость пробиотика к АМП. Помимо того, что не все антибиотики, особенно назначаемые парентерально, создают эффективные концентрации в кишечнике, прежде всего в просвете и в пристеночном слое слизи, при пероральном приеме АМП возможно разделять по времени введение антибиотика и пробиотика (после того как концентрация антибиотика в просвете кишечника снизится до минимальной).
Кроме того, можно использовать сведения об устойчивости пробиотических штаммов к АМП.
Наибольшей устойчивостью к антибиотикам обладают сахаромицеты. Чаще всего применяются Saccharomyces boulardii, однако следует учитывать, что они чувствительны к противогрибковым препаратам. Определенным уровнем устойчивости к действию антимикробных препаратов обладают пробиотические штаммы бацилл (Bacillus), энтерококков (Enterococcus), лактобацилл (Lactobacillus) и в меньшей степени — бифидобактерий (Bifidobacterium) и кишечных палочек (Escherichia coli). Наибольший практический интерес в последних вызывают пробиотические штаммы энтерококков, число которых в Европе достигает нескольких десятков.
Безопасность применения энтерококковых пробиотиков обусловлена отсутствием факторов вирулентности у энтерококков, входящих в состав таких препаратов, как, например, Линекс и Ламинолакт [21]. Молочнокислые энтерококки, входящие в состав пробиотиков (Линекс и Ламинолакт), не адаптированы к длительной персистенции в организме человека. Учитывая естественную концентрацию энтерококков в кишечнике человека — 107–108 на грамм кишечного содержимого, для введения сколько-нибудь значимого количества пробиотиков, сравнимого с количеством собственных энтерококков, нужно в сотни раз увеличивать дозы приема. Пробиотические энтерококки не замещают естественную популяцию энтерококков и других представителей нормофлоры пациента, не передают ей и не принимают от нее никакие факторы патогенности. Исследования штаммов энтерококков, используемых в качестве пробиотиков (Линекс и Ламинолакт), выявили их низкий уровень генетической компетентности по сравнению с индигенными штаммами, что также снижает риск приобретения новых генетических маркеров.
Безопасность применения энтерококковых пробиотиков изучается в течение нескольких десятилетий. В результате сравнительного анализа штаммов установлено, что вирулентность энтерококков обусловлена наличием в их геноме ряда генов, расположенных на островах патогенности большого размера, состоящих в среднем из 154 000 нуклеотидных пар. На островах патогенности могут располагаться многие из известных генов, кодирующих факторы вирулентности: цитолизин (сylA, cylM), фактор аггрегации (agg), поверхностные белки (esp, asa1, efaA), сериновой протеиназы (sprE), феромона (fsrB), комплекс генов репарации ДНК, AraC-подобный регулятор транскрипции, компоненты системы PTS, гидролаза желчной кислоты и др. Набор генов в островке может различаться, но у авирулентных штаммов острова с таким составом генов отсутствуют. Если штамм не имеет такого острова в геноме, то он практически не представляет опасности (Shankar N., 2002). Недавние исследования штаммов энтерококков клинического происхождения в сравнении с аутоштаммами и штаммами пробиотиков (Ламинолакт, Линекс) показали, что штаммы энтерококков можно достаточно четко разделить на две большие генетические линии, разительно отличающиеся между собой. Исследования показали, что клинические штаммы отличаются от штаммов пробиотиков по характеру организации их генома, что можно установить с применением рутинных методов генетического анализа, таких как электрофорез в пульсирующем электрическом поле [21, 22].
Бифидобактерии и лактобациллы обладают менее широким спектром устойчивости к антимикробным препаратам, но и эти микроорганизмы могут применяться в составе схем комплексной терапии. Так, L. acidophillus, входящая в состав Линекса, характеризуется видовой устойчивостью к гентамицину, канамицину, стрептомицину; низкой чувствительностью к бацитрацину, клиндамицину, амоксициллину/клавуланату [23]. Как правило, пробиотические штаммы лактобацилл устойчивы к двум и более АМП [24, 25].
Не вызывает сомнений тот факт, что пробиотики обладают самостоятельной активностью, позволяющей применять их для лечения инфекционных диарей различного генеза. Анализ 63 исследований с общим количеством 8014 пациентов показал, что назначение пробиотиков при диарейных заболеваниях не сопровождается развитием нежелательных реакций. Пробиотики оказывали статистически достоверное влияние на длительность диареи, сохранение диареи в течение четырех и более дней и частоту стула на вторые сутки. Показано, что использование наряду со стандартной регидратационной терапией пробиотиков безопасно и обладает явным полезным эффектом, влияя на сокращение длительности острой инфекционной диареи и снижение частоты стула [26]. В сочетании с имеющимися сведениями об устойчивости пробиотиков к антимикробным препаратам давний спор о целесообразности совместного применения антибиотиков и пробиотиков для абсолютного большинства клинических ситуаций закончился в пользу назначения пробиотиков, особенно содержащих штаммы с предсказуемым спектром устойчивости к АМП, одновременно с началом этиотропной терапии, т. е. с первых суток лечения.
При назначении пробиотиков врач должен четко понимать, что эта группа препаратов не может давать значимый клинический эффект через 1–2 приема. Для достижения того или иного положительного результата требуется от нескольких суток до нескольких недель лечения в зависимости от поставленной цели. Кроме того, целью назначения пробиотика все чаще становится не исчезновение каких-то конкретных симптомов заболевания, а именно предупреждение негативных последствий лечения антибиотиками.
Читайте также:

