Трансплантация гемопоэтических стволовых клеток реферат
Обновлено: 07.07.2024
Для цитирования: Грицаев С.В., Кузяева А.А., Волошин С.В. и др. Заготовка трансплантата для аутологичной трансплантации гемопоэтических стволовых клеток онкогематологическим больным: частота и причины неудачных сборов. РМЖ. 2013;1:30.
Реферат. Аутологичная трансплантация гемопоэтических стволовых клеток (АутоТГСК) повышает эффективность лечения онкогематологических больных. Успех АутоТГСК зависит от количества заготовленных CD34+ клеток, число которых должно быть не ниже 2,0×106/кг. Частота неудачных аферезов ГСК достигает 40%. Причинами неэффективных мобилизаций могут быть различные факторы.
Литература
1. Волкова М.А. Клиническая онкогматология. М.: Медицина, 2007. 1120 с.
2. Bensinger W., DiPersio J.F., McCarty J.M. Improving stem cell mobilization strategies: future directions // Bone Marrow Transplant. 2009. Vol. 43 (3). Р. 181–195.
3. Lemoli R.M., D’Addio A. Hematopoietic stem cell mobilization // Haematologica. 2008. Vol. 93 (3). Р. 321–324.
4. Perseghin P., Terruzzi E., Dassi M., Baldini V., Parma M., Coluccia P. et al. Management of poor peripheral blood stem cell mobilization: incidence, predictive factors, alternative strategies and outcome. A retrospective analysis on 2177 patients from three major Italian institutions // Transfus Apher Sci. 2009. Vol. 41 (1). Р. 33–37.
5. Yang S.M., Chen H., Chen Y.H., Zhu H.H., Zhao T., Liu K.Y. The more, the less: age and chemotherapy load are predictive of poor stem cell mobilization in patients with hematologic malignancies // Chin Med J. 2012. Vol. 125 (4). Р. 593–598.
6. Ameen R.M., Alshemmari S.H., Alqallaf D. Factors associated with successful mobilization of progenitor hematopoietic stem cells among patients with lymphoid malignancies // Clin Lymphoma Myeloma. 2008. Vol. 8 (2). Р. 106–110.
7. Mazumder A., Kaufman J., Niesvizky R., Lonial S., Vesole D., Jagannath S. Effect of lenalidomide therapy on mobilization of peripheral blood stem cells in previously untreated multiple myeloma patients // Leukemia. 2008. Vol. 22 (6). Р. 1280–1281.
8. Meldgaard K.L., Jensen L., Gaarsdal E., Nikolaisen K., Johnson H.E. A comparative study of sequential priming and mobilization of progenitor cells with rhG-CSF alone and high-dose cyclophosphamide plus rhG-CSF // Bone Marrow Transplant. 2000. Vol. 26 (7). Р. 717–722.
9. Покровская О.С. Механизм действия и клиническая эффективность антагониста хемокинового рецептора CXCR4 плериксафора при мобилизации гемопоэтических стволовых клеток // Клиническая онкогематология. 2012. № 4. С. 371–379.
10. DiPersio J.F., Uy G.L., Yasothan U., Kirkpatrick P. Plerixafor // Nat Rev Drug Discov. 2009. Vol. 8 (2). Р. 105–106.
11. Fruehauf S ., Ehninger G., Hubel K., Topaly J., Goldschmidt H., Ho A.D. et al. Mobilization of peripheral blood stem cells for autologous transplant in non-Hodgkin’s lymphoma and multiple myeloma patients by plerixafor and G-CSF and detection of tumor cell mobilization by PCR in multiple myeloma patients // Bone Marrow Transplant. 2010. Vol. 45 (2). Р. 269–275.
12. Costa L.J., Miller A.N., Alexander E.T., Hogan K.R., Shabbir M., Schaub C., Stuart R.K. Growth factor and patient-adapted use of plerixafor is superior to CY and growth factor for autologous hematopoietic stem cells mobilization // Bone Marrow Transplant. Vol. 2011. Р. 46 (4). Р. 523–528.
13. D’Addio A., Curti A., Worel N., Douglas K., Motta M.R., Rizzi S. et al. The addition of plerixafor is safe and allows adequate PBSC collection in multiple myeloma and lymphoma patients poor mobilizers after chemotherapy and G-CSF // Bone Marrow Transplant. 2011. Vol. 46 (3). Р. 356–363.
14. Popat U., Saliba R., Thandi R., Hosing C., Qazilbash M., Anderlini P. et al. Impairment of filgrastim-induced stem cell mobilization after prior lenalidomide in patients with multiple myeloma // Biol Blood Marrow Transplant. 2009. Vol. 15 (6). Р. 718–723.
15. Auner H.W., Mazzarella L., Cook L., Szydlo R., Saltarelli F., Pavlu J. et al. High rate of stem cell mobilization failure after thalidomide and oral cyclophosphamide induction therapy for multiple myeloma // Bone Marrow Transplant. 2011. Vol. 46 (3). Р. 364–367.
16. Boccadoro M., Palumbo A., Bringhen S., Merletti F., Ciccone G., Richiardi L. et al. Oral melphalan at diagnosis hampers adequate collection of peripheral blood progenitor cells in multiple myeloma // Haematologica. 2002. Vol. 87 (8). Vol. 846–850.
17. Meldgaard K.L., Jensen L., Gaarsdal E., Nikolaisen K., Johnson H.E. A comparative study of sequential priming and mobilization of progenitor cells with rhG-CSF alone and high-dose cyclophosphamide plus rhG-CSF // Bone Marrow Transplant. 2000. Vol. 26 (7). Р. 717–722.
18. Kumar S., Giralt S., Stadtmauer E.A., Harousseau J.L., Palumbo A., Bensinger W. et al. Mobilization in myeloma revisited: IMWG consensus perspectives on stem cell collection following initial therapy with thalidomide-, lenalidomide-, or borezomib-containing regimens // Blood. 2009. Vol. 114 (9). Р. 1729–1735.
19. Uy G.L., Rettig M.P., Cashen A.F. Plerixafor, a CXCR4 antagonist for the mobilization of hematopoietic stem cells // Expert Opin Biol Ther. 2008. Vol. 8 (11). Р. 1797–1804.
20. Pusic I., Fiang S.Y., Landua S., Uy G.L., Rettig M.P., Cashen A.F. et al. Impact of mobilization and remobilization strategies on achieving sufficient stem cell yields for autologous transplantation // Biol Blood Marrow Transplant. 2008. Vol. 14 (9). Р. 1045–1056.
21. Jagasia M.H., Savani B.N., Neff A., Dixon S., Chen H., Pickard A.S. Outcome, toxicity profile and cost analysis of autologous stem cell mobilization // Bone Marrow Transplant. 2011. Vol. 46 (8). Р. 1084–1088.
22. Stockerl-Goldstein K.E., Reddy S.A., Horning S.F., Blume K.G., Chao N.F., Hu W.W. et al. Favorable treatment outcome in non-Hodgkin’s lymphoma patients with “poor” mobilization of peripheral blood progenitor cells // Biol Blood Marrow Transplant. 2000. Vol. 6 (5). Р. 506–512.
23. Calandra G., McCarty J., McGuirk J., Tricot G., Crocker S.A., Badel K. et al. AMD3100 plus G-CSF can successfully mobilize CD34+ cells from non-Hodgkin’s lymphoma, Hodgkin’s disease and multiple myeloma patients previously failing mobilization with chemotherapy and/or cytokine treatment: compassionate use data // Bone Marrow Transplant. 2008. Vol. 41 (4). Р. 331–338.
24. Bensinger W., Appelbaum F., Rowley S., Storb R., Sanders J., Lilleby K. et al. Factors that influence collection and engraftment of autologous peripheral-blood stem cells. J Clin Oncol 1995; 13(10): 2547-2555.
25. Sola C., Maroto P., Salazar R., Mesía R., Mendoza L., Brunet J. et al. Bone marrow transplantation: prognostic factors of peripheral blood stem cell mobilization with cyclophosphamide and filgrastim (r-metHuGCSF): the CD34+ cell dose positively affects the time to hematopoietic recovery and supportive requirements after high-dose chemotherapy // Hematology. 1999. Vol. 4 (3). Р. 195–209.
26. Glaspy J.A., Shpall E.J., LeMaistre C.F., Briddell R.A., Menchaca D.M., Turner S.A. et al. Peripheral blood progenitor cell mobilization using stem cell factor in combination with filgrastim in breast cancer patients // Blood. 1997. Vol. 90 (8). Р. 2939–2951.
27. Stiff P.J., Micallef I., Nademanee A.P., Stadtmauer E.A., Maziarz R.T., Bolwell B.J. et al. Transplanted CD34(+) cell dose is associated with long-term platelet count recovery following autologous peripheral blood stem cell transplant in patients with non-Hodgkin lymphoma or multiple myeloma // Biol Blood Marrow Transplant. 2011. Vol. 17 (8). Р. 1146–1153.
28. Micallef I.N., Stiff P.J., DiPersio J.F., Maziarz R.T., McCarty J.M., Bridger G., Calandra G. Successful stem cell remobilization using plerixafor (Mozobil) plus granulocyte colony-stimulating factor in patients with non-Hodgkin lymphoma: results from the plerixafor NHL phase 3 study rescue protocol // Biol Blood Marrow Transplant. 2009. Vol. 15 (12). Р. 1578–1586.
Аллогенная трансплантация гемопоэтических стволовых клеток наиболее радикальный метод терапии больных ОМЛ, позволяющий надеяться на полное излечение. При многовариантном анализе показано, что поводом для раннего обсуждения вопроса о проведении алло-трансплантации гемопоэтических стволовых клеток при остром миелоидном лейкозе служит возраст больного (до 40 лет), скорость ответа на индукционный курс химиотерапии, характер цитогенетических и молекулярно-биологических изменений.
Неблагоприятными в отношении прогноза цитогенетическими маркерами при остром миелобластном лейкозе являются нарушения хромосом: -5/del(5q), -7/del(7q), +8, t(4;11), t(9;11), t(11;19), 11q23, 20q-, тандемное удвоение гена FLT3. К молекулярно-биологическим изменениям, имеющим отрицательное значение при определении прогноза ОМЛ, относятся идентификация патологических генов MLL, MLL/ AF4, MLL/AF9, MLL/ELL, MLL/ENL, а также повышенная экспрессия бета-гликопротеина, генов BCL2 и WT1.
На отдаленные результаты после алло-трансплантации гемопоэтических стволовых клеток влияют возраст пациента, стадия заболевания в момент выполнения трансплантации, источник гемопоэтических стволовых клеток (родственный, неродственный донор), степень совместимости по HLA-системе, возможно, режим кондиционирования и протокол профилактики острой РТПХ.
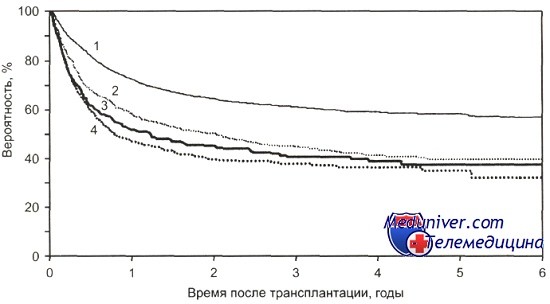
Общая выживаемость после алло-ТГСК у больных ОМЛ в зависимости от источника ГСК и стадии болезни.
1 — HLA-совместимый сиб-линг, ПР1+ (n = 3298); 2-HLA-совместимый сиблинг, ПР2+ (n = 837); 3 - неродственная ТГСК, ПР1 (n = 424); 4 — неродственная ТГСК, ПР2+ (п = 567); р = 0,0001.
По данным CIBMTR, 3-летняя общая выживаемость без учета возраста после родственной алло-трансплантации гемопоэтических стволовых клеток при остром миелобластном лейкозе в 1 ПР составила 60 %, во 2 ПР и последующих ремиссиях — 40 %. После неродственной алло-трансплантации гемопоэтических стволовых клеток эти показатели были равны 43 и 32 % соответственно. Зависимость общей выживаемости больных ОМЛ после родственной алло-трансплантации гемопоэтических стволовых клеток от возраста и стадии заболевания представлена на рисунке.
Вероятно, проведение алло-трансплантация периферических стволовых клеток крови у больных ОМЛ имеет некоторое преимущество по сравнению с алло-ТКМ. Ранее показано, что режим кондиционирования тотальное облучение тела (ТОТ) + циклофосфан является более эффективным по сравнению с режимом бусульфан + циклофосфан. Однако, несмотря на объективность выполненных исследований, эти результаты до настоящего времени не подтверждены статистически.
При алло-трансплантации гемопоэтических стволовых клеток у больных острым миелобластным лейкозом не было установлено влияния предшествующих курсов консолидации на общую и безрецидивную выживаемость. Так, 5-летняя безрецидивная выживаемость после алло-ТГСК составила в группе пациентов без консолидации 50 %, получивших стандартную и высокодозную консолидацию ремиссии — соответственно 56 и 59 %, при этом 5-летняя общая выживаемость была 60, 56 и 60 %.
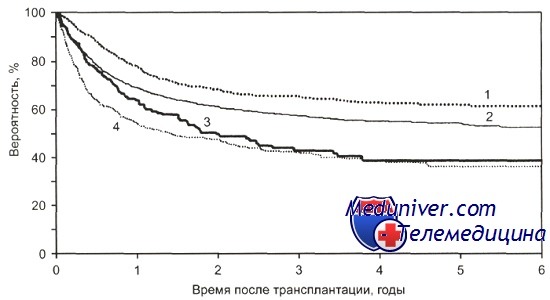
Общая выживаемость после алло-ТГСК от HLA-совместимого сиблинга больных ОМЛ в зависимости от стадии болезни и возраста.
1 - ПР1, моложе 20 лет (n = 839);
2 — ПР1, 20 лет и старше (n = 2449); 3 - ПР2+, 20 лет и старше (n = 653); 4 — ПР2+, моложе 20 лет (n = 184); р = 0,0001.
Соблюдение указанных выше критериев приводит к достижению 5-летней бессобытийной выживаемости при прогностически неблагоприятных вариантах ОМЛ у 70 % больных, что свидетельствует о перспективности этого метода терапии. Гаплоидентичная алло-ТПСКК может быть особенно актуальной в случае необходимости срочного выполнения алло-трансплантация гемопоэтических стволовых клеток и отсутствия при этом совместимого родственного или неродственного донора.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Наш фонд также собирает деньги на лекарства, которые нужны до или после трансплантации, на наборы для очистки трансплантата или системы для фотофереза.
Как проходит трансплантация костного мозга? «Сначала, примерно за семь дней перед пересадкой, проводится химиотерапия, — рассказывает Михаил Масчан. — Она называется кондиционированием. Потом день, когда мы переливаем собственно клетки донора, это похоже на обычное переливание крови. Потом проходит примерно три недели до того момента, когда приживаются донорские клетки, появляются лейкоциты, и мы говорим: да, трансплантат прижился. Потом проходит еще примерно 4-12 месяцев, за которые иммунная система восстанавливается.
Гемопоэтические стволовые клетки (ГСК)
В зависимости от того, кто становится донором, аллогенные трансплантации бывают трех видов: от совместимого родственного, от совместимого неродственного и от не полностью совместимого родственного донора. История ТКМ и в мире, и в России началась с пересадок от совместимых родственных доноров.
Этап 1. Пересадки от совместимых родственных доноров
Трансплантации костного мозга стали проводиться в России еще в 90-е годы XX века. Первые трансплантации были проведены в Российской детской клинической больнице в Москве и в Санкт-Петербургском ГМУ им. Павлова четверть века назад, и тогда же появились первые дети, спасенные с их помощью. При этом в те годы донорами чаще всего становились братья и сестры больных детей.
Тяжелые формы РТПХ часто приводят к гибели больного или к тяжелой инвалидности. Чтобы снизить риск осложнений, донора подбирают по принципу так называемой тканевой совместимости: белки и гены, отвечающие за узнавание клеток иммунной системой, у донора и больного должны быть одинаковыми или почти одинаковыми.
Действительно, многие из таких пересадок проходили удачно. Но получалось, что шанс на пересадку имело, по оценкам врачей, лишь 15% детей: в большинстве российских семей всего 1-2 ребенка, и наличие совместимого донора в семье было большой и редкой удачей…
Этап 2. Пересадки от совместимых неродственных доноров
Поэтому на рубеже девяностых и нулевых годов внимание российских врачей привлекла другая возможность: если в семье нет подходящего донора, можно провести пересадку от **совместимого неродственного донора** В самом деле, если у нас есть данные о многих сотнях тысяч людей, готовых стать донорами костного мозга (гемопоэтических стволовых клеток), среди этих людей с достаточно высокой вероятностью можно выбрать генетически подходящего. Для этого создаются специальные базы данных — регистры потенциальных доноров.
В боксе отделения ТКМ
Прошли годы. Пересадки от неродственных доноров стали в России гораздо доступней: они проводятся (по-прежнему при поддержке благотворительных фондов) уже в большем числе клиник. Понемногу формируется и российский донорский регистр: в нем уже десятки тысяч потенциальных доноров — и расходы на их поиск и активацию куда меньше, чем при обращении в зарубежные регистры. Однако с неродственными трансплантациями связаны и существенные ограничения.
Во-первых, это фактор времени. Поиск и активация неродственного донора происходят небыстро, обычно речь идет о нескольких месяцах. Но если у ребенка агрессивный лейкоз и трансплантация нужна срочно, этих нескольких месяцев может просто не быть в запасе. Во-вторых, не всегда удается найти совместимого неродственного донора. Особенно часто это случается, если больной принадлежит к редкой этнической группе — скажем, к одному из народов Кавказа или Крайнего Севера. Но и в других случаях, увы, полной гарантии нет. В-третьих, даже при трансплантации от полностью совместимого неродственного донора риск тяжелых форм РТПХ все же довольно высок. Врачи могут вспомнить немало трагических историй, когда они теряли пациентов именно из-за этого осложнения…
И хотя неродственные пересадки и сейчас играют немалую роль, в детской трансплантологии в последние годы происходит частичный переход к другому подходу — к пересадкам от частично совместимого родственного донора. Они также называются гаплоидентичными трансплантациями или просто гаплотрансплантациями.
Этап 3. Гаплоидентичные трансплантации
Ребенок получает половину генов от отца, а половину — от матери. Это значит, что каждый родитель на 50% генетически совместим со своим ребенком. Казалось бы, этого мало для успешной трансплантации — всегда считалось, что шанс избежать тяжелой РТПХ есть только в случаях, когда степень совместимости близка к 100%. Но в последние годы во многих мировых клиниках разработаны и внедрены технологии, позволяющие производить успешные пересадки даже при половинной совместимости.
Долгое время врачи волновались, насколько эффективной будет эта технология. Не приведет ли ее использование, например, к росту числа рецидивов лейкоза после пересадки? Или к другим проблемам?
К счастью, опасения не оправдались. При остром лимфобластном лейкозе число рецидивов не увеличилось, а при пересадках пациентов с острым миелоидным лейкозом даже заметно уменьшилось! С инфекционными осложнениями тоже научились бороться. Есть и другие преимущества: сократилось среднее время приживления трансплантата. Но главное – что тяжелые формы РТПХ действительно стали встречаться намного реже.
Применение гаплоидентичных трансплантаций позволило решить две важнейшие проблемы: доступности донора и срочности пересадки. В самом деле, почти у каждого пациента кто-то из родителей может быть донором. Или если не родители, то другие родственники, наполовину совместимые с ним: братья и сестры (здесь вероятность половинного совпадения — 50%), иногда дяди и тети. Родители всегда рядом и всегда готовы поделиться клетками, чтобы спасти сына или дочь. Не надо тратить драгоценные месяцы на поиск другого донора. И сейчас, например, в Центре детской гематологии при острых лейкозах проводятся почти исключительно гаплоидентичные трансплантации, если, конечно, в семье нет полностью совместимого донора.
Тем не менее неродственные трансплантации по-прежнему сохраняют свою значимость, и не только у взрослых (для которых гаплотрансплантация часто является не лучшим вариантом из-за слишком медленного восстановления иммунитета), но и у детей, в том числе в Центре детской гематологии. Во-первых, они широко применяются при незлокачественных заболеваниях, таких, например, как первичные иммунодефициты. Во-вторых, иногда бывает так, что подходящих родственных доноров у ребенка нет — например, если он сирота.
Куда уходят деньги
Значительная часть расходов на трансплантацию покрывается за счет государственной квоты. Но, к сожалению, не все. В этом смысле дешевле всего в качестве доноров обходятся совместимые братья и сестры. Строго говоря, при наличии квот на ТКМ (а если точнее, финансирования по госзаданию) активация совместимых родственных доноров не стоит благотворителям ничего. Правда, квоты в российских больницах имеют тенденцию заканчиваться, и тогда активация обходится в сумму от 150 до 400 тысяч рублей.
При неродственных трансплантациях необходимо оплачивать поиск и активацию донора в зарубежных регистрах — ведь в российском регистре пока удается найти доноров лишь небольшому числу пациентов. Получается очень значительная сумма: от 1,6 (в обычных случаях) до 3 миллионов рублей (если донор, например, найден не в Европе, а в Америке или Японии).
При гаплоидентичных трансплантациях расходов на поиск и активацию нет, но есть другие — на очистку трансплантата. Разделение смеси клеток – сложная процедура, требующая не только специального оборудования, но и использования дорогостоящих реактивов и расходных материалов. С учетом расходов на их покупку процедура очистки может стоить от 800 тысяч до 1 млн 400 тысяч рублей. Это, безусловно, тоже немало, но все же в два раза меньше, чем затраты на неродственные ТКМ. Другой, не менее важный фактор (в том числе и с финансовой точки зрения) — пациенты после таких трансплантаций быстрее восстанавливаются, им нужно меньше переливаний крови, они быстрее выписываются из больницы и гораздо реже, чем когда-то, возвращаются туда с тяжелыми осложнениями, требующими многомесячной терапии. Но главное — гаплоидентичные трансплантации с применением очистки ежегодно дарят здоровье и благополучие десяткам детей, и это не измеришь никакими деньгами.

Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
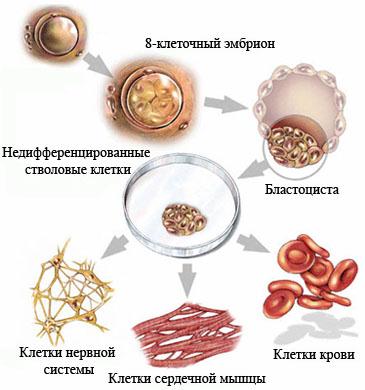
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
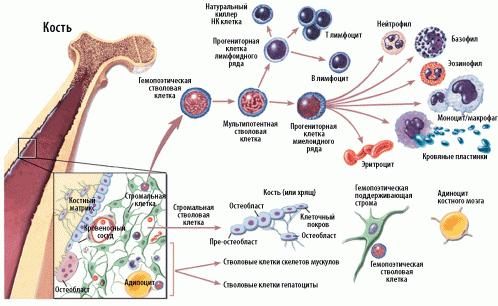
Схема кроветворения и дифференцировки стволовых клеток
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 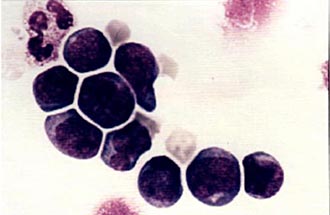 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
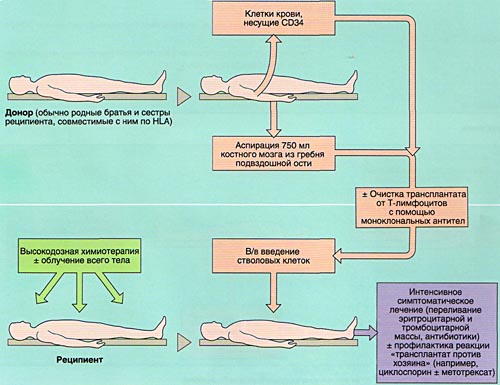
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
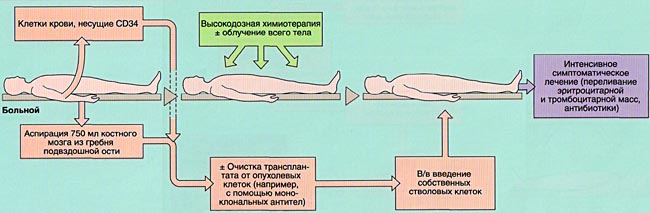
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Сепаратор клеток крови
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
 А) |  Б) |
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.

Инфузия костного мозга пациенту
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Читайте также:
- Географическое распространение землетрясений реферат
- Экологический аудит в казахстане реферат
- Документ и документированная информация общее и особенное реферат
- Физическая культура и ее значение в формировании здорового образа жизни повышения долголетия реферат
- Казахстан и февральская революция реферат

