Тимомегалия у детей реферат
Обновлено: 30.06.2024
С.Ю. Макаров 1 , аспирант, А.В. Катилов 2 , к.мед.н., доцент, О.И. Макарова 3 , к.мед.н., ассистент, 1 кафедра нормальной физиологии, 2 кафедра пропедевтики детских болезней и ухода за больными детьми, 3 кафедра гистологии, Винницкий национальный медицинский университет имени Н.И. Пирогова
С учетом очевидной важности и актуальности поднимаемой темы (хотя бы потому, что речь идет о факторе, сильно влияющем на формирование достаточной иммунной прослойки детского населения) следует тщательно разобраться в данном вопросе, обратившись к современным авторитетным мировым источникам. Что, собственно говоря, авторы данной публикации и сделали.
Таким образом, современные данные мировой медицинской науки позволяют заключить, что относительно более крупный тимус является вовсе не патологией, а признаком оптимального состояния иммунной системы и организма в целом.
Но начиная с 20-30-х годов ХХ столетия появляется все большее количество работ, в которых не только доказывается необоснованность концепции о существовании некоего status thymicolymphaticus и его причастности к внезапной младенческой смерти, но и в довольно резкой и ироничной форме осуждаются адепты данной теории, число которых к тому времени стремительно сокращалось.
И хотя причины синдрома внезапной младенческой смерти (СВМС) окончательно не определены, современными исследователями высказывается ряд предположений, возможно, объясняющих природу этого явления. Так, в числе одной из широко обсуждаемых теорий – высказывание о том, что причиной смерти может являться нарушение реакции пробуждения в ответ на обтурацию дыхательных путей.
Также доказано, что определенную роль может играть синдром удлиненного интервала QT, поскольку у детей с данной аномалией, определяемой при регистрации ЭКГ, определяется 40-кратное повышение риска СВМС по сравнению с общей популяцией [13]. Кроме того, рассматривается возможная роль нарушения синтеза некоторых нейротрансмиттеров (в частности, серотонина и субстанции Р), патоморфологические изменения аркуатного ядра гипоталамуса, нарушение перфузии ствола мозга из-за компрессии arteria vertebralis и так далее.
Отмечено, что такие обстоятельства, как сон на животе, слишком мягкий матрас и наличие подушки, пассивное курение, перегрев, недоношенность и отягощенный акушерский анамнез, низкий социально-экономический статус семьи, совместный сон с родителями, не являясь непосредственной причиной СВМС, все же могут быть серьезными способствующими факторами, существенно повышающими риск этого явления.
В любом случае, хотим заметить, что среди современных гипотез больше не упоминаются версии о зависимости риска возникновения СВМС от каких-либо размеров вилочковой железы.
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
История относительно интенсивного изучения вилочковой железы (glandula thymus, thymus) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него на глазах внезапную смерть 5-месячного ребенка, при вскрытии трупа которого не было найдено никаких причин, способных объяснить смерть, кроме очень большого тимуса. Смерть этого ребенка тогда впервые связали с огромным тимусом, назвав данное состояние тимическим удушьем — asthma thymicum.
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
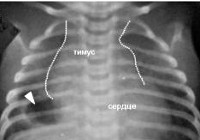
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва
Тимомегалия - гиперплазия тимуса и его гипофункция, сопровождающие ряд заболеваний детского возраста. Незначительная тимомегалия протекает бессимптомно; выраженное увеличение тимуса может проявляться синдром сдавления жизненно важных органов, синдромом лимфопролиферации, иммунными и эндокрино-обменными нарушениями. Диагностика тимомегалии требует участия детского иммунолога, проведения УЗИ вилочковой железы, рентгенографии грудной клетки, исследования показателей Т-звена иммунной системы и гормонального статуса. Детям с тимомегалией рекомендуются общеоздоровительные мероприятия, прием поливитаминов, биостимуляторов; по показаниям - глюкокортикостероидов.
Общие сведения
Тимомегалия – превышение массы и объема вилочковой железы у детей предельных возрастных норм с сохранением нормальной гистологической структуры органа. Тимомегалия обнаруживается примерно у 13-34% детей раннего возраста и 3-12% детей старше 3-х лет. После 5-6 лет количество детей с тимомегалией существенно уменьшается. У мальчиков тимомегалия диагностируется в 1,5-2 раза чаще, чем у девочек. Дети, страдающие тимомегалией, составляют в педиатрии группу риска по развитию аллергических, эндокринных, аутоиммунных и онкологических заболеваний, синдрома внезапной детской смерти, потому нуждаются в особом уходе и дополнительном наблюдении со стороны педиатра и детского аллерголога-иммунолога.

Причины тимомегалии
Вилочковая железа или тимус представляет собой центральный орган иммунной системы и железу внутренней секреции. В тимусе происходит трансформация клеток-предшественников (претимоцитов) в Т-лимфоциты, участвующие в регуляции клеточного и гуморального иммунитета. Кроме этого, вилочковая железа секретирует свыше 20 биологически активных веществ, среди которых гормоны и гормоноподобные вещества, регулирующие обмен веществ, гемопоэз, уровень кальция и сахара в крови, фосфора в скелетных мышцах, рост и половое созревание. Максимальную массу тимус имеет к моменту рождения ребенка (4,4% массы тела); его рост продолжается до 15 лет, после чего орган подвергается постепенной возрастной инволюции – замещению железистой ткани жировой и соединительной.
К развитию тимомегалии могут приводить различные эндогенные и экзогенные факторы, а также их сочетание. Доказана генетическая детерминированность тимомегалии и ее связь с HLA-антигенами B15, B18, В27. Определенную роль в формировании тимомегалии у ребенка играет отягощенный акушерский анамнез матери (аборты и выкидыши в анамнезе, токсикозы беременности, резус-конфликт, поздняя беременность и др.); вредное влияние на плод лекарств, алкоголя, рентгеновского облучения; патология периода новорожденности и раннего возраста (асфиксия, недоношенность, родовые травмы, синдром дыхательных расстройств, конъюгационная желтуха, сепсис новорожденных) и др. Тимомегалия является характерным проявлением лимфатико-гипопластического диатеза.
Классификация тимомегалии
Исследователи выделяют врожденную (первичную) и приобретенную (вторичную) тимомегалию. При врожденной тимомегалии вилочковая железа сформирована правильно, однако увеличена в размерах, что сопровождается снижением ее секреторной функции, гиперплазией лимфоидной ткани и дисфункцией нейро-эндокринной системы.
Приобретенная тимомегалия развивается вследствие первичного поражения других эндокринных желез: гипокортицизма, обусловленного аддисоновой болезнью, травмами, воспалительным или опухолевым поражением коры надпочечников; гипоталамического синдрома при окклюзионной гидроцефалии, васкулитах, опухолях головного мозга и пр.
Кроме этого, увеличение вилочковой железы может носить функциональный характер (например, при ОРВИ, пневмонии и др. заболеваниях); в этих случаях после выздоровления размеры тимуса и иммуногормональные показатели приходят в норму. Органическая тимомегалия связана с непосредственным поражением вилочковой железы.
Симптомы тимомегалии
Дети с тимомегалией отличаются характерными фенотипическими чертами: округлыми мягкими формами тела, крупными чертами лица и увеличенными поперечными размерами тела (широким лицом, плечами, грудной клеткой, ладонями и стопами), бледной, слабо пигментированной кожей, светлыми волосами и глазами, слабо развитой мускулатурой, повышенным аппетитом. Чаще чем в популяции у них отмечается нарушение темпов и последовательности прорезывания зубов, позднее начало ходьбы, задержка речевого развития и дислалия.
Из сопутствующих заболеваний при тимомегалии могут встречаться паховые и пупочные грыжи, ВПС (септальные дефекты), перинатальная энцефалопатия, рахит, врожденный вывих бедра, синдактилия, крипторхизм, фимоз, гипоплазия матки и влагалища и др. Дети с тимомегалией склонны к артериальной гипотонии, аритмиям, повышенной потливости, необъяснимому длительному субфебрилитету. Клинически значимая тимомегалии может сопровождаться сдавлением жизненно важных органов (трахеи, сосудистого пучка, ВПВ, блуждающего нерва), развитием синдромов иммунодефицита и лимфопролиферации, эндокрино-обменных нарушений.
При компрессии увеличенным тимусом жизненно важных органов может развиваться синдром верхней полой вены: набухание шейных вен, расширение венозной сети на верхней части туловища, одышка, цианоз. В случае сдавления трахеи возникает кашель, одышка, шумное храпящее дыхание, возбужденное состояние. Раздражение блуждающего нерва сопровождается брадикардией, дисфонией, срыгиваниями или рвотой, коллапсами.
Тимомегалия обычно сочетается с гиперплазией лимфоидной ткани (лимфаденопатией, увеличением аденоидов и миндалин, спленомегалией). В раннем и дошкольном возрасте дети с тимомегалией относятся к группе часто болеющих; у них отмечаются частые эпизоды ОРВИ с сильным коклюшеподобным кашлем и ложным крупом, отиты, пневмонии, выраженные поствакцинальные реакции. Эндокринные сдвиги проявляются ожирением, гипокортицизмом, гипопаратиреозом, сахарным диабетом, дисфункцией щитовидной железы, гиперпигментацией кожных покровов.
Диагностика тимомегалии
Обследование детей с тимомегалией проводится педиатром, детским иммунологом, детским эндокринологом и включает несколько этапов (клинико-анамнестический, инструментальный и лабораторный). При оценке объективного статуса ребенка с тимомегалией обращается внимание на перинатальный анамнез, конституционные данные, перенесенные заболевания.
Основная роль в выявлении тимомегалии принадлежит инструментальному обследованию – рентгенографии грудной клетки, УЗИ вилочковой железы, УЗИ органов брюшной полости и надпочечников. Рентгенодиагностика позволяет определить степень тимомегалии на основании исчисления кардио-тимико-торакального индекса (КТТИ) и вазокардиального индекса (ВКИ). В норме на рентгенограммах в прямой проекции тень вилочковой железы располагается за тенью сердца и сосудистого пучка. При тимомегалии I степени тень тимуса занимает 1/2 половину грудной клетки, II степени - 1/2 - 3/4 грудной клетки, III степени - более 3/4 грудной клетки. УЗИ тимуса позволяет оценить объем и массу органа и составить более четкое представление о степени тимомегалии.
Лабораторные показатели при тимомегалии характеризуются снижением субпопуляции Т-лимфоцитов (CD3, CD4, CD8); резким уменьшением количества зрелых В-клеток, низким уровнем IgG и IgА, повышенным - IgM и IgE; снижением концентрации АКТГ, кортизола, повышением уровня СТГ и ТТГ, некоторым увеличением концентрации паратиреоидного гормона.
Лечение тимомегалии
Вопросы ведения детей с тимомегалией и необходимости проведения корригирующей терапии разработаны недостаточно. Общепринято считать, что при незначительном увеличении тимуса специальных лечебных мероприятий не требуется. Рекомендуется грудное вскармливание, рациональное питание, ограничение стрессов и контактов с инфекционными больными.
Объем медикаментозной терапии определяет иммунолог, наблюдающий ребенка с тимомегалией. Часто болеющим детям каждые 3-4 месяца показан прием адаптогенов и биостимуляторов (женьшеня, пантокрина, элеутерококка, лимонника китайского). С целью иммунокоррекции используется экстракт тимуса крупного рогатого скота. Дважды в год до достижения 5-6-летнего возраста ребенку назначаются курсы индукторов синтеза глюкокортикоидов (аммония глицирризината, этимизола).
При тяжелых заболеваниях, стрессах, а также перед оперативными вмешательствами детям с тимомегалией назначаются глюкокортикоиды (преднизолон, гидрокортизон). В случае развития синдрома тимусо-надпочечниковой недостаточности (апатии, сильной слабости, брадикардии, рвоты, диспепсии, артериальной гипотонии, признаков почечной недостаточности) показано введение преднизолона, инфузионных растворов, сердечных гликозидов, препаратов калия.
При тимомегалии I-II степени профилактическая вакцинация не противопоказана, но проводится на фоне гипосенсибилизирующей терапии и гипоаллергенной диеты. Детям с тимомегалией III степени при благоприятной эпидобстановке дается отвод от прививок на 6 месяцев (за исключением вакцинации против полиомиелита).
Прогноз и профилактика тимомегалии
Обычно тимомегалия у детей сохраняется до 3-6 лет, после чего размеры вилочковой железы приходят норму. Тем не менее, дети с тимомегалией более подвержены инфекционно-воспалительным и аллергическим заболеваниям, риску внезапной смерти от гипофункции коры надпочечников, сдавления увеличенным тимусом органов средостения.
Дети с тимомегалией должны состоять на диспансерном учете у педиатра, детского аллерголога-иммунолога, эндокринолога; проходить ежегодное лабораторно-инструментальное обследование. К возможным мерам по предупреждению тимомегалии можно отнести исключение перинатальных вредностей. Детям с увеличенной вилочковой железой следует избегать стрессов, контактов с инфекционными больными, своевременно проходить профилактические курсы лечения.
Тимомегалия или синдром Платтера – патологическое состояние, характеризующееся гиперплазией вилочковой железы, сочетающейся со снижением ее функции, гистологическое строение органа не меняется. Клиническая картина определяется степенью увеличения тимуса.

Тимомегалия – патологическое состояние, характеризующееся гиперплазией вилочковой железы и снижением ее функции
При небольшом увеличении железы клиника отсутствует. Если же размеры тимуса превышены значительно, развиваются синдромы компрессии торакальных органов, лимфопролиферации, иммунодефицита, возникают эндокринные нарушения. Диагноз устанавливается на основании осмотра пациента детским иммунологом и педиатром, данных рентгена грудной клетки, ультразвукового обследования вилочковой железы. Кроме того, исследуется кровь на содержание гормонов и состояние Т-лимфоцитов. Активная терапия проводится только в случае значительного увеличения тимуса.
Увеличение вилочковой железы, как и обратное ему состояние – гипоплазия тимуса, требует должного внимания со стороны родителей и врача.
Тимус: его роль в организме
Тимус – основное звено в иммунной системе у детей. Железа ответственна за пролиферацию и дифференцировку Т-лимфоцитов, которые затем проникают во вторичные лимфоидные органы (лимфоузлы, селезенку).
Кроме того, тимус выделяет большое количество биологически активных веществ, которые регулируют соотношение Т- и В-лимфоцитов крови, стимулируют клеточный иммунитет, усиливают фагоцитоз. Гормоны вилочковой железы стимулируют процессы регенерации и кроветворения, улучшают клеточный метаболизм, способствуют росту организма и половому созреванию.
Тимомегалия: формы патологии
Гиперплазия вилочковой железы вызывается как органической, так и функциональной патологией
Различают две формы органического увеличения тимуса:
- Первичное – характеризуется гипертрофией со сниженной функцией железы. Это приводит к патологии органов внутренней секреции и разрастанию лимфоидной ткани.
- Приобретенное – возникает в результате поражения других органов, чаще при заболеваниях головного мозга, надпочечников, гипоталамуса.
Функциональные формы тимомегалии развиваются на фоне различных острых состояний – бронхита, трахеита, тонзиллита. После болезни размеры тимуса восстанавливаются.
Какие факторы могут привести к увеличению тимуса
Тимомегалия – часто встречающееся состояние в детском возрасте. К формированию патологии могут привести многие факторы. Наиболее важными из них являются:
- наследственная предрасположенность;
- неблагоприятное антенатальное воздействие – гестозы у матери, инфекции во время гестации, наличие выкидышей и прерывание предшествующих беременностей;
- перинатальная патология – родовые травмы, гипоксия, гемолитическая болезнь, сепсис новорожденных.
Клинические проявления тимомегалии
При небольшом увеличении тимуса никаких симптомов болезни нет. Когда имеется выраженная гиперплазия, появляются характерные черты тимико-лимфатического состояния.
Делая вывод о том, что это такое и насколько опасным является, стоит учесть характер патологии и выраженность симптомов. Избыточное образование лимфоидной ткани может сочетаться с расстройствами нейро-эндокринной и сердечно-сосудистой систем.

Тимус – основное звено в иммунной системе у детей.
При осмотре пациентов до года обращают внимание на следующие признаки:
- паратрофия – повышенный вес и избыточное отложение подкожного жира у грудничков;
- бледность кожи и пастозность;
- свистящее шумное дыхание;
- вегетативная лабильность – гипергидроз, длительный субфебрилитет, преходящие приступы аритмии.
У малышей старшего возраста отмечаются следующие симптомы:
- генерализованное увеличение периферических лимфоузлов, спленомегалия, разрастание лимфоидной ткани глоточного кольца;
- врожденные пороки развития и аномалии;
- вегетативные расстройства – гипотония, аритмии, коллаптоидные состояния;
- эндокринопатический синдром – ожирение, недоразвитие половых органов.
Как диагностируется патология
Если возникает подозрение на увеличение вилочковой железы, ребенок должен быть осмотрен педиатром, а также иммунологом. После этого его направляют на дополнительное обследование.
Лабораторная диагностика включает определение:
- общего количества Т-клеток, а также их число в субпопуляциях;
- число и зрелость В-клеток;
- количество иммуноглобулинов по классам;
- уровень гормонов гипофиза, щитовидной и паращитовидной желез.
Специальные методы обследования:
- Рентген грудной клетки проводят, чтобы выявить увеличение вилочковой железы и определить кардио-тимико-торакального индекс (КТТИ). На нормальной рентгенограмме тимус не виден, его закрывают сердце и сосудистый пучок. Если тень железы визуализируется, то по ней определяют КТТИ и степень увеличения.
- Ультразвуковое исследование вилочковой железы позволяет более точно определить объем органа.
- УЗИ надпочечников помогает выявить воспалительный или опухолевый процесс.
Комплексное обследование – залог постановки правильного диагноза и выбора оптимальной лечебной тактики.
Врачебная тактика при лечении тимомегалии
Если увеличение тимуса незначительное, то пациент не нуждается в специфической терапии. В этих случаях врачебное вмешательство ограничивается простыми рекомендациями:
- в детское меню должны быть включены легко усваиваемые продукты с высоким содержанием аскорбиновой кислоты, для грудничков обязательно грудное вскармливание;
- необходимо всячески избегать стрессовых ситуаций, ребенок должен находиться в спокойной, дружеской атмосфере;
- исключить контакты с инфекционными больными.
Пациентам с третьей степенью гиперплазии обычно назначается консервативная терапия. Хирургические способы лечения применяются редко, они допустимы только при прямой угрозе жизни пациента.

Детям с третьей степенью тимомегалии чаще назначается консервативное лечение
Курс фармакотерапии назначает врач-иммунолог. Чаще всего это:
- Глюкокортикоиды – применяются в стрессовых ситуациях и перед операцией, обычно длительность курса составляет 5-10 дней, но при тяжелом течении болезни возможен и более продолжительный прием.
- Вещества, стимулирующие синтез кортикостероидов (глицирам, аскорбиновая и пантотеновая кислоты) – назначаются курсами, лечение индукторами прекращают после достижения пациентом шестилетнего возраста.
- Биостимуляторы и адаптогены – препараты женьшеня, элеутерококка, китайского лимонника. Принимаются 1 раз в квартал, дозировки и длительность терапии определяются индивидуально.
- Для коррекции иммунных нарушений назначаются препараты вилочковой железы.
Порядок проведения медицинских прививок при синдроме Платтера
При небольших степенях увеличения вилочковой железы вакцинация проводится по общему календарю прививок. За 3-5 дней до процедуры назначаются антигистаминные средства и диета с исключением высокоаллергенных продуктов. Часто и длительно болеющим детям рекомендуют предварительно пройти терапию препаратами тимуса.
При гиперплазии тимуса высокой степени прививки противопоказаны до того момента, пока железа не придет в норму.
Заключение
Иммунология – сравнительно молодая наука, поэтому многие аспекты, касающиеся иммунной системы, остаются спорными и малоизученными.
Одной из актуальных проблем детской иммунологии является увеличение вилочковой железы. Это состояние известно в медицинской литературе под различными названиями: персистирующий тимус, синдром Платтера, конституционная гиперплазия тимуса, тимомегалия. Даже простое перечисление терминологических обозначений говорит о различных подходах ученых к изучению роли увеличения вилочковой железы в педиатрии. Некоторые вообще не считают увеличение тимуса патологией, относя состояние к аномалиям конституции.
Конечно, многие положения концепции тимико-лимфатического состояния безнадежно устарели и не соответствуют действительности. Но считать детей с увеличением вилочковой железы совершенно здоровыми не допустимо.
В русской медицинской литературе принят термин тимомегалия или синдром Платтера, подразумевающий врожденную нейро-иммуно-эндокринную дисфункцию, ассоциированную с увеличением вилочковой железы.
Тимомегалия – понятие собирательное, включающее в себя как безобидные, так и опасные состояния. Она бывает врожденной, приобретенной, стойкой или транзиторной, может стать результатом пролиферации нормальных лимфоцитов или злокачественного разрастания лимфоидной ткани. Поэтому все дети с увеличенной вилочковой железой должны быть под диспансерным наблюдением врача.
Видео


* Представленная информация не может быть использована для самостоятельной постановки диагноза, определения лечения и не заменяет обращение к врачу!
Читайте также:

