Теломеразы теломераза старение рак реферат
Обновлено: 06.07.2024
С момента своего открытия теломеры и теломераза стали предметом множества исследований, сначала как механизм клеточного старения, а затем как индикатор здоровья и заболеваний у людей. Защищая концы хромосом, теломеры играют жизненно важную роль в сохранении информации в нашем геноме.
Ключевые слова: старение, клеточное старение, теломеры, укорочение теломер, возрастная макулярная дегенерация, возраст-ассоциированные заболевания, сиртуины.
From cellular senescence towards age-related macular degeneration: the role of telomeres
L.K. Moshetova 1 , O.I. Abramova 1 , K.I. Turkina 1 , O.P. Dmitrenko 2 , N.S. Karpova 2
1 Russian Medical Academy of Continuous Professional Education, Moscow,
Russian Federation
2 Institute of General Pathology and Pathophysiology, Moscow, Russian Federatios
Since the discovery, telomeres and telomerase have been extensively studied, at first, as a mechanism of cellular senescence, and then, as human health and disease indicators. Telomeres that protect chromosomal ends play a vital role in genomic stability by preserving information.
This article reviews the results of early studies that later became the basis for further in-depth experiments. Studies that demonstrate the association between telomere shortening and the development of neurodegenerative disorders, e.g., age-related macular degeneration (AMD), are addressed as well. In addition, authors discuss the mechanisms of cellular senescence as a result of telomere attrition. The understanding of molecular mechanisms involved in aging may provide innovative therapeutic and preventive strategies for AMD. This disease is the third leading cause of blindness in elderly patients after glaucoma and cataract. AMD is diagnosed by typical retinal lesions in persons over 50 years. The prevalence of dry and wet AMD varies among ethnic and racial groups worldwide. Various types, stages, and prevalence of the disease may be seen in the same age group. These findings demonstrate the need for a biomarker to monitor the process of aging underlying AMD as well as potential explanations for the differences in its course and outcomes.
Keywords: aging, cellular senescence, telomeres, telomere shortening, age-related macular degeneration, aging-associated diseases, sirtuins.
Введение
В 1961 г. L. Hayflick и P.S. Moorhead впервые представили клеточное старение как прогрессирующую потерю клеткой своего пролиферативного потенциала [1]. Одна из существующих парадигм объясняет старение как физиологическое явление, поддерживаемое эволюцией, в терминах сверхиндивидуального естественного отбора [2]. Различные типы клеток живого организма подвержены запрограммированной гибели, которая уравновешивается эквивалентной пролиферацией стволовых клеток. Нейрон как структурно-функциональная единица нервной системы может иметь более 1000 синаптических связей с другими нейронами. Гипотетический оборот нейронов должен восстанавливать для каждого из них все существовавшие ранее связи, чтобы избежать потери его функций. Это частично объясняет, почему, за единичными исключениями (Zhao С. et al., 2008), у нейронов отсутствует непрерывное обновление, в отличие от других типов клеток [3]. Функционирование фоторецепторов сетчатки, клеток центральной нервной системы и необходимость поддержания их полной функциональной активности на протяжении всей жизни организма хорошо сбалансированы.
Одной из основных причин клеточного старения является укорочение теломер. На сегодняшний день существует более 6000 публикаций на тему ассоциации длины теломер со старением, о компромиссе между клеточным старением и регенерацией [4, 5]. Укорочение теломер и связанное с этим истощение пролиферативного потенциала клеток может быть достаточным для возникновения заболеваний, ассоциированных со старением. Исследования показали, что теломеры и теломер-ассоциированные белки играют важную роль в процессе старения и что ускоренная эрозия теломер связана с метаболическими и воспалительными заболеваниями, ассоциированными со старением.
В литературе широко представлены работы, демонстрирующие связь между укорочением теломер и нейродегенеративными нарушениями, которые характеризуются ранней гибелью клеток, в частности, это было продемонстрировано при деменции, болезни Гентингтона и атаксии телеангиэктазии, болезни Альцгеймера и болезни Паркинсона. В большинстве случаев у лиц с этими заболеваниями наблюдалась прямая связь между укорочением теломер и постоянным высоким уровнем окислительного стресса [6].
Теломеры и теломераза
Теломеры укорачиваются постепенно, при каждом делении в течение всей жизни клетки [5]. Прогрессирующее укорочение теломер в конечном итоге приводит к критически коротким теломерам, которые могут нарушать регенеративную способность тканей. López-Otín et al. (2013) назвали это одним из молекулярных признаков старения [8]. Кроме того, теломеры подвергаются воздействию нуклеаз и других деструктивных факторов (активные формы кислорода, свободные радикалы). Помимо опосредованного теломерами репликативного старения длина теломер может влиять на заболевания человека, регулируя экспрессию генов [9].
Распространенным заблуждением является утверждение, что нормальные стареющие клетки сразу подвергаются апоптозу. В настоящее время признано, что стареющие клетки могут выделять особые вещества, которые могут влиять на развитие возрастных заболеваний [16]. При этом сами клетки остаются жизнеспособными. Таким образом, считается, что с возрастом происходит постепенное накопление стареющих клеток, которые могут влиять на некоторые аспекты старения и развитие возраст-зависимых заболеваний [17].
Недавнее исследование показало, что дисфункция теломер влияет на метаболизм посредством регуляции сиртуинов. Семейство сиртуинов относится к классу никотинамид-адениндинуклеотид (НАД + )-зависимых ферментов, обладающих деацетилазной активностью. Сиртуины играют роль универсального метаболического сенсора, отражающего состояние энергетического обмена в клетке, вовлечены в каскад регуляторных сигналов через модификацию белков, участвующих в ремоделировании хроматина, подавлении транскрипции, сохранении целостности генома, делении клеток, энергетическом метаболизме и апоптозе. Сиртуины способны регулировать длину теломер [18]. SIRT1 необходим для поддержания длины теломер в процессе старения. Кроме того, избыточная экспрессия SIRT1 увеличивает длину теломер у мышей. Умеренный эффект SIRT1 в отношении теломер контрастирует с серьезным дефектом длины теломер у мышей с дефицитом SIRT6, у которых развивается выраженная дисфункция теломер, геномная нестабильность и синдром преждевременного старения. SIRT6 может защищать клетки от дисфункции теломер [19]. Низкие уровни экспрессии SIRT1 и SIRT6 могут дестабилизировать теломеры, ускоряя их укорочение, и активировать реакцию повреждения ДНК. Повышенная экспрессия SIRT1 влияет на путь теломеразы [20, 21]. В свою очередь, дисфункция теломер приводит к подавлению экспрессии всех членов семейства сиртуинов [22]. Было обнаружено, что повышение уровня НАД + стабилизирует теломеры и замедляет реакцию повреждения ДНК, частично через реакции, регулируемые SIRT1-зависимым образом [21].
Теломеры и возрастная макулярная дегенерация (ВМД)
Старение считается одним из факторов, наиболее предрасполагающих к развитию ВМД, поскольку распространенность этого заболевания возрастает у лиц старше 60 лет [23]. Несмотря на важность этой темы, в настоящее время опубликовано небольшое количество исследований, отражающих взаимосвязь ВМД и теломер.
Пигментный эпителий сетчатки (ПЭС) играет ключевую роль в обеспечении функционирования органа зрения и в развитии ВМД [24]. ПЭС должен реагировать на исключительно высокую окислительную нагрузку, связанную с процессами жизнедеятельности и функционированием сетчатки, и эта нагрузка еще больше увеличивается при старении. Поскольку в клетках ПЭС отсутствует фермент теломераза, клетки подвергаются старению, вызванному репликативным и окислительным стрессом.
Терапевтические агенты
Стратегии активации теломеразы для лечения ВМД следует рассматривать с осторожностью, учитывая их потенциальные нецелевые эффекты, которые могут привести к появлению опухолевых клеток [27]. Тем не менее данные последних исследований не только продемонстрировали отсутствие неблагоприятных эффектов и повышенной предрасположенности к развитию рака у мышей со сверхдлинными теломерами, но и зарегистрировали у них увеличенную регенеративную способность [28].
J. Ramunas et al. экспериментально доказали, что доставка модифицированной матричной РНК, кодирующей TERT, временно увеличивает активность теломеразы, длину теломер и пролиферативную способность клеток без иммортализации [29].
Низкомолекулярное соединение, выделенное из растения астрагал перепончатый (Astragalus membranaceus), способно усиливать активность теломеразы [30]. Результаты исследования, включавшего в себя пациентов с ранней стадией ВМД, продемонстрировали улучшение зрительных функций, по данным проведенной микропериметрии, после перорального приема ТА-65 (8 мг очищенного экстракта корня Astragalus membranaceus) [31]. Х.Х. Dong et al. (2007) впервые зафиксировали, что экстракт гинкго двулопастного (Ginkgo biloba) задержал начало старения за счет стимулирования теломеразы [32].
В качестве терапевтического агента для лечения ВМД рассматривался мелатонин, успешно стимулирующий активность теломеразы в клетках ПЭС и продемонстрировавший в ходе клинического испытания уменьшение патологических изменений макулярной зоны после его системного применения [33].
Была установлена ассоциация между длиной теломер и активностью теломеразы у пожилых людей и приверженностью средиземноморской диете [34, 35]. Сиртуины, опосредованно влияющие на теломеры, являются датчиками распознавания питательных веществ и реагируют на изменение количества и качества питания — например, низкокалорийная диета стимулирует синтез сиртуинов. Другое вещество — токотриенол (одна из форм витамина Е) способен восстанавливать длину коротких теломер в фибробластах человека. Есть данные о способности витамина С стимулировать теломеразу. Фолиевая кислота и витамин В12 вовлечены во многие механизмы, обеспечивающие стабильность теломер. Ресвератрол напрямую активирует ген SIRT1, что положительно сказывается на состоянии теломер [36]. При этом ресвератрол уже показал свою эффективность в лечении ВМД, защищая клетки ПЭС от повреждений, вызванных окислительным стрессом, предотвращая преждевременную гибель клеток сетчатки и восстанавливая некоторые зрительные функции [37, 38].
Заключение
Длина теломер, активность теломеразы и экспрессия представителей семейства сиртуинов тесно связаны между собой. Опубликованные исследования отражают их прямую связь с предрасположенностью к болезням, ускоренным старением и сокращением продолжительности жизни. Это обусловливает выбор сиртуинов и теломеразы в качестве мишеней для разработки эффективных терапевтических агентов, способных влиять на теломеры и, соответственно, на возраст-ассоциированные заболевания.
Кроме того, современные модели прогнозирования развития ВМД не включают молекулярные факторы риска, в то время как эти факторы могут быть измерены количественно. Возможная корреляция длины теломер и активности теломеразы с формой и стадией ВМД может быть использована в качестве фактора, способного обеспечить более точное определение генетического риска для отдельных лиц. Это подтверждает необходимость дополнительных исследований и испытаний в данной области.
Сведения об авторах:
1 Мошетова Лариса Константиновна — д.м.н., профессор, академик РАН, заведующая кафедрой офтальмологии, ORCID iD 0000-0002-5899-2714;
1 Абрамова Ольга Игоревна — аспирант кафедры офтальмологии, ORCID iD 0000-0002-6156-6126;
1 Туркина Ксения Ивановна — к.м.н., доцент кафедры офтальмологии, ORCID iD 0000-0002-4989-7467;
2 Дмитренко Ольга Павловна — младший научный сотрудник, ORCID iD 0000-0002-2067-0971;
2 Карпова Наталия Сергеевна — младший научный сотрудник, ORCID iD 0000-0001-6391-4908.
1 ФГБОУ ДПО РМАНПО Минздрава России. 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1.
2 НИИ общей патологии и патофизиологии. 125315, г. Москва, ул. Балтийская, д. 8.
About the authors:
1 Larisa K. Moshetova — MD, PhD, Professor, Full Member of the Russian Academy of Sciences, ORCID iD 0000-0002-5899-2714;
1 Olga I. Abramova — MD, postgraduate student of the Department of Ophthalmology, ORCID iD 0000-0002-6156-6126;
1 Kseniya I. Turkina — MD, PhD, Associate Professor of the Department of Ophthalmology, ORCID iD 0000-0002-4989-7467;
2 Olga P. Dmitrenko — MD, Junior Researcher, ORCID iD 0000-0002-2067-0971;
2 Nataliya S. Karpova — MD, Junior Researcher, ORCID iD 0000-0001-6391-4908.
1 Russian Medical Academy of Continuous Professional Education. 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation.
2 Institute of General Pathology and Pathophysiology. 8, Baltiyskaya str., Moscow, 125315, Russian Federation.

Теломераза — это фермент, который обеспечивает добавление недостающих теломерных повторов к концам хромосом и способствует, таким образом, восстановлению длины теломер. Клетка, снабженная теломеразой, способна на бесконечное количество делений. Но в большинстве клеток нашего организма фермент теломераза находится в неактивном состоянии. Он действует лишь в эмбриональных стволовых клетках, дающих начало всем другим типам клеток, и в половых клетках. Однако есть случаи, когда теломераза проявляет свою активность совсем не к месту, то есть она активна в клетках большинства опухолей, и следовательно обеспечивает им возможность многократного делания.
Цель: изучение фермента теломеразы и его роли в процессе старения.
Задачи:
1. Дать определение ферменту теломераза.
2. Выяснить, каким образом укорочение теломер может служить причиной старения и ограничения продолжительности жизни.
3. Выяснить, как достичь долголетия человека, замедлив процессы старения, но в то же время не вызывать развития злокачественных новообразований.
Человечество прогрессивно стареет. Одним из ведущих механизмов старения является потеря клеток, которая не может быть восполнена регенерацией.
Теломераза — фермент, добавляющий особые повторяющиеся последовательности ДНК к 3'-концу цепи ДНК на участках теломер, которые располагаются на концах хромосом в эукариотических клетках. Теломеры содержат уплотнённую ДНК и стабилизируют хромосомы. В последнее время было установлено, что нормальные диплоидные клетки имеют ограниченный потенциал делений, и что теломеры хромосом при каждом делении укорачиваются, а также после открытия фермента теломеразы, восстанавливающего исходную длину теломер, было экспериментально показано, что активация теломеразы в исчерпавших лимит Хейфлика клетках возобновляет их пролиферацию.
Каким же образом укорочение теломер может служить причиной старения и ограничения продолжительности жизни?
Очевидно, что для старения и смерти от старости вовсе не обязательно, чтобы лимит Хейфлика был исчерпан во всех клетках и тканях организма. Достаточно исчерпания пролиферативного потенциала клеток в каком-то отдельном участке одной из тканей какого-либо органа, что повышает вероятность развития характерных возрастных болезней – рака, инсульта, инфаркта, сердечной недостаточности и т.п. Эти болезни, разумеется, могут возникать и в более молодом возрасте и не обязательно в результате исчерпания лимита Хейфлика, однако в участке ткани, где лимит пролиферации клеток исчерпан и группа клеток поставлена перед необходимостью либо преодолеть лимит Хейфлика (рак), либо погибнуть (инсульт, инфаркт), возникновение этих заболеваний более вероятно. Для рака это показано достаточно четко. Механизм развития рака в результате исчерпания клетками пролиферативного потенциала представляется следующим: более активная пролиферация эпителиальных клеток в некоем участке ткани приводит к критическому укорочению теломер. В сочетании с инактивацией определенных генов соматическими мутациями, также накапливающимися с возрастом, это может приводить к тому, что клетки преодолевают лимит Хейфлика. Продолжающаяся пролиферация за пределы лимита Хейфлика ведет к дальнейшему прогрессивному исчерпанию теломер и запуску в этих клетках хромосомных разрывов, слияний и мостов с последующей анеуплоидией и транслокациями, что и приводит к раннему канцерогенез, а включающаяся экспрессия теломеразы – к активному злокачественному росту.
Что касается постмитотических клеток (кардиоциты, нейроны), то на их состоянии, сопряженном с функционированием снабжающих их сосудов, может неблагоприятно сказываться состояние тех групп клеток, которые исчерпали свой пролиферативный потенциал и тем самым снизили гомеостатические возможности всего организма.
Как же достичь долголетия человека, замедлив старение, в то же время не вызывая развития злокачественных новообразований?
Одним из предлагаемых путей является реактивация теломеразы в пролиферирующих клетках на фоне стимулирования активности нормальных вариантов онкосупрессоров: р53, р16 и ARF. Так, было доказано, что конститутивная сверхэкспрессия обратной транскриптазы (субъединицы теломеразы) с повышенной активностью ключевых супрессоров опухолей, приводит к значительному увеличению медианной продолжительности жизни и замедлению различных показателей старения, в частности кожи и кишечника.
Клеточное старение – это генетическая программа необратимой остановки клеточного цикла, блокирующая реакцию клетки на пролиферирующие стимулы и факторы роста при наличии нерепарируемых повреждений ДНК, в частности, критически укороченных теломер. Старение клетки – это загадочный феномен, возможно, играющий определенную роль в старении целостного организма и как было показано у человека, что при более низких концентрациях теломеразы и меньшей длине теломер в лимфоцитах периферической крови в несколько раз увеличивался риск сердечно-сосудистых заболеваний, составляющих, как известно, главную причину старческой смертности.
Программа клеточного старения может быть активирована в теломераза-позитивных клетках, какими являются стволовые клетки и поэтому убыль количества стволовых клеток является одной из причин возраст-зависимых нарушений регенерационной способности организма. Решение данной проблемы возможно на путях введения эмбриональных стволовых клеток в организм человека, но это может приводить к отторжению чужих клеток при их трансплантации. Перепрограммирование собственных дифференцированных клеток в подобие эмбриональных клеток приводит к возникновению устойчивых свойств стволовых клеток благодаря обнаружению ряда регуляторых белков, обуславливающих свойства истинно стволовых клеток и увеличивающих продолжительность жизни человека.
Клеточное старение – репликативное и стресс-идуцированное, сокращение пролиферирующих клеток вообще и стволовых, в частности, приводит к нарушению регенераторной способности тканей и на фоне возраст-зависимой активации апоптоза в ряде тканей при подавлении компенсаторной пролиферации (замещение одних клеток другими) происходят дегенеративные нарушения, что снижает функциональные возможности организма, находя выражение в таких процессах:
Длина теломер связана со старением целостного организма;
Модельные организмы с дефектами теломеразы характеризуются ускоренным старением и пониженной продолжительностью жизни;
Некоторые симптомы ускоренного старения у человека связаны с преждевременной дисфункцией теломер;
Стареющие клетки способны разрушать межклеточный матрикс, а также индуцировать локальное воспаление и онкогенез;
Снижение пролиферативных способностей или утеря стволовых клеток при старении снижает регенераторные способности любой ткани организма.
Заключение
Таким образом, теломераза - это фермент, который достраивает укороченную теломеру в половых клетках и клетках опухолей, обеспечивая их бессмертие на основе установленных следующих фактов:
Концы линейных хромосом с 3’-конца ДНК заканчиваются повторяющимися последователностями нуклеотидов, получивших название теломер, которые синтезируются рибонуклеиновым ферментом - теломеразой;
Соматические клетки эукариот, имеющие линейные хромосомы, лишены теломеразной активности. Их теломеры укорачиваются в процессе онтогенеза по мере старения in vivo, так и при культивировании in vitro;
Половые клетки и клетки иммортиризованных линий, а также опухоли имеют высокоактивную теломеразу, которая достраивает 3’-конец ДНК, на котором реплицируется комплементарная цепь при делении.
Список используемой литературы
Акоев И.Г. Биофизика познает рак. - Москва.: Наука, 1987. – 160 с.
Баур Ш. Влияние положения теломеры в клетках человека.//Sciense. - 2001. - № 5524. – С. 2075- 2077.
Гильхрест В.А., Яар М. Старение кожи: теоретические допустимые механизмы и вытекающие из них изменения в структуре и функционировании//Медик. – 2001. - №17. – С. 617-630.
Дильман В.М. Большие биологические часы. – Москва: Учебное пособие, 1982. - 208 с.
Йоку, Фурумото. Связанное со старением укорачивание теломер замедляется обогащением внутриклеточного витамина С путём подавления оксидазного стресса.//Life Sci. -1996. - №63 (11). – С. 935-938.
Сарецки Г. Репликационное старение, теломеры и оксидативный стресс.//Ann. N. Acad Sci. -2002. - № 959. - С. 24-29.
Харли Л. Натуральный продукт – активатор теломеразы как часть программы сохранения здоровья.//Rejuvenation. -2010. – № 1. – С. 34-39.
Эффрос Р.Б. Старение и иммунная система. Восприимчивость и старение: причины и вмешательство.//Novartis Foundation Symposium. – 2008. - №5. - С. 210 - 235.
Старение является свойственным нашей жизни процессом. Согласно генно-регуляторной гипотезе, старение коррелирует с укорочением теломер хромосом в результате митоза. Достраивание теломерных повторов ДНК обеспечивается ферментом теломеразой. Мутации основных компонентов теломеразы приводят к возникновению врожденных и приобретенных заболеваний. В настоящее время активно исследуются способы контролирования длины теломер при помощи индукции теломеразной активности. Обнаружено, что активирующими теломеразу свойствами обладают некоторые природные соединения. Интеграция терапевтических методов лечения возрастных изменений и клеточного омоложения способствует повышению эффективности лечения заболеваний, связанных со старением.

Введение
По данным Росстата на 2019 год в РФ насчитывается 36,6 млн. пенсионеров по старости, что составляет более четверти населения. Только за последние 5 лет численность пожилого населения выросла на 8,1%, а к 2036 г., согласно прогнозам, доля пенсионеров по возрасту может вырасти до 30,1% [1, c.1]. Продолжительность жизни населения является показателем социально-экономического развития страны, однако на первый план сегодня выходит не рост продолжительности жизни как таковой, а повышение качества жизни населения, сохранение активного долголетия, снижение заболеваемости, связанной с возрастом. В связи с этим процессы старения и сопровождающие его морфологические и функциональные изменения клеток всё больше привлекают внимание учёных.
Цель исследования: изучение литературных данных о теломерной теории старения, зависимых от теломеразы заболеваниях и возможности активации теломеразной активности.
Материалы и методы исследования: контент-анализ литературных источников, доступных в научных и наукометрических базах NCBI (National Center for Biotechnology Information) и E-Library.
Результаты исследования:
Основным механизмом поддержания длины теломер является достраивание теломерных повторов ДНК при помощи фермента теломеразы. Теломераза представляет собой мультиединичный рибонуклеопротеиновый комплекс, основными компонентами которого являются теломеразная субъединица TER, содержащая матричный участок обратной транскрипции, и теломеразная обратная транскриптаза TERT, осуществляющая координацию связывания и селекции во время репликации. Обнаружен ряд ассоциированных белков DSC (дискератин) и других вспомогательных компонентов, обеспечивающих функционирование теломеразы (посадку теломеразы на теломеру в определенный момент клеточного цикла, регуляцию ее активности, созревание теломеразного комплекса, а также деградацию его компонентов) [3, c. 5].
Мутации основных компонентов теломеразы сопровождаются сокращением длины теломер и являются причиной многих заболеваний. Первым генетическим заболеванием, причина которого была идентифицирована, как нарушение поддержания элонгации теломер, является врождённый дискератоз. Клинически это заболевание проявляется избыточным ороговением эпидермиса, дистрофией ногтей, гиперпигментацией, лейкоплакией слизистых оболочек, явлениями прогрессирующей костномозговой недостаточности. Х-связанная форма дискератоза вызвана мутациями в гене, кодирующем дискерин. Предполагается, что дискератоз может быть вызван дефектом процессинга р - РНК. Аутосомно-доминантная форма дискератоза тесно связана с мутациями в TER. Обнаружено, что фибробласты и лимфобласты у мужчин с дискератозом имеют более низкий уровень РНК-теломеразы, экспрессируют более низкий уровень теломеразной активности и имеют более короткие теломеры. Позднее мутации теломеразы были обнаружены при апластической анемии, идиопатическом легочном фиброзе, синдроме атаксии-телеангиоэктазии [2, 3; с.2,3 c. 5,6].
В последнее время заболевания сердечно-сосудистой системы стали рассматривать в связи с вторичными нарушениями теломер-организующих систем. Так, сокращение длины теломер обнаружено в эндотелиальных клетках коронарных артерий у пациентов с артериальной гипертонией (АГ), ишемической болезнью сердца, риском развития сахарного диабета (при нормальных показателях АД длина теломер составляет около 6,07 ± 0,040 кб, у больных АГ - 5,93 ± 0,042 кб, р
Другой тип онкогенов — ген, кодирующий теломеразу (обратную транскриптазу), необходимую для синтеза шестичленного повтора TTTAGG, как компонента теломеры на концах хромосом. Теломераза необходима, поскольку в ходе нормальной полуконсервативной репликации ДНК ДНК-полимераза, только добавляющая нуклеотиды к 3'-концу нити ДНК, не может завершить синтез растущей нити, просто дойдя до 3'-конца шаблонной нити.
В половых и эмбриональных клетках человека теломеры содержат приблизительно 15 килобаз повторов. Поскольку клетки дифференцируются, активность теломеразы различается во всех соматических тканях, за исключением высокопролиферативных клеток тканей, подвергающихся самовосстановлению, например клеток костного мозга.
Если активность теломеразы утрачивается, теломеры укорачиваются, теряя при каждом делении клетки приблизительно 35 пар оснований теломерных повторов ДНК. Через несколько сотен клеточных делений хромосома становится поврежденной.
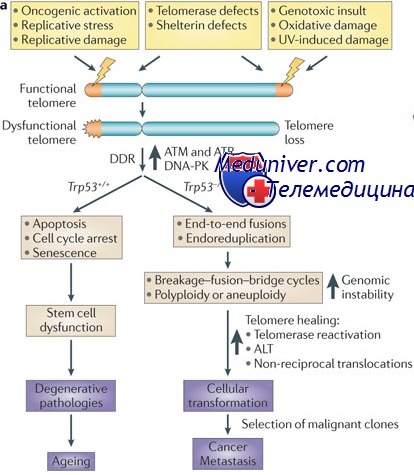
Нарушение ДНК, в свою очередь, приводит к прекращению деления и переводит клетку в стадию G0 клеточного цикла; в конце концов клетка подвергается апоптозу. В отличие от этого, в тканях многих опухолей экспрессия теломеразы сохраняется, что позволяет раковым клеткам неограниченно размножаться. В некоторых случаях появление активности теломеразы вызвано хромосомными или геномными мутациями, непосредственно затрагивающими ген теломеразы; в других ген теломеразы может быть только одним из многих генов, экспрессия которых изменена онкогеном, например MYC.
Стойкую экспрессию теломеразы не расценивают как первичную причину опухолей у человека, но она, вероятно, важна на следующем шаге, позволяя раковым клеткам сохраняться, несмотря на непрерывное деление клетки. Независимо от времени возникновения активности теломеразы в раковых клетках, присутствие ее активности в настоящее время используют как чувствительный диагностический метод опухолевого роста в образцах крови или в клетках, полученных при биопсии тканей, подозрительных на рак.
Кроме того, учитывая роль теломеразы в повышении клеточной пролиферации, ингибиция теломеразы активно используется как новый метод лечения рака.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

