Свойства клеток после иммобилизации реферат
Обновлено: 03.07.2024
Монография
Монография состоит из обзоров специалистов, имеющих публикации и научнопрактический опыт в исследованиях иммобилизованных клеток микроорганизмов, растений и животных, которые проводились ими в последние 10 лет. Основу обзоров составляют научные результаты самих авторов, а также актуальные данные по обсуждаемым вопросам, представленным в современной мировой литературе. В книге отражена информация о характеристиках иммобилизованных клеток, способах их регуляции, возможности длительного функционирования и хранения таких клеток, перспективах использования их в биомедицине, системах биодетекции, процессах синтеза биологически активных веществ и в решении экологических задач.
Издание предназначено для специалистов в области биотехнологии, гетерогенного катализа, зеленой химии, биохимии, биофизики, экологии, цитологии, биомедицины, для преподавателей, студентов и аспирантов естественнонаучных и технических факультетов высших учебных заведений, для всех, кто интересуется новыми результатами исследования свойств разных клеток и прикладными аспектами их возможного использования.
Содержание
| Предисловие редактора | |
| Ефременко Е.Н | 12 |
| Глава 1. Свойства иммобилизованных клеток и их регуляция | 15 |
| Иммобилизованные клетки в биокатализаторах и биопленках: свойства и общие закономерности их изменения Ефременко Е.Н. | 17 |
| Иммобилизованные нерастущие микроорганизмы и их лизаты для одноферментных биокаталитических процессов Коваленко Г.А., Перминова Л.В., Беклемишев А.Б. | 61 |
| Иммобилизация клеток как подход к их длительному хранению Махлис Т.А., Сенько О.В., Мамедова Ф.Т., Ефременко Е.Н. | 97 |
| Иммобилизованные клетки грибов: общие тенденции развития исследований и способов регуляции функциональной активности в процессах получения биологически активных соединений Ефременко Е.Н., Сенько О.В., Маслова О.В., Степанов Н.А., Лозинский В.И., Варфоломеев С.Д. | 123 |
| Глава 2. Иммобилизованные клетки и их значение для биомедицины | 161 |
| Иммобилизация клеток лекарственных растений — одно из направлений развития фармацевтической биоэкономики Юрин В.М., Дитченко Т.Н., Филиппова С.Н., Молчан н О.В. | 163 |
| Иммобилизованные животные клетки в/на биодеградируемых матриксах для тканевой инженерии и регенеративной медицины Балабанова Т.В., Дроздова М.Г., Водякова М.А., Марквичева Е.А. | 186 |
| Глава 3. Иммобилизованные клетки в системах биодетекции | 209 |
| Биосенсорные системы и топливные элементы на основе микробных клеток Решетилов А.Н., Плеханова Ю.В. | 211 |
| Иммобилизованные клетки бактерий, обладающих биолюминесценцией, в системах биодетекции и экомониторинга Маслова О.В., Сенько О.В., Холстов А.В., Исмаилов А.Д., Ефременко Е.Н. | 257 |
| Глава 4. Иммобилизованные клетки в процессах синтеза биологически активных веществ | 293 |
| Трансформация стероидов иммобилизованными клетками микроорганизмов как один из эффективных способов получения высокоактивных и промышленно значимых стероидных соединений Андрюшина В.А., Стыценко Т.С., Карпова Н.В., Ядерец В.В., Джавахия В.В. | 295 |
| Получение экзополисахаридов иммобилизованными клетками микроорганизмов Степанов Н.А., Сенько О.В., Маслова О.В., Ефременко Е.Н. | 332 |
| Иммобилизованные клетки микроорганизмов в процессах трансформации нитрилов и амидов карбоновых кислот Максимова Ю.Г., Демаков В.А. | 385 |
| Глава 5. Иммобилизованные клетки в решении экологически значимых проблем | 407 |
| Иммобилизация углеводородокисляющих родококков как фактор усиления нефтяной ремедиации Ившина И.Б., Куюкина М.С., Криворучко А.В. | 409 |
| Иммобилизованные биокатализаторы в системах получения биогаза и анаэробной очистки сточных вод Сенько О.В., Ефременко Е.Н. | 429 |
| Иммобилизованные биокатализаторы в процессах биодеградации токсичных соединений Ефременко Е.Н., Лягин И.В., Сенько О.В., Завьялова Н.В. | 460 |
90-летию
химического факультета
МГУ имени М.В. Ломоносова и
45-летию
кафедры химической энзимологии
химического факультета МГУ
посвящается
ПРЕДИСЛОВИЕ РЕДАКТОРА
Традиционно любые юбилейные события дают повод для подведения определенных итогов, анализа полученных и накопленных результатов, формулировки новых текущих задач, осмысления возможности достижения новых стратегических целей. Эта книга стала своего рода предвестником грядущих в 2019 г. юбилейных событий на химическом факультете МГУ имени М.В.Ломоносова и на кафедре химической энзимологии, благодаря которым появилась возможность для многих исследователей, вовлеченных в проблемы изучения и применения иммобилизованных клеток, как мощных биокатализаторов различных процессов и составной части ряда биосенсорных систем, объединиться и, испытывая пиетет к указанным структурным подразделениям МГУ, поделиться результатами своей работы за последние 10 лет, проанализировать мировые достижения в осваиваемых научных направлениях, показать потенциал проводимых изысканий и выделить те точки, которые ожидаемо окажутся значимыми в ближайшем будущем для приложения знаний и усилий.
Отдельно обсуждаются оригинальные подходы, стратегии получения лиальных грибов для разных целей. Представлены результаты уникального комплексного исследования физиолого-биохимических особенностей иммобилизованных клеток разных лекарственных растений, культивированием которых обеспечивается экологическая чистота производимых лекарственных субстанций, а также полная независимость от географических и климатических факторов. Рассмотрены разнообразные подходы к использованию носителей (20-подложек и ЗО-матриксов) для иммобилизации животных клеток, включая стволовые, с целью обеспечения клеточной адгезии, роста, пролиферации, дифференцировки и регенерации тканей. Обсуждаются вопросы теоретических основ и практического применения иммобилизованных клеток как компонентов микробных биосенсоров и биотопливных элементов, показана возможность их использования для экомониторинга разных токсикантов в водных объектах, почве и воздушных средах. Продемонстрирована эффективность применения иммобилизованных клеток микроорганизмов в качестве биокатализаторов реакций трансформации и биосинтеза стероидных соединений с гарантией преодоления ряда сложностей, связанных с биотрансформацией стероидных субстратов. Показана перспективность использования высококонцентрированных клеточных популяций в иммобилизованном виде для получения разных микробных полисахаридов как источников новых биодеградируемых материалов с привлекательными свойствами. Представлены методы иммобилизации клеток нитрилгидролизующих микроорганизмов и примеры их использования в процессах трансформации нитрилов и амидов карбоновых кислот для целей биокатализа и биологической очистки загрязненных сред, показано влияние иммобилизации клеток на стереоселективность гидролитических реакций.
Проанализированы и обобщены преимущества использования иммобилизованных углеводородокисляющих клеток для решения вопросов нефтяной биоремедиации, обсуждены основные подходы к выбору носителей и созданию оптимальных условий иммобилизации клеток нефтедеструкторов. Рассмотрены способы иммобилизации консорциумов клеток, входящих в состав активных илов для анаэробной очистки стоков и получения биогаза, показаны приемы интенсификации этих процессов. Проведен анализ эффективного применения иммобилизованных клеток в процессах биодеградации различных токсичных веществ, изложены основные тенденции в развитии подходов к повышению концентраций биоразлагаемых токсикантов под действием иммобилизованных биокатализаторов, отдельно представлены достижения в области детоксификации нейротоксичных фосфорорганических соединений.
Всем членам сложившегося авторского коллектива как своим единомышленникам я хочу выразить большую благодарность за проявленное уважение к идее написания этой монографии, отзывчивость, научный интерес, поддержку, желание делиться своими результатами и знаниями, а также уверенность в том, что такие исследования нужны и актуальны.
профессор Ефременко Е.Н.
Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Принципиально новые перспективы открылись перед прикладной энзимологией в результате создания нового типа биоорганических «катализаторов, так называемых иммобилизованных ферментов,т.е.ферментов,связанных с носителем.Нельсон и Гриффинц уже в 1916 г.показали,что инвертаза,если адсорбировать её на угле или алюмогеле,сохраняет каталитическую активность,однако целенаправленная разработка такого рода гетерогенных катализаторов на основе ферментов началась лишь в 50-х годах.
Содержание
Введение ……………………………………………………………….3
Понятие ферментов …………………………………………………. 4
Общая характеристика иммобилизованных ферментов…….………5
Классификация носителей для ферментов …………….……………6
Методы иммобилизации ферментов …………………………………9
Иммобилизация клеток ……………………………………………. 17
Применение иммобилизованных ферментов ………………………19
Применение иммобилизованных ферментов в пищевой промышленности ………………………………….…………………20
Заключение ……………………………………….…………………..21
Список используемых источников …………………………………23
Работа состоит из 1 файл
Копия Копия МОЙ РЕФЕРАТ.doc
Федеральное агентство по образованию
Волгоградский Государственный Технический Университет
Реферат по биотехнологии
студентка группы хт-444
Волгоград 2010
Общая характеристика иммобилизованных ферментов…….………5
Классификация носителей для ферментов …………….……………6
Методы иммобилизации ферментов …………………………………9
Иммобилизация клеток ……………………………………………. 17
Применение иммобилизованных ферментов ………………………19
Применение иммобилизованных ферментов в пищевой промышленности ………………………………….…………………20
Список используемых источников …………………………………23
Принципиально новые перспективы открылись перед прикладной энзимологией в результате создания нового типа биоорганических «катализаторов, так называемых иммобилизованных ферментов,т.е.ферментов, связанных с носителем.Нельсон и Гриффинц уже в 1916 г.показали,что инвертаза,если адсорбировать её на угле или алюмогеле,сохраняет каталитическую активность,однако целенаправленная разработка такого рода гетерогенных катализаторов на основе ферментов началась лишь в 50-х годах.
Во-первых, гетерогенный катализатор легко отделить от реакционной среды, что позволяет: 1) остановить реакцию; 2) использовать катализатор повторно; 3) получать продукт, не загрязненный ферментом. Последнее особенно важно в ряде пищевых или фармацевтических производств.
Во-вторых, гетерогенные катализаторы позволяют проводить ферментный процесс непрерывно (например, в проточных реакторах) и регулировать скорость катализируемой реакции (или выход продукта) скоростью потока.
В-третьих, иммобилизация или модификация позволяют целенаправленно изменять свойства фермента, в том числе его специфичность (особенно в отношении к макромолекулярным субстратам), зависимость активности от рН-среды и, что особенно важно, его стабильность по отношению к различного рода денатурирующим воздействиям среды.
Ферменты (от лат. fermentum - брожение, закваска), специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Через их посредство реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах. Ферменты бывают простыми или сложными белками, в состав которых наряду с белковым компонентом (апоферментом) входит небелковая часть - кофермент.
Эффективность действия ферментов определяется значительным снижением энергии активации катализируемой реакции в результате образования промежуточных фермент-субстратных комплексов. Присоединение субстратов происходит в активных центрах, которые обладают сходством только с определенными субстратами, чем достигается высокая специфичность (избирательность) действия ферментов.
Одна из особенностей ферментов - способность к направленному и регулируемому действию. За счёт этого контролируется согласованность всех звеньев обмена веществ. Эта способность определяется пространственностью структурной молекулы ферментов. Она реализуется через изменение скорости действия ферментов и зависит от концентрации соответствующих субстратов и кофакторов, рH среды, температуры, а также от присутствия специфических активаторов и ингибиторов (например, адениловых нуклеотидов, карбонильных, сульфгидрильных соединений и др.).
Известно более 20000 различных ферментов, из которых многие выделены из живых клеток и получены в индивидуальном состоянии. Первый кристаллический фермент (уреаза) выделен американским биохимиком Д.Самнером в 1926 г. Для ряда ферментов изучена последовательность аминокислот и выяснено расположение полипептидных цепей в трёхмерном пространстве. В лабораторных условиях осуществлен искусственный химический синтез фермента рибонуклеазы. Ферменты используют для количественного определения и получения различных веществ, для модификации молекул нуклеиновых кислот методами генной инженерии, диагностики и лечения ряда заболеваний, а также в ряде технологических процессов, применяемых в лёгкой, пищевой и фармацевтической промышленностях.[2]
Общая характеристика иммобилизованных ферментов.
В современной биотехнологии одно из видных мест принадлежит ферментам. Ферменты и ферментные системы широко используются в различных отраслях промышленности, медицине, сельском хозяйстве, химическом анализе и т.д.
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Сущность иммобилизации ферментов — прикрепление их в активной форме к нерастворимой основе или заключение в полупроницаемую мембранную систему. Прикрепление фермента к носителю осуществляется адсорбционно, химической связью или путем механического включения фермента в органический или неорганический гель (в капсулу и т. п.). При этом допускается прикрепление фермента только за счет функциональных групп, не входящих в активный центр фермента и не участвующих в образовании фермент-субстратного комплекса. Носитель фермента или матрица может иметь вид зернистого материала, волокнистой структуры, пластинчатой поверхности, пленок или тканей, полых волокон, трубочек, капсул и т. д. Имеет значение размер частиц носителя. Важно иметь большую поверхность, поэтому рекомендуются небольшие частицы диаметром 0,1—0,2 мм. Носитель фермента может быть как природное вещество, так и синтетический полимер.
Ещё раз повторю,преимущества иммобилизованных ферментов перед предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру. [3]
Классификация носителей для ферментов.
Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования (Дж.Порат, 1974):
высокая химическая и биологическая стойкость;
высокая химическая прочность;
достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность;
возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
Классификация носителей схематично представлена на рисунке 1.
Рис. 1. Классификация носителей для иммобилизованных ферментов
Следует отметить, что органические носители (как низко-, так и высокомолекулярные) могут быть природного или синтетического происхождения. Природные полимерные органические носители делят в соответствии с их биохимической классификацией на 3 группы: полисахаридные, белковые и липидные.
Синтетические полимеры также можно разделить на группы в связи с химическим строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфирные.
Для иммобилизации ферментов наиболее широко используются природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступностью и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенностью этой группы носителей также является их высокая гидрофильность. Недостаток природных полимеров - неустойчивость к воздействию микроорганизмов и довольно высокая стоимость.
Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильна, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путем частичного гидролиза, в результате которого разрушаются аморфные участки. На их место для сохранения пористости между кристаллическими участками вводят химические сшивки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д.
Широко распространены носители на основе декстрана, выпускаемые под названием "сефадексы". При высушивании они легко сжимаются, в водном растворе сильно набухают. В этих носителях размер пор в геле регулируется степенью сшитости. К группе декстранов относят и крахмал. Химически модифицированный крахмал сшивается агентами, такими как формальдегид. Таким способом был получен губчатый крахмал, обладающий повышенной устойчивостью по отношению к ферментам, гидролизу. Водорастворимые препараты на основе декстрана часто применяются как носители лекарственных средств в медицине.
Пробиотические продукты — это группа функциональных продуктов с растущей долей рынка и большим коммерческим интересом. Использование технологии иммобилизации способствует повышению жизнеспособности пробиотических клеток в пищевых продуктах, так и во время их прохождения через желудочно-кишечный тракт. В обзоре проанализированы критерии использования пробиотических микроорганизмов. Описываются преимущества и способы технологии иммобилизации в пищевой промышленности, направленные на повышение жизнеспособности клеток. Были рассмотрены различные природные материалы для иммобилизации клеток. Приведены примеры использования технологии иммобилизации пробиотических микроорганизмов в создании функциональных пищевых продуктов.
Ключевые слова: пробиотики, функциональные продукты, иммобилизация, альгинаты, пектин.
IMMOBILIZATION OF PROBIOTICS FOR FUNCTIONAL FOOD DEVELOPMENT
Zhantlesova S.D.*
Al-Farabi Kazakh National University, Almaty, Kazakhstan
Abstract
Probiotic products are a group of functional food with a growing market share and significant commercial interest. The use of immobilization technology helps to increase the viability of probiotic cells both in food products and during their passage through the gastrointestinal tract. The current study analyzes the criteria for the use of probiotic microorganisms and describes the advantages and methods of immobilization technology in the food industry aimed at increasing cell viability. The author of the study examines different natural materials for the immobilization of cells as well as provides examples of using the technology of immobilization of probiotic microorganisms in the creation of functional food.
Keywords: probiotics, functional food, immobilization, alginates, pectin.
На сегодняшний день на рынке доступно большое количество пробиотических пищевых продуктов. Потребление пробиотиков через функциональные пищевые продукты, такие как йогурт, творог и т. д., как правило, более предпочтительно и популярно среди потребителей чем в таких формах как таблетки, капсулы и др. [3].
В качестве пробиотиков наиболее часто используются бактерии, относящиеся к родам лактобацилл и бифидобактерий, являющиеся важными представителями нормальной микрофлоры человека [4], [5].
В процессе отбора подходящего пробиотика следует учитывать несколько аспектов [6]:
1 Безопасный штамм, вид и род пробиотиков;
2 Жизнеспособность и биологическая активность во время процесса и хранения;
3 Способность к выживанию в кишечнике и устойчивость к действию желчи и желудочного сока;
4 Стимулирование ростовых свойств полезных бактерий и угнетение роста вредных микроорганизмов (посредством производства противомикробных соединений и конкурентного уничтожения);
5 Антагонистическая активность в отношении патогенных и условно-патогенных микроорганизмов;
6 Способность к адгезии слизистой кишечника;
7 Антимутагенные и антиканцерогенные свойства;
8 Иммуностимулирующие действие.
Для получения терапевтического эффекта, пробиотические штаммы должны оставаться жизнеспособными в течение всего срока годности продукта до момента употребления и поддерживать высокую жизнеспособность в процессе их транзита через верхние отделы желудочно-кишечного тракта (ЖКТ) вплоть до толстой кишки [7].
Пробиотические продукты должны содержать достаточное количество живых клеток (не менее 10 6 -10 7 КОЕ/г) [8], [9], [10]. Введение такого большого количества клеток связано с негативным воздействием вредных факторов различного происхождения. Основными факторами, которые оказывают негативное влияние, являются [7]: условия обработки (температура, окисление и др.), условия хранения (упаковочные материалы и окружающая среда: влажность, кислород, температура и т. д.), деградация в желудочно-кишечном тракте (низкий pH в желудке и желчные соли в тонком кишечнике).
Однако выживаемость пробиотиков при хранении и прохождении через желудочно-кишечную систему обычно низкая [7]. Одним из возможных решений этой проблемы является иммобилизация или инкапсулирование бактериальных клеток [11].
Технология иммобилизации клеток позволяет увеличить стабильность клеток и снизить летальное воздействие на клетки микроорганизмов, улучшить органолептические показатели и клинический результат по сравнению со свободными клетками. Методы иммобилизации обеспечивают увеличение жизнеспособности пробиотиков как в продуктах питания, так и во время их прохождения через желудочно-кишечный тракт.
К наиболее распространённым методам иммобилизации клеток можно отнести: связывание на твердом носителе, включение в пространственную структуру носителя и иммобилизация с использованием мембранной технологии [12].
Все больший интерес проявляется к иммобилизации с использованием мембранной технологии, а именно к технологии микрокапсулирования, так как получение микрокапсулированных форм пробиотиков является многообещающей перспективой внедрения жизнеспособных пробиотических бактерий в продукты питания [13]. Микрокапсулирование — это процесс формирования непрерывной оболочки вокруг внутренней матрицы, которая полностью содержится в стенке капсулы [14].
Использование сочетания методов адсорбционной и пространственной иммобилизации создают оптимальные условия для живых клеток. Адсорбционная и пространственная иммобилизация — это наиболее мягкий и преимущественный для живых клеток способ фиксации [12]. Включение живых клеток в гели биополимеров происходит в мягких условиях иммобилизации. Клетки включают в носитель, обладающий развитой системой открытых пор с достаточными условиями для газообмена.
Существуют большое количество носителей для иммобилизации, но лишь некоторые считаются пригодными в использовании для производства продуктов питания. В производстве функциональных пищевых продуктов наиболее всего применяют природные полисахариды для иммобилизации клеток микроорганизмов [15]. К полисахаридам, которые используются как пищевые покрытия, относятся: крахмал, производные целлюлозы, хитозан, альгинат, пектин, каррагинан, пуллулан, геллановая камедь, ксантановая камедь и др. [16], [17]. Такие покрытия служат хорошими кислородными, ароматическими и масляными барьерами, также обладают хорошими механическими свойствами [18].
Материалом, наиболее часто используемым для иммобилизации бактериальных клеток, является природный полисахарид альгинат натрия, главным образом из-за его безопасности, хороших гелеобразующих свойств и биосовместимости [19], [20].
Альгинаты, которые являются природными анионными полисахаридами, состоящими из остатков D-маннуроновой и L-гулуроновой кислот, линейно соединенных (1-4) гликозидными связями, считаются безопасными для употребления в пище [21], [22]. С физиологической точки зрения, главное преимущество альгината заключается в том, что иммобилизованные клетки не претерпевают резких изменений физико-химического состояния во время процедуры иммобилизации, а гель является прозрачным и проницаемым [23].
Альгинат использовался для приготовления многослойных шариков гидрогеля, защищающих пробиотические бактерии Bifidobacterium breve в условиях низкого pH желудочного сока [24]. Клетки пробиотиков инкапсулировали в сферические шарики из альгината кальция, используя эмульсионный метод. Полученные шарики с инкапсулированными пробиотическими клетками, а также свободные клетки подвергали воздействию сред с различными значениями pH, которые имитируют условия желудочного сока и кишечной жидкости. Жизнеспособность клеток B. breve, инкапсулированных в гранулы альгината кальция, по сравнению с жизнеспособностью свободных клеток была значительно выше.
Tapia и соавторы предложили съедобные фрукты (яблоки и папайя) на основе альгината и геллана [25]. Благодаря защите клеток L. acidophilus и B. lactis покрытием альгината и геллана, выживаемость клеток была значительно улучшена.
Пектин – природный анионный полисахарид, который применяется для иммобилизации клеток пробиотических микроорганизмов, представляющий собой систему c большими размерами пор [26]. Пектиновые гели, обладают хорошими диффузионными свойствами и способны образовывать структуры с оптимальным размером пор [27].
В исследовании Коркач А.В. и др., бифидобактерии Bifidobacterium bifidum были включены в гель биополимера пектина, в результате чего клетки бактерий заключались в полимерную сетку, сшитого химическими и физическими связями полимера [15]. Клетки, иммобилизованные в гели биополимера пектина, характеризовались большой стабильностью в агрессивной среде желудка и двенадцатиперстной кишки, по сравнению со свободными клетками. Как следует из результатов эксперимента, их выживаемость в ЖКТ составила 57-78 %.
В таблице 1 приведены примеры использования технологии иммобилизации клеток в разработке пробиотических продуктов питания.
Таблица 1 – Применение иммобилизации пробиотических микроорганизмов
в создании функциональных пищевых продуктов
| Носитель для иммобилизации | Микроорганизм | Пробиотический пищевой продукт | Источник |
| Альгинат, желатин | Bifidobacterium animalis subsp. lactis DSM 10140 | Яблоко | [28] |
| Альгинат | Lactobacillus paracasei ssp. paracasei LBC-1 (LBC-1e) | Сыр | [29] |
| Ксантан-хитозан | Lactobacillus acidophilus | Йогурт | [30] |
| Альгинат натрия | Bifidobacterium bifidum F‐35 | Йогурт | [31] |
| Альгинатные шарики, покрытые двухслойным хитозаном | Lactobacillus plantarum | Гранатовый сок | [32] |
| Альгинат и геллан | L.acidophilus и B. lactis | Яблоки и папайя | [25] |
| Сыворочный белок/альгинат | Lactobacillus rhamnosus GG | Гранатовый и клюквенный сок | [33] |
Использование пробиотиков в пищевых продуктах в промышленных масштабах включает в себя ряд микробиологических, технологических и экономических проблем. Необходимы дальнейшие исследования по разработке соответствующих технологий, матриц-носителей и подбору бактериальных штаммов, способствующих выживанию бактериальных клеток в различных условиях обработки (при тепловом, осмотическом и кислородном стрессах), а также при их прохождении через верхние отделы желудочно-кишечного тракта.
Различные технологии иммобилизации еще не полностью освоены и требуют дополнительной экспериментальной работы для успешного внедрения в пищевые матрицы. Исследовательские усилия должны быть направлены на улучшение свойств биокомпозитов, расширение имеющихся в настоящее время методов и преодоление технологических проблем производства новых функциональных пищевых продуктов.
Список литературы / References
- FAO/WHO. Working group on drafting guidelines for the evaluation of probiotics in food. Guidelines for the evaluation of probiotics in food. 2002.
- Isolauri E. Functional foods and probiotics: Working Group Report of the First World Congress of Pediatric Gastroenterology, Hepatology, and Nutrition / E. Isolauri, H. Ribeiro, G. Gibson et al. // J Pediatr Gastroenterol Nutr. 2002;35:S106–S109.
- Roy P. Functional Food: Probiotic as Health Booster / P. Roy, V. Kumar // J Food Nutr Popul Health, Vol.2, No.2:12.
- Etchepare M.A. Microencapsulation of probiotics using sodium alginate / M.A. Etchepare, J.S. Barin, A.J. Cichoski et al., // Ciência Rural, vol. 45, no. 7, pp. 1319–1326, 2015.
- Khosravi Zanjani Microencapsulation of Probiotics by Calcium Alginate-gelatinized Starch with Chitosan Coating and Evaluation of Survival in Simulated Human Gastro-intestinal Condition / Khosravi Zanjani, Mohammad Ali et al.// Iranian journal of pharmaceutical research : IJPR 13,3 (2014): 843-52.
- Saarela M. Probiotic bacteria: safety, functional and technological properties / M. Saarela, G. Mogensen, R. Fonden et al. // J Biotechnol 2000; 84: 197-
- Chávarri, M. Encapsulation technology to protect probiotic bacteria / Chávarri, M., Marañon, I., Villarán, C. // In: Rigobelo, E. (Ed.), Probiotics. InTech, pp. 501-540.
- Boylston T.D. Incorporation of Bifidobacteria into Cheeses: Challenges and Rewards / T.D. Boylston, C.G. Vinderola, H.B. Ghoddusi et al. // International Dairy Journal, Vol. 14, No. 5, 2004, pp. 375-387.
- Krasaekoopt W. Evaluation of encapsulation techniques of probiotics for yoghurt / W. Krasaekoopt, B. Bhandari, and H. Deeth // Int. Dairy J.13, 3–13.
- Marinova V. Microbiological quality of probiotic dietary supplements / Marinova, I. Rasheva, Y. Kizheva et al.// Biotechnology & Biotechnological Equipment,33:1, 834-841.
- Corona-Hernandez R.I. Structural stability and viability of microencapsulated probiotic bacteria: a review / R.I. Corona-Hernandez, E. Álvarez-Parrilla, J. Lizardi-Mendoza, et al. // Comprehensive Reviews in Food Science and Food Safety, vol. 12, no. 6, pp. 614–628, 2013.
- Корочинский А.В. Исследование возможности создания иммобилизованных структур на базе пробиотиков / А.В. Корочинский, В.В. Верниковский, Э.Ф. Степанова // Успехи современного естествознания. – 2010. – № 5. – С. 34-38.
- Chavarri M. Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions / M. Chavarri, I. Marañón, R. Ares et al., // International journal of food microbiology. 142. 185-9.
- Vidhyalakshmi R. Encapsulation “The future of probiotics”: A review / Vidhyalakshmi R., Bhakyaraj R., Subhasree R.S. // Adv. Biol. Res. 2009, 39, 96–103.
- Коркач А. В.Обоснование метода иммобилизации микроорганизмов и их применение в технологии кондитерских изделий / А. В. Коркач, Г. В. Крусир, А. В. Егорова // Харчова наука і технологія. – 2013. – № 1. – С. 35-38.
- Danijela Šuput Edible films and coatings – sources, properties and application / Danijela Šuput et al. // Food and Feed Research, 42 (1), 11-22, 2015.
- Valencia-Chamorro S.A. Antimicrobial Edible Films and Coatings for Fresh and Minimally Processed Fruits and Vegetables: A Review / S.A. Valencia-Chamorro, Palou L., M.A. del Río et al. // Crit. Rev. Food Sci. Nutr. 2011, 51, 872–900.
- Ramos O.L. Edible Films and Coatings from Whey Proteins: A Review on Formulation, and on Mechanical and Bioactive Properties / Ramos O.L., Fernandes J.C., Silva S.I. et al. // Crit. Rev. Food Sci. Nutr. 2012, 52, 533–552.
- Etchepare M.A. Microencapsulation of probiotics using sodium alginate / M.A. Etchepare, J.S. Barin, A.J. Cichoski et al., // Ciência Rural, vol. 45, no. 7, pp. 1319–1326, 2015.
- Yeung T.W. Microencapsulation in alginate and chitosan microgels to enhance viability of Bifidobacterium longumfor oral delivery / T.W. Yeung, E.F. Üçok, K.A. Tiani et al. // Frontiers in Microbiology, vol. 7, p. 494, 2016.
- Chávarri M. Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions / M. Chávarri, I. Marañón, R. Ares et al. // Int J Food Microbiol. 2010;142 (1-2):185-9.
- George M. Polyionic hydrocolloids for the intestinal delivery of protein drugs: Alginate and chitosan-a review / M. George, T.E. Abraham // J. Control. Release Off. J. Control. Release Soc. 2006, 114, 1–14.
- Bashan L.E. Immobilized microalgae for removing pollutants: Review of practical aspects / L.E. Bashan, Y. Bashan // Bioresour. Technol. 101:1611-1627.
- Li Y. Construction of multilayer alginate hydrogel beads for oral delivery of probiotics cells / Li Y., Feng C., Li J., Mu Y. et al. // Int. J. Biol. Macromol. 2017; 105: 924–930.
- Tapia M. S. Alginate- and gellan-based edible films for probiotic coatings on fresh-cut fruits / Tapia M. S., Rojas-Grau M. A., Rodríguez E. J. et al. // J. Food Sci.72, pp. 190–196.
- Li Y. Atomic force microscopic investigations on pectin gelling made under optimum conditions / Li Y., Wu Y., Cai J. // Chemical Journal on Internet. 10, (9), P. 45.
- Гаврилова Н. Б. Экспериментальное исследование иммобилизации клеток микроорганизмов в гель биополимеров / Н. Б. Гаврилова // Техника и технология пищевых производств – 2012. – № 3. – С. 21-28.
- Campaniello D. Alginate- and Gelatin-Coated Apple Pieces as Carriers forBifidobacterium animalislactis DSM 10140 / D. Campaniello, A. Bevilacqua, B. Speranza et al. // Front Microbiol. 2020 Oct 16;11:566596.
- Ortakci F. Survival of microencapsulated probiotic Lactobacillus paracasei LBC-1e during manufacture of Mozzarella cheese and simulated gastric digestion / F. Ortakci, Broadbent J., W. McManus et al. // Journal of dairy science. 95. 6274-81.
- Guowei Sh. Microencapsulation of Lactobacillus Acidophilus by Xanthan-Chitosan and Its Stability in Yoghurt / Guowei Sh. & He Y. & Chen Li et al. // Polymers. 9. 733.
- Mousa A. Evaluation of physiochemical, textural, microbiological and sensory characteristics in set yogurt reinforced by microencapsulated Bifidobacterium bifidum F-35 / A. Mousa, X.M. Liu, Y.Q. Chen et al. // Int. J. Food Sci. Technol. 2014, 49, 1673–1679.
- Nualkaekul S. Chitosan coated alginate beads for the survival of microencapsulated Lactobacillus plantarum in pomegranate juice / S. Nualkaekul, D. Lenton, M.T. Cook et al. // Carbohydr. Polym. 2012, 90, 1281–1287.
- Doherty S.B. Application of whey protein micro-bead coatings for enhanced strength and probiotic protection during fruit juice storage and gastric incubation / S.B. Doherty, M.A. Auty, C. Stanton et al. // J. Microencapsul. 2012, 29, 713–728.
Список литературы на английском языке / References in English
Разработан метод иммобилизации бактериальных клеток Erwinia rhapontici ‒ продуцентов фермента изомальтулозосинтазы в структуру поли-N-винилпирролидона. Установлено, что активность иммобилизованных клеток сопоставима со значением таковой нативных клеток. Определены оптимальные параметры процесса иммобилизации.

Факультативно-анаэробные бактерии Erwinia rhapontici являются продуцентами высокоактивного фермента изомальтулозосинтазы, катализирующего реакцию изомеризации сахарозы в изомальтулозу ‒ природный заменитель сахара [1, 2]. Изомальтулоза отличается рядом преимуществ по сравнению с известными сахарозаменителями, а именно: имеет чистый сладкий вкус, низкую калорийность
(2,0 ккал/г), низкий гликемический индекс (32 единицы), некариогенна, обладает пребиотическим действием, устойчива к изменениям температуры и рН. За рубежом изомальтулоза широко применяется в пищевой и фармацевтической промышленности как заменитель сахарозы. В России разработаны концептуальные аспекты биотехнологии изомальтулозы с помощью фермента бактериального происхождения [3, 4].
С целью разработки конкурентоспособной технологии натурального сахарозаменителя целесообразным является исследование процесса иммобилизации бактериальных клеток Erwinia rhapontici. Известно, что использование иммобилизованных клеток в биокаталитических системах имеет много преимуществ, которые обеспечивают высокую экономичность и эффективность применяемых технологий. Так, разработка метода иммобилизации клеток с целью получения изомальтулозы позволит интенсифицировать процесс трансформации сахарозы, использовать фермент многократно, увеличить его исходную активность, увеличить выход изомальтулозы, а также снизить энергетические затраты процесса.
В настоящей работе представлены результаты исследования условий иммобилизации бактериальных клеток Erwinia rhapontici в структуру поли-N-винилпирролидона. Интерес к данному полимеру вызван тем, что поли-N-винилпирролидон способен осаждаться из водных растворов в физиологическом интервале температур (32-37°С). Также следует отметить его биосовместимость, нетоксичность, способность растворяться в воде и большинстве органических растворителей, способность к комплексообразованию. Указанные свойства позволяют применять поли-N-винилпирролидон для иммобилизации ферментов и живых клеток.
Цель исследования ‒ изучение процесса иммобилизации бактериальных клеток Erwinia rhapontici ‒ продуцентов фермента изомальтулозосинтазы в структуру поли-N-винилпирролидона.
Материал и методы исследования
Динамику биотрансформации сахарозы изучали при оптимальных условиях для работы фермента изомальтулозосинтазы ‒ рН 6,0, температура 30°С в течение 3-4 ч.
Для изучения влияния рН и температуры на активность изомальтулозосинтазы иммобилизованных клеток трансформацию сахарозы осуществляли в интервале рН 4,0-8,0 и температуры 20-40°С соответственно. Заданное значение рН субстрата поддерживали с помощью ацетатного буфера в зоне рН 4,0-5,0 и фосфатного в зоне рН 6,0-8,0.
Результаты исследования и их обсуждение
В результате проведенных исследований разработан метод иммобилизации бактериальных клеток Erwinia rhapontici в структуру поли-N-винилпирролидона. Метод основан на взаимодействии раствора полимера в ацетатном буфере (рН 6,0) с водной дисперсией живых клеток.
Из литературных данных следует, что иммобилизацию живых клеток и ферментов на полимерные носители следует проводить при низких концентрациях полимера [6]. Использование концентрированных растворов приводит к блокированию активных центров ферментов и, следовательно, к утрате их активности. Нами проводилось исследование процесса иммобилизации бактериальных клеток в полимерный носитель при концентрациях последнего в области 0,025-0,35 мас. %.
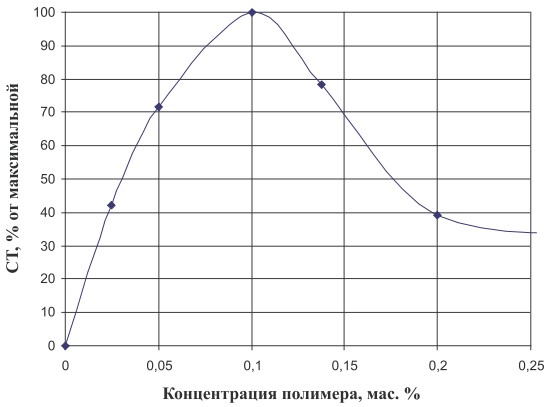
Рис. 1. Эффективность процесса иммобилизации бактериальных клеток в зависимости от концентрации полимера. СТ ‒ степень трансформации сахарозы
Как видно из рис. 1, увеличение концентрации полимера приводило к заметному снижению активности иммобилизованных клеток. Оптимальной концентрацией является 0,1 мас. %. При этой концентрации полимерные клубки находятся в индивидуальном состоянии, что способствует лучшему их взаимодействию с бактериальными клетками. В случае исследования более концентрированных растворов полимера последние находятся в виде агрегатов клубков, и клетка помещается в агрегат. Это приводит к снижению активности фермента изомальтулозосинтазы. Концентрация клеток по отношению к концентрации полимера составляла 1:1 по массе.
С целью определения продолжительности процесса иммобилизации клеток смесь выдерживали в течение 4-5 ч и контролировали активность фермента изомальтулозосинтазы через определенные промежутки времени. Установлено, что максимальный выход изомальтулозы (92-95 %) наблюдался при условии продолжительности контакта бактериальных клеток с носителем в течение 3 ч. Кроме этого, изучено влияние температуры и рН на процесс иммобилизации (рис. 2 а, б).
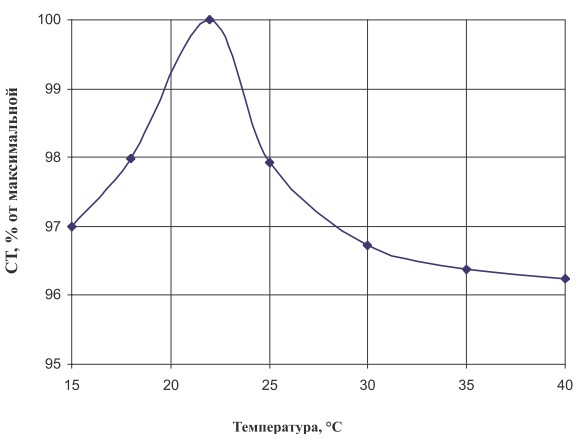
Рис. 2 а. Зависимость эффективности процесса иммобилизации от температуры
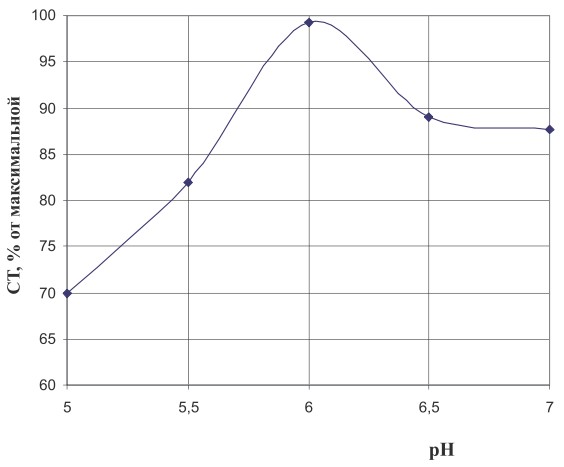
Рис. 2 б. Влияние кислотности среды на процесс иммобилизации бактериальных клеток
Как видно из рисунков, оптимальными условиями являются температура 22°С и рН 6,0 соответственно. Исследование активности фермента показало, что при данных значениях температуры и рН выход изомальтулозы был максимальным.
Следующим этапом работы явилось изучение влияния молекулярной массы поли-N-винилпирролидона на процесс иммобилизации бактериальных клеток. Исследования показали, что оптимально иммобилизация протекает при молекулярном весе полимера 500 кДа (рис. 3). Предположительно, именно при данном значении молекулярной массы поли-N-винилпирролидона происходит взаимодействие отрицательно заряженной мембраны клетки и положительно заряженных протонов в гидратной оболочке макромолекулы полимера.
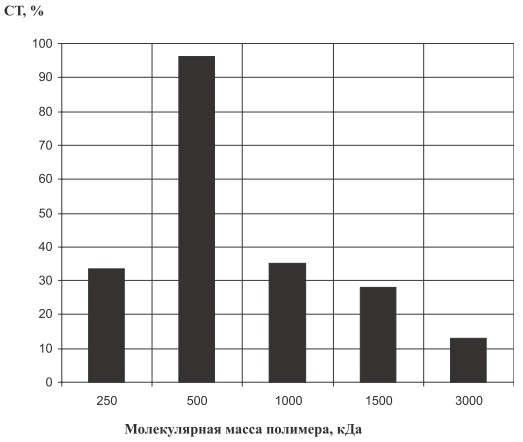
Рис. 3. Влияние молекулярной массы поли-N-винилпирролидона на процесс биотрансформации. СТ ‒ степень трансформации сахарозы
Выводы и заключение
В результате проведенных исследований изучено влияние физико-химических параметров на процесс иммобилизации бактериальных клеток Erwinia rhapontici с целью получения природного сахарозаменителя. Установлено, что выход изомальтулозы достигает максимального значения при концентрации полимера 1 мг/см3, молекулярном весе 500 кДа, температуре 22 °С, рН 6,0, продолжительности 3,0 ч.
Полученные данные в дальнейшем будут положены в основу биотехнологии изомальтулозы в промышленных масштабах.
Список литературы
- Kawaguti H.Y. Application of response surface methodology for glucosyltrasferase production and conversion of sucrose into isomaltulose using free Erwinia sp. cells / H.Y. Kawaguti, E. Manrich, H.H. Sato // Electronic J. Biotechnology. ‒ 2006. ‒ V. 9, №5. ‒ P. 482-493.
- Klebsiella singaporensis sp. a novel isomaltulose-producing bacterium / X. Li [et al.] // Int. J. Syst. Evol. Microbiol. ‒ 2004. ‒ V. 54. ‒ P. 2131-2136.
- Корнеева О.С. Биотехнология изомальтулозы ‒ природного заменителя сахара с пребиотическими свойствами / О.С. Корнеева, О.Ю. Божко, Г.П. Шуваева // Биотехнология. ‒ 2008. ‒ № 2. ‒ С. 46-50.
- Корнеева О.С. Физиолого-биохимические свойства бактерий Erwinia rhapontici ‒ продуцентов изомальтулозосинтазы / О.С. Корнеева, О.Ю. Божко, З.М. Мангуева // Прикладная биохимия и микробиология. ‒ 2008. ‒ Т. 44, № 6. ‒ С. 626-631.
- Somogyi M.J. Determination of reducing sugar // J. Biol. Chem. ‒ 1952. ‒ V. 195. ‒ P. 19-23.
- Кирш Э.Ю. Поли-N-винилпирролидон и другие поли-N-виниламиды. Синтез и физико-химические свойства. ‒ М.: Наука, 1998. ‒ 252 с.
Рецензенты:
Читайте также:

