Современные представления о строении атома реферат
Обновлено: 05.07.2024
Зарождение теории строения вещества Атомистическая теория — современная теория строения вещества — зародилась еще в Древней Греции. Древнегреческие мыслители интересовались на первый взгляд отвлеченным вопросом: можно ли делить вещество бесконечно на все меньшие и меньшие части, или же оно состоит из некоторых неделимых частиц, не поддающихся дальнейшему делению? Основное направление мысли… Читать ещё >
Современные представления о строении атома ( реферат , курсовая , диплом , контрольная )
Содержание
- 1. Зарождение теории строения вещества
- 2. Атомистическая теория Дальтона
- 3. Ядерная модель строения атома
- 4. Состав атомных ядер
- 5. Квантовая (волновая) механика. Характеристика поведения электронов в атомах
- 6. Современные представления о строении атома
- 7. Форма электронных облаков
- Литература
Даже если было бы доказано, что материя имеет атомное строение, возник бы вопрос, чем отличаются друг от друга атомы различных веществ. Лукреций считал, что у атомов и веществ, имеющих горький вкус, на поверхности есть зазубринки, которые царапают язык, тогда как атомы веществ с приятным вкусом должны иметь гладкую поверхность. Атомистические представления о природе веществ не намного продвинулись вперед за последующие 18 веков, прошедших со времен Лукреция. Научная мысль в Европе много веков находилась под влиянием философских идей Платона и Аристотеля, которые не разделяли атомистических воззрений на природу материи. И хотя об атомистических представлениях время от времени вспоминали, в прежние времена сторонники любой конкретной теории строения материи искали подтверждения своих взглядов главным образом в интуиции. Однако и на протяжении этого долгого периода медленно, с перерывами, шла экспериментальная работа. Часто ею двигали ошибочные взгляды: например, алхимики считали, что простые металлы, наподобие свинца, можно превратить в драгоценные металлы. Тем не менее накапливались сведения о том, как химические вещества реагируют друг с другом, и разрабатывались более количественные методы изучения химических реакций. Это подготовило почву для новых, более содержательных формулировок в рамках атомистической теории.
2. Атомистическая теория Дальтона Джон Дальтон (1766 — 1844) большую часть своей жизни преподавал в школе и колледже в Манчестере. Возможно потому, что сам Дальтон не был химиком, он подошел к ее проблемам с иных позиций, чем химики его времени. Его атомистическая теория, опубликованная в период 1803—1807 гг., прочно основывалась на экспериментальных наблюдениях. Она оказалась столь успешной, что с этого времени заняла господствующее положение в науке и почти не потребовала дальнейшего пересмотра.
Основные постулаты теории Дальтона заключались в следующем:
Каждый элемент состоит из чрезвычайно мелких частиц, называемых атомами.
3. Атомы различных элементов обладают разными свойствами, в том числе имеют разные массы.
4. Атомы одного элемента не превращаются в атомы других элементов в результате химических реакций; атомы не создаются и не разрушаются в химических реакциях.
5. Соединения образуются в результате комбинации атомов двух или нескольких элементов.
6. В данном соединении относительные количества атомов разных сортов и сорта этих атомов всегда постоянны.
Теория Дальтона позволяет мысленно нарисовать картину строения материи. Мы представляем себе элемент состоящим из мельчайших частиц, называемых атомами. Атомы являются основными структурными единицами материи, это мельчайшие частицы элемента, которые могут соединяться с другими элементами. Соединения состоят из атомов двух или нескольких элементов, образующих определенные сочетания друг с другом.
А́том (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Файлы: 1 файл
xe.doc
Введение: определение атома
Основная часть: современные представления о строении атома
Заключение: немного об ученых
А́том (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
История представлений о строении атома
Впервые понятие “атом” (неделимый) было введено греческим философом Демокритом в V веке до нашей эры. Он утверждал, что атомы существуют вечно; они настолько малы, что их размеры не поддаются измерению; все атомы одинаковы, но они различаются внешне (атомы воды, например, гладкие, они способны перекатываться, и поэтому жидкости свойственна текучесть; атомы железа имеют зубчики, которыми они зацепляются друг за друга, что придает железу свойства твердого тела). Представления Демокрита были умозрительными и мало полезными.
В начале нглийский химик и физик Д. Дальтон вновь предположил, что вещества состоят из мельчайших частиц - атомов. Он установил, что атомы одного и того же химического элемента имеют одинаковые свойства, а разным элементам соответствуют разные атомы. Введена важнейшая характеристика атома - атомная масса. Атом также считался неделимой частицей.
Однако со временем эпериментальные доказательства сложной структуры атома: фотоэффект (явление, когда при освещении некоторых металлов с их поверхности испускаются носители электрического заряда), катодные лучи (поток отрицательно заряженных частиц - электронов из катода в вакуумированной трубке, содержащей катод и анод), рентгеновские лучи (электромагнитное излучение, подобное видимому свету, но с гораздо более высокой частотой, испускаемое веществами при сильном воздействии на них катодных лучей), радиоактивность (явление самопроизвольного превращения одного химического элемента в другой, сопровождающееся испусканием электронов, положительно заряженных частиц, других элементарных частиц и рентгеновского излучения).
Таким образом, было установлено, что атомы состоят из отрицательно и положительно заряженных частиц, сильно взаимодействующих между собой. Возник вопрос, как же устроен атом?
Современные представления о строении атома.
Подтверждённая экспериментально в 1927 г. двойственная природа электрона, обладающего свойствами не только частицы, но и волны, побудила учёных к созданию новой теории строения атома, учитывающей оба этих свойства. Современная теория строения атома опирается на квантовую механику.
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), а с другой — его движение напоминает волну и может быть описано определённой амплитудой, длиной волны, частотой кол***ий и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона — можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства.
Cледовательно, под электронной орбитой следует понимать не определённую линию перемещения электрона, а некоторую часть пространства вокруг ядра, в пределах которого вероятность пребывания электрона наибольшая. Иными словами, электронная орбита не характеризует последовательность перемещения электрона от точки к точке, а определяется вероятностью нахождения электрона на определённом расстоянии от ядра. В связи с этим электрон представляют не в виде материальной точки, а как бы "размазанным" по всему объёму атома в виде так называемого электронного облака, имеющего области сгущения и разрежения электрического заряда. Представление об электроне как о некотором облаке электрического заряда удобно; оно довольно точно передаёт особенности поведения электрона. Однако следует иметь в виду, что электронное облако не имеет резко очерченных границ, и даже на большом расстоянии от ядра существует вероятность пребывания электрона. Для характеристики формы электронного облака понятие орбиталь вместо понятия орбита было введено именно для того, чтобы не смешивать движение электрона с движением тела в классической физике. Однако при упрощённом рассмотрении строения атома иногда сохраняют термин орбита, помня тем не менее об особом характере движения электрона в атоме.
По современным представлениям состояние элетрона в атоме описывается четырьмя квантовыми числами. Главное квантовое число n характеризует величину энергии электрона и может принимать только положительные целочисленные значения: 1, 2, 3 и т. д. С увеличением главного квантового числа энергия электрона возрастает. Состояние электрона, отвечающее определённому значению главного квантового числа, называют энергетическим уровнем электрона в атоме. Помимо энергии электрона главное квантовое число определяет размеры электронного облака: чем выше значение главного квантового числа, тем больше электронное облако. Электроны, характеризующиеся одним и тем же квантовым числом, имеют электронные облака приблизительно одинаковых размеров. Поэтому говорят о существовании в атоме электронных слоёв. Электронные слои обозначают большими буквами латинского алфавита K, L, M, N, O, причём K-слой является первым от ядра атома, ему соответствует главное квантовое число n = 1, L-слой — вторым, M-слой — третьим и т. д. Электроны, образующие данный слой, могут обладать несколько отличающейся друг от друга энергией и иметь орбитали различных форм. Из квантовомеханической теории следует, что с увеличением главного квантового числа n изменяются число и характер электронных орбиталей в пределах данного электронного слоя. Количество орбиталей для каждого значения n равно квадрату главного квантового числа (n2).
Второе квантовое число l, описывающее форму электронного облака, называется орбитальным квантовым числом. При данном главном вантовом числе n орбитальное квантовое число l может принимать любые целочисленные значения от 0 до n–1. Соответствующие орбитали обозначаются строчными буквами латинского алфавита: s (l = 0), p (l = 1), d (l = 2), f (l = 3). Орбитальное квантовое число отображает энергию электрона на подуровне. Электроны с различными орбитальными квантовыми числами несколько отличаются друг от друга: их энергия тем выше, чем больше число l. Число возможных подуровней в каждом энергетическом уровне совпадает с порядковым номером электронного слоя, но фактически ни один энергетический уровень не содержит больше четырёх подуровней. Это справедливо для стационарного состояния атомов всех элементов. Так, первому энергетическому уровню соответствует s-подуровень; второму уровню — два подуровня: s и p; третьему уровню — три подуровня: s, p и d; четвёртому и следующим уровням —четыре подуровня: s, p, d и f.
Ориентацию орбиталей в пространстве определяет третье квантовое число, называемое магнитным квантовым числом и обозначаемое m. При данном орбитальном квантовом числе l магнитное квантовое число m может принимать любые целочисленные значения от –l до +l, в том числе нулевое значение. Оно определяет число орбиталей в одном и том же электронном слое: одна s-орбиталь (m = 0), три p-орбитали (m равно –1, 0, +1), пять d-орбиталей (m равно –3, –2, –1, 0, +1, +2, +3). Орбитали с различными магнитными квантовыми числами, но с одинаковым главным и орбитальным квантовыми числами характеризуются одной и той же энергией. Магнитное квантовое число есть вектор, следовательно, ему соответствует не только определённое числовое значение, но и определённое направление, что выражается в знаках "+" и "–".
Четвёртое квантовое число, называемое спином и обозначаемое ms, раньше связывали с вращением электрона вокруг своей оси, но теперь ему не придают какого-либо наглядного образа и считают чисто квантовомеханической величиной. Спин электрона может иметь два значения: +1/2 и –1/2.
Строение атомного ядра. Субатомные частицы. Элементы. Изотопы.
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот – захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона. Плотность вещества в ядре фантастически велика – порядка 1013 - 1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн!
Внешние размеры атома – это размеры гораздо менее плотного электронного облака, которое примерно в 100000 раз больше диаметра ядра.
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона. Вместе протоны и нейтроны называются нуклонами (от латинского nucleus – ядро).
Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами. Их заряды и массы в кг и в специальных “атомных” единицах массы (а.е.м.) показаны в таблице 1.
Согласно современным представлениям, атом состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов. Ядро образовано двумя видами элементарных частиц — положительно заряженными протонами р + и незаряженными нейтронами n 0 , вместе они называются нуклонами. Число нуклонов в ядре атома равно массовому числу А:

Число протонов в ядре равно атомному (порядковому) номеру Z химического элемента в Периодической системе элементов Д.И. Менделеева. Следовательно, положительный заряд ядра определяется атомным номером элемента. Поскольку атом в целом электронейтрален, то число электронов в атоме равно числу протонов в атомном ядре:

Практически вся масса атома сосредоточена в ядре, так как масса электронов чрезвычайно мала (mэ ≈ 1/2000 mр+).
Все атомы одного и того же элемента, имея один и тот же заряд ядра, могут отличаться по массе. Разновидности атомов одного и того же химического элемента, различающиеся по массе, называются изотопами. Различие в массе связано с различным числом нейтронов в ядре. Так, водород имеет 3 изотопа, которые обозначаются так:

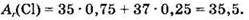
где заряд ядра указан слева внизу, а массовое число — слева вверху. Ядро самого легкого изотопа (протия) не содержит нейтронов, ядро дейтерия содержит 1 нейтрон, ядро трития — 2 нейтрона. Приведенные в Периодической системе значения атомных масс элементов учитывают содержание всех изотопов данного элемента в природе. Так, элемент хлор представлен в природе двумя изотопами: 17 35 Cl (примерно 75%) и 17 37 Cl (примерно 25%). Отсюда атомная масса природного хлора равна:
Область околоядерного пространства, в которой вероятность нахождения электрона наиболее высока, называют атомной орбиталью. Каждой атомной орбитали отвечает своя форма электронного облака. Известны s, р, d и f-атомные орбитали; так же называются и электроны, занимающие эти орбитали. Электронное облако s-орбитали имеет сферическую симметрию, р-электронные облака (рис. 1) напоминают вытянутую объемную восьмерку, форма d-облаков более сложная.

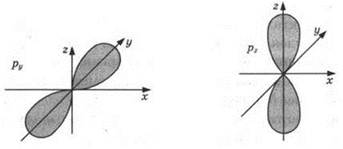
Рис. 1. s- и р-орбитали
Изучение атомных спектров показало, что электроны в атоме обладают разным запасом энергии, распределяясь по отдельным энергетическим уровням и подуровням. Энергетические уровни (или электронные оболочки) обозначают цифрами или латинскими буквами (табл. 1)

Каждый энергетический уровень включает в себя электроны с близкой энергией и состоит из нескольких энергетических подуровней, которые состоят из электронов с одинаковой энергией. Число подуровней в уровне равно номеру данного уровня. Так, первый уровень состоит всего из одного подуровня, обозначаемого 1s-подуровень. Второй уровень состоит из двух подуровней — 2s и 2р. Третий уровень включает в себя три подуровня — 3s, 3р и 3d. Четвертый подуровень включает в себя четыре подуровня — 4s, 4р, 4d и 4f. Электроны на ближайшем к ядру энергетическом уровне (n = 1) обладают наименьшей энергией. По мере увеличения номера уровня запас энергии электронов возрастает. Для данного энергетического уровня энергия s-подуровня наименьшая, а энергия f-подуровня — наибольшая:

Любой из s-подуровней включает в себя одну s-атомную орбиталь, р-подуровень включает три р-орбитали, d-подуровень содержит пять d-орбиталей.
Электронная конфигурация показывает распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям. Электронная конфигурация составляется в соответствии с принципом минимума энергии: вначале электронами заполняются атомные орбитали с наименьшей энергией, расположенные ближе к ядру.
Экспериментально установлено, что атомные орбитали заполняются электронами в следующем порядке:

Составляя электронную формулу атома, сначала цифрой указывают номер энергетического уровня, затем буквой (s, р, d, f) обозначают подуровень и, наконец, указывают число электронов на данном подуровне (верхний индекс). Так, запись 1s2 означает, что на 1s-подуровне находятся два электрона.
Для составления электронной формулы любого атома достаточно знать порядковый номер элемента в Периодической системе (это дает число электронов в атоме), номер периода (указывает на число энергетических уровней, заполняющихся электронами) и приведенную выше последовательность заполнения атомных орбиталей электронами.
Первый период содержит два элемента — водород и гелий. Атом водорода имеет один электрон, а атом гелия — два электрона, располагающихся на 1s-подуровне, что записывается электронными формулами:

Второй период начинается элементом литием и заканчивается неоном. Он включает 8 элементов. Все электроны в атомах элементов второго периода располагаются на двух энергетических уровнях:
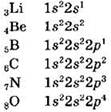
Третий период включает 8 элементов: 2 — s-элемента и 6 p-элементов. Все электроны в атомах элементов третьего периода располагаются на трех энергетических уровнях.

Однако следует помнить, что число элементов, у которых электроны располагаются на трех энергетических уровнях, равно 18.
Четвертый период начинается, как и другие периоды, с s-элементов — калия и кальция, в атомах которых происходит заполнение электронами 4s-орбиталей. И только после заполнения 4s-оболочки происходит заполнение вакантной 3d-оболочки. Первый 3d-электрон появляется в атоме скандия:

(сначала заполняется 4s-подуровень, а записывается в электронной формуле сначала 3d-подуровень).
Скандий и последующие элементы называются 3d-элементами, всего их десять (так как на пяти d-орбиталях может максимально разместиться 10 электронов), d-элементы наряду с f-элементами относятся к так называемым переходным элементам, которые всегда располагаются в побочных подгруппах Периодической системы.
Электронные конфигурации переходных элементов четвертого периода:
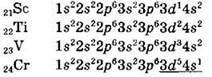

Обратите внимание на электронные конфигурации атомов хрома и меди. Вместо конфигурации 3d 4 4s 2 атом хрома имеет конфигурацию 3d 5 4s 1 . Это связано с переходом одного из 4s-электронов на 3d-подуровень вследствие близости энергий 4s и 3d-подуровней, что приводит к повышенной устойчивости наполовину заполненной d-оболочки. Аналогичный “провал электрона” имеет место и в атоме меди, что также связано с повышенной устойчивостью полностью заполненной d-оболочки.
Мы рассмотрели электронные конфигурации атомов, находящихся в основном состоянии. Основное состояние — самое устойчивое, в нем атом может находиться бесконечно долго. Кроме основного состояния, существуют и возбужденные состояния атома. Сообщив атому небольшую энергию, можно перевести электрон на соседнюю вакантную орбиталь того же уровня или даже уровень с большей энергией. В возбужденном состоянии атом может находиться ничтожно малое время, не больше 10-8 с, после чего вновь переходит в устойчивое основное состояние.

Современные представления о строении атома
Элемент ЕГЭ: 1.1 Современные представления о строении атома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов.
Современные представления о строении атома

Атом – химически неделимая электронейтральная частица, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Атомы не имеют заряда (нейтральны). Если атом присоединяет один или несколько электронов, он приобретает отрицательный заряд и превращается в анион. Если атом теряет один или несколько электронов, он приобретает положительный заряд и превращается в катион. Заряд иона указывают арабской цифрой и знаком после символа атома.
Состав ядра: А = Z + N, где А — массовое число; Z — протонное число (число протонов); N — число нейтронов.
Элементарные частицы
Порядковый номер элемента в периодической системе:
- Заряд ядра атома
- Число протонов в ядре атома
- Число электронов в атоме

Нуклиды – разновидности атомов с фиксированным массовым числом А, числом протонов Z и нейтронов N в ядре.

Основные положения квантовой теории строения атома:
- Дискретность энергии электрона
- Двойственная (корпускулярно-волновая) природа электрона
- Невозможность определения траектории электрона (принцип неопределенности)
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы изотопа углерода 12 С.

Атомные орбитали
Орбиталь — пространство вокруг ядра, в котором нахождение электрона наиболее вероятно (вероятность более 90%)

Порядок заполнения орбиталей в основном состоянии
1) Принцип наименьшей энергии. Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.


2) Принцип Паули. На каждой орбитали могут находиться не более двух электронов, причём спины их противоположны.
Спин электрона — свойство электрона, характеризующее его способность взаимодействовать с магнитным полем. Может принимать два значения (положительное и отрицательное).

Последовательность заполнения орбиталей электронами в основном состоянии:
Энергетические уровни и подуровни

Элементы, у которых идет заполнение s-подуровня, называют s-элементами.
Элементы, у которых заполняется р-подуровень, называют р-элементами.
Элементы, у которых заполняется d-подуровень, называют d-элементами.
Элементы, у которых заполняется f-подуровень, называют f-элементами.
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровням
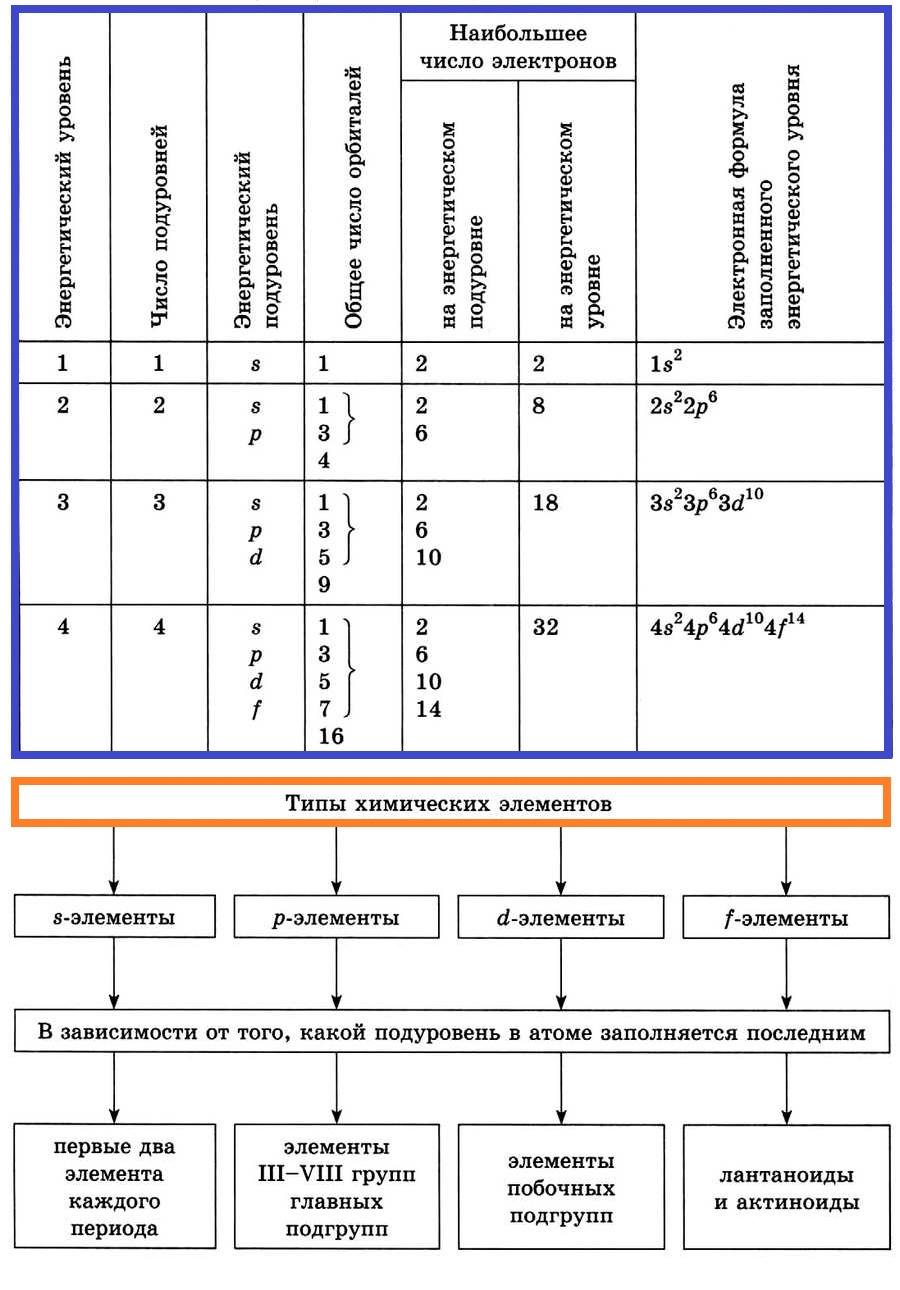
Электроны, относящиеся к последнему энергетическому уровню, называют внешними (валентными) электронами.
Строение электронных оболочек атомов первых четырёх периодов
Распределение электронов по орбиталям атома называют электронной конфигурацией атома, или электронной формулой.
Строение элементов первого периода

Строение элементов второго периода

Строение элементов третьего периода

Строение элементов четвёртого периода

Основное и возбуждённое состояние атомов
Наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальна, называется основным состоянием атома. Любые другие состояния атома называют возбужденными состояниями.

Для возможности перехода атома в возбуждённое состояние необходимо выполнение одновременно двух условий:
- наличие спаренных электронов;
- наличие вакантных орбиталей.

Читайте также:

