Современные иммунобиотехнологические вакцины реферат
Обновлено: 06.07.2024
Иммунобиотехнология- наука о защитных реакциях организма, направленных на сохранение его структурной и функциональной целостности и биологической индивидуальности. Иммунология — быстро развивающаяся дисциплина широкого биологического профиля, выросшая как отрасль медицинской микробиологии. Теоретические направления в Иммунобиотехнологии — изучение на клеточном и молекулярном уровне механизма образования антител, их патогенетической роли, филогенеза и онтогенеза иммунной системы — всё чаще объединяют термином иммунобиология.
Прикрепленные файлы: 1 файл
История развития иммунобиотехнологии.docx
Иммунобиотехнология- наука о защитных реакциях организма, направленных на сохранение его структурной и функциональной целостности и биологической индивидуальности. Иммунология — быстро развивающаяся дисциплина широкого биологического профиля, выросшая как отрасль медицинской микробиологии. Теоретические направления в Иммунобиотехнологии — изучение на клеточном и молекулярном уровне механизма образования антител, их патогенетической роли, филогенеза и онтогенеза иммунной системы — всё чаще объединяют термином иммунобиология.
Иммунология берёт своё начало из следующего наблюдения: люди, перенёсшие заразное заболевание, обычно могут без опасности для себя ухаживать за больными во время эпидемий данного заболевания. В 1796 Э. Дженнер разработал способ искусственной иммунизации против оспы путём заражения человека коровьей оспой. Начало И. как самостоятельной науке положило открытие Л. Пастера (1880), обнаружившего, что иммунизация кур старой холерной культурой создаёт у них устойчивость к заражению высоковирулентным возбудителем куриной холеры. Пастер сформулировал основной принцип создания вакцин и получил вакцины против сибирской язвы и бешенства. И. И.Мечников (1887) открыл феномен Фагоцитоза и создал клеточную (фагоцитарную) теорию иммунитета. К 1890 работами немецкого бактериолога Э. Беринга и его сотрудников было показано, что в ответ на введение микробов и их ядов в организме вырабатываются защитные вещества — Антитела. Немецкий учёный П. Эрлих (1898, 1900) выдвинул гуморальную теорию иммунитета. В 1898—99 бельгийский учёный Ж. Борде и русский учёный Н. Н. Чистович обнаружили образование антител в ответ на введение чужеродных эритроцитов и сывороточных белков. Это открытие положило начало неинфекционной И. В 1900 австрийский иммунолог К. Ландштейнер открыл Группы крови человека и создал основу учения о тканевых изоантигенах .Новое, предсказанное австралийским учёным Ф. Бёрнетом направление в иммунологии — учение об иммунологической толерантности — возникло после экспериментального воспроизведения этого феномена английским учёным П. Медаваром (1953).
Начало отечественной И. положили работы И. И. Мечникова, А. А. Безредки, Г. Н. Габричевского, Н. Ф. Гамалеи, Л. А. Тарасевича. Советская И. 20—30-х гг. наряду с решением практических вопросов плодотворно занималась теоретическими исследованиями (работы И. Л. Кричевского, В. А. Барыкина, В. А. Любарского, С. И. Гинзбург-Калининой). В 40—60-е гг. проблемы И. успешно решались под руководством Л. А. Зильбера, П. Ф. Здродовского, Г. В. Выгодчикова, М. П. Покровской, В. И. Иоффе, А. Т. Кравченко, П. Н. Косякова и др.
Иммунобиотехнология развивается очень быстрыми темпами, особенно на стыках с химией, генетикой, физиологией, радиобиологией и др. отраслями биологии и медицины. Иммунология состоит из ряда более или менее четко определившихся направлений. Иммуноморфология изучает анатомию, гистологию и цитологию иммунной системы организма. В ней используются гистологические и цитологические методы исследования, культивирование клеток вне организма, световая, флуоресцентная и электронная микроскопия, авторадиография и др. В последние годы весь процесс первичного иммунного ответа лимфоидных клеток удалось воспроизвести в пробирке. Установлено, что специфический иммунный ответ, а отчасти и естественная устойчивость организма обеспечиваются функцией его лимфоидной системы и рассеянных по всем тканям фагоцитирующих клеток .Свойством захватывать антиген обладают нейтрофильные и эозинофильные гранулоциты, моноциты и тромбоциты в крови; гистиоциты в соединительной ткани; микроглия в мозге; синусные клетки печени, селезёнки, надпочечников, костного мозга и передней доли гипофиза; ретикулярные клетки селезёнки, лимфатических узлов, костного мозга, тимуса (вилочковой, или зобной, железы) и небольшая часть циркулирующих лимфоцитов. Основная масса введённого во внутреннюю среду организма антигена захватывается, разрушается и устраняется этими клетками. Лишь доли процента антигенных молекул сохраняются долгое время, вызывая специфические иммунологические реакции. Особо важную роль приписывают тем молекулам антигена, которые оседают на поверхности ретикулярных клеток в лимфатических узлах. Иммунный ответ происходит при взаимодействии, по крайней мере, двух типов малых лимфоцитов ,которые постоянно мигрируют в тканях, циркулируя по лимфатическим и кровеносным путям.
Клетки одного типа (В-клетки) происходят из костного мозга и при встрече с антигеном превращаются в клетки, образующие антитела (плазматические клетки). Клетки другого типа (Т-клетки) происходят из тимуса. Им свойственна способность специфически реагировать на антигенные молекулы и обеспечивать взаимодействие В-клеток с антигеном.
Сравнительная иммунология изучает иммунный ответ у разных видов животных. Эволюционное толкование явлений иммунитета помогает выяснить их механизмы. Лимфоидная система и способность к образованию специфических антител впервые появляются только у позвоночных. Например, морская минога имеет примитивный лимфоэпителиальный тимус, лимфоидные островки в селезёнке и костном мозге и циркулирующие лимфоциты; у неё образуются антитела и возникает иммунологическая память, но ассортимент антигенов, на которые отвечает минога, очень ограничен. У примитивных хрящевых рыб (акул, скатов) лимфоидная система более развита; они способны реагировать на большее число антигенов. Типичные плазматические клетки появляются у хрящевых, лучепёрых и костистых рыб. У этих животных вырабатывается несколько типов иммуноглобулинов. У земноводных впервые в филогенетическом ряду образуется система плазматических клеток, синтезирующих высоко- и низкомолекулярные иммуноглобулины, различающиеся по антигенным свойствам. Весьма похожая система имеется у пресмыкающихся. Система Комплемента (состоящая из различных белков нативной сыворотки), по-видимому, очень древняя, так как в сходной форме имеется как у низших, так и у высших позвоночных.
У большинства млекопитающих иммунные реакции развиваются в полной мере только после рождения. Во время эмбрионального развития, когда зародыш защищен от действия антигенов, функционирует система избирательного переноса иммуноглобулинов от матери к плоду. Однако к 4—5 месяцам плод человека самостоятельно образует иммуноглобулины М и G. Птицы и млекопитающие, в том числе человек, обладают одинаковым спектром иммунологических реакций. Степень иммунореактивности связана с возрастом и заметно снижается по мере старения организма.
3.Теория иммунологических реакций
Физиология иммунных реакций изучает также факторы, регулирующие количественные характеристики иммунного ответа, в том числе роль нервной системы ( преимущественно гипоталамуса), гормонов, возраста, питания, состояния организма (в частности, степени утомления) и внешних воздействий. Теперь известно, что не только гормоны гипофиза и надпочечников могут изменять иммунологическую реактивность, но и плацента выделяет особый гормон, который в значительной степени тормозит иммунные реакции организма матери на антигены плода.
Иммунопатология изучает не только чрезмерные или повреждающие организм иммунные реакции, но и заболевания, сопровождающиеся дефектами иммунной системы: наследственные и приобретённые агаммаглобулинемии и иммуноглобулинопатии при опухолях лимфо-ретикулярной ткани, при нефрозах, после применения цитостатических лекарственных препаратов и после облучения. В иммунопатологии особое внимание уделяется методам торможения и стимуляции иммунного ответа. Усиление иммунного ответа неспецифическими стимуляторами (так называемыми адъювантами) или трансплантацией активных лимфоидных тканей перспективно при инфекционных заболеваниях и при дефектах иммунной системы. И наоборот, торможение иммунного ответа — лечебный приём при заболеваниях с чрезмерной или нежелательной активностью иммунной системы. Торможения достигают, повреждая лимфоидные клетки облучением, азотистыми ипритами, антиметаболитами, кортикостероидными гормонами, антилимфоцитарной сывороткой. Иммунный ответ подавляют также пассивным введением антител, например введением матери антирезусных антител для предотвращения гемолитической желтухи новорождённых.
В последние годы интенсивно изучаются реакции организма на клетки и макромолекулы индивидуумов того же или другого вида. Эту отрасль называют неинфекционной иммунологии. Каждый многоклеточный организм обладает некоторыми уникальными, неповторимыми особенностями строения белков и клеточных мембран. Отличие одного индивидуума от другого обусловлено генетическими механизмами. Именно по этой причине введённые в организм извне клетки и молекулы распознаются как чужеродные и вызывают комплекс иммунных реакций, направленных на их удаление. Поэтому, несмотря на самую совершенную хирургическую технику, пересаженные органы и ткани обычно отторгаются, будучи не в состоянии преодолеть барьер тканевой несовместимости; её изучением занимается трансплантационная И. Другой раздел неинфекционной иммунологии. — иммунология опухолей — изучает опухолевые антигены и механизмы распознавания и удаления злокачественно перерожденных клеток. В круг проблем неинфекционной И. входит также разработка способов создания специфической иммунологической толерантности, которые в будущем позволят сделать трансплантацию органов практически применяемым методом лечения всевозможных заболеваний. Получаемые данные служат основой для развития прикладной, клинической И. и таких её основных направлений, как Иммунопрофилактика, Иммуно терапия, Иммунодиагностика.
Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные ( аттенуированные ) вакцины. Дивергентные вакцины.
Вакцины — иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
• цельные микробные тела (живые или убитые);
• отдельные Аг микроорганизмов (наиболее часто протективные Аг);
• токсины микроорганизмов;
• искусственно созданные Аг микроорганизмов;
• Аг, полученные методами генной инженерии.
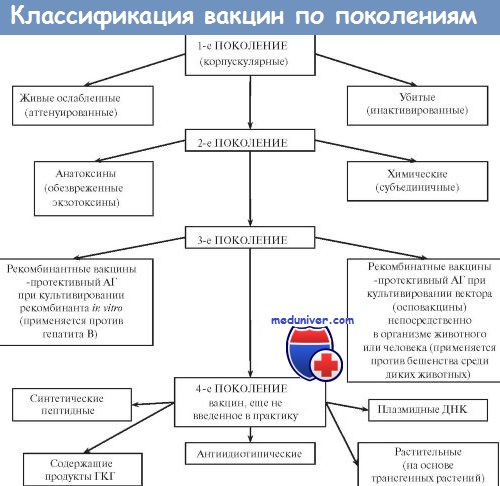
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг — на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям — на моно- и ассоциированные.
Живые вакцины
Живые вакцины — препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин— полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный — риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные ( аттенуированные ) вакцины
Ослабленные (аттенуированные) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин — противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Используя один и тот же плазмидный или вирусный вектор, можно создавать вакцины против различных инфекционных заболеваний, меняя только последовательность, кодирующую необходимые белки-антигены. При этом отпадает необходимость работать с опасными вирусами и бактериями, становится ненужной сложная и дорогостоящая процедура очистки белков. Препараты ДНК-вакцин не требуют специальных условий хранения и доставки, они стабильны длительное время при комнатной температуре.
Уже разработаны и испытываются ДНК-вакцины против инфекций, вызываемых вирусами гепатитов B и C, гриппа, лимфоцитарного хориоменингита, бешенства, иммунодефицита человека (ВИЧ), японского энцефалита, а также возбудителями сальмонеллеза, туберкулеза и некоторых паразитарных заболеваний (лейшманиоз, малярия). Эти инфекции крайне опасны для человечества, а попытки создать против них надежные вакцинные препараты классическими методами оказались безуспешными.
ДНК-вакцинация — одно из самых перспективных направлений в борьбе с раком. В опухоль можно вводить разные гены: те, что кодируют раковые антигены, гены цитокинов и иммуномодуляторов.
Проведя компьютерный (in silico) анализ генома, исследователь получает не только список кодируемых белков, но и некоторые их характеристики, например, принадлежность к определенным группам, возможная локализация внутри бактериальной клетки, связь с мембраной, антигенные свойства.
Третий подход основан на протеомной технологии. Ее методы дают возможность детализировать количественную и качественную характеристики белков в компонентах клетки. Существуют компьютерные программы, которые по аминокислотной последовательности могут предсказать не только трехмерную структуру изучаемого белка, но и его свойства и функции.
Используя эти три метода, можно отобрать набор белков и соответствующие им гены, которые представляют интерес для создания вакцины. Как правило, в эту группу входит около 20-30% всех генов бактериального генома. Для дальнейшей проверки нужно синтезировать и очистить отобранный антиген в количествах, необходимых для иммунизации животных. Очистку белка проводят с помощью полностью автоматизированных приборов. Используя современные технологии, лаборатория, состоящая из трех исследователей, может в течение месяца выделить и очистить более 100 белков.
Важно не только создать вакцину, но и найти наилучший способ ее доставки в организм. Сейчас появились так называемые мукозальные вакцины, которые вводятся через слизистые оболочки рта или носа либо через кожу. Преимущество таких препаратов в том, что вакцина поступает через входные ворота инфекции и тем самым стимулирует местный иммунитет в тех органах, которые первыми подвергаются атаке микроорганизмов.
Терапевтические вакцины
Существующие терапевтические вакцины для лечения хронических воспалительных заболеваний, вызванных бактериями или вирусами, получают классическими методами. Такие вакцины способствуют развитию иммунитета к входящим в их состав микроорганизмам и активизируют врожденный иммунитет.

Одна из важнейших целей разработчиков терапевтических вакцин — ВИЧ-инфекция. Уже проведена серия доклинических и клинических испытаний нескольких препаратов. Их способность вызывать развитие клеточного иммунитета у здоровых людей не вызывает сомнений. Однако убедительных данных о том, что вакцины подавляют размножение вируса у больных, пока нет.
Схема изготовления дендритной вакцины такова: из крови больного выделяют клетки, которые дают начало дендритным клеткам, и размножают их в лабораторных условиях. Одновременно из опухоли пациента выделяют белки-антигены. Дендритные клетки некоторое время выдерживают вместе с опухолевыми антигенами, чтобы они запомнили образ врага, а затем вводят больному. Такая стимуляция иммунной системы заставляет организм активно бороться с опухолью.
У мышей дендритные вакцины помогают предупредить повторное развитие карциномы после удаления опухоли. Это позволяет надеяться, что они будут эффективны для продления безрецидивного периода онкологических больных после хирургического вмешательства.

В мире сложилась тяжелая эпидемиологическая ситуация. Пандемия COVID-19 никуда уходить пока не собирается. Работа над лекарствами и вакцинами идет полным ходом практических во всех странах и Россия не исключение. Разберемся какие есть разработки и технологии на примере вакцин против коронавируса.
Из белков

Большая часть вакцинных препаратов, разрабатываемых для профилактики COVID-19 — субъединичные. Прививки разработанные по этой технологии самые безопасные: ни на одной стадии создания не используется живой вирус, а сама она содержит только вирусные белки. Для формирования полноценного иммунного ответа такие препараты вводятся несколько раз и требуют добавления компонентов, усиливающих иммунный ответ, например адъювантов или иммуностимуляторов.
Из частиц вирусов

Вакцины на основе вирусоподобных частиц также состоят только из вирусных белков, адъювантов и иммуностимуляторов. Для усиления иммунного ответа эти белки собираются в частицы, похожие на вирус. Они безопасны и способны вызывать иммунный ответ, но их создание для массовой вакцинации технологически сложно и дороже.
Из нуклеиновых кислот

ДНК- и РНК-вакцины — препараты на основе нуклеиновых кислот. Создание таких прививок осложняется тем, что технологии доставки генетического материала внутрь клетки организма еще разрабатываются. Это ограничивает использование ДНК- и РНК-вакцин: пока ни один препарат на основе нуклеиновой кислоты не применяется в клинической практике на людях.
С помощью других вирусов
Немалая часть разработок прототипов иммунобиологических препаратов основана на применении вирусных векторов: реплицирующихся — способных размножаться; нереплицирующихся — не способных размножаться. Технология создания этих двух видов одинакова: в геном вирусного вектора встраивается ген, кодирующий целевой белок другого вируса. Вектор — другой вирус, не вызывающий болезнь у человека. Например, для создания вакцины против COVID-19 в аденовирус встраивается ген, кодирующий белок коронавируса. Препятствие при использовании таких препаратов — присутствие у человека антител к вирусному вектору. В этом случае полноценный иммунный ответ может не сформироваться. Выбор вирусного вектора важный и определяющим этап при их разработке. Иммунитет при использовании реплицирующегося вектора формируется, как правило, уже после однократного введения, тогда как для вакцин на основе нереплицирующихся вирусных векторов чаще всего требуется несколько введений препарата.
Проверенные временем
Цельновирионные живые аттенуированные и инактивированные вакцины имеют самую продолжительную историю применения и являются классическими технологическими платформами. Инактивированные содержат нежизнеспособные вирусы, и для формирования иммунного ответа часто требуются повторные введения препарата. Для живых аттенуированных вакцин чаще требуется однократное введение, так как вирус сохраняет возможность размножаться в организме человека. Вирус в аттенуированной вакцине ослаблен, однако есть вероятность возврата к дикому типу, что приведет к вспышке при её использовании. Это приводит к необходимости регулярного проведения исследований по изучению генетической стабильности таких препаратов. Кроме того, технологическое создание вакцин этих типов медленнее в сравнении с производством ДНК- и РНК- или субъединичных вакцин. Кроме этого, при этом особых санитарных норм и требований биологической безопасности.
Где привиться
На данный момент созданные вакцины против коронавируса, к сожалению, доступны не всем. В первую очередь они используются для защиты людей, которые каждый день сталкиваются с вирусом, а также тех чьи профессии связаны с контактом с большим количеством людей, например учителя. Скоро привиться сможет и каждый желающий, а пока можно сделать прививку от гриппа и защитить себя и своих близких.

В мире сложилась тяжелая эпидемиологическая ситуация. Пандемия COVID-19 никуда уходить пока не собирается. Работа над лекарствами и вакцинами идет полным ходом практических во всех странах и Россия не исключение. Разберемся какие есть разработки и технологии на примере вакцин против коронавируса.
Из белков

Большая часть вакцинных препаратов, разрабатываемых для профилактики COVID-19 — субъединичные. Прививки разработанные по этой технологии самые безопасные: ни на одной стадии создания не используется живой вирус, а сама она содержит только вирусные белки. Для формирования полноценного иммунного ответа такие препараты вводятся несколько раз и требуют добавления компонентов, усиливающих иммунный ответ, например адъювантов или иммуностимуляторов.
Из частиц вирусов

Вакцины на основе вирусоподобных частиц также состоят только из вирусных белков, адъювантов и иммуностимуляторов. Для усиления иммунного ответа эти белки собираются в частицы, похожие на вирус. Они безопасны и способны вызывать иммунный ответ, но их создание для массовой вакцинации технологически сложно и дороже.
Из нуклеиновых кислот

ДНК- и РНК-вакцины — препараты на основе нуклеиновых кислот. Создание таких прививок осложняется тем, что технологии доставки генетического материала внутрь клетки организма еще разрабатываются. Это ограничивает использование ДНК- и РНК-вакцин: пока ни один препарат на основе нуклеиновой кислоты не применяется в клинической практике на людях.
С помощью других вирусов
Немалая часть разработок прототипов иммунобиологических препаратов основана на применении вирусных векторов: реплицирующихся — способных размножаться; нереплицирующихся — не способных размножаться. Технология создания этих двух видов одинакова: в геном вирусного вектора встраивается ген, кодирующий целевой белок другого вируса. Вектор — другой вирус, не вызывающий болезнь у человека. Например, для создания вакцины против COVID-19 в аденовирус встраивается ген, кодирующий белок коронавируса. Препятствие при использовании таких препаратов — присутствие у человека антител к вирусному вектору. В этом случае полноценный иммунный ответ может не сформироваться. Выбор вирусного вектора важный и определяющим этап при их разработке. Иммунитет при использовании реплицирующегося вектора формируется, как правило, уже после однократного введения, тогда как для вакцин на основе нереплицирующихся вирусных векторов чаще всего требуется несколько введений препарата.
Проверенные временем
Цельновирионные живые аттенуированные и инактивированные вакцины имеют самую продолжительную историю применения и являются классическими технологическими платформами. Инактивированные содержат нежизнеспособные вирусы, и для формирования иммунного ответа часто требуются повторные введения препарата. Для живых аттенуированных вакцин чаще требуется однократное введение, так как вирус сохраняет возможность размножаться в организме человека. Вирус в аттенуированной вакцине ослаблен, однако есть вероятность возврата к дикому типу, что приведет к вспышке при её использовании. Это приводит к необходимости регулярного проведения исследований по изучению генетической стабильности таких препаратов. Кроме того, технологическое создание вакцин этих типов медленнее в сравнении с производством ДНК- и РНК- или субъединичных вакцин. Кроме этого, при этом особых санитарных норм и требований биологической безопасности.
Где привиться
На данный момент созданные вакцины против коронавируса, к сожалению, доступны не всем. В первую очередь они используются для защиты людей, которые каждый день сталкиваются с вирусом, а также тех чьи профессии связаны с контактом с большим количеством людей, например учителя. Скоро привиться сможет и каждый желающий, а пока можно сделать прививку от гриппа и защитить себя и своих близких.
Читайте также:
- Нормируемые и ненормируемые затраты рабочего времени реферат
- Иноязычная лексика в русском языке последних десятилетий реферат
- Субъективизм направление экономической мысли его особенности и последствия реферат
- Реферат на тему коньки
- Ответственность за нарушения правил миграционного законодательства реферат

