Семичленные гетероциклические соединения реферат
Обновлено: 05.07.2024
Гетероциклические соединения — это вещества, молекулы которых содержат циклы, построенные из атомов разных химических элементов. Обычно такими гетероатомами являются азот, кислород, сера, но могут быть фосфор, кремний, селен, бор и др. Циклы могут быть ароматическими, насыщенными и ненасыщенными.
Гетероциклические соединения чрезвычайно распространены как в животном, так и в растительном мире. Очень многие биологически важные вещества содержат в своём составе гетероциклические фрагменты.
12.1. классификация и номенклатура
по размеру цикла,
по природе гетероатома,
по числу гетероатомов в цикле.
пиррол пирролидин тиофен имидазол
Размер цикла обозначается с помощью корня слова: трёхчленные циклы — -ир, четырёхчленные — -ет, пятичленные — -ол, шестичленные — -ин, семичленные — -епин.
В названии гетероциклических соединений отражают и степень гидрирования (насыщенности) атомов гетероцикла. Основное название (без суффиксов) относится к соединению с максимально возможным числом двойных связей в цикле, но исключение составляют трёхчленные циклы — для обозначения их ненасыщенности добавляется суффикс -ен (для азотосодержащих — -ин).
Полностью гидрированное соединение обозначают суффиксами -идин (для азотосодержащих гетероциклов) или -ан (для кислородо- и серосодержащих гетероциклов), но для циклов с числом атомов 6 и более может быть использована приставка пергидро-. Для частично гидрированных соединений используют приставки дигидро-, тетрагидро-, при этом цифровыми локантами указываются атомы цикла, к которым присоединены атомы водорода. Если водородный атом присоединён только к одному из гетероатомов, это обозначается буквой Н и цифрой, указывающей гидрированный атом.
Для названия производных гетероциклических соединений необходимо пронумеровать атомы цикла. Обычно нумерация начинается с гетероатома. Если имеется несколько гетероатомов, то используют ряд убывающего старшинства: O, S, Se, Te, N, P, As, Sb, Bi, Si, Ge, Sn, Pb, B, Hg. Для некоторых гетероциклических соединений сохраняется особый вид нумерации. Примеры названий некоторых соединений:
азирин 2Н-азирин азиридин оксиран 1,3-диазол 1,2-оксазол
4,5-дигидро-1,3-тиазол 1,3-диазин тиепин 2,2-диметилпергидро-
-1,3,2-диоксасилин
Гетероциклы могут быть названы и по заменительной номенклатуре. При этом заменительные приставки окса-, тиа-, аза- и др. присоединяются к названию карбоциклического соединения, например:
1-азациклопропен-2 1-азациклобутадиен-1,3 1-тиациклопентадиен-2,4
Названия гетероциклических соединений с двумя и более конденсированными циклами строятся по следующим правилам.
1. Выбирают главный цикл. При этом старшинство циклических систем определяется по следующим критериям (в порядке убывания приоритета):
а) при наличии карбоциклической и гетероциклической систем выбирается цикл, содержащий гетероатом;
б) при наличии гетероциклов с разными гетероатомами выбирается цикл, содержащий наиболее электроотрицательный гетероатом;
в) если циклы имеют разный размер, выбирается цикл большего размера;
г) если гетероциклы содержат разное число гетероатомов, выбирается цикл, содержащий наибольшее число гетероатомов.
2. Для указания места сочленения циклов в главном цикле связи обозначают буквами a, b, c, d и т.д., начиная со связи гетероатом—углерод. В младшем цикле место сочленения циклов указывается с помощью цифровых локантов. Например:
3. Название младшего цикла даётся приставкой бензо-, пирро-, имидазо- и др. по названию бензольного, пиррольного или имидазольного циклов соответственно. Примеры названий конденсированных систем (часто используются тривиальные названия циклов):
бензо[b]фуран тиено[2,3-b]фуран имидазо[4,5-b]пиридин
12.2. пятичленные гетероциклические
соединения с одним гетероатомом
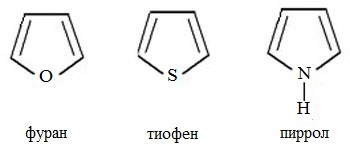
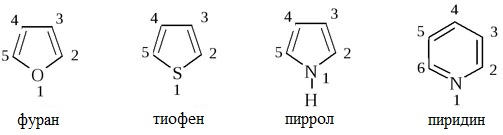
Наиболее важны в практическом отношении такие пятичленные гетероциклы, как пиррол, фуран, тиофен и конденсированные системы на их основе: индол, кумарон и карбазол.
пиррол фуран тиофен
индол кумарон карбазол
12.2.1. номенклатура пиррола, фурана и тиофена и их производных
Пиррол, фуран и тиофен могут иметь систематические названия по номенклатуре гетероциклов азол, оксол и тиол соответственно или по заменительной номенклатуре 1-азациклопентадиен-2,4, 1-оксациклопентадиен-2,4, 1-тиациклопентадиен-2,4 соответственно. Но систематические названия практически не используются.
Положение заместителей указывается греческими буквами или цифровыми локантами:
2-бром-5-метилпиррол 2-фуранкарбальдегид 2,4-диметилтиофен
-бром-’-метилпиррол -фуранкарбальдегид ,’-диметилтиофен
фурфурол
Радикалы, образованные от пиррола, фурана, тиофена и их производных, имеют следующие тривиальные названия:
-пиррил -пиррил -тиенил -тиенил
-фурил -фурил фурфурил
12.2.2. строение пиррола, фурана и тиофена
Молекулы пиррола, фурана и тиофена содержат систему сопряжённых связей и атом с неподелённой электронной парой. В результате образуется циклическая сопряжённая система с шестью -электронами (четыре -электрона от двух двойных связей и два — от гетероатома). Поэтому можно считать, что эти соединения имеют ароматический характер.
За счёт неподелённой электронной пары гетероатом в этом кольце является электронодонором, поэтому на углеродных атомах электронная плотность повышена (по сравнению с бензолом) и пятичленные гетероциклы в целом являются -избыточными ароматическими системами. Циклическую делокализацию неподелённой пары электронов гетероатома можно показать с помощью граничных структур:
Квантово-химическими расчётами показано, что величина электронной плотности в -положении больше, чем в -положении.
В пространстве молекула такого соединения представляет плоский пятиугольник, однако длины связей и валентные углы неодинаковы. Это связано с неравномерностью распределения -электронной плотности в кольце и зависит от природы гетероатома. Чем электроотрицательнее гетероатом, тем более неравномерно распределена электронная плотность и, следовательно, меньшей ароматичностью обладает система. Поэтому ряд уменьшения ароматичности (по сравнению с бензолом) можно показать следующим образом (в скобках приведена энергия делокализации ароматической системы в кДж/моль):
бензол (151) > тиофен (122) > пиррол (90) > фуран (68).
12.2.3. физические и химические свойства
пиррола, фурана и тиофена
Пиррол, фуран и тиофен являются бесцветными жидкостями с приятным запахом, практически нерастворимы в воде.
Химические свойства пятичленных гетероциклических соединений определяются как наличием ароматического цикла, так и наличием гетероатома.
12.2.3.1. Кислотно-оснόвные свойства
Наибольшей основностью обладает пиррол, он легче всего протонируется. Самым слабым основанием из рассматриваемых гетероциклов является тиофен, он наиболее трудно протонируется, поэтому он наименее ацидофобен.
Введение в молекулу электроноакцепторных заместителей уменьшает электронную плотность на ароматическом кольце и тем самым снижает ацидофобность. При наличии сильных электроноакцепторов в гетероциклическом кольце соединение может и вовсе быть устойчиво к действию кислот, как, например, молекула пирослизевой кислоты:
пирослизевая кислота
К действию оснований фуран и тиофен устойчивы, так как не содержат подвижных атомов водорода, а пиррол является слабой NH-кислотой (рКа = 17.5) и при сплавлении со щелочами образует соли:
пиррил-калий
По кислотности пиррол сравним со спиртами, и поэтому для получения его солей могут использоваться также алкоголяты или металлорганические соединения, как, например, при взаимодействии с реактивом Гриньяра:
бромид N-пиррилмагния
Соли пиррола используются для алкилирования (и ацилирования) молекулы пиррола соответствующими алкилгалогенидами (или ацилгалогенидами). Реакция протекает по азоту или по -углеродному атому:
12.2.3.2. Реакции электрофильного замещения
В общем случае электрофильное замещение для пиррола, фурана и тиофена протекает легче, чем для бензола в связи с большей величиной -электронной плотности в молекуле гетероциклов. При этом на атомах углерода в наибольшей степени повышена электронная плотность в кольце пиррола по причине большего +М-эффекта атома азота по сравнению с другими гетероатомами. Поэтому реакционная способность по отношению к электрофилам будет увеличиваться в ряду: бензол Для нитрования пиррола, фурана и тиофена азотная кислота не используется по причине ацидофобности этих соединений. Нитрование фурана и тиофена проводят ацетилнитратом CH3COONO2, для чего используют раствор азотной кислоты в уксусном ангидриде:
,
хотя возможно использование и других смешанных ангидридов или эфиров азотной кислоты. При этом фуран первоначально образует продукт присоединения ввиду своего выраженного диенового характера, а затем отщепляет молекулу уксусной кислоты (обычно под действием органического основания) и превращается в продукт замещения:
2-нитрофуран
-Нитропиррол в отличие от нитропроизводных фурана и тиофена получают через соли пиррола. Например, при использовании этилнитрата:
2-нитропиррол
Сульфировать серной кислотой можно только тиофен:
тиофен-2-сульфокислота
(Механизм сульфирования здесь такой же, как и механизм взаимодействия с холодной концентрированной серной кислотой бензола и его производных.)
Для сульфирования пиррола и фурана по причине их ацидофобности используют комплексы триоксида серы с электронодонорами, обычно пиридинсульфотриоксид или диоксансульфотриоксид:
пиридинсульфотриоксид диоксансульфотриоксид
Механизм сульфирования такими комплексами аналогичен механизму сульфирования триоксидом серы:
Пиридин (или диоксан) в качестве донора электронной пары необходим для связывания отщепляющегося протона.
Галогенирование (хлорирование, бромирование, йодирование) пиррола и тиофена протекает настолько легко, что если специальным образом не контролировать течение реакции, образуются тетрагалогенопроизводные. Так, например, бромирование пиррола раствором брома в этаноле при 273 К даёт тетрабромпиррол:
Получение монобромпиррола (-изомер) представляет определённую трудность, и необходимо специальным образом контролировать течение реакции или использовать специальные бромирующие агенты. Для получения монобромтиофена применяют достаточно низкие температуры (248—268 К). Для хлорирования используют сульфурилхлорид SO2Cl2или тетрахлорид олова SnCl4. Йодирование осуществляется молекулярным йодом (или KI + H2O2) в присутствии кислотного катализатора.
Галогенирование фурана протекает через реакцию присоединения (с последующим отщеплением галогеноводорода) — в этом проявляется диеновый характер этого гетероцикла. Здесь возможно хлорирование (газообразным хлором) или бромирование с образованием полигалогенопроизводных, но не йодирование. Фуран не реагирует с йодом.
Ацилирование пиррола, фурана и тиофена осуществляют ангидридами (реже галогенангидридами) карбоновых кислот.
Алкилирование фурана и пиррола не проводят, так как вероятные продукты этой реакции ещё более ацидофобны и полимеризуются за счёт выделяющегося галогеноводорода.
Высокая активность пиррола иллюстрируется его способностью реагировать со слабыми электрофилами, например с солями арендиазония, диоксидом углерода, альдегидами. Скорость азосочетания сильно зависит от рН среды. При значениях рН ниже 8 в реакцию сочетания с катионом бензолдиазония вступает нейтральная молекула пиррола, а при значениях рН раствора выше 10 в реакции участвует пиррил-анион, и она в этом случае протекает в 10 8 раз быстрее. В более щелочных условиях происходит образование 2,5-бис-диазопроизводных.
Взаимодействие пиррил-калия с диоксидом углерода протекает по механизму, аналогичному реакции Кольбе–Шмитта (гл. 10.5.3.3), с образованием пиррол-2-карбоновой кислоты.
12.2.3.3. Реакции присоединения
В этих реакциях проявляется диеновый характер гетероциклов. Поэтому такие реакции наиболее характерны для фурана. Примерами могут быть присоединение водорода, галогенов и реакция диенового синтеза.
Водород присоединяется в присутствии катализаторов (Ni,Pd,Pt) при нагревании и под давлением. Из пиррола, фурана и тиофена образуются соответствующие тетрагидропроизводные — пирролидин, тетрагидрофуран и тиофан:
(X = NR, O, S)
Труднее всех гидрируется тиофен и его производные, а легче — фуран.
Присоединение галогенов наиболее характерно для фурана, причём продукт присоединения может отщеплять молекулу галогеноводорода, давая продукт формального замещения, например:
2,5-дибром-2,5-дигидрофуран 2-бромфуран
Реакции диенового синтеза характерны, главным образом, для фурана. Это, например, взаимодействие с малеиновым ангидридом:
Тиофен с малеиновым ангидридом не реагирует, но он может быть введён в реакцию Дильса–Альдера при использовании очень реакционноспособных алкинов, например дицианоацетилена; но продукт присоединения легко теряет атом серы и превращается во фталодинитрил:
Пиррол взаимодействует с малеиновым ангидридом как с электрофилом:
12.2.3.4. Реакции замены гетероатома
Эти реакции представляют взаимное превращение пиррола, фурана и тиофена:
Они были открыты в 1936 году Ю.К. Юрьевым и называются также синтезом Юрьева или циклом Юрьева.
Реакции осуществляются при температуре 670—770 К в присутствии катализатора Al2O3. Практическое значение имеют только превращения фурана в пиррол и тиофен:
В остальных четырёх реакциях (с участием пиррола и тиофена) выход продуктов не превышает 2%.
Причиной предпочтительного участия фурана во взаимопревращениях в другие гетероциклы можно считать его меньшую ароматичность, а также наибольшую жёсткость атома кислорода как оснόвного центра (по Р. Пирсону) в сравнении с азотом и серой в пирроле и тиофене. Тогда механизм превращения фурана, например в тиофен, можно представить в следующем виде:
(2 HAlO2 Al2O3 + H2O)
Гетероциклические соединения — это органические соединения, молекулы которых содержат циклы, в образовании которых кроме атома углерода принимают участие и атомы других элементов (гетероатомы).
К гетероатомам относят атомы азота, кислорода, серы, кремния, фосфора, селена, бора и некоторых других элементов.
Гетероциклические соединения широко распространены как в животном, так и в растительном мире. Очень многие биологически важные вещества содержат в своем составе гетероциклические фрагменты.
Гетероциклические соединения играют большую роль в жизнедеятельности организмов и имеют важное физиологическое значение (ДНК, РНК, хлорофилл, алкалоиды, ряд витаминов, антибиотиков).
Классификация гетероциклических соединений
Гетероциклические соединения классифицируют согласно следующим структурным признакам:
- размеру цикла (числу атомов в цикле);
- по природе гетероатома;
- по числу гетероатомов в цикле;
- по степени ненасыщенности (насыщенные и ненасыщенные).
1. В зависимости от числа атомов в цикле гетероциклические соединения подразделяют на трех- , четырех- , пяти- , шести- и семичленные.
2. По природе гетероатома наиболее распространены гетероциклы, в состав которых входят атомы азота, кислорода или серы.
Простейшие пятичленные гетероциклы с одним гетероатомом – фуран, тиофен и пиррол:
3. По числу гетероатомов, входящих в цикл, наиболее распространены гетероциклы с
4. По степени насыщенности гетероциклы могут быть насыщенными, ненасыщенными и ароматическими.
Насыщенные
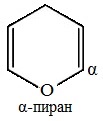
Ненасыщенные
Ароматические
Особый интерес представляют непредельные гетероциклические соединения, которые удовлетворяют условиям ароматичности. Они имеют плоское строение и замкнутую систему π-электронов.
Наиболее разнообразны и хорошо изучены ароматические азотсодержащие гетероциклические соединения.
По некоторым свойствам гетероциклы сходны с соответствующими алифатическими и карбоциклическими соединениями.
Аналогично карбоциклическим соединениям, наиболее устойчивыми являются пяти- и шестичленные гетероциклы.
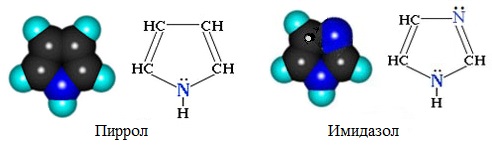
Пятичленные гетероциклы
а) с одним атомом азота
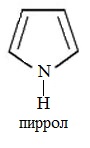
б) с двумя атомами азота
Эти гетероциклы имеют плоское строение и единую π-систему из шести электронов (по одному от четырех атомов углерода и пара электронов – от атома кислорода, серы или азота).
В этом проявляется сходство данных соединений с бензолом: пятичленные гетероциклы обладают ароматическим характером и склонны к реакциям замещения.
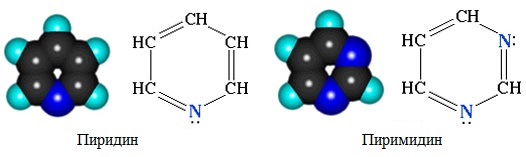
Шестичленные гетероциклы
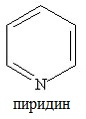
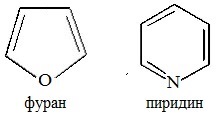
а) с одним атомом азота (пиридин и его производные)

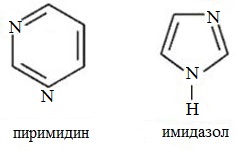
б) с двумя атомами азота (пиримидин и его производные)
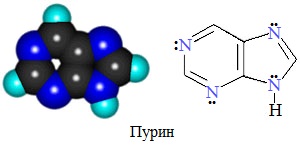
Конденсированные (бициклические) гетероциклы (пурин и его производные)
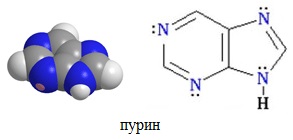
Большое значение имеют гетероциклы, конденсированные с бензольным кольцом или с другим гетероциклом.
При названии гетероциклов широко используются тривиальные названия:
Гетероциклические соединения, как и бензол, более склонны к реакциям замещения, чем к реакциям присоединения. Они вступают в типичные для бензола реакции электрофильного замещения, устойчивы по отношению к восстановителям и окислителям.
Эти особенности в химическом поведении определяются наличием в их кольцах электронного секстета. Благодаря сопряжению, связи выравниваются, и кольцо становится плоским. Однако стабильность секстетов π-электронов в молекуле бензола и в молекулах гетероциклов различна.
К гетероциклическим относятся соединения, содержащие циклы, в которых один или два (несколько) атомов являются элементами, отличными от углерода. Гетероциклические системы многообразны. Элементы, которые участвуют в образовании цикла, называют гетероатомами . В соответствии с количеством гетероатомов циклы разделяют на моно -, ди -, тригетероатомные кольца .
Гетероциклы могут содержать три, четыре, пять и более атомов. Как и в случае карбоциклических соединений, наиболее устойчивы циклы с пятью и шестью атомами.

Число возможных гетероциклических систем увеличивается из-за существования конденсированных ядер.

Широко распространены гетероциклические системы в природе, являются побочными продуктами при коксовании угля, переработки нефти и сланцев.
Наиболее важны гетероциклические системы, обладающие ароматическими свойствами. Простейшие из них содержат по одном гетероатому:

Если исходить из этих структур, то можно было бы ожидать, что каждое соединение будет обладать свойствами сопряженных диенов и свойствами амина, простого эфира, сульфида. Но для указанных соединений не характерны реакции, которые можно ожидать из-за наличия гетероатомов.
Для пятичленных циклов типичными являются реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование, сочетание с солями диазония. Поэтому пиррол, фуран и тиофен можно считать ароматическими соединениями.
Рассмотрим строение тиофена исходя из молекулярных орбиталей. Каждый атом кольца связан s-связями с тремя другими атомами. Для образования этих связей атом использует три sp 2 -орбитали, которые лежат в плоскости под углом 120 о . Каждый атом затрачивает один электрон на образование s-связи, после чего у атома углерода остается один электрон, а у атома серы - два электрона. Эти электроны занимают p -орбитали. Перекрывание p -орбиталей приводит к возникновению p-облаков выше и ниже плоскости кольца. Эти p-облака содержат в сумме шесть p-электронов (ароматический секстет).

Делокализация p-электронов стабилизирует кольцо. В результате этого тиофен вступает в реакции с сохранением кольца, т.е. в реакции замещения.
Номенклатура и изомерия
Нумерация всегда начинается с гетероатома. Если в цикле имеется несколько гетероатомов, то их нумеруют в следующем порядке: O , S , N . Если имеется третичный азот и NH , то нумерацию начинают с NH .

Положения 2 и 5 часто обозначают a и a’, а положения 3 и 4 - b и b’. По рациональной номенклатуре названия гетероциклов: фуран, тиофен, пиррол, имидазол, тиазол. В систематической номенклатуре природа гетероатома обозначается приставками:
| O | окса- |
| S | тиа- |
| N | аза- |
| 3 | -ир |
| 4 | -ет |
| 5 | -ол |
| 6 | -ин |
| 7 | -ен |
| 8 | -ок |
Соответственно суффиксами обозначается степень ненасыщенности:
| -идин | насыщенный цикл с атомом N |
| -ан | насыщенный цикл без атома N |
| -ин | ненасыщенный цикл с атомом N |
Допускаются упрощения названий.
Методы получения пятичленных гетероциклов
Пиррол и тиофен содержатся в каменноугольной смоле. Фракционной перегонкой смолы тиофен (Тпл 84 о С ) перегоняется вместе с бензолом (Ткип 80 о С ) и содержание его в бензоле 0,5% (1884 г., В.Мейер). Тиофен в промышленности может быть получен при взаимодействии бутана с серой при 560 о С :

Гомологи получают при нагревании 1,4-дикарбонильных соединений:



Пентозы, претерпевая дегидратацию и циклизацию, образуют фурфурол. При нагревании его с окисным катализатором образуется фуран. При сухой перегонке соли пирослизевой кислоты:

Большинство замещенных тиофена и фурана получают циклизацией:

Пятичленные циклы могут взаимно переходить друг в друга (реакция Юрьева ) при нагревании над Al 2 O 3 при 450 о С:

Электрофильное замещение, реакционная способность, ориентация
Фуран, пиррол и тиофен обладают значительной реакционной способностью по отношению к электрофильным реагентам. Это вызвано несимметричным распределением заряда в этих гетероциклах, из-за чего на углеродных атомах в цикле сосредоточен больший отрицательный заряд, чем в бензоле. Фуран обладает несколько большей реакционной способностью, чем пиррол.

Фуран бурно реагирует с сильными кислотами с образованием смолистых веществ, пиррол в результате протонирования по атому азота также неустойчив в кислых средах и полимеризуется. Тиофен более устойчив по отношению к кислотам, что позволяет использовать кислые реагенты при выборе условий для реакций электрофильного замещения.
Механизм электрофильного замещения в пятичленных гетероциклах существенно не отличается от общепринятого механизма замещения в ароматических соединениях, который предполагает изменение гибридизации атакуемого атома углерода от sp 2 в sp 3 и образование комплексов, являющимися промежуточными соединениями. Образование s-комплекса является стадией, определяющей скорость реакции.
В настоящее время основные пятичленные гетероциклы расположены в ряд по реакционной способности:
пиррол ³ фуран > теллурофен > селенофен > тиофен
Электрофильное замещение по a-положению происходит легче, чем в b-положение, так как в возникающем при этом промежуточном переходном состоянии в результате присоединения по a-положению резонансная стабилизация больше, чем в катионе, являющаяся результатом присоединения по b-положению.

В катионе (2) двойная связь не может участвовать в мезомерной делокализации положительного заряда.
Скорость замещения зависит от различия энергий основного и переходного состояний, и более высокую скорость будет иметь тот процесс, который протекает через более стабильное переходное состояние.
Реакционная способность a- и b-положений сильно зависит от электрофильного агента и экспериментальных условий. Чем меньше сила электрофильного агента, тем выше величина a:b. Это соотношение зависит также от гетероатома. 2-Монозамещенные производные образуют с элктрофильными реагентами смеси изомеров. Положения 2 и 5 находятся в сопряжении подобно п -положениям в бензоле, поэтому возможно резонансное взаимодействие реакционного центра в положении 5 с заместителем в положении 2. Положения 2 и 4 являются положениями мета -типа, между которыми невозможно резонансное взаимодействие. Если в положении 2 находятся орто -пара -ориентирующие группы, то замещение протекает в положении 5, которое является a -положением по отношению к гетероатому и пара -положением по отношению к заместителю. Если мета -ориентирующий заместитель находится в положении 2, возникает конкуренция между ориентирующим влиянием гетероатома и заместителя. В фуране и тиофене, для которых соотношение a : b велико, a -ориентирующий эффект гетероатома преобладает и замещение протекает, главным образом, в положении 5. В пирроле образуется смесь изомеров с преобладанием 4-изомера.
Реакции электрофильного замещения в фуране
1. Бромирование диоксандибромидом:

2. Сульфирование комплексом SO 3 с пиридином (А.П. Терентьев, Л.А. Яновская):


4. Нитрование фурана ацетилнитратом с обработкой продукта присоединения пиридином

Реакции электрофильного замещения тиофена
1. Хлорирование тиофена сульфурилхлоридом:

2. Тиофен легко сульфируется H 2 SO 4 (95%) с образованием 2-тиофенсульфокислоты:

3. Нитрование ацетилнитратом приводит к смеси 2- и 3-нитротиофенов в соотношении 6:1.

4. Введение альдегидной группировки в тиофен может быть достигнуто при взаимодействии тиофена с комплексом POCl 3 и N , N -диметилформамида.

5. Бромирование тиофена может протекать при взаимодействии с бромом:

Лучшие выходы достигаются при бромировании N-сукцинимидом

6. Ацилирование тиофена в положение 2:

Реакции электрофильного замещения пиррола
Для пиррола также характерны реакции электрофильного замещения в мягких условиях. Кислотность пиррольного водорода намного выше, чем кислотность алифатических аминов. При нагревании с сухим KOH пиррол депротонируется.
1. Соли пиррола со щелочными металлами получают действием калия или натрия в жидком аммиаке:

2. Пирролнатрий легко вступает в реакции замещения натрия на алкилы с образованием N-алкилпиррола

3. При нагревании N-алкилпиррол изомеризуется в С-алкилпирролы:

4. Амилнитрат реагирует с пирролом в присутствии этилата натрия с образованием натриевой соли 3-нитропиррола:
Функция "чтения" служит для ознакомления с работой. Разметка, таблицы и картинки документа могут отображаться неверно или не в полном объёме!
Эти соединения имеют большое биологическое значение, они распространены в природе в виде витаминов, алкалоидов, пигментов и других составных частей животных и растительных клеток, участвуют в построении аминокислот, входящих в состав белков; они входят в состав нуклеотидов, нуклеиновых кислот.
Классификация В основу классификации положены фора ядра и число гетероатомов.
1) Пятичленные гетероциклы:
а) с одним гетероатомом;
б) с двумя гетероатомами и тд.
2) Шестичленные гетероциклы:
а) с одним гетероатомом;
б) с двумя гетероатомами и тд.
3) Гетероциклы с конденсированной системой ядер. Пятичленные гетероциклы с одним гетероатомом Важнейшими представителями являются следующие:НССННССНHCCHНССННССНHCCH
фуранТиофенПиррол Все эти соединения в своем составе имеют по четыре углеродных атома и один гетероатом. У этих соединений имеются две двойные связи, между которыми имеется одинарная связь (это напоминает диеновые углеводороды с сопряженной системой двойных связей). Однако, в химическом отношении ионии больше напоминают ароматические соединения. Каждый углеродный атом у них затрагивает 3 электрона на образование обычных σ-свзей, то есть связей, образованных гибридизированными электронными облаками, а один электрон образует Р - электронное облако (в виде правильной восьмерки).
У гетероатома на образование σ-связей израсходовано два электрона, а еще два электрона образуют Р-электронные облака. В результате видим, то в ядре имеется 6 Р - электронных облаков, которые взаимно перекрываясь, образуют сплошное Р – электронное облако, как и в бензоле. Поэтому они и напоминают по свойствам ароматические соединения, особенно ярко они выражены у тиофена. Как и у ароматических соединений, у них прочное ядро – при обычных химических реакциях не разрывается. И более характерными для них являются реакции замещения атомов водорода.
Более подвижен водород в α-положении, то есть при углероде, который расположен рядом с гетероциклом.
Приведенные гетероциклы легко переходят друг в друга, по реакции Ю.К.Юрьева, которая протекает при катализаторе Al2O3 и при t=4500C.НССН+H2SНССННССН+H2OНССН
При реакциях гидрогенизации этих гетероциклов образуются их гидрированные производные, у которых уже нет двойных связей.Н2CСН2Н2CСН2H2CCH2Н2CСН2Н2CСН2H2CCH2
тетрагидрофурантетрагидротиофентетрагидропирролФуран- это бесцветная жидкость, со слабым запахом хлороформа. Температура кипения 31.90С. это вещество нейтрального характера. Не растворим в воде. Фуран и его гомологи содержатся в древесном дегте. В промышленности фуран получают из фурфурола путем отщепления окиси углерода (СО).НССНHCCH
фурфуролфуран В природе широко встречаются производные тетрагидрофурана - это фурановые формы сахаров.
Тиофен – это бесцветная жидкость, с запахом бензола, температура кипения 840С, не растворим в воде. Содержится в каменноугольной смоле, которая образуется при коксовании каменного угля. Выделяется с фракцией
К числу гетероциклических относят органические соединения, циклы которых включают, кроме атомов углерода, один или несколько других элементов. В образовании циклов могут принимать участие различные гетероатомы, но чаще всего — кислород, азот и сера.
Гетероциклические соединения широко распространены в природе. На их долю приходится около 50% природных веществ, в том числе отличающихся высокой биологической активностью (алкалоиды, витамины, ферменты, антибиотики). Многие из этих биологически активных веществ применяют в качестве лекарственных средств или исходных продуктов для их синтеза. Источниками биологически активных природных веществ, имеющих гетероциклическую структуру, служат продукты растительного и животного происхождения.
По химическому строению гетероциклические соединения очень разнообразны. Они различаются общим числом атомов в цикле, природой гетероатомов и их количеством в цикле.
По числу всех атомов в циклах гетероциклические соединения делят на трех-, четырех-, пяти-, шести- и семичленные, а по характеру гетероатомов — на азот-, кислород-, серосодержащие. Число этих гетероатомов может быть от одного до четырёх.
Классифицируют гетероциклические соединения на следующие группы.
Трехчленные гетероциклы с одним гетероатомом:
Пятичленные гетероциклы с одним гетероатомом:
Пятичленные гетероциклы с несколькими гетероатомами:
Шестичленные гетероциклы с одним гетероатомом:
Шестичленные гетероциклы с несколькими гетероатомами:
Семичленные гетероциклы с одним и двумя гетероатомами:
Молекулы гетероциклов могут содержать различные заместители. Известно также большое число систем, в которых гетероциклы конденсированы между собой и с другими ароматическими или гидроароматическими циклами. Конденсированные гетероциклические системы составляют структурную основу многих природных и синтетических лекарственных веществ.
Наличие гетероатомов в молекулах гетероциклических соединений обусловливает значительную лабильность их молекул по сравнению с другими органическими соединениями. Это особенно проявляется у гетероциклов с несколькими гетероатомами и при наличии различных заместителей в молекуле. Такие производные имеют наибольшую тенденцию к раскрытию цикла и рециклизации, а также к различного рода таутомерным превращениям.
Перечисленные особенности химической структуры имеют важное значение для синтеза и анализа гетероциклических соединений. Кроме того, есть все основания предполагать, что одной из основных причин высокой биологической активности многих гетероциклических соединений является особенность их химической структуры, обеспечивающая в широких пределах возможность перемещения электронов.
Лекарственные средства, имеющие гетероциклическую структуру, можно получить из природного сырья или синтетическим путем. Некоторые гетероциклические соединения выделяют из продуктов переработки каменноугольной смолы, содержащей пиридин и его гомологи, хинолин, изохинолин, акридин, индол и др. Древесная смола содержит метилфуран, фурфурол. Более сложные по химической структуре гетероциклические соединения представляют собой многие алкалоиды, витамины, ферменты, содержащиеся в растениях.
Способы синтеза гетероциклических соединений разнообразны. Их синтезируют из ряда алифатических производных путем замыкания цикла, превращения гетероциклов друг в друга (рециклизация), гидрирования ненасыщенных гетероциклических соединений до насыщенных, введения различных радикалов в простые по структуре гетероциклы или получения из них конденсированных систем.
Большинство методов синтеза основано на так называемой гетероциклизации, т.е. на образовании гетероцикла в результате замыкания в цикл одного или двух алифатических соединений. Такие реакции основаны главным образом на конденсации дикарбонильных соединений (альдегидов, карбоновых кислот) с аммиаком или алифатическими и ароматическими соединениями, содержащими в молекуле первичную ароматическую аминогруппу. Этот общий принцип использован для получения различных азотсодержащих гетероциклов, составляющих структурную основу многих синтетических и природных лекарственных веществ. Гетероциклические системы получают также из ароматических и гетероциклических соединений, содержащих в молекулах аминогруппы, путем конденсации их с карбонильными соединениями (альдегидами, кетонами).
ПРИМЕНЕНИЕ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ.
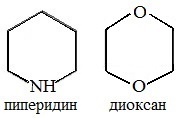
Диоксан (рис. 2) и тетрагидрофуран (рис. 8) широко используют в качестве высокополярных растворителей в органическом синтезе.
Фурфурол (рис. 8) является исходным продуктом для получения фурана (рис. 8), тетрагидрофурана, а также для синтеза некоторых лекарственных препаратов (фурацилин).
При конденсации фурфурола в кислой среде образуются полимерные продукты (фурановые смолы), по строению напоминающие фенольные смолы, метиленовые группы СН2, соединяющие гетероциклы (рис. 12А). При нагревании таких смол в присутствии кислотных катализаторов (например, толуолсульфокислота) двойные связи раскрываются с образованием поперечных сшивок, в результате полимер переходит в нерастворимое состояние, что позволяет его использовать в качестве связующего при изготовлении различных наполненных прессматериалов: стекло- и углепластиков, древесноволокнистых плит и т.п. В твердом состоянии фурановые полимеры представляют собой химически стойкие вещества (до 300° С), это позволяет применять их и как коррозийноностойкие и огнеустойчивые герметики и мастики.
При конденсации ароматических тетраминов (4 амино-группы) с эфирами ароматических дикарбоновых кислот (см. СЛОЖНЫЕ ЭФИРЫ) образуются полимеры, в структуре которых в процессе синтеза возникают фрагменты бензимидазола (рис. 12Б). Такие полимеры, получившие название полибензимидазолы, обладают высокой прочностью и термостойкостью (до 500° С), из них изготавливают пленки, волокна (торговое название АРМОС и РУСАР), армированные пластики.
Рис. 12. ПОЛИМЕРЫ, СОДЕРЖАЩИЕ В ЦЕПИ ГЕТЕРОЦИКЛИЧЕСКИЕ ФРАГМЕНТЫ: фурановый полимер (А), полибензимидазол (Б).
Производные бензимидазола входят в состав лекарственных препаратов (дибазол).
Индол (рис. 2) применяют как фиксатор запахов в парфюмерной промышленности и при изготовлении некоторых лекарств (индометацин).
13. Производные фурана и 5-нитрофурана – фурацилин, фурадонин, фуразолидон, фурагин. Методы анализа, хранение, применение
Читайте также:

