Роль аминокислот в глюконеогенезе реферат
Обновлено: 01.07.2024
а) Глюконеогенез — образование углеводов из белков и жиров. Когда запасы углеводов в организме становятся ниже нормы, некоторое количество глюкозы может образовываться из аминокислот и составной части жиров — глицерола. Этот процесс называют глюконеогенезом.
Глюконеогенез особенно важен для предупреждения существенного снижения уровня глюкозы в крови во время голодания. Глюкоза является основным субстратом, используемым для получения энергии такими тканями, как нервная ткань и клетки крови, поэтому в крови должно присутствовать достаточное количество глюкозы в промежутках между приемами пищи, которые могут составлять несколько часов.
Печень играет ключевую роль в поддержании уровня глюкозы в крови натощак, обеспечивая превращение депонированного гликогена в глюкозу (гликогенолиз), а также путем синтеза глюкозы, главным образом из лактата и аминокислот (глюконеогенез). Приблизительно 25% глюкозы, синтезированной печенью натощак, образуется путем глюконеогенеза, что способствует доставке необходимого мозгу количества глюкозы.
В условиях длительного отсутствия пищи значительное количество глюкозы может образовываться в почках из аминокислот и других предшественников.
Приблизительно 60% аминокислот из присутствующих в организме белков свободно превращаются в углеводы. Остальные 40% имеют химическую структуру, затрудняющую их превращение в углеводы или делающую этот процесс невозможным. Превращение каждой аминокислоты в глюкозу сопряжено с индивидуальными особенностями химических реакций.
Например, путем дезаминирования аланин может напрямую превращаться в пировиноградную кислоту; затем пировиноградная кислота превращается в глюкозу или запасается в виде гликогена. Большая часть используемых аминокислот может объединяться, превращаясь в различные сахара, содержащие 3, 4, 5 и даже 7 атомов углерода. Затем они вступают в фосфоглюконатные реакции и преобразуются в глюкозу.
Таким образом, путем дезаминирования и некоторых простых преобразований большое количество аминокислот становится глюкозой. Подобным способом глицерол также преобразуется в глюкозу или гликоген.
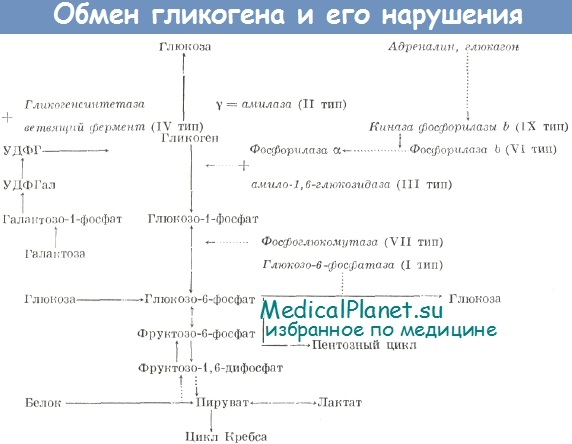
б) Регуляция глюконеогенеза. Уменьшение количества углеводов в клетках или снижение сахара в крови является основным стимулом для увеличения скорости глюконеогенеза. Кроме того, уменьшение количества углеводов может стать причиной изменения направления гликолитических или фосфоглюконатных реакций, что способствует превращению дезаминированных аминокислот в углеводы, наряду с глицеролом. Такой гормон, как кортизол, играет особенно важную роль в регуляции процессов глюконеогенеза.
в) Роль кортикотропина и глюкокортикоидов в глюконеогенезе. Если количество углеводов в клетках не соответствует нормальному уровню, это по не совсем понятной причине приводит к тому, что аденогипофиз начинает продуцировать большое количество гормона кортикотропина. Кортикотропин стимулирует кору надпочечников к продукции больших количеств глюкокор-тикоидных гормонов, особенно кортизола.
В свою очередь, кортизол мобилизует белки из большинства тканей организма, повышая уровень аминокислот в жидких средах организма. Большая часть выделяемых аминокислот сразу дезаминируется в печени и становится прекрасным субстратом для превращения в глюкозу. Таким образом, один из наиболее важных способов стимуляции глюконеогенеза опосредован выделением глюкокортикоидов из коры надпочечников.
г) Глюкоза крови. Нормальная концентрация глюкозы в крови, взятой натощак спустя 3-4 ч после приема пищи, составляет 90 мг/дл. После приема пищи, содержащей большое количество углеводов, уровень глюкозы в крови иногда достигает почти 140 мг/дл, даже если у человека нет сахарного диабета.
Регуляция концентрации глюкозы в крови тесно связана с гормонами поджелудочной железы, инсулином и глюкагоном; этот вопрос подробно изложен в отдельной статье на сайте (просим вас пользоваться формой поиска выше) в связи с функциями этих гормонов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Обоснование необходимого запаса белков в организме человека. Механизмы циркуляции аминокислот в крови. Оценка способности синтезироваться рассматриваемых структурных химических единиц в организме. Незаменимые аминокислоты, основанные на радикалах.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 19.11.2015 |
| Размер файла | 259,4 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Ростов-на-Дону, 2015 год
1. Белковый обмен
2. Незаменимые аминокислоты
3. Классификация незаменимых аминокислот, основанная на химическом строении радикала
Клетки нашего тела, как и любого живого организма, в основном состоят из протеинов - белков. Потому и необходимо запас белков в организме постоянно пополнять. Вот только не все белки являются ценными, а ценность белка зависит от того, насколько он богат незаменимыми аминокислотами. Ведь именно из аминокислот, образующихся в результате расщепления белков из пищевых продуктов, и синтезируются в человеческом организме белки. Что такое аминокислоты? Это структурные химические единицы, которые образуют белки.
1. Белковый обмен
Белки в организме также являются источником энергии. Они содержатся главным образом в мышцах и их количество составляет в организме здорового человека массой 70 кг. около 6000 г., что соответствует 24000 ккал. Циркуляция их в крови в виде аминокислот незначительна и составляет всего 6 г., или 24 ккал. Белки - необходимый компонент любой ткани организма - поступают в организм с пищей и в желудочно-кишечном тракте после воздействия на них ферментов (пепсина, трипсина) гидролизуются до небольших пептидов и аминокислот, которые затем всасываются в кровь и лимфу. В организме человека для синтеза пуринов, пиримидинов, порфиринов используются только аминокислоты, поэтому все поступающие с пищей белки должны быть диссоциированы в различных ферментативных реакциях до отдельных аминокислот.
Некоторые аминокислоты могут синтезироваться в организме, поэтому называются заменимыми: аланин, аспарагиновая кислота, цистеин, глутаминовая кислота, глицин, пролин, серин, тирозин, аспарагин, глутамин? другие же не могут быть синтезированы и называются незаменимыми: лейцин, изолейцин, валин, лизин, метионин, фенилаланин, триптофан, треонин, гистидин, аргинин (гистидин и аргинин синтезируются в организме взрослого человека).
В зависимости от путей катаболизма различают глюкогенные, кетогенные и смешанные аминокислоты. Кетогенной аминокислотой является лейцин, который распадается на ацетоуксусную кислоту и ацетил-КоА, вызывающие повышение уровня кетоновых тел в крови.
Изолейцин, лизин, фенилаланин и тирозин - глюкогенные и кетогенные аминокислоты. Фенилаланин и тирозин распадаются на фурамат и ацетоацетат, которые могут быть использованы в процессах глюконеогенеза. К глюкогенным аминокислотам относятся аланин, аргинин, аспарагиновая кислота, цистеин, глутаминовая кислота, глицин, гистидин, гидроксипролин, метионин, серин, треонин, триптофан, валин. Продукты распада этих аминокислот участвуют в процессах глюконеогенеза. Количество аминокислот в сыворотке крови поддерживается постоянно на определенном уровне за счет поступления их из желудочно-кишечного тракта и депо, которыми являются печень и мышцы. В мышцах содержится более 50% общего количества свободных аминокислот организма.
Наиболее мобильны из них аланин и глутамин, составляющие более 50% всех аминокислот, высвобождающихся из мышц. Аланин синтезируется в мышцах путем трансаминирования пирувата. Глутамин поступает в почки, где отщепляющийся азот используется для образования аммиака.
Аланин же задерживается печенью, где быстро конвертируется в глюкозу через образование пирувата. Последний процесс получил название цикла аланина и наряду с циклом лактата (цикл Кори) имеет большое значение в процессах глюконеогенеза.
Синтез белка - сложный процесс, происходящий постоянно. Информация о структуре любого белка данного организма хранится в хромосомах в виде генетического кода.
При поступлении сигнала о необходимости синтеза определенного белка с участка ДНК, на котором закодирована структура данного белка, при участии фермента РНК-полимеразы начинает образовываться мРНК. Процесс образования РНК называется "транскрипция". Если молекула ДНК относительно стабильна, то период полураспада мРНК составляет 2-80 ч. (время, необходимое для синтеза белка).
Образовавшаяся мРНК покидает ядро и направляется к рибосомам, где и осуществляется синтез белка. На рибосомах локализуются рибосомальная РНК (рРНК) и транспортная РНК (тРНК), которые вместе участвуют в процессе считывания информации, заложенной в мРНК, и"сборки" нового белка. Обычно рРНК и метионил-тРНК присоединяются к специальной точке мРНК, и с этого момента начинается их движение вдоль молекулы мРНК, во время которого "считываются" триплетные кодоны и начинается "сборка" полипептидной цепи нового белка. Аминокислоты могут использоваться рибосомами лишь после их взаимодействия с соответствующими ферментами, число которых по всей вероятности соответствует количеству аминокислот. Незаменимые аминокислоты не синтезируются клетками животных и человека и поступают в организм в составе белков пищи. Для человека незаменимые аминокислоты: валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин и в некоторых случаях аргинин. Для разных животных набор незаменимых аминокислот неодинаков. Отсутствие или недостаток незаменимых аминокислот приводит к остановке роста, падению массы, нарушениям обмена веществ, при острой недостаточности - к гибели организма.
2. Незаменимые аминокислоты
Рисунок 1. - Формула валина:
Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме. Он может быть использован мышцами в качестве источника энергии. Чрезмерно высокий уровень валина может привести к таким симптомам, как парестезии. Валин содержится в следующих пищевых продуктах: зерновые, мясо, грибы, молочные продукты, арахис. Прием валина в виде пищевых добавок следует сбалансировать с приемом других разветвленных аминокислот - L-лейцина и L-изолейцина.
Рисунок 2. - Формула лейцина:
Лейцин - незаменимая аминокислота. Она защищает мышечные ткани и является источником энергии, а также способствует восстановлению костей, кожи, мышц.
Лейцин несколько понижает уровень сахара в крови и стимулирует выделение гормона роста.
К пищевым источникам лейцина относятся: бурый рис, бобы, мясо, орехи, соевая и пшеничная мука.
Биологически активные пищевые добавки, содержащие лейцин, применяются в комплексе с валином и изолейцином.
Рисунок 3. - Формула изолейцина:
Изолейцин - одна из незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.
Метаболизм изолейцина происходит в мышечной ткани. Изолейцин очень нужен спортсменам, так как увеличивает выносливость и способствует восстановлению мышечной ткани. К пищевым источникам изолейцина относятся: миндаль, кешью, куриное мясо, яйца, рыба, чечевица, печень, мясо, рожь, большинство семян, соевые белки.
Рисунок 4. - Формула треонина:
Треонин - это незаменимая аминокислота, способствующая поддержанию нормального белкового обмена в организме. Она важна для синтеза коллагена и эластина, помогает работе печени и участвует в обмене жиров. Треонин находится в сердце, центральной нервной системе, скелетной мускулатуре и препятствует отложению жиров в печени. Эта аминокислота стимулирует иммунитет.
Рисунок 5. - Формула метионина:
Метионин - незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и в стенках артерий. Эта аминокислота способствует пищеварению, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Метионин применяют в комплексной терапии ревматоидного артрита и токсикоза беременности.
Пищевые источники метионина: бобовые, яйца, чеснок, чечевица, мясо, лук, соевые бобы, семена и йогурт.
Рисунок 6. - Формула фенилаланина:
Фенилаланин в организме может превращаться в другую аминокислоту - тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норэпинефрина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Фенилаланин используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения.
Биологически активные пищевые добавки, содержащие фенилаланин, не дают беременным женщинам, лицам с диабетом, высоким артериальным давлением, фенилкетонурией.
Рисунок 7. - Формула триптофана:
Триптофан - это незаменимая аминокислота, необходимая для продукции ниацина. Он используется для синтеза в головном мозге серотонина, одного из важнейших нейромедиаторов. Триптофан применяют при бессоннице, депрессии и для стабилизации настроения. Он используется при заболеваниях сердца, для контроля за массой тела, уменьшения аппетита, а также для увеличения выброса гормона роста. Триптофан снижает вредное воздействие никотина. К пищевым источникам триптофана относятся: бурый рис, деревенский сыр, мясо, арахис и соевый белок.
Рисунок 8. - Формула лизина:
Лизин - это незаменимая аминокислота, входящая в состав практически любых белков. Он необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Его применяют в восстановительный период после операций и спортивных травм. Прием добавок, содержащих лизин в комбинации с витамином С и биофлавоноидами, рекомендуется при вирусных заболеваниях.
Рисунок 9. - Формула аргинина:
Аргинин замедлят рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Его также применяют при заболеваниях печени (циррозе и жировой дистрофии), он способствует дезинтоксикационным процессам в печени (прежде всего обезвреживанию аммиака). Семенная жидкость содержит аргинин, его иногда применяют в комплексной терапии бесплодия у мужчин. В соединительной ткани и в коже также находится большое количество аргинина, поэтому он эффективен при различных травмах. Аргинин - важный компонент обмена веществ в мышечной ткани. Аргинин помогает снизить вес.
3. Классификация незаменимых аминокислот, основанная на химическом строении радикала
Алифатические аминокислоты не несут в боковых цепях гетероатомов (азота (N), кислорода (О), серы (S)). Из незаменимых аминокислот к этой группе относятся:
Гидроксиаминокислоты характеризуются присутствием гидроксильной (ОН) группы в составе боковых цепей. Из незаменимых аминокислот к этой группе относятся: треонин.
Аминокислоты с катинирующими группами. Эти аминокислоты в составе боковых цепей содержат группировки способные заряжаться положительно, образуя катионы.
Серосодержащие аминокислоты в своем составе содержат серу (S): метионин.
Ароматические аминокислоты характеризуются присутствием циклической, ароматической группировкой:
- фенилаланин; аминокислота химический радикал
Аминокислоты имеют огромное значение для работы организма. Пищевые добавки могут быть полезны, но иногда их прием ведет к побочным эффектам, а потому обязательно проконсультируйтесь с квалифицированным специалистом перед началом приема препаратов аминокислот. Это очень важно, поскольку скрытые проблемы со здоровьем могут обостриться на фоне приема аминокислот.
Кроме того, часть этих аминокислот образуется в организме, и многие аминокислоты поступают с продуктами питания, а потому важно определить, действительно ли необходим дополнительный приток этих нутриентов. Следует отметить, что аминокислоты продаются без рецепта и в целом считаются безопасными.
4. Якубке Х.Д., Ешкайт Х. Аминокислоты. Пептиды. Белки. М.: Мир, 1985 г., 456 с.
Подобные документы
Белки – высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Наследственная информация сосредоточена в молекуле ДНК. С помощью белков реализуется генетическая информация. Классификация аминокислот.
реферат [21,6 K], добавлен 17.01.2009
Строение РНК, ее синтез и роль в передаче наследственности. Формула незаменимых аминокислот; структура холестерина, его источники и функции в организме. Распад и всасывание углеводов в желудочно-кишечном тракте; ферменты. Витамин В3; строение жиров.
контрольная работа [1,1 M], добавлен 01.06.2012
Физико-химические свойства аминокислот. Получение аминокислот в ходе гидролиза белков или как результат химических реакций. Ряд веществ, способных выполнять некоторые биологические функции аминокислот. Способность аминокислоты к поликонденсации.
презентация [454,9 K], добавлен 22.05.2012
Электрохимические методы анализа веществ. Общие физико-химические свойства аминокислот и белков, их функции в клетках живых организмов. Использование методов полярографии и амперометрии в исследовании кинетики химических процессов в аминокислотах.
курсовая работа [2,5 M], добавлен 18.07.2014
Пути внедрения ферментативных методов синтеза в химическое производство. Способ определения содержания аминокислот триптофана и цистеина в составе белков. Специфика строения и состава структурных белков биологической мембраны. Характеристика видов РНК.
Организм может синтезировать глюкозу из соединений, способных предварительно превратиться в пируват, то есть из большинства аминокислот и лактата, поступающего в кровь из работающих мышц. Совокупность таких превращений называют глюконеогенезом.
Глюкоза не может быть синтезирована из ацетил-КоА и жирных кислот. Глюконеогенез позволяет как бы сохранить энергию превращений в виде гликогена. Однако помимо этого глюконеогенез в ряде случаев спасает организм от гибели.
Содержание
Прикрепленные файлы: 1 файл
Организм может синтезировать глюкозу из соединений.docx
Субстрат для глюконеогенеза……… ……………………………………………….
Метаболические пути, участвующие в глюконеогенезе…………………………..
Индукции или репрессии синтеза ключевых ферментов……………………….
Влияние алкоголя на глюконеогенез…………………..……. .
Организм может синтезировать глюкозу из соединений, способных предварительно превратиться в пируват, то есть из большинства аминокислот и лактата, поступающего в кровь из работающих мышц. Совокупность таких превращений называют глюконеогенезом.
Глюкоза не может быть синтезирована из ацетил-КоА и жирных кислот. Глюконеогенез позволяет как бы сохранить энергию превращений в виде гликогена. Однако помимо этого глюконеогенез в ряде случаев спасает организм от гибели.
Глюконеогенез - это синтез глюкозы и синтез гликогена из органических молекул, не относящихся к углеводам. Главными субстратами служат глюкогенные аминокислоты , лактат,аланин, глицерол и (у жвачных) пропионат.
Глюкогенные аминокислоты сначала превращаются в пируват , альфа- кетоглутарат , фумарат или окс алоацетат .
Во время ночного голодания только 25% глюкозы печеночного происхождения образуется путем глюконеогенеза. После пробуждения вклад гликогенолиза в общую продукцию глюкозы значительно снижается, и по мере удлинения периода голодания глюконеогенез все более преобладает над гликогенолизом.
Глюконеогенез включает все механизмы и пути, обеспечивающие образование глюкозы и гликогена из неуглеводных компонентов. Происходит главным образом в печени и почках, поскольку именно в этих органах имеется полный набор необходимых ферментов.
Субстрат для глюконеогенеза
Основные субстраты глюконеогенеза: лактат (образуется при катаболизме глюкозы во всех тканях); аминокислоты образуются при катаболизме белков мышечной ткани; глицерин (продукт катаболизма триглицеридов жировой ткани.
Глюкогенные аминокислоты: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
Метаболические пути, участвующие в глюконеогенезе
Эти пути являются модификациями путей гликолиза и цикла лимонной кислоты. Простому обращению гликолиза препятствуют энергетические барьеры на ряде стадий: 1) между пируватом и фосфоенолпируватом, 2) между фруктозо 1,6-бисфосфатом и фруктозо-6-фосфатом, 3) между глюкозо-6-фосфатом и глюкозой, а также 4) между глюкозо-1-фосфатом и гликогеном. Эти барьеры обходятся с помощью специальных реакций.
1) В митохондриях имеется фермент пируваткарбоксилаза, который при участии АТФ, биотина и СО2 превращает пируват в оксалоацетат. Функция биотина заключается в присоединении СО2 (из бикарбоната) к ферменту, далее СО2 переносится на пируват. Во внемитохондриальной среде клетки имеется второй фермент - фосфоенолпируваткарбоксикиназа , который катализирует превращение оксалоацетата в фосфоенолпируват. Для этой реакции требуется высокоэнергетический фосфат в форме GTP или ITP; в результате реакции освобождается СО2. Таким образом, с помощью этих двух ферментов и лактатдегидрогеназы лактат может превращаться в фосфоенолпируват. Существенное препятствие, однако, заключается в том, что выход оксалоацетата из митохондрии весьма затруднен. Оно преодолевается следующим образом: оксалоацетат превращается в соединение, легко диффундирующее из митохондрии во внемитохондриальный компартмент клетки, где это соединение снова превращается в оксалоацетат. Таким соединением служит малат; его образование из оксалоацетата внутри митохондрий и превращение обратно в оксалоацетат вне митохондрий катализируются малатдегидрогеназой.
2) Превращение фруктозо-1,6- бисфосфата во фруктозо-6-фосфат катализируется специфическим ферментом фруктозо1,6-бисфосфатазой. Это — ключевой фермент в том смысле, что именно его присутствием определяется, способна ли ткань ресинтезировать гликоген из пирувата и триозофосфатов. Этот фермент имеется в печени и почках, он был также обнаружен в поперечнополосатых мышцах. В сердечной мышце и гладких мышцах он отсутствует.
3) Превращение глюкозо-6-фосфата в глюкозу катализируется другой специфической фосфатазой—глюкозо-6- фосфатазой. Она присутствует в печени и почках, но отсутствует в мышцах и жировой ткани. Наличие этого фермента позволяет ткани поставлять глюкозу в кровь.
4) Распад гликогена с образованием глюкозо1-фосфата осуществляется фосфорилазой. Синтез гликогена идет по совершенно другому пути, через образование уридиндифосфатглюкозы, и катализируется гликогенсинтазой.
После переаминирования или дезаминирования глюкогенные аминокислоты образуют либо пируват, либо интермедиат цикла лимонной кислты. Поэтому описанные выше реакции могут обеспечить превращение как глюкогенных аминокислот, так и лактата в глюкозу и гликоген. Так, например, лактат превращается в пируват, который далее поступает в митохондрии, где превращается в оксалоацетат, а затем - в глюкозу.
Глюконеогенез обеспечивает потребности организма в глюкозе в тех случаях, когда диета содержит недостаточное количество углеводов. Постоянное поступление глюкозы в качестве источника энергии особенно необходимо для нервной системы и эритроцитов.
При понижении концентрации глюкозы в крови ниже определенного критического уровня нарушается функционирование мозга; при тяжелой гипогликемии возникает коматозное состояние и может наступить летальный исход.
Глюкоза необходима также для жировой ткани как источник глицерола, входящего в состав глицеридов; она играет, вероятно, существенную роль в поддержании эффективных концентраций интермедиатов цикла лимонной кислоты во многих тканях.
Из этого следует, что даже в условиях, когда большая часть потребностей организма в калориях обеспечивается за счет жира, всегда сохраняется определенная потребность в глюкозе. Кроме того, глюкоза служит единственным видом топлива для работы скелетной мышцы в анаэробных условиях. Она является предшественником молочного сахара (лактозы) в молочных железах и активно потребляется плодом в период развития.
Следует отметить также, что механизм глюконеогенеза используется для удаления из крови продуктов тканевого метаболизма, например лактата, образующегося в мышцах и эритроцитах, глицерола, непрерывно образующегося в жировой ткани.
Пропионат — главная глюкогенная жирная кислота, образующаяся в процессе переваривания углеводов жвачными животными, является главным субстратом глюконеогенеза у этих животных.
Переключение печени с гликолиза на глюконеогенез и обратно происходит с участием инсулина и глюкозагона и осуществляется с помощью:
- аллостерической регуляции активности ферментов;
- ковалентной модификации ферментов путём фосфорилирования/дефосфорилиро вания;
- индукции/репрессии синтеза ключевых ферментов.
- Превращение пирувата в оксалоацетат (фермент пируваткарбоксилаза)
- Превращение оксалоацетата в фосфоенолпируват (фермент фосфоенолпируваткарбоксикиназа)
- Превращение фруктозо-1,6-дифосфата в фруктозо-6-фосфат (фермент фруктозо-1,6-дифосфатаза)
- Превращение глюкозо-6-фосфата в глюкозу (фермент глюкозо-6-фосфатаза)
- ↑ Наглядная биохимия. Ян Кольман, Клаус-Генрих Рем, Юрген Вирт. М., Мир, 2000, с.302
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
Аллостерическии контроль осуществляется регуляции активности ряда ферментов углеводного обмена. При биосинтезе в ходе глюконеогенеза оксалоацетата из бикарбоната и пирувата, катализируемого пируваткарбоксилазои, в качестве аллостерического активатора выступает ацетил-СоА. Последний изменяет конформацию белка в результате уменьшается величина Км для бикарбоната.
Этот эффект также имеет важное значение для саморегуляции промежуточного обмена веществ, поскольку ацетил-СоА, кислоты образующиися из пирувата, активирует пируваткарбоксилазу и тем самым способствует оксалоацетата и его дальнейшему окислению в цикле лимонной кислоты. Активация пируваткарбоксилазы и ингибирование пируватдегидрогеназы, которые вызываются ацетил-СоА, образующимся при окислении жирных кислот, позволяют понять тормозящее действие окисления жирных кислот на окисление пирувата и активирующее влияние на глюконеогенез в печени.
Как в печени, так и в почках регуляция активностей пируватдегидрогеназы и пируваткарбоксилазы имеет реципрокный характер, благодаря этому метаболическая судьба пирувата изменяется при переходе от окисления углеводов, начинающегося с гликолиза, к глюконеогенезу
Окисление жирных кислот обеспечивает глюконеогенез, поставляя АТР, необходимый для протекания реакций, которые катализируются пируваткарбоксилазой и фосфоенолпируваткарбоксикиназо й.
Фосфофруктокиназа (фосфофруктокиназа-1) является еще одним ферментом, регуляция которого осуществляется по принципу обратной связи. Этот фермент играет ключевую роль в регуляции гликолиза. Фосфофруктокиназа-1 ингибируется цитратом и АТР и активируется AMP. Последний функционирует как своего рода индикатор энергетического состояния клетки. Благодаря присутствию аденилаткиназы в клетках печени и многих других тканей быстро достигается равновесие в реакции АТР+АMP 2АDР
Таким образом, при расходовании АТР в потребляющих энергию реакциях и образовании ADP возрастает концентрация AMP. Поскольку в исходном равновесии концентрация АТР может в 50 раз превышать концентрацию AMP, то при сравнительно небольшом уменьшении концентрации АТР может многократно увеличиться концентрация AMP. Таким образом, большое увеличение концентрации АМР действует как своего рода метаболический усилитель при незначительном изменении концентрации АТР.
Данный механизм делает фосфофруктокиназу-1 высокочувствительной к небольшим изменениям энергетического состояния клетки и позволяет регулировать количество углеводов, подвергающихся гликолизу, до их вступления в цикл лимонной кислоты. Увеличение концентрации AMP позволяет также объяснить, почему процесс гликолиза усиливается при недостатке кислорода, когда концентрация АТР снижается. Одновременно AMP активирует фосфорилазу и тем самым усиливает гликогенолиз.
Ингибирование фосфофруктокиназы-1 цитратом и АТР является еще одним путем, который объясняет тормозящее действие окисления жирных кислот на окисление глюкозы; это ингибирование объясняет также эффект Пастера, заключающийся в том, что аэробное окисление субстратов в цикле лимонной кислоты ингибирует анаэробное расщепление глюкозы. Следствием ингибирования фосфофруктоки¬назы-1 является также накопление глюкозо-6-фосфата, который снижает поступление глюкозы во внепеченочные ткани путем аллостерического ингибирования гексокиназы.
Наиболее мощным аллостерическим активатором фосфофруктокиназы-1 и ингибитором фрукто¬зо-1,6-бисфосфатазы печени является фруктозо2.6- бисфосфат. Он снижает ингибирующее действие АТР на фосфофруктокиназу-1 и увеличивает сродство этого фермента к фруктозо-6-фосфату. При ингибировании фруктозо-1,6-бисфосфатазы фруктозо-2.6-бисфосфатом происходит увеличение Км для фруктозо-1,6-бисфосфата. Концентрация фруктозо2.6- бисфосфата регулируется концентрацией фруктозо-6-фосфата и гормонами.
Фруктозо-2.6-бисфосфат образуется при фосфорилировании фруктозо-6-фосфата, катализируемом фосфофруктокиназой-2. Этот фермент является бифункциональным (он обладает также фруктозо-2.6-бисфосфатазной активностью) и находится под. аллостерическим контролем фруктозо-6-фосфата (при повышении концентрации фруктозо-6-фосфата, наблюдаемой в случае избытка глюкозы, происходит стимулирование киназной и ингибирование фосфатазной активности).
С другой стороны, при снижении концентрации глюкозы глюкагон стимулирует образование с АМР; последний активирует сАМР-зависимую протеинкиназу, которая в свою очередь ингибирует фосфофруктокиназу-2 и активирует фруктозо-2,6-бисфосфатазу путем фосфорилирования. Таким образом, при избытке глюкозы увеличивается концентрация фруктозо-2,6-6исфосфата, который активирует фосфофруктокнназу-1 и ингибирует фруктозо-1,6-бисфосфатазу; в результате происходит стимулирование гликолиза. При недостатке глюкозы гликагон уменьшает концентрацию фруктозо-2,6-бисфосфата; это приводит к снижению активности фосфофруктокиназы-1 и повышению активности фруктозо-1,6-бисфосфатазы, в результате чего стимулируется глюконеогенез. Рассмотренный механизм регуляции позволяет понять, каким образом при стимулировании гликогенолиза глюкагоном происходит высвобождение глюкозы и тормозится ее превращение по гликолитическому пути.
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты, так называемые гликогенные аминокислоты, гли-церол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот.
У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе).
Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакции гликолиза (гексокиназная, фосфо-фруктокиназная и пируваткиназная) необратимы, поэтому в процесс глю-конеогенеза на 3 этапах используются другие ферменты. Рассмотрим путь синтеза глюкозы из пирувата.
Образование фосфоенолпирувата из пирувата. Синтез фосфоенолпирувата осуществляется в несколько этапов. Первоначально пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:

Затем оксалоацетат в результате декарбоксилирования и фосфорилирования под влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ):
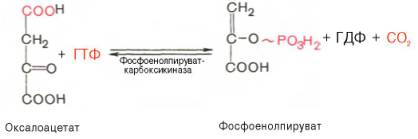
Установлено, что в процессе образования фосфоенолпирувата участвуют ферменты цитозоля и митохондрий.
Первый этап синтеза протекает в митохондриях (рис. 10.6). Пируват-карбоксилаза, которая катализирует эту реакцию, является аллостери-ческим митохондриальным ферментом. В качестве аллостерического активатора данного фермента необходим ацетил-КоА. Мембрана митохондрий непроницаема для образовавшегося оксалоацетата. Последний здесь же, в митохондриях, восстанавливается в малат:

Реакция протекает при участии митохондриальной НАД-зависимой малатдегидрогеназы. В митохондриях отношение НАДН/НАД + относительно велико, в связи с чем внутримитохондриальный оксалоацетат легко восстанавливается в малат, который легко выходит из митохондрии через митохондриальную мембрану. В цитозоле отношение НАДН/НАД + очень мало, и малат вновь окисляется при участии цитоплазматической НАД-зависимой малатдегидрогеназы:
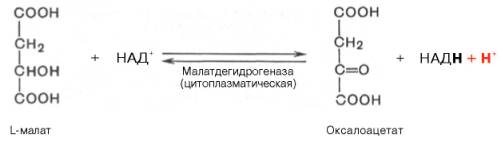
Дальнейшее превращение оксалоацетата в фосфоенолпируват происходит в цитозоле клетки.
Превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат. Фосфо-енолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бис-фосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:
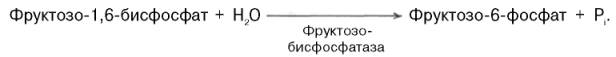
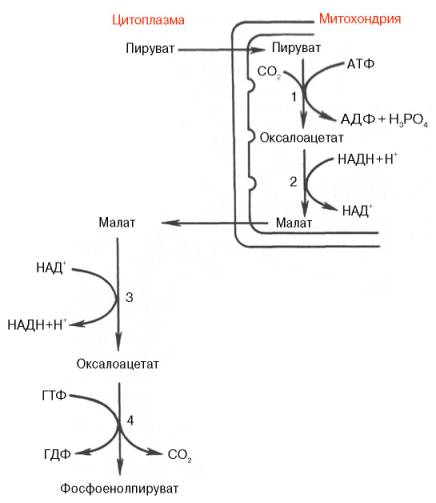
Рис. 10.6. Образование фосфоенол-пирувата из пирувата. 1 - пируваткарбоксилаза; 2 - малатде-гидрогеназа (митохондриальная); 3 -малатдегидрогеназа (цитоплазматиче-ская); 4 - фосфоенолпируват-карбокси-киназа.
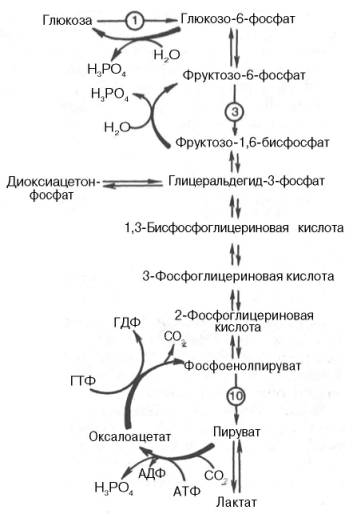
Образование глюкозы из глюкозо-6-фосфата. В последующей обратимой стадии биосинтеза глюкозы фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6-фосфатазы:

Регуляция глюконеогенеза. Важным моментом в регуляции глюконеоге-неза является реакция, катализируемая пируваткарбоксилазой. Роль положительного аллостерического модулятора этого фермента выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил-КоА одновременно является отрицательным модулятором пируватдегидроге-назного комплекса (см. далее). Следовательно, накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует превращению последнего в глюкозу.
Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бисфосфатазой – ферментом, который ингибиру-ется АМФ. Противоположное действие АМФ оказывает на фосфофруктокиназу, т. е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы.
В 1980 г. группой бельгийских исследователей (Г. Херс и др.) в ткани печени был открыт фруктозо-2,6-бисфосфат, который является мощным регулятором активности двух перечисленных ферментов:
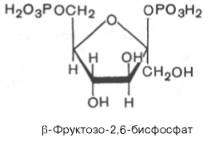
Фруктозо-2,6-бисфосфат активирует фосфофруктокиназу и ингибирует фруктозо-1,6-бисфосфатазу. Повышение в клетке уровня фруктозо-2,6-бис-фосфата способствует усилению гликолиза и уменьшению скорости глю-конеогенеза. При снижении концентрации фруктозо-2,6-бисфосфата отмечается обратная картина.
Установлено, что биосинтез фруктозо-2,6-бисфосфата происходит из фруктозо-6-фосфата при участии АТФ, а распадается он на фруктозо-6-фосфат и неорганический фосфат. Биосинтез и распад фруктозо-2,6-бис-фосфата катализируется одним и тем же ферментом, т.е. данный фермент бифункционален, он обладает и фосфокиназной, и фосфатазной активностью:
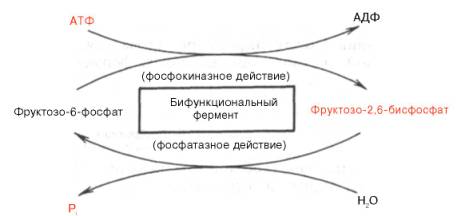
Показано также, что бифункциональный фермент в свою очередь регулируется путем цАМФ-зависимого фосфорилирования. Фосфорилирова-ние приводит к увеличению фосфатазной активности и снижению фосфо-киназной активности бифункционального фермента. Этот механизм объясняет быстрое воздействие гормонов, в частности глюкагона, на уровень фруктозо-2,6-бисфосфата в клетке (см. главу 16).
Активность бифункционального фермента регулируется также некоторыми метаболитами, среди которых наибольшее значение имеет гли-церол-3-фосфат. Действие глицерол-3-фосфата на фермент по своей направленности аналогично эффекту, который наблюдается при его фосфори-лировании с помощью цАМФ-зависимых протеинкиназ.
В настоящее время фруктозо-2,6-бисфосфат, помимо печени, обнаружен и в других органах и тканях животных, а также у растений и микроорганизмов.
Показано, что глюконеогенез может регулироваться и непрямым путем, т.е. через изменение активности фермента, непосредственно не участвующего в синтезе глюкозы. Так, установлено, что фермент гликолиза пиру-ваткиназа существует в 2 формах – L и М. Форма L (от англ. liver – печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингиби-руется избытком АТФ и некоторыми аминокислотами, в частности ала-нином. М-форма (от англ. muscle – мышцы) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией происходит инги-бирование L-формы пируваткиназы. Как следствие ингибирования замедляется гликолиз и создаются условия, благоприятствующие глюконеоге-незу.
Наконец, интересно отметить, что между гликолизом, интенсивно протекающим в мышечной ткани при ее активной деятельности, и глюко-неогенезом, особенно характерным для печеночной ткани, существует тесная взаимосвязь. При максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, в печени значительная ее часть превращается в глюкозу (глюконеогенез). Такая глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани. Взаимосвязь между процессами гликолиза в мышечной ткани и глюконеогенезом в печени может быть представлена в виде схемы:
Глюконеогенез — процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина. Свободные жирные кислоты у млекопитающих для глюконеогенеза не используются.
Содержание
Стадии глюконеогенеза
Стадии глюконеогенеза повторяют стадии гликолиза в обратном направлении и катализируются теми же ферментами за исключением 4 реакций:

Суммарное уравнение глюконеогенеза: 2 CH3COCOOH + 4ATP + 2GTP + 2NADH . H + + 6 H2O = C6H12O6 + 2NAD + 4ADP + 2GDP + 6Pn [1] .
Роль в организме
При голодании в организме человека активно используются запасы питательных веществ (гликоген, жирные кислоты). Они расщепляются до аминокислот, кетокислот и других неуглеводных соединений. Большая часть этих соединений не выводится из организма, а подвергаются реутилизации. Вещества транспортируются кровью в печень из других тканей, и используются в глюконеогенезе для синтеза глюкозы — основного источника энергии в организме. Таким образом при истощении запасов организма, глюконеогенез является основным поставщиком энергетических субстратов.
Примечания
Ссылки
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Глюконеогенез" в других словарях:
глюконеогенез — глюконеогенез … Орфографический словарь-справочник
ГЛЮКОНЕОГЕНЕЗ — процесс образования глюкозы в животном организме (преимущественно в печени) из белков, жиров и других веществ, отличных от углеводов, напр., из глицерина … Большой Энциклопедический словарь
ГЛЮКОНЕОГЕНЕЗ — биохимич. процесс образования глюкозы из неуглеводных предшественников. Общим центр, путём Г. в живых организмах является биосинтез глюкозы из пировиноградной к ты (пирувата). Общее уравнение Г.: 2 пируват + 4 АТФ + 2 ГТФ (ИТФ) + + 2 НАД• Н + 2Н+ … Биологический энциклопедический словарь
глюконеогенез — сущ., кол во синонимов: 1 • реакция (33) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
глюконеогенез — – биосинтез глюкозы, протекает аналогично гликолизу, но в обратном направлении … Краткий словарь биохимических терминов
глюконеогенез — процесс образования глюкозы в животном организме (преимущественно в печени) из белков, жиров и других веществ (не из углеводов), например из глицерина. * * * ГЛЮКОНЕОГЕНЕЗ ГЛЮКОНЕОГЕНЕЗ, процесс образования глюкозы в животном организме… … Энциклопедический словарь
ГЛЮКОНЕОГЕНЕЗ — (от греч. glykys сладкий, neos новый и genesis рождение, происхождение), синтез моносахаридов (гл. обр. глюкозы) из неуглеводных предшественников, происходящий в живых клетках под действием ферментов. Г. осуществляется в направлении, обратном… … Химическая энциклопедия
ГЛЮКОНЕОГЕНЕЗ — процесс образования глюкозы в животном организме (преим. в печени) из белков, жиров и др. в в (не из углеводов), напр. из глицерина. Глухарь: токующий самец и самка (вверху) … Естествознание. Энциклопедический словарь
Читайте также:

