Реферат углерод основа жизни
Обновлено: 05.07.2024
Содержание
Введение……………………………………………………………………. 3
Глава 1 Происхождения углерода
1.1. История открытия углерода………………………………………. 4
1.2. Строение атома углерода………………………. ………………….5
Глава 2 Характеристика свойств углерода
2.1. Физические свойства углерода……………………………………..9
2.2. Химические свойства углерода……………………..…………….10
Заключение…………………………………………………………………13
Список литературы…………………………………………………………14
Приложение………………………………………………….……………..15
Введение
Введение
Для начала приведём общеизвестные данные об углероде. Углерод - химический элемент четвёртой группы периодической системы Менделеева: атомный номер 6, атомная масса 12.011. Температура плавления 3825С0, температура кипения 4817. Имеет два стабильных изотопа 12 - 98,892%, и
13 - 1.008%. Содержание углерода в земной коре составляет 2.3 10-2% по массе.
Углерод – это важнейший биогенный элемент, составляющий основу жизни на Земле. Структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности. Актуальность моей работы заключается в том, что возникновение жизни на Земле рассматривается в современной науке, как сложный процесс эволюции углеродистых соединений. Значительную часть необходимой организмам энергии образует ся в клетках за счет окисления углерода. Уникальная роль углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один другой элемент периодической системы..
Фрагмент работы для ознакомления
Список литературы
Пожалуйста, внимательно изучайте содержание и фрагменты работы. Деньги за приобретённые готовые работы по причине несоответствия данной работы вашим требованиям или её уникальности не возвращаются.
* Категория работы носит оценочный характер в соответствии с качественными и количественными параметрами предоставляемого материала. Данный материал ни целиком, ни любая из его частей не является готовым научным трудом, выпускной квалификационной работой, научным докладом или иной работой, предусмотренной государственной системой научной аттестации или необходимой для прохождения промежуточной или итоговой аттестации. Данный материал представляет собой субъективный результат обработки, структурирования и форматирования собранной его автором информации и предназначен, прежде всего, для использования в качестве источника для самостоятельной подготовки работы указанной тематики.
Все без исключения живые организмы построены из соединений углерода. Особенностью атома углерода является их способность соединяться между собой, образуя сколь угодно длинные цепи, которые могут быть и разветвленными, содержащими миллионы и миллиарды атомов углерода, соединенных с атомами других элементов (самые из известных молекул – это молекулы белков, содержащих до миллиарда углеродных звеньев). Их длина может даже достигать одного метра!
Углерод в организме. Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и другие). Значительная часть необходимой организмам энергии образуется в клетках за счет окисления Углерода. Возникновение жизни на Земле рассматривается в современное науке как сложный процесс эволюции углеродистых соединений.
Уникальная роль Углерода в живой природе обусловлена его свойствами, которыми в совокупности не обладает ни один других элемент периодической системы. Между атомами Углерода, а также между Углеродом и другими элементами образуются прочные химические связи, которые, однако, могут быть разорваны в сравнительно мягких физиологических условиях (эти связи могут быть одинарными, двойными и тройными). Способность Углерода образовывать 4 равнозначные валентные связи с других атомами Углерода создает возможность для построения углеродных скелетов различных типов - линейных, разветвленных, циклических. Показательно, что всего три элемента - С, О и Н - составляют 98% общей массы живых организмов. Этим достигается определенная экономичность в живой природе: при практически безграничном структурном разнообразии углеродистых соединений небольшое число типов химических связей позволяет намного сократить количество ферментов, необходимых для расщепления и синтеза органических веществ. Особенности строения атома Углерода лежат в основе различных видов изомерии органических соединений (способность к оптической изомерии оказалась решающей в биохимической эволюции аминокислот, углеводов и некоторых алкалоидов).
Согласно общепринятой гипотезе А. И. Опарина, первые органических соединения на Земле имели абиогенное происхождение. Источниками Углерода служили метан (СН4) и цианистый водород (HCN), содержавшиеся в первичной атмосфере Земли. С возникновением жизни единственным источником неорганического Углерода, за счет которого образуется все органическое вещество биосферы, является оксид углерода (IV) (СО2), находящийся в атмосфере, а также растворенный в природных водах в виде НСО3. Наиболее мощный механизм усвоения (ассимиляции) Углерода (в форме СО2) - фотосинтез - осуществляется повсеместно зелеными растениями (ежегодно ассимилируется около 100 млрд. т СО2). На Земле существует и эволюционно более древний способ усвоения СО2 путем хемосинтеза; в этом случае микроорганизмы-хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют Углерод с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать автотрофные организмы и гетеротрофные организмы. Применение для биосинтеза белка и других питательных веществ микроорганизмов, использующих в качестве единственного источника Углерода углеводороды нефти, - одна из важных современное научно-технических проблем.
Содержание Углерода в живых организмах в расчете на сухое вещество составляет: 34,5-40% у водных растений и животных, 45,4-46,5% у наземных растений и животных и 54% у бактерий. В процессе жизнедеятельности организмов, в основные за счет тканевого дыхания, происходит окислительный распад органических соединений с выделением во внешнюю среду СО2. Углерод выделяется также в составе более сложных конечных продуктов обмена веществ. После гибели животных и растений часть Углерода вновь превращается в СО2 в результате осуществляемых микроорганизмами процессов гниения. Таким образом происходит круговорот Углерода в природе. Значительная часть Углерода минерализуется и образует залежи ископаемого Углерода: каменные угли, нефть, известняки и другие. Помимо основной функции - источника Углерода - СО2, растворенная в природных водах и в биологических жидкостях, участвует в поддержании оптимальной для жизненных процессов кислотности среды. В составе СаСО3 Углерод образует наружный скелет многих беспозвоночных (например, раковины моллюсков), а также содержится в кораллах, яичной скорлупе птиц и других Такие соединения Углерода, как HCN, СО, ССl4, преобладавшие в первичной атмосфере Земли в добиологический период, в дальнейшем, в процессе биологической эволюции, превратились в сильные антиметаболиты обмена веществ.
Помимо стабильных изотопов Углерода, в природе распространен радиоактивный 14С (в организме человека его содержится около 0,1 мккюри). С использованием изотопов Углерода в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота Углерод в природе. Так, с помощью радиоуглеродной метки была доказана возможность фиксации Н14СО3- растениями и тканями животных, установлена последовательность реакций фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т. д. Применение 14С способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14С в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии
Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент.
Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа пожирают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возврашением в атмосферу, либо захоронением в виде угля или нефти.
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества. В смеси с техническими маслами в качестве смазочного материала. Из смеси графита с глиной изготавливают плавильные тигли. Графит используют в ядерной промышленности, как поглотитель нейтронов.
Кокс применяют в металлургии, как восстановитель. Древесный уголь – в кузнечных горнах, для получения пороха (75%KNO3 + 13%C + 12%S), для поглощения газов (адсорбция), а также в быту. Сажу применяют, как наполнитель резины, для изготовления черных красок – типографская краска и тушь, а также в сухих гальванических элементах. Стеклоуглерод применяют для изготовления аппаратуры для сильно агрессивных сред, а также в авиации и космонавтике.
Активированный уголь поглощает вредные вещества из газов и жидкостей: им заполняют противогазы, очистительные системы, его применяют в медицине при отравлениях.
На первый взгляд, эти понятия совершенно не связаны между собой. Но это - только на первый взгляд. Разобраться в этих понятиях крайне необходимо, чтобы глубже понять все происходящие в органической жизни процессы, а также разобраться в обменных процессах при изучении Природного земледелия. Это понимание поможет вам уяснить, что такое сама Жизнь (углеродная). Эта оговорка не случайна, потому что не вся Жизнь на планете Земля представлена только в углеродной форме, как считалось до недавнего времени. Но об этом позже.
Вся наша жизнь, как и жизнь окружающих нас "живых" существ, возможна благодаря главному химическому элементу этой жизни - углероду (С). Да, мы - существа, как и все остальные, наполовину состоящие из угля - углерода. Этот внушительный удельный вес объясняется универсальностью данного элемента, способного вступать в самые различные химические реакции почти со всеми другими химическими элементами (известными науке). Углерод образовывает с ними самые разные соединения - от самых простых (как глюкоза - соединение углерода с водой), до невероятно огромных полимеров (имеющих большой размер, меру); примером полимеров в быту могут быть различные пластмассы. Углерод способен создавать бесконечные формы, цепи и структуры, вступая в химические реакции почти со всеми веществами, что оказываются поблизости. Все углеродные соединения и их свойства в живой природе изучает специальный раздел химии - биохимия, или по-другому - "химия жизни", а в неживой природе - органическая химия.
Работа состоит из 1 файл
Uglerod_osnova_zhizni.docx
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
Естественно- географический факультет
Выполнил: студент V курса
доцент Нелюбина Е. Г.
Углекислый газ, глюкоза и углеродная жизнь
На первый взгляд, эти понятия совершенно не связаны между собой. Но это - только на первый взгляд. Разобраться в этих понятиях крайне необходимо, чтобы глубже понять все происходящие в органической жизни процессы, а также разобраться в обменных процессах при изучении Природного земледелия. Это понимание поможет вам уяснить, что такое сама Жизнь (углеродная). Эта оговорка не случайна, потому что не вся Жизнь на планете Земля представлена только в углеродной форме, как считалось до недавнего времени. Но об этом позже.
Вся наша жизнь, как и жизнь окружающих нас "живых" существ, возможна благодаря главному химическому элементу этой жизни - углероду (С). Да, мы - существа, как и все остальные, наполовину состоящие из угля - углерода. Этот внушительный удельный вес объясняется универсальностью данного элемента, способного вступать в самые различные химические реакции почти со всеми другими химическими элементами (известными науке). Углерод образовывает с ними самые разные соединения - от самых простых (как глюкоза - соединение углерода с водой), до невероятно огромных полимеров (имеющих большой размер, меру); примером полимеров в быту могут быть различные пластмассы. Углерод способен создавать бесконечные формы, цепи и структуры, вступая в химические реакции почти со всеми веществами, что оказываются поблизости. Все углеродные соединения и их свойства в живой природе изучает специальный раздел химии - биохимия, или по-другому - "химия жизни", а в неживой природе - органическая химия.
Но прежде чем пойти в своих объяснениях дальше, я должен познакомить вас с некоторыми понятиями. Процесс соединения химических элементов иначе называется синтез (этот термин так и переводится - "соединение"). Процесс разложения, или расчленения сложных химических соединений до более простых называется анализ (переводится как "разложение", "расчленение"). Но эти процессы в органической химии невозможны сами по себе, т.е. бесконтрольно, и природа мудро придумала специальные вещества для этого. Таким образом, в процессе соединения (или синтеза) используются специальные вещества, которые управляют этим процессом, ускоряя его, и называются они катализаторы. Они взаимодействуют с исходными веществами химических реакций, но не расходуются и не входят в состав синтезируемых продуктов. Это своего рода нейтральные "ускорители"; без их присутствия синтез либо невозможен, либо протекает очень медленно (но сами они при этом остаются неизменными).
Роль ускорителей химических реакций в живых клетках выполняют вещества несколько другой структуры, специальные белки - ферменты, очень сложные специфические соединения. Это тоже катализаторы, но для процессов в живых клетках, или живой природе. В основе биокатализа, или ферментативного катализа лежат те же химические закономерности, что и в основе небиологического катализа (ускорение химических реакций, их контроль).
Ферменты, или биологические катализаторы присутствуют во всех живых клетках. Без них не обходится ни одна химическая реакция. Они своего рода строгие "контролеры". Но их роль двояка: ферменты участвуют как в синтезе (соединении), так и в анализе (расщеплении) - в этом их универсальность. Но каждый вид ферментов "ускоряет", или катализирует, превращение определенных веществ, иногда лишь единственного и в единственном направлении (синтеза или анализа). Поэтому многочисленные химические реакции в организме животных и растений осуществляются огромным количеством различных ферментов. Так мудро задумано природой - чтобы химические реакции не происходили сами по себе, стихийно, а строго регламентировались в зависимости от потребностей организма. Это самая общая схема порядка биохимических процессов, это регулирующая основа жизни.
Итак, мы уяснили, что без ферментов - биологических катализаторов - ничего не происходит в органической жизни, никакие биохимические реакции и превращения. Ферменты - основа биохимии животных, растений и грибов. Но в первичном процессе синтеза - образовании молекулы глюкозы как основы всей органической жизни и источника энергии - роль "катализатора" в листьях растений (если допустить такое сравнение) выполняет зелёное вещество - хлорофилл. Процесс этот сложный, я не стану его описывать. Для общего понимания сути этого и не требуется - просто следует знать, что такой процесс происходит. Далее все функции передаются ферментам, основным регуляторам биохимических процессов. Эти понятия пригодятся нам для дальнейшего изучения процессов синтеза (образования) гумуса, процессов "переваривания" (расщепления) микробами, грибами и червями разлагающихся органических остатков (детрита) под действием ферментов.
Но вернемся к углероду как основному химическому элементу, составляющему органическую жизнь. Я уже упомянул, что первичным органическим веществом, в состав которого входит углерод, является глюкоза. Глюкоза (дословный перевод - "сладкая") - моносахарид, наиболее распространенный в природе. В свободном состоянии глюкоза содержится в мёде, нектаре, тканях растений и животных, крахмале, является составной частью клетчатки и лигнина (полимеров, составляющих "остов" растений). Глюкоза в организме растений и животных - главный источник энергии. Углеродный обмен очень сложный, но всё начинается с образования глюкозы, а заканчивается расщеплением глюкозы.
Вот как это выглядит в упрощенной схеме. При синтезе идет поглощение солнечной энергии листьями растений, и под действием хлорофилла из углекислого газа и воды образуется молекула глюкозы (для этого требуется несколько молекул углекислого газа и воды). При расщеплении молекулы глюкозы под действием ферментов происходит обратный процесс - высвобождение энергии и образование молекул углекислого газа и воды. Таким образом, при синтезе идет поглощение энергии, при расщеплении - выделение энергии. Именно таким способом растения, животные и человек получают энергию для своего роста и движения во всём организме.
Здесь существует очень важный момент для понимания: эти процессы сопровождаются выделением и поглощением молекул кислорода (часть процесса дыхания). При синтезе молекулы глюкозы кислород выделяется листьями растений (весь этот процесс называется "углеродное питание растений"). При расщеплении молекулы глюкозы, наоборот, идет поглощение молекул кислорода (процесс под названием "окисление"); при окислении происходит высвобождение энергии. Всё это сопровождается процессами обмена (поглощением кислорода и высвобождением молекул углекислого газа) под названием "дыхание". Вот почему так важен кислород воздуха в обменных процессах: без него невозможны процессы дыхания и окисления, а в итоге - получения энергии, необходимой для роста. Не менее важен и углекислый газ воздуха как поставщик углеродного питания растений (и источник кислорода при синтезе молекул глюкозы).
В природе эти процессы взаимно уравнивают друг друга: в замкнутой системе - сколько элементов углерода и кислорода расходуется, столько же их и выделяется. Эти процессы постоянно взаимосвязаны, и если какого-то элемента не хватает, происходит нарушение самой жизни. При нехватке кислорода растения, животные и человек задыхаются; без кислорода растения не могут получить энергию для роста. И при нехватке углекислого газа прекращается рост растений. И это очень важный момент для понимания. Растениям "как воздух" необходим углекислый газ; без него они ни могут расти, строить ткани своего организма. Однако содержание углекислого газа в атмосферном воздухе очень мало (около 0,03%). В солнечные дни растения поглощают углекислый газ столь интенсивно, что его концентрация в непосредственной близости от листьев заметно падает.
Основными поставщиками углекислого газа в почву и атмосферу (особенно, в её приземный слой) являются почвенные обитатели: аэробные микробы, грибы и животные (черви и др.). Именно они "производят" необходимое растениям количество углекислого газа как источника их углеродного питания. Поэтому, заботясь о повышении количества этих "незримых помощников" - микробов, грибов и червей - мы улучшаем условия жизни нашим растениям, обеспечивая их углеродом - основным источником питания растений.
Так вот о чём надо заботиться в первую очередь! Не "удобрять" почву химическими удобрениями - они яд для микробов, грибов и червей - а, наоборот, ни в коем случае не применять химические удобрения. Как бы ни описывали "внешне убедительно" сторонники такой агротехники полезность удобрений для получения больших урожаев - знайте, это самообман. В погоне за прибавкой урожая люди начинают принимать эти слова на веру головой, и не "думают сердцем" - они забывают, что сами являются частью природы, которую губят своими неразумными действиями.
Прошу вас, не уподобляйтесь глупцам.
Чтобы получать высокие урожаи и здоровую продукцию, вовсе не нужны удобрения. Для этого достаточно понять истинные процессы, которые происходят в природе, и сделать правильный вывод: надо "разводить" наших помощников - микробов, грибы и червей - у себя на огороде и в саду, как разводят домашних животных, заботясь об их численности и здоровье. Как это делать, я рассказывал в предыдущей статье, но повторюсь. Необходимо создать им "дом" - толстый слой органической мульчи, что одновременно обеспечит их и кормом. Вот и весь "секрет" больших урожаев, и при том БЕСПЛАТНО. В природе всё сбалансировано и взаимосвязано - только не надо об этом забывать и от этого отступать, нарушать этот баланс.
Итак, я рассказал вам об основных понятиях углеродной жизни на Земле, о её основе - углероде и глюкозе. Усвоив это, вы поймёте все тонкости Природного земледелия.
В конце - небольшое отступление от этой темы. До недавнего времени считалось, что основой жизни на Земле является углерод. Но оказалось, что таким же универсальным химическим элементом является кремний, местоположение которого в периодической системе химических элементов по отношению к углероду отличается на порядок. Кремний, как и углерод, способен вступать в химические реакции практически со всеми элементами. Он образует (на 87%) основной пласт поверхности Земли, её "кору" в виде различных минералов. Теоретически ученые допускали возможность существования "кремниевой жизни", но не находили таких доказательств на Земле; высказывались предположения о существовании кремниевой формы жизни на других планетах. Но относительно недавно и на Земле были обнаружены существа, в основе жизни которых лежит кремний, а не углерод. Это глубоководные губки, которым совсем не нужен солнечный свет; они способны развиваться и жить в кромешной тьме. Ученые сейчас изучают такое проявление жизни. Из этого примера следует очевидное: гипотезы о том, что и камни "живые" имеют под собой реальное обоснование и подтверждение. Кстати, компьютерный "интеллект" основан на кремниевых соединениях.
Эта информация никак не относится к теме Природного земледелия, разве что еще раз подтверждает мысль о том, что ещё не познан мир вокруг нас - многообразный и огромный (а, вместе с тем, он хрупкий и уязвимый). Это еще один аргумент в пользу того, что если мы чего-то не понимаем в Природе (в силу своей ограниченности), это вовсе не значит, что этого не существует. Ведь человечество пока не знает и доли того, что происходит в Природе на самом деле - но, при этом, оно берёт на себя смелость активно вмешиваться в её процессы, не предполагая о последствиях. Подумайте над этим.
Три формы углерода
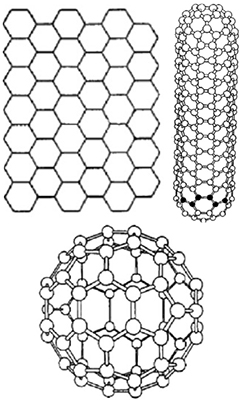
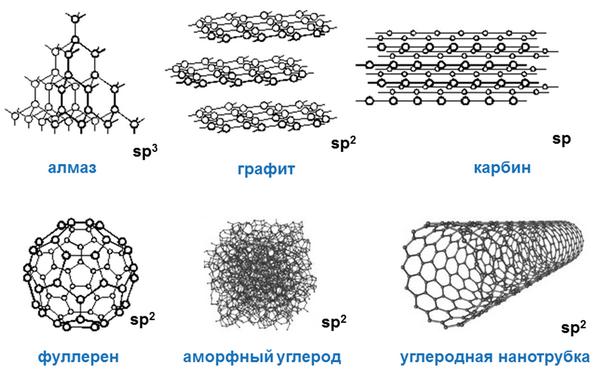
Углерод — удивительное вещество, физические свойства которого и даже внешний вид описать однозначно просто невозможно. Этот элемент — рекордсмен по количеству аллотропных модификаций. Три формы углерода:
• кристаллическая: алмазы, наноалмазы, фуллерены, фуллерит, графиты, карбины, лонсдейлиты, углеродные нанотрубки и нановолокна, графен, волокна и структуры;
• аморфная: угли (древесный, в том числе активированный уголь, антрацит и др.), коксы, сажа, углеродная нанопена, стеклоуглерод, техуглерод;
• кластерная: астралены, диуглерод, углеродные наноконусы.

Молекулы кристаллического углерода характеризуются правильной кристаллической решеткой. Большинство форм кристаллического углерода отличаются очень высокой твердостью и тугоплавкостью. Алмаз обладает высокой плотностью, почти не проводит тепло и ток. Графит, наоборот, имеет невысокую плотность и слоистое строение; проводит ток, может возгоняться, минуя жидкое состояние.
Вещества, относящиеся к аморфным формам, не являются чистой формой углерода, но содержат углерод в очень значительных количествах. Для аморфного углерода характерна высокая теплоемкость, свойства полупроводников, невысокая плотность, относительно невысокая термостойкость — при температуре выше 1600 °С он превращается в графит. Как правило, их основой являются разные формы мелкокристаллического графита в виде неупорядочной структуры.
Углеродные кластеры — сложные соединения с очень интересными свойствами. Им, а также другим перспективным материалам на основе углерода, мы посвятим одну из ближайших статей.
Химические свойства
С химическими свойствами немного проще. В нормальных условиях углерод практически не вступает в реакции с другими элементами и веществами, инертен к кислотам, щелочам, галогенам. При высоких температурах проявляет сильные восстановительные свойства. Наиболее химически активны аморфные виды углерода, наиболее инертны — кристаллические. Графит по химической активности занимает серединное положение. При высоких температурах углерод окисляется кислородом (горит), образует несколько видов оксидов.
Графит и аморфный углерод при высоких температурах реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).
Следующая статья будет о содержании углерода в природе, его опасности и сферах применения.

Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Место в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12 С (98,892%) и 13 С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14 С с периодом полураспада 5,73*10 3 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s 2 2s 2 2p 2 . Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
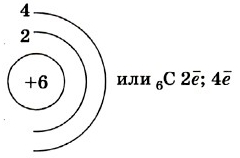
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C 0 + O2 – t° = CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C 0 + O2 – t° = 2C +2 O угарный газ
— с водяным паром
C 0 + H2O – 1200° = С +2 O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C 0 + 2CuO – t° = 2Cu + C +4 O2
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
Ca + 2C 0 = CaC2 -4
Вступая в реакцию с водородом, углерод образует метан:
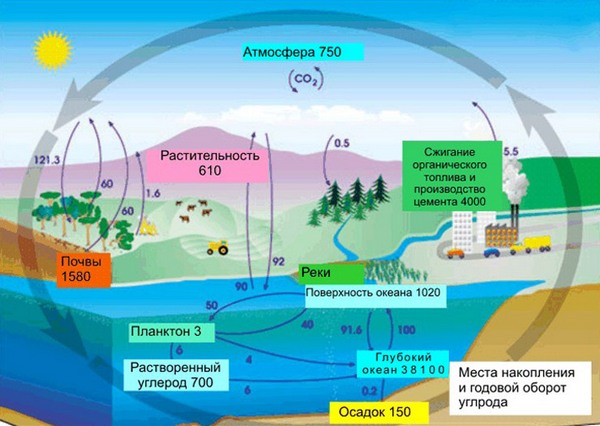
Роль в природе
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
Применение
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.
Читайте также:

