Реферат обратимость химических реакций
Обновлено: 07.07.2024
Изучение особенностей и закономерностей течения химических реакций, как продолжение формирования представлений о различных типах химических реакций по признаку обратимости.
Обобщение и конкретизация знаний о закономерностях химических реакций, формирование умений и навыков определять, объяснять особенности и, вытекающие из них условия, необходимые для протекания той или иной реакции.3) Расширить и углубить знания о многообразии химических процессов 4) Рассмотреть этот раздел химической науки как важнейший в прикладном аспекте и рассмотреть представления о химическом равновесии - как частном случае единого закона природного равновесия, стремления к компенсации, устойчивости равновесия в единстве с основной формой существования материи, движении, динамики.
Содержание
Введение…………………………………………………………. 1
Равновесие в химических реакция……………………………….2
Смещение химического равновесия. Принциа Ле-Шателье…. 5
Скорость реакции и равновесие………………………………….7
Список используемой литературы………………………………13
Работа состоит из 1 файл
Химия реферат.docx
ГБОУ ВПО ВГМУ Минздравсоцразвития России
Реферат на тему
Выполнила: студентка 101 группы стоматологического факультета Воронцова Дарья
Преподаватель: Ситникова А.А.
Зам кафедры: Иванова Н.С.
Равновесие в химических реакция……………………………….2
Смещение химического равновесия. Принциа Ле-Шателье…. 5
Скорость реакции и равновесие………………………………….7
Список используемой литературы………………………………13
Введение
- Изучение особенностей и закономерностей течения хими ческих реакций, как продолжение формирования представлений о различных типа х химических реакций по признаку обратимости.
- Обобщение и конкретизация знаний о закономерностях химических реакций, формирование умений и навыков определять, объяснять особенности и, вытекающие из них условия, необходимые для протекания той или иной реакции.3) Расширить и углубить знания о многообразии химических процессов 4) Рассмотреть этот раздел химической науки как важнейший в прикладн ом аспекте и рассмотреть представ ления о химическом равновесии - как частном случае единого закона природного равновесия, стремления к компенсации, устойчивости равновесия в единстве с основной формой существования материи, движении, динамики.
- Рассмотреть тему: “Обратимые и необратимые реакции" на конкретных примерах, используя предшествующие представления о скорости химических реакций.
- Продолжить изучение особенностей обратимых химических реакций и формирование представлений о химическом равновесии как динамичном состоянии реагирующей системы.
- Изучить принципы смещения химического равновесия и пронаблюдать условия смещения химического равновесия.
Равновесие в химических реакциях
Химические реакции - это явления, при которых одно (или одни) вещества превращаются в другие, доказательством этого являются видимые и невидимые изменения. Видимые: изменения цвета, запаха, вкуса, выпадение осадка, изменение окраски индикатора, поглощение и выделение тепла. Невидимые: изменение состава вещества, которое можно определить с помощью качественных и аналитических реакций. Все эти реакции можно подразделить на два типа: обратимые и необратимые реакции.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB pC + dD константа равновесия равна
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции. В состоянии равновесия молекулы не перестают испытывать соударения, и между ними не прекращается взаимодействие, но концентрации веществ остаются постоянными. Эти концентрации называются равновесными.
Равновесная концентрация - концентрация вещества, участвующего в обратимой химической реакции, достигшей состояния равновесия.
Равновесная концентрация обозначается формулой вещества, взятой в квадратные скобки, например:
Как и любая другая концентрация, равновесная концентрация измеряется в молях на литр.
Если бы в рассмотренных нами примерах мы взяли другие концентрации исходных веществ, то после достижения равновесия получили бы другие значения равновесных концентраций. Эти новые значения (обозначим их звездочками) будут связаны со старыми следующим образом:
В общем случае для обратимой реакции aA + bB dD + fF в состоянии равновесия при постоянной температуре соблюдается соотношение
Это соотношение носит название закон действующих масс, который формулируется следующим образом:
при постоянной температуре отношение произведения равновесных концентраций продуктов реакции, взятых в степенях, равных их коэффициентам, к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их коэффициентам, есть величина постоянная.
Постоянная величина (КС) называется константой равновесия данной реакции. Индекс " с" в обозначении этой величины показывает, что для расчета константы использовались концентрации.
Если константа равновесия велика, то равновесие сдвинуто в сторону продуктов прямой реакции, если мала, то - в сторону исходных веществ. Если константа равновесия очень велика, то говорят, что реакция " практически необратима", если константа равновесия очень мала, то реакция " практически не идет".Константа равновесия - для каждой обратимой реакции величина постоянная только при постоянной температуре. Для одной и той же реакции при разных температурах константа равновесия принимает разные значения.Приведенное выражение для закона действующих масс справедливо только для реакций, все участники которых представляют собой либо газы, либо растворенные вещества. В других случаях уравнение для константы равновесия несколько меняется.
Например, в протекающей при высокой температуре обратимой реакции
участвует твердый графит С (гр). Формально, пользуясь законом действующих масс, запишем выражение для константы равновесия этой реакции, обозначив ее К':
Твердый графит, лежащий на дне реактора, реагирует только с поверхности, и его " концентрация" не зависит от массы графита и постоянна при любом соотношении веществ в газовой смеси.
Умножим правую и левую части уравнения на эту постоянную величину:
Получившаяся величина и есть константа равновесия этой реакции:
Аналогичным образом, для равновесия другой обратимой реакции, протекающей также при высокой температуре, CaCO3 (кр) СаО (кр) + СО2 (г), получим константу равновесия КС = [CO2].
В этом случае она просто равна равновесной концентрации углекислого газа.
С метрологической точки зрения константа равновесия не является одной физической величиной. Это группа величин с различными единицами измерений, зависящими от конкретного выражения константы через равновесные концентрации. Например, для обратимой реакции графита с углекислым газом [Kc] = 1 моль/л, такая же единица измерений и у константы равновесия реакции термического разложения карбоната кальция, а константа равновесия реакции синтеза йодоводорода - величина безразмерная. В общем случае [Kc] = 1 (моль/л) n .
Смещение химического равновесия. Принцип Ле Шателье
Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии. Так как почти все реакции в той или иной степени обратимы, в промышленности и лабораторной практике возникают две проблемы: как получить продукт " полезной" реакции с максимальным выходом и как уменьшить выход продуктов " вредной" реакции. И в том, и в другом случае возникает необходимость сместить равновесие либо в сторону продуктов реакции, либо в сторону исходных веществ. Чтобы научиться это делать, надо знать, от чего зависит положение равновесия любой обратимой реакции.
Положение равновесия зависит:
- от значения константы равновесия (то есть от природы реагирующих веществ и температуры),
- от концентрации веществ, участвующих в реакции и 3) от давления (для газовых систем оно пропорционально концентрациям веществ).
- На состояние равновесия оказывает влияние температура.
- Если хотя бы один из участников обратимой реакции является газом, на состояние равновесия оказывает влияние давление.
- На состояние равновесия можно повлиять изменением концентрации реагирующих веществ.
Для качественной оценки влияния на химическое равновесие всех этих очень разных факторов используют универсальный по своей сути принцип Ле Шателье (французский физикохимик и металловед Анри Луи Ле Шателье сформулировал его в 1884 году), который применим к любым равновесным системам, не только химическим.
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в направлении, в котором происходит частичная компенсация этого воздействия.
В качестве примера влияния на положение равновесия концентраций веществ-участников реакции рассмотрим обратимую реакцию получения йодоводорода
По закону действующих масс в состоянии равновесия
Пусть в реакторе объемом 1 литр при некоторой постоянной температуре установилось равновесие, при котором концентрации всех участников реакции одинаковы и равны 1 моль/л ([H2] = 1 моль/л; [I2] = 1 моль/л; [HI] = 1 моль/л). Следовательно, при этой температуре КС = 1. Так как объем реактора 1 литр, n (H2) = 1 моль, n (I2) = 1 моль и n (HI) = 1 моль. В момент времени t 1 введем в реактор еще 1 моль HI, его концентрация станет равной 2 моль/л. Но, чтобы КС оставалась постоянной, должны увеличиться концентрации водорода и йода, а это возможно только за счет разложения части йодоводорода по уравнению
Пусть к моменту достижения нового состояния равновесия t 2 разложилось x моль HI и, следовательно, образовалось дополнительно по 0,5x моль H2 и I2. Новые равновесные концентрации участников реакции: [H2] = (1 + 0,5x) моль/л; [I2] = (1 + 0,5x) моль/л; [HI] = (2 - x) моль/л. Подставив числовые значения величин в выражение закона действующих масс, получим уравнение
Откуда x = 0,667. Следовательно, [H2] = 1,333 моль/л; [I2] = 1,333 моль/л; [HI] = 1,333 моль/л.
Скорость реакции и равновесие
Пусть есть обратимая реакция A + B C + D. Если предположить, что прямая и обратная реакция проходят в одну стадию, то скорости этих реакций будут прямо пропорциональны концентрациям реагентов: скорость прямой реакции v1 = k1 [A] [B], скорость обратной реакции v2 = k2 [C] [D] (квадратными скобками обозначены молярные концентрации реагентов). Видно, что по мере протекания прямой реакции концентрации исходных веществ А и В снижаются, соответственно, уменьшается и скорость прямой реакции. Скорость же обратной реакции, которая в начальный момент равна нулю (нет продуктов C и D), постепенно увеличивается. Рано или поздно наступит момент, когда скорости прямой и обратной реакций сравняются. После этого концентрации всех веществ - А, В, С и D не изменяются со временем. Это значит, что реакция достигла положения равновесия, а не изменяющиеся со временем концентрации веществ называются равновесными. Но, в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции - и прямая, и обратная - продолжают идти, однако их скорости равны и поэтому кажется, что никаких изменений в системе не происходит. Доказать протекание прямой и обратной реакций после достижения равновесия можно множеством способов. Например, если в смесь водорода, азота и аммиака, находящуюся в положении равновесия, ввести немного изотопа водорода - дейтерия D2, то чувствительный анализ сразу обнаружит присутствие атомов дейтерия в молекулах аммиака. И наоборот, если ввести в систему немного дейтерированного аммиака NH2D, то дейтерий тут же появится в исходных веществах в виде молекул HD и D2. Другой эффектный опыт был проведен на химическом факультете МГУ. Серебряную пластинку поместили в раствор нитрата серебра, при этом никаких изменений не наблюдалось. Затем в раствор ввели ничтожное количество ионов радиоактивного серебра, после чего серебряная пластинка стала радиоактивной. Эту радиоактивность не могло "смыть" ни споласкивание пластинки водой, ни промывание ее соляной кислотой. Только травление азотной кислотой или механическая обработка поверхности мелкой наждачной бумагой сделало ее неактивной. Объяснить этот эксперимент можно единственным образом: между металлом и раствором непрерывно происходит обмен атомами серебра, т.е. в системе идет обратимая реакция Ag (тв) - е - = Ag + . Поэтому добавление радиоактивных ионов Ag + к раствору приводило к их "внедрению" в пластинку в виде электронейтральных, но по-прежнему радиоактивных атомов. Таким образом, равновесными бывают не только химические
реакции между газами или растворами, но и процессы растворения металлов, осадков. Например, твердое вещество быстрее всего растворяется, если его поместить в чистый растворитель, когда система далека от равновесия, в данном случае - от насыщенного раствора. Постепенно скорость растворения снижается, и одновременно увеличивается скорость обратного процесса - перехода вещества из раствора в кристаллический осадок. Когда раствор становится насыщенным, система достигает состояния равновесия, при этом скорости растворения и кристаллизации равны, а масса осадка со временем не меняется. Как система может "противодействовать" изменению внешних условий? Если, например, температуру равновесной смеси повышают нагреванием, сама система, конечно, не может "ослабить" внешний нагрев, однако равновесие в ней смещается таким образом, что для нагревания реакционной системы до определенной температуры требуется уже большее количество теплоты, чем в том случае, если бы равновесие не смещалось. При этом равновесие смещается так, чтобы теплота поглощалась, т.е. в сторону эндотермической реакции. Это и можно трактовать, как "стремление системы ослабить внешнее воздействие". С другой стороны, если в левой и правой частях уравнения имеется неодинаковое число газообразных молекул, то равновесие в такой системе можно сместить и путем изменения давления. При повышении давления равновесие смещается в ту сторону, где число газообразных молекул меньше (и таким способом как бы "противодействует" внешнему давлению). Если же число газообразных молекул в ходе реакции не меняется (H2 + Br2 (г) 2HBr, СО + Н2О (г) СО2 + Н2), то давление не влияет на положение равновесия. Следует отметить, что при изменении температуры изменяется и константа равновесия реакции, тогда как при изменении только давления она остается постоянной.
Несколько примеров использования принципа Ле Шателье для предсказания смещения химического равновесия. Реакция 2SO2 + O2 2SO3 (г) экзотермична. Если повысить температуру, преимущество получит эндотермическая реакция разложения SО3 и равновесие сместится влево. Если же понизить температуру, равновесие сместится вправо. Так, смесь SО2 и О2, взятых в стехиометрическом соотношении 2: 1 (, при температуре 400° С и атмосферном давлении превращается в SО3 с выходом около 95%, т.е. состояние равновесия в этих условиях почти полностью смещено в сторону SО3. При 600° С равновесная смесь содержит уже 76% SО3, а при 800° С - только 25%. Именно поэтому при сжигании серы на воздухе образуется в основном SО2 и лишь около 4% SО3.

Видеофрагмент позволяет понять, что такое обратимость химических реакций и химическое равновесие. В уроке рассказано о способах смещения химического равновесия.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Обратимость химических реакций. Химическое равновесие"
Все химические реакции делятся на обратимые и необратимые. Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций тэрмического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра один), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
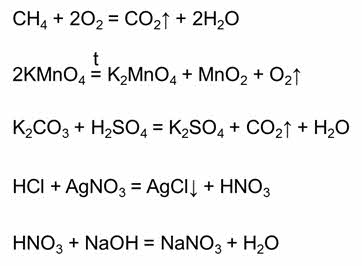
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
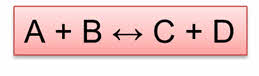
Реакция образования веществ Цэ и Дэ является прямой, а реакция образования А и Бэ является обратной.

Обратимыми являются также реакции этэрификации – это реакции взаимодействия карбоновых кислот со спиртами.
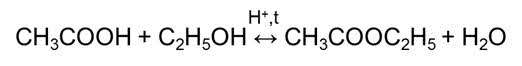
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.
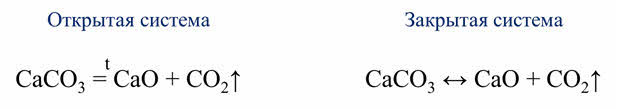
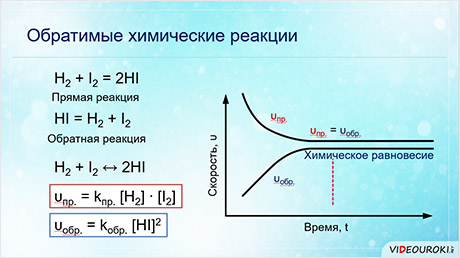
Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
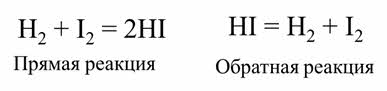
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
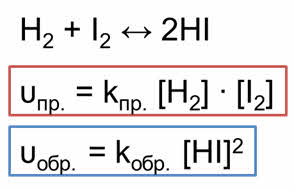
Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
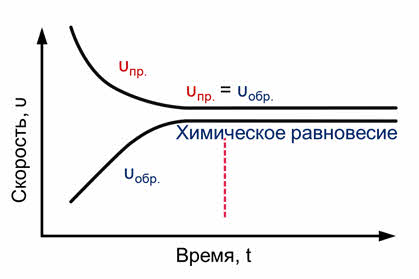
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же обратной реакции увеличивается, потому что концентрация образующегося йодоводорода увеличивается. Как только скорость прямой реакции окажется равной скорости обратной реакции, наступит химическое равновесие. Это равновесие считается динамическим, так как идут и прямая, и обратная реакции, скорости их также равны, а значит и концентрации веществ не изменяются. То есть их концентрации являются равновесными.
Если рассмотреть реакцию образования веществ Цэ и Дэ из А и Бэ, то скорость прямой реакции будет равна произведению равновесных концентраций А и Бэ с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций Цэ и Дэ с учётом их стереохимических коэффициентов.
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое равновесие является подвижным. То есть изменения внешних условий ведёт к смещению или сдвигу химического равновесия. Состояние же химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому для таких химических реакций нужно создавать условия, когда равновесие будет смещаться в нужную сторону.
Направление смещения равновесия определяется принципом, который сформулировал французский учёный Ле Шатэлье в 1884 году.

Согласно этому принципу, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На смещение химического равновесия влияют такие факторы, как концентрация реагирующих веществ, температура и давление.
Рассмотрим влияние концентрации на смещение химического равновесия. Как правило, при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
Так, в реакции получения оксида серы шесть из оксида серы четыре и кислорода, при увеличении концентрации оксида серы четыре равновесие смещается вправо, то есть в сторону прямой реакции.

Аналогично, при увеличении концентрации кислорода, равновесие смещается в сторону прямой реакции, то есть в сторону образования оксида серы шесть. При увеличении концентрации оксида серы шесть равновесие смещается в сторону обратной реакции, то есть влево.
Следовательно, при уменьшении концентрации оксида серы четыре и кислорода равновесие смещается влево, то есть в сторону обратной реакции, при уменьшении концентрации оксида серы шесть равновесие смещается в сторону образования оксида серы шесть, то есть в сторону прямой реакции.
Рассмотрим пример реакции взаимодействия хлорида железа три и роданида калия. В результате реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой. Если к хлориду железа три добавить роданид калия, то образуется раствор кроваво-красного цвета.
Разделим этот раствор на три равные части. В первую пробирку добавим роданид калия и раствор приобретает ещё более насыщенный кроваво-красный цвет, так как равновесие сместилось в сторону продуктов реакции. К третьей пробирки добавим твёрдый хлорид калия, раствор стал более светлым, то есть равновесие сместилось, в данном случае, в сторону исходных веществ.
Из этого опыта понятно, что при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции, равновесие смещается в сторону исходных веществ.
Рассмотрим, как влияет изменение температуры на смещение химического равновесия. Для начала большинства химических реакций необходимо нагреть исходные вещества, чтобы частицы получили необходимую энергию. Однако скорость прямой и обратной реакции зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
Как правило, увеличение температуры ведёт к увеличению скорости реакции. Для того, чтобы узнать как температура повлияет на смещение равновесия нужно знать тепловой эффект реакции. Так реакция превращения оксида азота четыре в его димер, является экзотэрмической.
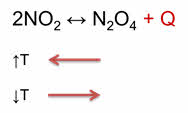
При увеличении температуры равновесие смещается в сторону эндотэрмической реакции, а при уменьшении температуры равновесие смещается в сторону экзотэрмической реакции.
Для подтверждения этого проведём следующий эксперимент. В одну ёмкость нальём горячую воду, в другую – холодную. Опустим в две ёмкости колбы с бурым газом – оксидом азота четыре. Во второй колбе, которая опущена в холодную воду, газ бледнеет, так как оксид азота четыре переходит в его димер, который является бесцветным.
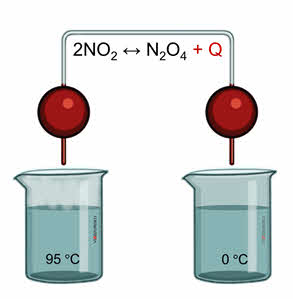
Как же влияет давление на смещение химического равновесия? Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. При увеличении давления увеличивается концентрация газообразных веществ.
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
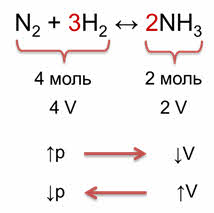
Таким образом, при увеличении давления равновесие смещается в сторону той реакции, при которой объём образующихся газообразных веществ уменьшается, и, наоборот, при уменьшении давления равновесие смещается в сторону той реакции, которая приводит к увеличению объёма. То есть, при увеличении давления равновесие смещается в сторону образования аммиака (вправо), а при уменьшении давления равновесие смещается в сторону исходных веществ (влево).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.
Определение скорости химической реакции в химической кинетике, факторы, влияющие на нее. Сущность и принципы химического равновесия: обратимость реакций и константа равновесия. Причины и последствия смещения химического равновесия, принцип Ле Шателье.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 26.02.2015 |
| Размер файла | 36,1 K |
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ОМСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ ИМ П.А. СТОЛЫПИНА
ТЕМА: Скорость химических реакций. Химическое равновесие
1. Скорость химической реакции
2. Химическое равновесие
2.1 Обратимость реакций
2.2 Константа равновесия
2.3 Смещение химического равновесия. Принцип Ле Шателье
Раздел химии, изучающий скорость и механизмы химических реакций, называется химической кинетикой.
Не каждая термодинамически возможная реакция, для которой энергия Гиббса отрицательна (AG с г с у = ±Лс/Лт,
где Сь С2 - концентрации вещества в момент времени ij и т2;
Ti, i2 - момент времени.
Иногда вместо концентрации практикуется изменение других величин, связанных с концентрацией, - массы, давления, объема, электропроводности, окраски и т.д.
На скорость реакций влияют природа и концентрация взаимодействующих веществ, температура и катализаторы. На скорость гетерогенных реакций, которые осуществляются на поверхности раздела фаз, влияет также величина этой поверхности, т.е. размер частиц твердого вещества, а на скорость цепных реакций - размеры и форма реакционного сосуда, так как при соударении промежуточных активных частиц с внутренней поверхностью реактора они теряют свою активность и способность продолжать цепочку превращений.
Скорость реакции по мере ее протекания изменяется. Если реакция проводится в закрытой системе (без добавления реагентов извне), то ее скорость максимальна вначале, когда концентрации реагентов самые большие и число столкновений между молекулами максимально. По мере протекания реакции концентрации реагентов, число столкновений и скорость уменьшаются. Такова общая закономерность. Однако, встречаются реакции, скорость которых постоянна. Известны автокаталитические реакции (продукты реакции являются ее катализаторами), скорость которых по мере их протекания сначала возрастает, а потом уменьшается, а также автоколебательные реакции, скорость которых то уменьшается, то увеличивается.
2. Химическое равновесие
2.1 Обратимость реакций
Химическая реакция самопроизвольно протекает в прямом направлении, если ее энергия Гиббса AG 0. Теоретически (изменением температуры, давления и концентрации) можно для любой реакции изменить знак AG, т.е. любую реакцию провести как в прямом, так и в обратном направлении. Однако в действительности имеются реакции совершенно необратимые, практически необратимые и обратимые.
Теоретически (при давлении кислорода около 10“ Па) эта реакция может протекать в обратном направлении, однако практически такое давление на Земле создать невозможно.
Практически необратимыми являются такие реакции, в которых обратный процесс подавляется за счет огромного избытка исходных веществ или когда продукты взаимодействия выводятся из зоны реагирования, например, молекулярно-ионные реакции в растворах с образованием слабого электролита, осадка, газа или комплексного соединения:
НС1 + NaOH = NaCl + Н20;
Однако даже слабые электролиты и самые прочные комплексы немного диссоциируют на ионы, а самые малорастворимые вещества и самые летучие газы немного растворяются, поэтому в таких процессах идут в незначительной степени обратные реакции, которыми в некоторых случаях пренебречь нельзя (такие случаи рассматриваются при изучении растворов).
Обратимыми (или двусторонними) являются реакции, которые идут в обоих направлениях - прямом и обратном, например:
Обратимая химическая реакция через некоторое время после ее начала приходит в состояние химического равновесия. Химическое равновесие изучает и объясняет химическая термодинамика. Состояние химического равновесия с позиций термодинамики - это тот предел, до которого в данных условиях реакция протекает самопроизвольно.
Движущей силой любого химического процесса является убыль энергии Гиббса: чем AG меньше нуля, тем дальше находится система от равновесия и тем более она реакционноспособна. При протекании реакции величина |AG|, зависящая от концентраций (давлений) реагентов, уменьшается и при достижении химического равновесия принимает нулевое значение (AG=0). Но переход системы в состояние химического равновесия не означает прекращения реакции, а говорит лишь о том, что перестают изменяться концентрации реагирующих веществ и продуктов.
Равновесным состоянием называется такое термодинамическое состояние, которое при постоянных внешних условиях не изменяется во времени, причем стабильность характеристик системы (состав, давление и др.) не обусловлено протеканием какого-либо процесса с участием внешней среды.
С позиции химической кинетики, которая изучает скорость и механизм химических реакции, состоянием равновесия является такое состояние, при котором скорость прямой реакции равна скорости обратной. В состоянии равновесия сколько молекул (или других частиц) продукта реакции в единицу времени образуется, столько их и разлагается, т.е. химическое равновесие является динамическим или подвижным. Таким образом, в состоянии химического равновесия концентрации всех веществ (реагентов и продуктов) являются постоянными и не изменяются до тех пор, пока не изменятся внешние условия проведения реакции: температура, давление и другие.
Химическое равновесие называется истинным и устойчивым. Оно характеризуется следующими признаками:
1) при отсутствии внешних воздействий оно остается неизменным во времени;
2) его характеристики изменяются при внешних воздействиях, сколь малы бы они не были;
3) состояние равновесия не зависит от того, с какой стороны система к нему подходит - со стороны исходных веществ или со стороны продуктов реакции.
Если состояние не соответствует хотя бы одному из этих трех признаков, оно называется кажущимся равновесием или метастабильным состоянием: смесь водорода с кислородом (гремучая смесь), термит (смесь Fe203 с А1), металлы в контакте с воздухом и т.д.
2.2 Константа равновесия
Для химической обратимой реакции, представленной в общем виде:
установлено, что, независимо от того, каковы были начальные концентрации реагентов, присутствовали или нет продукты реакции, в состоянии равновесия сохраняется постоянным отношение: где [А]/;, [В];„ [D];„ [Е];, - равновесные молярные концентрации реагентов и продуктов реакции; a, b, d, е - стехиометрические коэффициенты в уравнении реакции; Кс - константа химического равновесия.
Константа химического равновесия зависит от температуры, природы веществ, но не зависит от концентрации реагирующих веществ, т.к. она показывает при каких соотношениях произведений концентраций реагирующих веществ в системе наступает химическое равновесие.
Данная формула является выражением закона действующих масс для равновесия, установленного Гульдбергом и Вааге (1867).
_ D Е Р р а pb А В
Константа равновесия, выраженная через концентрации, и константа равновесия, выраженная через парциальные давления веществ, связаны соотношением:
где Ап - разность коэффициентов при формулах газообразных веществ в правой и левой частях уравнения.
При Дп=0 константы равновесия Кр и Кс равны.
Таким образом, константа химического равновесия представляет собой дробь, в числителе которой стоит произведение равновесных концентраций (если реакция протекает в растворе) или равновесных парциальных давлений (для реакций в газовой фазе) продуктов реакций, возведенных в степени, показатели которых равны стехиометрическим коэффициентам. А в знаменателе - произведение концентраций (или парциальных давлений) исходных веществ, возведенных в соответствующие степени.
Если протекает гетерогенная реакция
то константа равновесия имеет вид
т.е. в выражение константы равновесия гетерогенной реакции входят равновесные концентрации веществ, находящихся только в жидкой или газообразной фазах.
Константа равновесия определяет полноту протекания реакции к моменту достижения равновесного состояния: чем больше значение константы равновесия, тем в большей степени в равновесной реакционной смеси преобладают продукты реакции, тем больше выход продуктов реакции.
2.3 Смещение химического равновесия. Принцип Лe Шателье
При изменении условий, в которых находится система (температура, давление, концентрация), химическое равновесие нарушается. Через некоторое время в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход от одного равновесного состояния в другое называется сдвигом или смещением равновесия.
Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Jle Шателье: если на систему, находящуюся в истинном равновесии, воздействовать извне, изменяя какое- либо из условий, определяющих положение равновесия, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Кратко этот принцип формулируется так: если находящаяся в равновесии система подвергается внешнему воздействию, то равновесие смещается в таком направлении, которое способствует ослаблению этого воздействия.
1 Аликберова Л. Занимательная химия: Книга для учащихся, учителей и родителей. - М.: АСТ-ПРЕСС, 1999. - с. 207-211
3. Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб, для общеобразоват. учреждений. - М.: Дрофа, 2007. - с. 126-135
4. Габриелян О.С. Химия. 11 класс. Учеб. для общеобразоват. учреждений. - М.: Дрофа, 2004. - с. 126-139
6. Кондратьев В.Н., Определение констант скорости газофазных реакций, М., 1971;
7. Колдин Е., Быстрые реакции в растворе, пер. с англ., М., 1966;
8. Кузнецова Л.М. Химия: учебник для 8 кл. средней общеобразов. шк. - Обнинск: Титул, 2000. - с. 117-118
10. Уэйт Н. Химическая кинетика, пер. с англ. - М. Просвещение, 1994.
Подобные документы
Предмет термохимии, изучение тепловых эффектов химических реакций. Типы процессов химической кинетики и катализа. Энтальпия (тепловой эффект) реакции. Скорость реакции, закон действующих масс. Константа химического равновесия, влияние катализатора.
презентация [2,2 M], добавлен 19.10.2014
Гомогенные и гетерогенные реакции: мрамора с соляной кислотой. Факторы, влияющие на скорость химических реакций. Закон действующих масс. Правило Вант-Гоффа. Катализатор нейтрализации выхлопных газов автомобиля. Три признака химического равновесия.
презентация [304,0 K], добавлен 27.04.2013
Определение содержания химической кинетики и понятие скорости реакции. Доказательство закона действующих масс и анализ факторов, влияющих на скорость химических реакций. Измерение общей энергии активации гомогенных и гетерогенных реакций, их обратимость.
презентация [100,2 K], добавлен 11.08.2013
Характеристика химического равновесия. Зависимость скорости химической реакции от концентрации реагирующих веществ, температуры, величины поверхности реагирующих веществ. Влияние концентрации реагирующих веществ и температуры на состояние равновесия.
лабораторная работа [282,5 K], добавлен 08.10.2013
Характеристика химического равновесия в растворах и гомогенных системах. Анализ зависимости константы равновесия от температуры и природы реагирующих веществ. Описания процесса синтеза аммиака. Фазовая диаграмма воды. Исследование принципа Ле Шателье.
презентация [4,2 M], добавлен 23.11.2014
Понятия химической кинетики. Элементарный акт химического процесса. Законы, постулаты и принципы. Закон сохранения энергии. Принцип микроскопической обратимости, детального равновесия, независимости химических реакций. Закон (уравнение) Аррениуса.
реферат [74,3 K], добавлен 27.01.2009
Изменение энтропии в химических и фазовых переходах. Простые и сложные вещества. Скорость химической реакции. Смещение химического равновесия, принцип Ле Шателье. Модель атома Томсона. Классификация элементарных частиц. Двойственная природа электрона.
Ключевые слова конспекта: Необратимые и обратимые реакции. Химическое равновесие и способы его смещения. Общая характеристика реакции синтеза аммиака и условия смещения её равновесия.

При изучении теории электролитической диссоциации вы установили отличие сильных электролитов от слабых. Сильные электролиты в растворах диссоциируют полностью, т. е. существуют только в виде ионов. Например:

Слабые электролиты диссоциируют частично, т. е. существуют в растворе как в виде ионов, так и в виде молекул. Одни молекулы распадаются на ионы (диссоциация), другие образуются из получившихся ионов (ассоциация). Например:
Сильные электролиты диссоциируют необратимо, а слабые — обратимо. Эту особенность отражают с помощью двух стрелок, направленных в противоположные стороны: стрелка, указывающая слева направо, отражает процесс диссоциации, обратная — ассоциации.

Из курса органической химии вы знаете, что ацетилен можно получить взаимодействием карбида кальция с водой:
Если вы попытаетесь из гидроксида кальция и ацетилена получить карбид кальция, т. е. провести обратную реакцию, у вас ничего не выйдет. Гидролиз карбида кальция относится к необратимым химическим реакциям.

Взаимодействие карбоновой кислоты со спиртом называют, как вы знаете, реакцией этерификации. Катализаторами таких реакций являются сильные кислоты, например серная:

В то же время сложные эфиры, в том числе этиловый эфир уксусной кислоты, способны вступать в реакцию с водой в присутствии серной кислоты, т. е. гидролизоваться:
Нетрудно заметить, что реакции этерификации и гидролиза сложного эфира — зеркальное отражение друг друга, два взаимно противоположных процесса.

В обратимых реакциях вместо знака равенства часто изображают две противоположно направленные стрелки — стрелки обратимости:
Условно реакцию, которая записана слева направо, называют прямой, а противоположную ей — обратной.

Обратимой, например, является реакция синтеза аммиака. Смесь азота с водородом пропускают через нагретый железный катализатор. Начинается химическая реакция:

Однако часть образующегося аммиака в тех же самых условиях (температура, катализатор) распадается:

Общее уравнение этого обратимого процесса можно записать так:
В реакции синтеза аммиака, как и в любой обратимой реакции, наступает такой момент времени, когда скорость прямой реакции становится равной скорости обратной.
При химическом равновесии концентрации участников реакции перестают изменяться, хотя ни прямая, ни обратная реакции не прекращаются. Сколько продуктов реакции образовалось за единицу времени, столько и разложилось с образованием исходных веществ.
Какие факторы оказывают влияние на химическое равновесие? В общем случае таких факторов три: изменение температуры реакции, давления и концентрации реагирующих веществ.
Общий принцип смещения химического равновесия сформулировал в 1884 г. французский химик Анри Ле Шателье.
Проиллюстрируем этот принцип на примере реакции синтеза аммиака.

Реакция соединения водорода и азота сопровождается выделением теплоты, т. е. является экзотермической. Естественно, что разложение аммиака — эндотермический процесс:
Если в состоянии равновесия увеличить температуру реакционной смеси, то это вызовет ускоренное разложение аммиака, т. е. смещение равновесия влево. Это реакция эндотермическая, идёт с поглощением теплоты, и, следовательно, система препятствует повышению температуры.
Можно запомнить частное правило: увеличение температуры смещает равновесие в сторону эндотермической реакции.
Синтез аммиака сопровождается понижением давления, так как из четырёх объёмов исходных газов получается два объёма газообразного продукта (в соответствии с коэффициентами в уравнении реакции). Если в состоянии равновесия увеличить давление в системе, то равновесие сместится вправо, при этом объём смеси уменьшится и давление также станет меньше.
Получается, что увеличение давления смещает равновесие в сторону реакции, которая сопровождается уменьшением суммарного объёма газообразных веществ.
Допустим, в равновесную смесь азота, водорода и аммиака добавили дополнительное количество азота, т. е. увеличили его концентрацию. Равновесие в системе будет смещаться таким образом, чтобы азота стало меньше, т. е. в сторону образования аммиака.
Сделаем общий вывод: добиться большего выхода продукта в реакции синтеза аммиака можно уменьшением температуры, повышением давления, увеличением концентрации азота или водорода и уменьшением концентрации аммиака.

А как влияет катализатор на смещение равновесия? Синтез аммиака — это каталитический процесс, но катализатор в одинаковой степени увеличивает скорость как прямой, так и обратной реакции. Поэтому наличие катализатора на смещение равновесия никак не влияет, он только сокращает время установления равновесия.
Из-за того, что реакция синтеза аммиака обратима, выход аммиака меньше теоретически возможного; конечный продукт надо отделять от примеси исходных газов, а непрореагировавшие азот и водород вновь возвращать в аппарат синтеза. Таким образом, менее трети исходных газов за одно прохождение через реактор превращается в аммиак.
Читайте также:

