Реферат на тему силы взаимодействия молекул
Обновлено: 05.07.2024
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул.
Существование сил притяжения между атомами может доказать такой наглядный опыт. Надо взять два свинцовых бруска и острым ножом срезать тонкие слои с их торцов. При достаточном навыке срезы получаются гладкими и чистыми, свободными от оксидов свинца. Если плотно прижать бруски друг к другу свежими срезами, то они слипнутся. После этого можно один из брусков нагрузить гирей в несколько килограммов, но разрыва брусков не произойдет. Силы притяжения между атомами оказываются достаточными, чтобы предотвратить разрыв.
Если бы между молекулами не существовало сил притяжения, то вещество при любых условиях находилось бы в газообразном состоянии. Только благодаря силам притяжения молекулы могут удерживаться около друг друга и образовывать жидкие и твердые тела.
Но кроме сил притяжения между молекулами должны действовать силы отталкивания. В том, что между атомами или молекулами при непосредственном их сближении появляются силы отталкивания, убедиться очень просто. Если бы таких сил не существовало, то вы свободно могли бы проткнуть пальцем толстую стальную плиту. Более того, без появления сил отталкивания на очень малых расстояниях между молекулами вещество не могло бы существовать. Молекулы проникли бы друг в друга, и весь кусок вещества сжался бы до объема одной молекулы.
Представления о существенной роли межмолекулярных сил для описания свойств газов впервые ввел нидерландский физик Я. Д. Ван-дер-Ваальс (1837—1923). Он не пытался установить точную зависимость сил от расстояния. Ван-дер-Ваальс считал, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения, сравнительно медленно убывающими при дальнейшем увеличении расстояния. Силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми силами.
Электромагнитная природа молекулярных сил
Приступить к теоретическому исследованию молекулярных сил до начала XX в. было почти невозможно. Простые и хорошо изученные гравитационные силы при взаимодействии столь малых тел, как молекулы, явно не могли играть заметной роли. Оставалось предположить, что молекулярные силы имеют электромагнитную природу.
Любой атом и тем более молекула — это сложная система, состоящая из большого числа заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, между ними действуют значительные электрические силы: происходит взаимодействие между электронами и ядрами соседних молекул. Описание движения частиц внутри атомов и молекул — очень сложная задача. Ее рассматривают в атомной физике и решают с помощью законов квантовой механики. Мы ограничимся качественным рассмотрением межмолекулярных сил различных типов и потом приведем конечный результат: примерную зависимость сил взаимодействия двух молекул от расстояния между ними.
Ориентационные силы
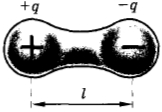
У многих молекул, например у молекулы воды, распределение положительных и отрицательных зарядов таково, что в среднем центры этих зарядов не совпадают. Такую молекулу приближенно можно рассматривать как совокупность двух точечных зарядов +q и -q на небольшом расстоянии l друг от друга (рис. 2.7). Эта система зарядов называется электрическим диполем(1). Электрические свойства такой молекулы характеризуются дипольным моментом

где q — абсолютное значение заряда.
Рассчитывать значения дипольных моментов молекул на первых порах не умели. До создания квантовой механики это вообще было невозможно.
Но если считать дипольные моменты р1 и р2 двух молекул известными, то зависимость силы взаимодействия между ними от расстояния можно вычислить.
Для этого нужно только знать закон взаимодействия двух точечных электрических зарядов. Этот закон (закон Кулона) уже давно был известен. Сила притяжения двух диполей максимальна, когда они располагаются вдоль одной линии (рис. 2.8). Эта сила возникает из-за того, что расстояние между разноименными зарядами, находящимися в точках 2 и 3, чуть меньше, чем между одноименными, расположенными в точках 1, З и 2, 4.
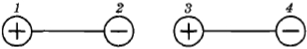
Сила взаимодействия диполей зависит от их взаимной ориентации. Поэтому она называется ориентационной. Хаотическое тепловое движение непрерывно меняет ориентацию молекул-диполей. Учитывая это, силу взаимодействия диполей нужно вычислять как среднюю по всевозможным ориентациям. Расчеты приводят к следующему результату: сила притяжения пропорциональна произведению дипольных моментов р1 и р2 молекул и обратно пропорциональна расстоянию между ними в седьмой степени:

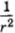
Это очень быстрое убывание по сравнению с силой взаимодействия точечных заряженных частиц, которая пропорциональна .
Индукционные (поляризационные) силы
Можно указать еще одно достаточно простое взаимодействие молекул. Оно возникает между двумя молекулами, одна из которых обладает дипольным моментом, а другая — нет.
Дипольная молекула создает электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределенными по объему. Положительные заряды смещаются по направлению линий напряженности электрического поля, а отрицательные — против. В результате неполярная молекула растягивается (поляризуется) и у нее возникает дипольный момент (рис. 2.9).

Силу взаимодействия можно рассчитать и в этом случае. Она пропорциональна дипольному моменту р полярной молекулы, некоторой величине α, характеризующей способность неполярной молекулы поляризоваться (она называется поляризуемостью), и обратно пропорциональна седьмой степени расстояния между молекулами:

Эти силы притяжения называются индукционными или поляризационными, так как они возникают благодаря поляризации молекул, вызванной электростатической индукцией.
Дисперсионные силы
Хорошо известно, что силы притяжения существуют и между неполярными молекулами. Например, атомы инертных газов не имеют дипольного момента, но тем не менее притягиваются друг к другу.
Расчет, выполненный в рамках квантовой механики, приводит к выводу, что сила взаимодействия в этом случае пропорциональна произведению поляризуемостей молекул α1 и α2 и обратно пропорциональна седьмой степени расстояния:

Эти силы называются дисперсионными, потому что дисперсия света (зависимость показателя преломления света от частоты) определяется теми же свойствами молекул, что и рассмотренные силы.
Дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их проявления не зависит от того, есть ли у них постоянные дипольные моменты или нет. Обычно эти силы превосходят как ориентационные, так и индукционные силы. Только при взаимодействии молекул с большими дипольными моментами, например молекул воды, ориентационная сила оказывается больше дисперсионной (для молекул воды в 3 раза). При взаимодействии же таких полярных молекул, как СО, НСl, дисперсионные силы в десятки и сотни раз превосходят другие силы.
Существенно, что все три типа сил притяжения одинаковым образом убывают с расстоянием пропорционально . Впрочем, на расстояниях, в несколько раз больших размеров молекул, начинает сказываться конечность скорости распространения электромагнитных взаимодействий. Из-за этого на расстояниях порядка 10 -5 см силы притяжения начинают убывать уже .
Силы отталкивания
Теперь обратим внимание на силы отталкивания, действующие между молекулами на очень малых расстояниях. С одной стороны, ситуация здесь проще, а с другой — сложнее. Проще в том смысле, что эти силы очень быстро возрастают при сближении молекул, и поэтому та или иная быстрота изменения силы с расстоянием не оказывает заметного влияния на течение любых процессов.
Сложность состоит в том, что силы отталкивания в значительно большей мере, чем силы притяжения, зависят от индивидуальности молекул. Зная, как молекула А отталкивает молекулы В и С, мы еще не в состоянии судить, какие силы отталкивания будут действовать между молекулами В и С. При непосредственном сближении молекул их электронные оболочки начинают перекрываться и особенность строения молекул сказывается в большей степени, чем при больших расстояниях между ними.
К достаточно хорошим результатам приводит допущение, что силы отталкивания возрастают при сближении молекул по закону

Учитывая, что силы притяжения с уменьшением расстояния увеличиваются пропорционально , а силы отталкивания — пропорционально , можно примерную зависимость сил от расстояния изобразить графически.
График зависимости молекулярных сил от расстояния между молекулами
Рассмотрим, как меняется в зависимости от расстояния между молекулами проекция результирующей силы взаимодействия между ними на прямую, соединяющую центры молекул. Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия между ними практически не сказываются. Силы взаимодействия между молекулами короткодействующие.
На расстояниях, превышающих 2—3 диаметра молекул, сила отталкивания практически равна нулю. Заметна лишь сила притяжения. По мере уменьшения расстояния сила притяжения возрастает и одновременно начинает сказываться сила отталкивания. Эта сила очень быстро увеличивается, когда электронные оболочки молекул начинают перекрываться.
На рисунке 2.10 графически изображена зависимость проекции Fr силы взаимодействия молекул от расстояния между их центрами. На расстоянии г0, примерно равном сумме радиусов молекул, Fr = 0, так как сила притяжения равна по модулю силе отталкивания. При г > г0 между молекулами действует сила притяжения. Проекция силы, действующей на правую молекулу, отрицательна. При г
На рисунке 2.11 вы видите изображение полимерных цепей аминокислоты аланина, полученное с помощью АСМ. Каждый бугорок представляет собой одну молекулу аминокислоты.

В настоящее время сконструированы атомные микроскопы, устройство которых основано на действии молекулярных сил притяжения на расстояниях, в несколько раз превышающих размеры атома. Эти силы примерно в 1000 раз меньше сил отталкивания в АСМ. Поэтому применяется более сложная чувствительная система для регистрации сил.
Атомы и молекулы состоят из электрически заряженных частиц. Благодаря действию электрических сил на малых расстояниях молекулы притягиваются, но начинают отталкиваться, когда электронные оболочки атомов перекрываются.
Можно ли объяснить свойства вещества во всех его агрегатных состояниях строением вещества, движением и взаимодействием его частиц?
Силы взаимодействия молекул.
Молекулы взаимодействуют друг с другом. Без этого взаимодействия не было бы ни твёрдых, ни жидких тел.
Доказать существование значительных сил взаимодействия между атомами или молекулами несложно. Попробуйте-ка сломать толстую палку! А ведь она состоит из молекул. Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров порядка размеров одной молекулы.
Молекула — это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер.
В целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул.
Если молекулы находятся на расстояниях, превышающих их размеры в несколько раз, то силы взаимодействия практически не сказываются.
На расстояниях, превышающих 2—3 диаметра молекул, действуют силы притяжения. По мере уменьшения расстояния между молекулами сила их взаимного притяжения сначала увеличивается, но одновременно увеличивается и сила отталкивания. При определённом расстоянии r0 сила притяжения становится равной силе отталкивания. Это расстояние считается равным диаметру молекулы.


При дальнейшем уменьшении расстояния электронные оболочки атомов начинают перекрываться и быстро увеличивается сила отталкивания. На рисунке 8.5 показаны графики зависимости потенциальной энергии взаимодействия молекул (рис. 8.5, а) и сил притяжения (1) и отталкивания (2) (рис. 8.5, б) от расстояния между молекулами. При r = r0 потенциальная энергия минимальна, сила притяжения равна силе отталкивания. При r > r0 сила притяжения больше силы отталкивания; при r
Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объёма силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей.
Жидкости: 1) малосжимаемы;
2) текучи, т. е. не сохраняют своей формы.
Объяснить текучесть жидкостей можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы. Вот почему жидкость течёт и принимает форму сосуда.
В жидкостях средняя кинетическая энергия теплового движения молекул сравнима со средней потенциальной энергией их взаимодействия. Наличие поверхностного натяжения доказывает, что силы взаимодействия молекул жидкостей существенны, и ими пренебрегать нельзя.
Твёрдые тела.
Атомы или молекулы твёрдых тел, в отличие от атомов и молекул жидкостей, колеблются около определённых положений равновесия. По этой причине твёрдые тела сохраняют не только объём, но и форму.
В твёрдых телах средняя потенциальная энергия взаимодействия молекул много больше средней кинетической энергии их теплового движения.
Если соединить центры положений равновесия атомов или ионов твёрдого тела, то получится правильная пространственная решётка, называемая кристаллической.

На рисунках 8.6 и 8.7 изображены кристаллические решётки поваренной соли и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Основные положения МКТ. Тепловые явления - Физика, учебник для 10 класса - Класс!ная физика
* Данная работа не является научным трудом, не является выпускной квалификационной работой и представляет собой результат обработки, структурирования и форматирования собранной информации, предназначенной для использования в качестве источника материала при самостоятельной подготовки учебных работ.
Парные потенциалы взаимодействия между двумя молекулами в вакууме
Разделение межмолекулярных взаимодействий по типам
Zbond - энергия связи
Теоретические модели и параметры
Вода как диэлектрик
Парные потенциалы взаимодействия между двумя молекулами в вакууме
Межмолекулярные взаимодействия имеют фундаментальное значение для понимания того, как атомы и молекулы организованы в жидкостях и твердых телах. В качестве примера рассмотрим образование мицелл заряженными молекулами ПАВ. Почему образуются мицеллы и какие силы действуют между молекулами поверхностно-активного вещества? Поскольку мицеллы не образуются в газовой фазе, очевидно, что недостаточно рассматривать взаимодействия только между молекулами ПАВ. Растворитель играет определяющую роль в процессе мицеллярного агрегирования, а вода в этом отношении вообще уникальна. На рис. показано, что мицеллы не могут возникать в растворителе с низкой диэлектрической проницаемостью вследствие очень слабого экранирования полярных групп молекул ПАВ и, следовательно, сильного электростатического отталкивания между ними. Можно ли разобраться в механизме мицеллообразования, основываясь на знании взаимодействий между молекулами ПАВ, противоионами и молекулами воды? На качественном уровне, безусловно, да, однако при этом количественно описать систему невозможно. Последующие разделы посвящены подробному рассмотрению типов межмолекулярных взаимодействий, существующих между указанными частицами.
При изучении атомных и молекулярных сил взаимодействия можно не учитывать некоторые силы, действие которых не соответствует размерам молекул; например, для данного случая исчезающе малы гравитационные силы. Для анализа рассматриваемой системы важны только электростатические силы, возникающие при взаимодействии между электронами и протонами различных молекул. Здесь уместно напомнить размеры небольших молекул и величину энергии водородной связи, например, в водном растворе. Грубая оценка размера молекулы воды может быть получена из ее плотности. Оценочное значение диаметра молекулы воды составляет 3 А. Основной вклад в межмолекулярные взаимодействия молекул воды дают диполь-дипольные взаимодействия. Используя известное значение дипольного момента воды, равное 1.85 Д, и принимая усредненное расстояние между молекулами воды равным 3 А, найдем, что типичная энергия взаимодействия составляет 10-20 кДж/моль. Такой расчет, безусловно, является грубым приближением. Но, как станет понятно далее, он приводит к значению, совпадающему по порядку величины с реальной энергией взаимодействия. Этот пример приведен специально, чтобы показать, насколько полезно проводить приближенные оценки при обсуждении межмолекулярных взаимодействий. Следующий расчет, немного более строгий, показывает, как усложненные квантово-механические расчеты помогают разобраться в межмолекулярных взаимодействиях.
Мицеллярные структуры октаноата натрия в двух растворителях с различными диэлектрическими проницаемостями Sr: Sr = 20 и Sr = 80. Мицеллы не могут образовываться в растворе с низкой диэлектрической проницаемостью из-за сильного электростатического отталкивания полярных групп молекул ПАВ
Допустим, что два атома находятся на бесконечном расстоянии друг от друга. Суммарная энергия взаимодействия состоит из индивидуальных вкладов, т.е. энергий изолированных атомов 1 и 2. При приведении в контакт атомы будут взаимодействовать друг с другом, и суммарная энергия взаимодействия выражается уравнением
где U - межмолекулярный потенциал. По определению, он равен работе, которую необходимо совершить для переноса атомов из бесконечного удаления на расстояние г друг от друга:
где F - сила, действующая между двумя атомами. Так как сила является отрицательной производной потенциальной энергии, можно заключить, что сила отталкивания не обязательно определяется энергией отталкивания.
Рассмотрим атом, состоящий из тяжелого, положительно заряженного ядра, окруженного быстрыми электронами, способными мгновенно реагировать на изменения в положении ядра. Согласно приближению Борна-Оппенгеймера, потенциальная энергия зависит только от относительного расположения ядер. В таком приближении можно численно решить уравнение Шрёдингера. На практике этот подход можно применять только к молекулам, содержащим не более 1000 электронов. Для изучения взаимодействий более крупных молекул можно попытаться разделить суммарную энергию на серию наиболее важных вкладов и исследовать каждый вклад отдельно, надеясь на то, что проигрыш в строгости теории компенсируется более глубоким пониманием физической природы молекулярных сил.
Напоминаем, что наше обсуждение изначально ограничено взаимодействием между парами атомов или молекул в вакууме. В таком случае это действительно парные взаимодействия, не зависящие от растворителя и температуры. Далее рассмотрим взаимодействие между двумя молекулами в некоторой среде, например взаимодействие двух ионов в воде. В этом случае взаимодействие зависит от диэлектрической проницаемости растворителя, поэтому взаимодействие становится температурно-зависимым. Такой тип взаимодействий обозначим как эффективный парный потенциал. Химики часто пользуются эффективными потенциалами; например, гидрофобные взаимодействия или экранированные кулоновские взаимодействия описываются такими потенциалами.
Разделение межмолекулярных взаимодействий по типам
Взаимодействие на близких расстояниях называется обменным взаимодействиям Uqxc. Энергия обменного взаимодействия рассчитывается на основе квантовой механики, исходя из принципа Паули. Другие силы межмолекулярного взаимодействия можно рассматривать в рамках классической электростатики. Суммарную энергию взаимодействия можно представить следующим выражением:
где Ue\Q - энергия непосредственно электростатического взаимодействия, a Umd и CZdis - энергии индукционного и дисперсионного взаимодействий соответственно.
В качестве примера на рис. показана энергия взаимодействия между двумя молекулами воды, рассчитанная квантовомеханическим способом.
Энергия взаимодействия между двумя молекулами воды, рассчитанная неэмпирическим квантовомеханическим методом. Сплошная линия - полная энергия взаимодействия U. Точками показан вклад электростатической составляющей L r eIe.
Такое распределение энергии на несколько вкладов не является единственно возможным. Оно предполагает, что взаимодействующие частицы сохраняют индивидуальность и все присущие им свойства.
Но это условие не всегда выполняется: любая химическая реакция с образованием новых ковалентных связей служит типичным примером непригодности такого подхода.
Рассмотрим, например, образование воды из О2 и Н2. Ни один из реагентов, вступающих в реакцию, не имеет дипольного момента, в то время как продукт реакции обладает очень большим дипольным моментом.
Разделение и классификация вкладов различных взаимодействий является в некотором смысле персональным выбором. Водородную связь и комплексы с переносом заряда не имеет смысла рассматривать как отдельные виды взаимодействий. Водородную связь можно описать с помощью электростатического вклада UQ\Q, а перенос заряда в основном представляет собой индукционное взаимодействие, включенное в Сind. Безусловно, указанные четыре типа взаимодействий не независимы, но для большинства систем члены, характеризующие их взаимосвязь, малы и ими можно пренебречь.
Распределять суммарную энергию взаимодействия на отдельные вклады можно и для внутримолекулярных взаимодействий в больших молекулах, таких как белки или полимеры. В этом случае атомы или группы атомов, разделенные друг от друга более чем тремя или четырьмя связями, рассматривают как принадлежащие разным молекулам. Обычно из-за неявности данного приближения выделяют вклады связей, валентных углов и диэдральных углов. Некоторые виды внутримолекулярных движений относятся к почти классическим, например вращение вокруг связи, в то время как быстрые колебания связи являются строго квантовомеханическими. Эти силы невозможно точно описать. Учитывая задачи данного изложения, можно ограничиться оценочными классическими приближениями.
Электростатические взаимодействия
Для двух произвольно выбранных распределений зарядаиэнергия кулоновского взаимодействия описывается уравнением
Для двух точечных зарядов выражение приводится к виду
Обычно распределение заряда представляют мультипольным рядом, что позволяет рассматривать отдельно ион-ионные, ион-дипольные, диполь-дипольные и т.д. взаимодействия.
Молекулы, не обладающие сферической симметрией, характеризуются постоянными электрическими моментами.
Момент нулевого порядка - это полный заряд Qy а момент первого порядка - дипольный момент, являющийся векторной величиной:
Моменты более высоких порядков являются тензорными величинами. Электрические моменты различных молекул взаимодействуют между собой, не нарушая распределения зарядов.
Дипольные моменты молекул различаются очень сильно: дипольный момент м полярных молекул Н2О равен 1.85 Д; молекул Н33 - 1.47 Д, в то же время дипольные моменты молекул насыщенных углеводородов очень малы и проявляются только для определенных конформаций. Значения дипольных моментов некоторых небольших молекул приведены в табл.
Рассмотрим снова взаимодействие между двумя молекулами воды. В данном случае достаточно учитывать только электростатические взаимодействия в форме диполь-дипольного потенциала:
который для коллинеарного параллельного расположения диполей описывается выражением
где м = 1.85 Д и = 3 А. Для сравнения напомним, что квантово-механический расчет энергии взаимодействия для димера молекул воды дает величину около - 25 кДж/моль.

Существование различных агрегатных состояний вещества объясняется тем, что между молекулами существуют силы притяжения и отталкивания. При изменении температуры баланс этих сил и энергии теплового движения изменяется, что и приводит к изменению состояния вещества. Кратко рассмотрим силы взаимодействия между молекулами.
Природа сил взаимодействия молекул
В 10 классе известно, что атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронных оболочек вокруг. Взаимодействие электронных оболочек приводит к образованию молекул, состоящих из некоторого числа атомов.
Получается, что в любой молекуле существуют области, имеющие как положительный, так и отрицательный заряд. Распределение этих областей и создает силы, действующие на молекулы в данный момент времени, а с учетом изменения температуры оно определяет строение газообразных, жидких и твердых тел.
При этом природа этих сил всегда электростатическая. Впервые они были описаны в середине XIX в. Я. Ван-дер-Ваальсом. Поэтому нередко их называют ван-дер-ваальсовыми.
Виды межмолекулярных сил
Из-за того, что силы притяжения между молекулами изменяют пространственную ориентацию и форму самих молекул, они гораздо сильнее изменяются с изменением расстояния, как правило, пропорционально седьмой степени.
Это убывание гораздо быстрее, чем обычное кулоновское, пропорциональное квадрату расстоянию. Поэтому межмолекулярные силы играют значительную роль лишь на малых расстояниях.
По механизму их возникновения можно выделить следующие.
Ориентационные силы
Ориентационные силы еще называют дипольными. Они возникают в результате того, что многие молекулы представляют собой электрические диполи. Разноименные полюса диполей притягиваются, а одноименные — отталкиваются. В результате дипольные молекулы стремятся занять определенное пространственное положение друг относительно друга, что также влияет на величину сил.
В результате ориентационные силы прямо пропорциональны дипольным моментам молекул:

Рис. 1. Ориентационные силы.
Поляризационные (индукционные) силы
Сила взаимодействия будет пропорциональна дипольному моменту полярной молекулы и способности к поляризации под внешним воздействием неполярной молекулы (поляризуемости $\alpha$):

Рис. 2. Поляризационные силы.
Дисперсионные силы
Поляризуемость неполярных молекул приводит к тому, что даже между ними возникают силы притяжения.
Хотя в среднем у неполярной молекулы дипольный момент отсутствует, в каждый конкретный момент времени электроны в электронном облаке могут иметь несимметричное положение. В результате мгновенный дипольный момент будет отличен от нуля. То же самое происходит и с соседними молекулами. Суммарное взаимодействие этих мгновенных дипольных моментов приводит к существованию сил притяжения, называемых дисперсионными.
Дисперсионные силы пропорциональны поляризуемостям взаимодействующих молекул:

Рис. 3. Дисперсионные силы.
Что мы узнали?
Силы взаимодействия молекул имеют электростатическую природу. Механизм их возникновения определяется существованием дипольных моментов у молекул. По виду эти силы делятся на ориентационные, поляризационные и дисперсионные. Их величина пропорциональная седьмой степени расстояния, поэтому они проявляются лишь на относительно небольших дистанциях.

В этом видеоуроке мы вспоминаем, что такое броуновское движение и в чём причина его появления. Также мы познакомимся с опытами Жана Батиста Перрена. Выясним, какие силы действуют между молекулами вещества. Поговорим о строении твёрдых тел, жидкостей и газов.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Броуновское движение. Силы взаимодействия молекул"
Частицы вещества (атомы, молекулы и ионы) настолько малы, что увидеть их даже с помощью очень сильных оптических микроскопов не предоставляется возможным. Однако существует целый ряд явлений, которые подтверждают дискретность веществ. Одним из таких явлений является диффу́зия, о которой мы говорили с вами на прошлом уроке.
Но, пожалуй, самым убедительным явлением, доказывающим первые два положения МКТ, является броуновское движение.

Каково было его удивление, когда он заметил, что каждая частичка пыльцы (её называют броуновской) совершала причудливое зигзагообразное движение, которое не замедлялось ни на секунду. Вода в капле была неподвижна, так что объяснить движение частиц с завихрениями течений в капле не удалось. Поэтому учёный изначально приписал спорам пыльцы свойства живых существ.
Первоначально, как это часто бывало в мире науки, учёные не проявили никакого интереса к результатам опыта Броуна. Лишь в 1863 году немецкий математик Людвиг Кристиан Винер, обобщив результаты многочисленных опытов, предположил, что движение броуновской частицы связано с её столкновением с молекулами жидкости.
При беспорядочном движении молекул передаваемые ими броуновской частице импульсы с разных сторон неодинаковы. Поэтому отлична от нуля результирующая сила давления молекул жидкости на броуновскую частицу. Эта сила и вызывает изменение движения частицы.
Но опять же, эти идеи были восприняты учёным миром в штыки. Лишь к концу XIX — началу ХХ веков учёные приняли тот факт, что броуновское движение вызвано соударением частицы с молекулами жидкости (или газа). Но все объяснения строились лишь на качественном уровне, пока в 1904)году польский физик Мариан Смолуховский и в мае 1905 года Альберт Эйнштейн смогли дать строгое объяснение и описать математической формулой движение броуновской частицы. В соответствии с теорией Смолухо́вского — Эйнште́йна, среднее значение квадрата смещения броуновской частицы за некоторый промежуток времени прямо пропорционально температуре и обратно пропорционально вязкости жидкости, размеру частицы и постоянной Авогадро:

Оказалось принципиально важным, что в эту формулу входит постоянная Авогадро, которую теперь можно было определить путём количественных измерений перемещения броуновской частицы.
В 1908 году французский физик Жан Батист Перрен на основании теории Смолуховского — Эйнштейна решил вычислить значение постоянной Авогадро. Для этого он получил однородную эмульсию из частичек гуммигута (это такая древесная смола), которую поместил на специальное предметное стекло с цилиндрическим углублением. Вся эта конструкция накрывалась покровным стеклом и помещалась под микроскоп. Наблюдая за броуновскими частицами в микроскоп, Перрен фиксировал положение некоторых из них через каждые 30 с и зарисовывал эти положения в масштабе на листе бумаги. Соединяя полученные точки прямыми, он получал замысловатые треки частиц. Обработав полученные результаты, Перрен доказал, что средний квадрат перемещения броуновской частицы пропорционален времени её движения.

В 1876 году Людвиг Больцман открыл закон распределения молекул воздуха в поле тяготения. Согласно ему, концентрация молекул газа в атмосфере убывает с высотой по экспоненциальному закону:

Для проверки этого закона Перрен подсчитал число частиц гуммигута в слоях раствора на разной высоте. Оказалось, что каждые 30 мкм число частиц, или лучше сказать, концентрация частиц уменьшалась почти вдвое. Это свидетельствовало как о справедливости полученного Больцманом закона распределения молекул атмосферного воздуха в поле тяготения, так и о применимости этого закона к распределению числа броуновских частиц по высоте.

Используя теоретическую формулу Больцмана и результаты своего эксперимента, он получил достаточно точное для того времени значение фундаментальной константы — постоянной Авогадро:
NA = 6,82 ∙ 10 23 моль –1 .
Таким образом, открытие, сделанное Робертом Броуном, неоспоримо доказывает, что все вещества состоят из мельчайших частиц, которые находятся в непрерывном тепловом движении.
А теперь давайте с вами вспомним третье положение МКТ: между молекулами вещества существуют силы взаимодействия. Сам факт существования твёрдых и жидких тел говорит нам о том, что между частицами веществ существуют силы взаимного притяжения. Оно и понятно, не было бы притяжения — не было бы и тел.
С другой стороны, относительно малая сжимаемость жидкостей и твёрдых тел указывает нам на то, что между молекулами вещества существуют и силы отталкивания. В противном случае мы могли бы сжать любое тело до размеров молекулы.
Ну а то, что большинство тел обладают определёнными размерами и формой, говорит о том, что силы притяжения и отталкивания действуют одновременно.
И несмотря на то, что молекулы в целом электрически нейтральны, силы притяжения и отталкивания имеют электромагнитную природу, так как вызваны они взаимодействием электронов и атомных ядер соседних молекул.
График зависимости проекции равнодействующей сил притяжения и отталкивания от расстояния между их центрами:

Расстояние между центрами частиц, при котором силы притяжения уравновешиваются силами отталкивания, называют равновесным.
В различных агрегатных состояниях вещества расстояние между его молекулами различно. Отсюда и различие в силовом взаимодействии молекул и существенное различие в характере движения молекул газов, жидкостей и твёрдых тел.
Например, вы знаете, что расстояние между молекулами в газах достаточно велико (во много раз больше самих молекул). Поэтому силы взаимодействия между молекулами очень малы. Но вот скорости их движения достаточно велики (порядка нескольких сотен метров в секунду). Поэтому даже при редких (в масштабах молекул) столкновениях сил притяжения не хватает, чтобы удержать молекулы друг возле друга. Сталкиваясь, они разлетаются в разные стороны, подобно бильярдным шарам. Поэтому газы не сохраняют ни своей формы, ни объёма и могут неограниченно расширяться.
Всё это приводит к тому, что средняя кинетическая энергия теплового движения молекул газа намного больше средней потенциальной энергии их взаимодействия. Поэтому часто значением последней мы будем пренебрегать.
Что касается твёрдых тел, то в них силы взаимодействия между молекулами так велики, что кинетическая энергия теплового движения оказывается на несколько порядков меньше, чем потенциальная энергия взаимодействия. Поэтому молекулы могут совершать лишь колебания с очень маленькой амплитудой около своих положений равновесия — узлах кристаллической решётки. Это приводит к тому, что твёрдые тела, в отличие от жидкостей и тем более газов, сохраняют и свою форму, и свой объём.
Читайте также:

