Реферат на тему сероводород
Обновлено: 05.07.2024
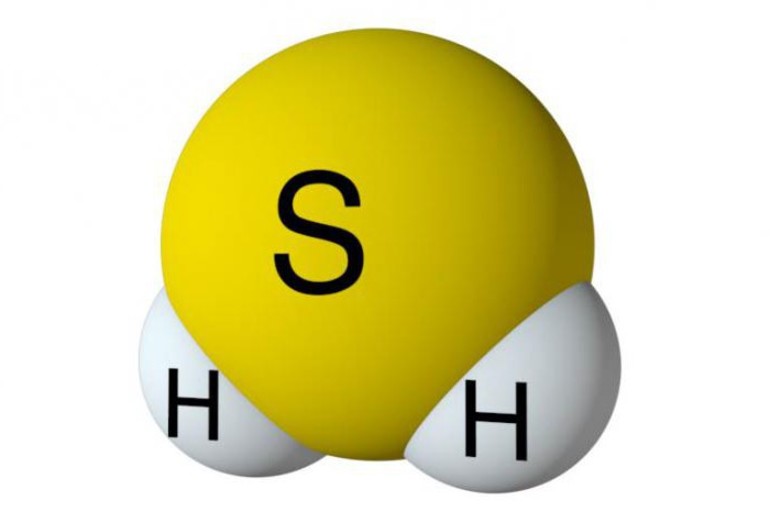
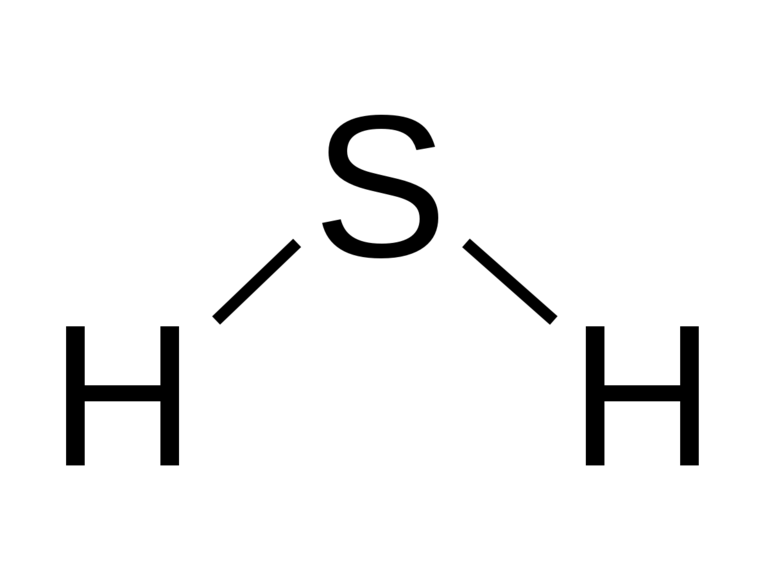
Молекула Н2S
имеет структуру равнобедренного треугольника с атомом серы в центре [d(HS) =
133 пм, угол HSH = 92°]. Сероводород представляет собой бесцветный и весьма
ядовитый газ, уже 1 часть которого на 100 000 частей воздуха обнаруживается по
его характерному запаху (тухлых яиц).
В жидком
состоянии Н2S проводит электрический ток несравненно хуже, чем вода,
так как собственная его электролитическая диссоциация ничтожно мала: [SH3+]
[HS-] = 3·10-33. Жидкий, сероводород имеет низкую
диэлектрическую проницаемость (e = 6 при 0 °С) и как растворитель похож скорее
на органические жидкости, чем на воду. Так, он практически не растворяет лед.
Твердый Н2S имеет строение плотной упаковки с 12 ближайшими соседями
у каждой молекулы (т. е. совершенно иное, чем лед). Теплота плавления
сероводорода равна 2,5 кДж/моль, а теплота испарения 18,8 кДж/моль.
tпл -85,54 °С,
tкип -60,35 °С; при 0 °С сжижается под давлением 1 МПа. Восстановитель.
Химические свойства.
Сероводород
взаимодействует с основаниями:
H2S + 2NaOH = Na2S + 2H2O
H2S
проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 = S0
+ 2HBr
H2S-2 + 2FeCl3 =
2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O
= H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) = 3H2S+6O4
+ 8NO + 4H2O
H2S-2 + H2S+6O4(конц) = S0
+ S+4O2 + 2H2O
(при нагревании
реакция идет по - иному:
H2S-2 + 3H2S+6O4(конц) =-t°=
4S+4O2 + 4H2O)
Серебро при
контакте с сероводородом чернеет:
4Ag + 2H2S + O2 = 2Ag2S
+ 2H2O
Качественная
реакция на сероводород и растворимые сульфиды - образование темно-коричневого
(почти черного) осадка PbS:
H2S + Pb(NO3)2 = PbS(осадок) + 2HNO3
Na2S + Pb(NO3)2 =
PbS(осадок) +
2NaNO3
Pb2+ + S2- = PbS(осадок)
Один объём воды
растворяет в обычных условиях около 3 объемов сероводорода (с образованием
приблизительно 0,1 М раствора (сероводородной воды)). При нагревании
растворимость понижается. Подожженный на воздухе сероводород сгорает по одному
из следующих уравнений:
2 Н2S
+ 3 O2 = 2 H2O + 2 SO2 + 1125 кДж (при избытке
кислорода)2 Н2S + O2 = 2 H2O + 2 S + 531 кДж
(при недостатке кислорода).
Растворимость
сероводорода (объемы на 1 объём воды).
Легко
окисляется сероводород и в растворе: при стоянии на воздухе сероводородная вода
постепенно мутнеет вследствие выделения серы (по второй из приведенных выше
реакций). Бром и йод восстанавливаются до НВr и HI. Аналогично действует он и
на многие другие вещества. Сероводород является, таким образом, сильным
восстановителем.
В водном
растворе Н2S ведёт себя как весьма слабая кислота. Средние соли (с
анионом S2-) называются сульфидами, кислые (с анионом HS-)
- гидросульфидами. Несмотря на бесцветность самих ионов S2- и HS-,
многие соли сероводорода окрашены в характерные цвета. Подавляющее большинство
сульфидов практически нерастворимо в воде. А большая часть гидросульфидов
хорошо растворима (но известна лишь в растворе).
Охлаждение
насыщенного водного раствора сероводорода может быть получен кристаллогидрат Н2S·6Н2О.
Растворимость Н2S в органических растворителях значительно выше, чем
в воде. Например, один объем спирта поглощает при обычной температуре 7 объемов
сероводорода. Растворимость его в расплавленной сере резко возрастает выше 130
°С и достигает максимума около 350 °С. По-видимому, это связано с образованием
полисульфидов. В водном растворе сероводород легко окисляется иодом до
свободной серы:I2 + Н2S = 2 НI + S.Напротив, в газовой фазе сера окисляет
иодистый водород
до свободного иода:S +2 НI = Н2S + I2 + 6 кДж.Ниже -50 °С может существовать молекулярное
соединение состава Н2S·I2. Сероводородная кислота
характеризуется константами диссоциации К1 = ([H+] * [HS-])
/ [H2S] = 1·10-7 и К2 = ([H+] * [S2-])
/ [HS-] = 1·10-14, т. е. она несколько слабее угольной.
Децинормальный раствор Н2S имеет рН = 4,1.Получение.
С водородом
сера в обычных условиях не соединяется. Лишь при нагревании протекает обратимая
реакция:
Н2 +
S = Н2S + 21 кДж
равновесие
которой около 350 °С смещено вправо, а при повышении температуры смещается
влево. Практически сероводород получают обычно действием разбавленных кислот на
сульфид железа:
FeS + 2 HСl = FeCl2 + Н2S
Удобный способ
получения Н2S состоит в нагревании выше 170 °С сплава
порошкообразной серы с парафином и измельченным асбестом (приблизительно 3 : 5
: 2 по массе). При охлаждении реакция прекращается, но вновь вызывается
нагреванием. Исходный сплав может заготовляться впрок и расходоваться по мере
надобности (один грамм дает около 150 мл Н2S). Очень чистый
сероводород может быть получен пропусканием смеси Н2 с парами серы
над нагретыми до 600 °С кусками пемзы. Критическая температура Н2S
равна 100 °С при критическом давлении 89 атм. Термическая диссоциация Н2S
начинается приблизительно с 400 °С и становится практически полной около 1700
°С.
Сульфгидрильные
группы (HS) входят в состав некоторых биологически важных органических
соединений.Применение.
Применяется в
производстве серы, серной кислоты, сульфидов, в органическом синтезе,
химическом анализе, для приготовления лечебных сероводородных ванн.
Отравление
сероводородом.
На воздухе сероводород воспламеняется около 300 °С. Взрывоопасны
его смеси с воздухом, содержащие от 4 до 45 объемн. % Н2S.
Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения
достаточных мер предосторожности. Между тем уже 0,1 % Н2S в воздухе
быстро вызывает тяжелое отравление. При вдыхании сероводорода в значительных
концентрациях может мгновенно наступить обморочное состояние или даже смерть от
паралича дыхания (если пострадавший не был своевременно вынесен из отравленной
атмосферы). Первым симптомом острого отравления служит потеря обоняния. В
дальнейшем появляются головная боль, головокружение и тошнота. Иногда через
некоторое время наступают внезапные обмороки. Противоядием служит прежде всего
чистый воздух. Тяжело отравленным сероводородом дают вдыхать кислород. Иногда
приходится применять искусственное дыхание. Хроническое отравление малыми
количествами Н2S обусловливает общее ухудшение самочувствия,
исхудание, появление головных болей и т. д. Предельно допустимой концентрацией
Н2S в воздухе производственных помещений считается 0,01 мг/л.
Содержащие его баллоны должны иметь белую окраску с красной надписью
"Сероводород" и красной чертой под ней.
Список литературы
Молекула Н2S имеет структуру равнобедренного треугольника с атомом серы в центре [d(HS) = 133 пм, угол HSH = 92°]. Сероводород представляет собой бесцветный и весьма ядовитый газ, уже 1 часть которого на 100 000 частей воздуха обнаруживается по его характерному запаху (тухлых яиц).
В жидком состоянии Н2S проводит электрический ток несравненно хуже, чем вода, так как собственная его электролитическая диссоциация ничтожно мала: [SH3 + ] [HS - ] = 3·10 -33 . Жидкий, сероводород имеет низкую диэлектрическую проницаемость (e = 6 при 0 °С) и как растворитель похож скорее на органические жидкости, чем на воду. Так, он практически не растворяет лед. Твердый Н2S имеет строение плотной упаковки с 12 ближайшими соседями у каждой молекулы (т. е. совершенно иное, чем лед). Теплота плавления сероводорода равна 2,5 кДж/моль, а теплота испарения 18,8 кДж/моль.
tпл -85,54 °С, tкип -60,35 °С; при 0 °С сжижается под давлением 1 МПа. Восстановитель.
Химические свойства.
Сероводород взаимодействует с основаниями:
H2S проявляет очень сильные восстановительные свойства:
(при нагревании реакция идет по - иному:
H2S -2 + 3H2S+6O4(конц) = -t° = 4S+4O2 + 4H2O)
Серебро при контакте с сероводородом чернеет:
Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS:
Pb 2+ + S 2- = PbS(осадок)
Один объём воды растворяет в обычных условиях около 3 объемов сероводорода (с образованием приблизительно 0,1 М раствора (сероводородной воды)). При нагревании растворимость понижается. Подожженный на воздухе сероводород сгорает по одному из следующих уравнений:
2 Н2S + 3 O2 = 2 H2O + 2 SO2 + 1125 кДж (при избытке кислорода)2 Н2S + O2 = 2 H2O + 2 S + 531 кДж (при недостатке кислорода).
Растворимость сероводорода (объемы на 1 объём воды).
Легко окисляется сероводород и в растворе: при стоянии на воздухе сероводородная вода постепенно мутнеет вследствие выделения серы (по второй из приведенных выше реакций). Бром и йод восстанавливаются до НВr и HI. Аналогично действует он и на многие другие вещества. Сероводород является, таким образом, сильным восстановителем.
В водном растворе Н2S ведёт себя как весьма слабая кислота. Средние соли (с анионом S 2- ) называются сульфидами, кислые (с анионом HS - ) - гидросульфидами. Несмотря на бесцветность самих ионов S 2- и HS - , многие соли сероводорода окрашены в характерные цвета. Подавляющее большинство сульфидов практически нерастворимо в воде. А большая часть гидросульфидов хорошо растворима (но известна лишь в растворе).
Охлаждение насыщенного водного раствора сероводорода может быть получен кристаллогидрат Н2S·6Н2О. Растворимость Н2S в органических растворителях значительно выше, чем в воде. Например, один объем спирта поглощает при обычной температуре 7 объемов сероводорода. Растворимость его в расплавленной сере резко возрастает выше 130 °С и достигает максимума около 350 °С. По-видимому, это связано с образованием полисульфидов. В водном растворе сероводород легко окисляется иодом до свободной серы:I2 + Н2S = 2 НI + S.Напротив, в газовой фазе сера окисляет иодистый водород до свободного иода:S +2 НI = Н2S + I2 + 6 кДж.Ниже -50 °С может существовать молекулярное соединение состава Н2S·I2. Сероводородная кислота характеризуется константами диссоциации К1 = ([H + ] * [HS - ]) / [H2S] = 1·10 -7 и К2 = ([H + ] * [S 2- ]) / [HS - ] = 1·10 -14 , т. е. она несколько слабее угольной. Децинормальный раствор Н2S имеет рН = 4,1.Получение.
С водородом сера в обычных условиях не соединяется. Лишь при нагревании протекает обратимая реакция:
равновесие которой около 350 °С смещено вправо, а при повышении температуры смещается влево. Практически сероводород получают обычно действием разбавленных кислот на сульфид железа:
Удобный способ получения Н2S состоит в нагревании выше 170 °С сплава порошкообразной серы с парафином и измельченным асбестом (приблизительно 3 : 5 : 2 по массе). При охлаждении реакция прекращается, но вновь вызывается нагреванием. Исходный сплав может заготовляться впрок и расходоваться по мере надобности (один грамм дает около 150 мл Н2S). Очень чистый сероводород может быть получен пропусканием смеси Н2 с парами серы над нагретыми до 600 °С кусками пемзы. Критическая температура Н2S равна 100 °С при критическом давлении 89 атм. Термическая диссоциация Н2S начинается приблизительно с 400 °С и становится практически полной около 1700 °С.
Сульфгидрильные группы (HS) входят в состав некоторых биологически важных органических соединений.Применение.
Применяется в производстве серы, серной кислоты, сульфидов, в органическом синтезе, химическом анализе, для приготовления лечебных сероводородных ванн.
Отравление сероводородом.
На воздухе сероводород воспламеняется около 300 °С. Взрывоопасны его смеси с воздухом, содержащие от 4 до 45 объемн. % Н2S. Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения достаточных мер предосторожности. Между тем уже 0,1 % Н2S в воздухе быстро вызывает тяжелое отравление. При вдыхании сероводорода в значительных концентрациях может мгновенно наступить обморочное состояние или даже смерть от паралича дыхания (если пострадавший не был своевременно вынесен из отравленной атмосферы). Первым симптомом острого отравления служит потеря обоняния. В дальнейшем появляются головная боль, головокружение и тошнота. Иногда через некоторое время наступают внезапные обмороки. Противоядием служит прежде всего чистый воздух. Тяжело отравленным сероводородом дают вдыхать кислород. Иногда приходится применять искусственное дыхание. Хроническое отравление малыми количествами Н2S обусловливает общее ухудшение самочувствия, исхудание, появление головных болей и т. д. Предельно допустимой концентрацией Н2S в воздухе производственных помещений считается 0,01 мг/л. Содержащие его баллоны должны иметь белую окраску с красной надписью "Сероводород" и красной чертой под ней.
Поясните, как называют соли сероводородной кислоты, напишите уравнение реакции, характерной для сероводорода и его солей. Реакция 2.1а протекает в природных условиях, и за счет ее протекания в природе формируются месторождения свободной серы. Поясните, чем сероводород отличается от сероводородной кислоты, несмотря на то что их обозначают одной формулой. Серная кислота — сильная и тем не менее эта… Читать ещё >
- химия. в 2 ч. часть 1. общая и неорганическая химия
Сероводород. Сероводородная кислота ( реферат , курсовая , диплом , контрольная )
I. Общая характеристика.
Эмпирическая формула H2S, структурная Н Н, электронная H: S:H. AfCH2S) = 34 г/моль.
II. Физические свойства.
Сероводород — газ, без цвета, с запахом тухлых яиц, растворяется в воде (1 объем воды растворяет 2,5 объема сероводорода); немного тяжелее воздуха. При высоких давлениях и низких температурах сжижается.
Раствор сероводорода в воде называется сероводородной кислотой.
III. Химические свойства.
1. Сероводород разлагается при нагревании:

- 2. Так как сероводород сильный восстановитель, то он реагирует с окислителями:
- 2.1. С кислородом:
- а) избыток сероводорода:
![Сероводород. Сероводородная кислота.]()
б) избыток кислорода:
![Сероводород. Сероводородная кислота.]()
Реакция 2.1а протекает в природных условиях, и за счет ее протекания в природе формируются месторождения свободной серы.
2.2. С другими окислителями:
![Сероводород. Сероводородная кислота.]()
3. Реагирует с диоксидом серы или с сернистой кислотой:
![Сероводород. Сероводородная кислота.]()
Химическая активность сероводорода резко усиливается при растворении его в воде — образуется сероводородная кислота. Это слабая двухосновная кислота, летучая, так как в воде сероводород растворяется ограниченно.
Сероводород в водном растворе диссоциирует ступенчато:
![Сероводород. Сероводородная кислота.]()
Для сероводородной кислоты характерны все свойства неокислительных кислот. Интересной особенностью этой кислоты является ее взаимодействие с солями меди (Н), так как сульфид меди (Н) [соль черного цвета] практически нерастворим. Эта реакция является характерной для сероводородной кислоты и ее солей (сульфидов):
![Сероводород. Сероводородная кислота.]()
Напишите уравнения реакций, характеризующих другие свойства сероводородной кислоты.
Сероводород ядовит для человека и животных, поэтому требует осторожного обращения; в этом состоит его негативная экологическая роль.
Сероводородную кислоту получают растворением сероводорода в воде.
1. Взаимодействием серы и водорода при нагревании:
![Сероводород. Сероводородная кислота.]()
- 2. При гниении белков (в природе).
- 3. Действием на растворимые сульфиды более сильных кислот:
![Сероводород. Сероводородная кислота.]()
Известны и другие способы получения сероводорода.
Сероводородную кислоту применяют как реактив в лаборатории (для проведения окислительно-восстановительных реакций, в анализе химических соединений).
Сероводород используют для получения сероводородной кислоты, диоксида серы и т. д.
Сернистый водород, или гидросульфит, представляет собой сладковатый газ без цвета с запахом тухлых яиц. Он является двоичным соединением серы и водорода, для обозначения применяется формула H2S. Ядовитый и огнеопасный газ используется в производстве серы, сульфидов и серной кислоты, применяется для лечебных ванн.
![Сероводород химические]()
Общее описание
Вещество в природных условиях встречается в смеси нефтяных газообразных углеводородов, содержится в составе вулканических выделений. В водной среде находится в форме раствора, например, в Черном море содержится в толще воды на глубине более 200 м. Гидросульфит выделяется в процессе разложения белков, которые имеют в составе цистеин или метионин (аминокислоты с содержанием серы). Малое количество сернистого водорода выделяется из кишечных газов животных и человеческих организмов.
Физические характеристики
![Сероводород как выглядит]()
Вещество относится к термически устойчивым соединениям в агрегатном состоянии, при повышении температуры свыше +400ºС разделяется на простые компоненты — Н2 и S. Молекула вещества представляется в изогнутой форме и отличается полярностью (μ = 0,34 . 10 -29 Кл . м). Водороды не обнаруживаются в дигидросульфидах, в отличие от воды, поэтому в нормальных условиях вещество в жидкое состояние не преобразуется.
Физические свойства сероводорода:
![Сульфат-серы]()
- При растворении дигидросульфида в водной среде получается малая по силе сероводородная кислота, которая становится сверхпроводником при понижении температуры до -70ºС и показателе давления 150 ГПа.
- В жидком состоянии H2S обладает сниженной электропроводимостью, по сравнению с водной средой, так как сернистый водород отличается слабой диэлектрической проницаемостью. В таком виде соединение получает свойства органического раствора, который почти не растворяет лед.
- Твердый дигидросульфид отличается плотностью молекулярного строения, при этом у всех частиц есть 12 расположенных рядом соседей (связи явно различаются со структурным сцеплением льда).
- Плавится серный водород при показателе 2,5 кДж/моль, а испаряется в случае достижения условий 18,7 кДж/моль.
- Вещество весит больше воздуха и подвергается сжатию при достижении температуры -60,2ºС. Полное сжатие проходит при -85,7ºС.
В воздушной среде происходит горение вещества с образованием воды и серного диоксида, реакция выражается уравнением: 2H2S + 3O2 = 2SO2 + 2H2O. Если в огонь поместить холодный твердый предмет, то окисление идет до свободной серы, которая образует остаток желтого цвета: O2 + 2H2S = 2S + 2H2O. Чтобы растворить 2,5 объема сернистого водорода, потребуется всего 1 объем жидкости, при этом раствор будет называться сероводородной водой. Смесь становится мутной при содержании на воздухе и на свету, так как происходит кислотная реакция между гидросульфидом и воздухом.
Химические свойства
В результате охлаждения насыщенного раствора можно получить кристаллогидрат H2S . 6H2O. Растворимость сероводородного компонента в органике происходит более активно, чем в воде. В одной порции спирта растворяется 7 частей сероводорода. Интенсивность растворимости достигает максимума при температуре 350ºС, что объясняется получением полисульфидов.
В воде вещество окисляется йодом с выделением свободной серы, а в газовой среде сера окисляет йодистый водород до появления свободного йода по схеме:
- I2 + H2S = S + 2HI.
- S + 2HI = I2 + H2S + 6 кДж.
![Свойства сероводорода]()
В газово-воздушной среде при температуре ниже -50ºС образуется молярное соединение H2S . I2. Константа диссоциации сероводородной кислоты слабее угольной, децинормальная смесь имеет кислотность pH = 4.1. Сера с водородом не вступает во взаимодействие в обычных обстоятельствах, только при увеличении температуры идет реакция: S + H2 = H2S + 21 кДж.
Химические свойства сероводорода позволяют выступать ему в качестве восстановителя, примером служит список реакций:
- Br 2 + H 2 S -2 = 2HBr + S 0 .
- 4Cl 2 + 4H 2 O +H 2 S -2 = H 2 S + 6SO 4 + 8HCl.
- 2FeCl 3 + H2S -2 = S 0 + 2FeCl 2 + 2HCl.
Серебро получает черный оттенок, если реагирует с сероводородом, что является результатом взаимного влияния растворимых сульфидов и дигидросульфидов в химии. Средние соли с содержанием аниона S 2- носят название сульфидов, а кислые массы с анионом HS относятся к классу гидросульфидов. Соли имеют различную цветность, несмотря на то, что ионы являются бесцветными. Сульфиды в воде почти не растворяются, а гидросульфиды реагируют и образуют водные растворы.
Соли кислоты
Вещества растворяются в воде, если находятся в таблице щелочных металлов. Остальные соединения подобного типа не взаимодействуют с водой. Сульфиды выпадают в осадок в результате реакции гибридизации, когда вводятся металлические соли или соль сероводородной кислоты.
У щелочноземельных и щелочных металлов есть гидросульфиды М 2+ (Н S) 2 и M + HS. Нестойкими являются гидросульфиды Ca 2+ Sr 2+ . Растворимые сульфиды героизируются в воде, так как относятся к слабым солям кислоты. Часто такая реакция является необратимой с появлением осадка в виде нерастворимого гидроксида.
![Получение сероводорода]()
Получение вещества
Практическое получение сероводорода проходит в реакции сульфида железа и разбавленных кислот. Другим удобным методом является нагревание сплавленной серы в виде порошка до 170ºС в сочетании с частицами асбеста и парафином. Концентрация смеси составляет 3:2:5, соответственно. В охлажденном состоянии взаимодействие прекращается, а активизируется реакция с повышением температуры.
Начальный сплав заготавливается заранее и расходуется в случае необходимости, при этом 1 г дает 150 г сероводорода. Для получения чистого вещества смесь пропускается вместе с серными парами над разогретыми глыбами пемзы, при этом температура равняется 100ºС, а давление составляет 90 атм. Температурная диссоциация сероводорода наступает при 400ºС и достигает апогея при достижении 1700ºС.
Вред сероводорода
![Диаллил-трисульфид]()
Взрывоопасной является смесь вещества с воздухом, при этом температура 300ºС ведет к воспламенению и дальнейшему взрыву в случае содержания 5−46% H2S. Ядовитость вещества часто недооценивается и деятельность с ним без защитных средств ведет к отравлению. Всего 0,1% концентрация сероводорода в атмосфере помещения вызывает неприятные последствия для организма.
После вдыхания сероводородных паров наступает потеря обоняния, затем обморок или паралич дыхания, что ведет к смерти человека. Помогает быстрое удаление пострадавшего из проблемного помещения. Симптомами отравления является головная боль, нарушение сознания и тошнота. Иногда обмороки наступают позднее, когда человек уже не работает с газом. Средства защиты необходимы, при этом требуется тщательно запахнуть респираторы и другие предметы предохранения.
Применение дигидросульфида
Сероводород в качестве сульфидов используется в технике, например, с его применением изготавливаются люминофоры, полупроводники. В этом производстве задействуются сульфиды кадмия и цинка. В качестве основы смазок берется дисульфид молибдена.
Польза от применения сероводорода:
![Применение сероводорода]()
- в области неорганической химии вещество применяется в качестве реагента для выделения осадка тяжелых металлов, если их сульфиды относятся к категории слаборастворимых;
- в медицине используется в виде искусственных и природных ванн и вводится в состав минеральных вод;
- серный водород участвует в производстве сульфидов, элементарной серы и серной кислоты;
- используется в синтезе меркаптанов и тиофена.
В последние годы рассматривается возможность применения вещества из глубин моря. Его планируется использовать в области сероводородной энергетики в виде химического и электронного сырья.
В нормальном состоянии
Эндогенный дигидросульфид в небольшой массе производится клетками живых организмов и является важным компонентом многих биологических действий. Вещество является третьим из найденных ранее трансмиттеров после угарного газа и азотной окиси. Этот тип соединения выделяется в организме с помощью цистеина и относится к группе спазмолитиков и вазодилататоров. Он активно действует на ЦНС, повышает трансмиссию нейронов и способствует функционированию памяти.
![Физические свойства сероводорода]()
Впоследствии вещество окисляется до ионов сульфитов в митохондриях с помощью тиосульфат-редуктазы, затем превращается в ионы сульфатов при воздействии специального фермента. Из организма в конечном виде выводится мочевыми протоками.
В организме человека эндогенный сероводород считается важным фактором для защиты от заболеваний сердца и сосудов, благодаря аналогичности со свойствами азотной окиси. Несмотря на схожесть, действие сероводорода и оксида азота различаются, хотя они оба оказывают кардиопротективное действие. Азот активирует гуанилатциклазу, а дисульфид приводит в тонус чувствительные каналы поставки калия в гладких мышцах.
Исследования показывают, что для поддержания сосудистого тонуса важно сочетание азота, сероводорода и угарного газа. Окись азота в условиях физиологической нормы расширяет крупные артерии и вены, а серный водород отвечает за расслабление периферических сосудов крови. В организме выявляется взаимодействие сигнальных путей азота и сероводорода, что говорит о зависимости спазмолитического, цитопротекторного и противовоспалительного действия газов друг от друга.
В теле человека серный водород реагирует с внутриклеточными ферментами, при этом образуется HSNO (нитрозотиол). Веществу отводится ведущая роль контроля внутриклеточной концентрации энзимов.
При патологических изменениях
В случае инфаркта выявляется дефицит эндогенного сероводородного газа, что негативно сказывается на состоянии сосудов. Сниженная биологическая доступность серного водорода и окиси азота ведет к некрозу мышцы сердца. Дефицит сероводорода способствует высвобождению большого числа радикалов и наступает экссудативный внутриклеточный стресс.
При недостатке серного водорода активность ферментов изменяется и угнетается биологическое воспроизводство азота. В это время применяется сероводородная терапия прекурсорами вещества или донорами, например, диалил-трисульфидами для увеличения содержания газа в крови и мышцах больного. В результате опасность патологии и повреждений сердечной мышцы становится минимальной.
![Сульфат серы формула]()
В организме серный водород может запасаться в виде сульфат-серы. Это промежуточный компонент, который образуется при взаимодействии избыточного вещества с кислородом и используется при необходимости. Порции запасного сероводорода вступают в реакцию с кислородом и активизируют выработку азота, что уменьшает число свободных радикалов.
При заболевании Альцгеймера снижается уровень сероводородного компонента в сосудах мозга, как и у пациентов с недугом Паркинсона. Введение прекурсоров вещества дает улучшение самочувствия вплоть до полного избавления от характерных симптомов. При синдроме Дауна, наоборот, содержание сероводорода обнаруживается в очень завышенной концентрации.
Использование при анабиозе
Теоретически и практически доказано, что продукция сернистого водорода у особей, которые впадают в зимнюю спячку, повышается в несколько раз. Дыхание замедляется и составляет около 10 движений в минуту, а температура тела снижается на 2º. На опытах с мышами было установлено, что гипотермия мозга при этом уменьшает повреждение в органе при инсульте или травматическом воздействии.
![Сероводородная гибернация]()
Если бы удалось воспроизвести такое действие в организме человека, то сероводородная гибернация стала бы полезным открытием в клинике спасения жизней после травм, инсультов и инфарктов, а также для хранения органов от донора.
Исследования показывают, что эндогенный серный водород влияет на скорость метаболизма, регулирует естественным способом уровень обменных процессов. Последние опыты показали, что эффект гибернации не возникает у крупных животных, а развивается исключительно у мышей. Анабиозу с помощью сероводородного компонента нельзя подвергнуть свиней или овец, что было практически доказано. Клинические испытания действия сероводорода на человека в части анабиоза были начаты, но неожиданно прекратились медицинской компанией без объяснения причин.
Читайте также: