Реферат на тему применение кислорода
Обновлено: 02.07.2024
Всем живым существам кислород необходим для дыхания. Поэтому его в баллонах применяют для дыхания в тех условиях, где нет воздуха: под водой, в космосе. Его используют пожарные при работе в условиях высокой задымленности, альпинисты при подъеме на большие высоты. В медицине кислород используют для пациентов, которые не могут самостоятельно дышать, а также для лечения некоторых болезней. Однако долго дышать именно чистым кислородом нельзя, это опасно для жизни.
Это вещество применяют для приготовления кислородных коктейлей, им насыщают куриный белок, смешивая его с витаминами и минералами. Такой продукт улучшает обменные процессы в организме. Газ необходим не только людям. Им обогащают воду при содержании аквариумных рыб и в прудовых хозяйствах, занимающихся выращиванием рыбы как продукта питания. В полеводстве хорошие результаты получают при замачивании семян перед посевом в воде, обогащенной кислородом.
Баллоны кислорода окрашивают в голубой цвет. В металлургии его используют при сварке, резке металлов. Ацетилен, когда сгорает в потоке чистого кислорода, помогает получить температуру около 3000 градусов. При таких высоких температурах железо плавится.
Кислород поддерживает горение. Для интенсификации процессов при сжигании топлива или мусора применяют не чистый кислород, но воздух, который его содержит. Всем теплостанциям, которые работают за счет сжигания нефти, газа или угля нужен кислород из атмосферы. Невозможно без этого элемента сделать качественную бумагу, кислород выступает в роли ее отбеливателя. В стиральных порошках также часто присутствуют кислородные отбеливатели.
Жидкий газ нашел применение в подрывном деле. Его смесь с древесным и угольным порошками, различными взрывчатыми веществами называется оксиликвит. В жидком виде кислород необходим для сжигания ракетного топлива.
Кислород используют при очистке сточных вод. Микроорганизмам активного ила, которые поедают органические отходы, для жизнедеятельности нужен кислород. Из-за этого при очистке воды в нее подают воздух.
Модификация кислорода – озон губителен для бактерий и грибков, поэтому его используют для обеззараживания питьевой воды и воды в бассейнах, стерилизации медицинских изделий, воздуха.
Кислород применяется в следующих случаях:
1) В энергоснабжении. Как известно, атмосфера является газовой геосферой Земли, содержащей огромное количество кислорода, без которого жизнь на нашей планете была бы невозможной. Поэтому все животные, растения, а также другие живые существа используют кислород для производства необходимой энергии.
Кислород у людей и животных поглощается гемоглобином в крови из воздуха в легкие. Затем он переносится в более глубокие ткани тела и далее распределяется по всем клеткам.
Кислород поглощается митохондриями на клеточном уровне. Там он используется для получения энергии от разрушения молекулы глюкозы. Отходы этой реакции включают молекулу воды и двуокись углерода.
2) В здравоохранении. При наличии респираторной недостаточности необходима кислородная терапия. Это может свидетельствовать о таких заболеваний, как ХОБЛ, пневмония, сердечная недостаточность и т. д.
Даже в случае отравления кислородная терапия может быть назначена для стабилизации состояния пациента. Таким образом, медикаментозное использование кислорода включает в себя поддержку дыхания в случае респираторной недостаточности, а также минимизацию воздействия ядовитых веществ на организм.
3) В анализе веществ. Анализ проб разных веществ является ключевым аспектом качества в промышленности. Из доступных аналитических методов в химии, пламенная фотометрия и атомно-абсорбционная спектрометрия используют пламя для определения элементов в образце. Для создания пламени высокой температуры необходим кислород, который преобразовывает возбужденные электроны в атомы.
4) В стерилизации. Кислород - электроотрицательный элемент, являющийся сильным стерилизующим агентом. Он может уничтожать микробы в любой среде, будь то вода или земля. Он используется в качестве дезинфицирующего средства в виде перекиси водорода H2O2.
Кроме того, существует метод, называемый кислородной плазменной обработкой, где молекула кислорода разрушается для выделения одного атома кислорода или его ионов, которые являются смертельно токсичными. Они используются для стерилизации веществ при комнатной температуре.
5) В химических реакциях. Кислород является частью многих химических реакций. Существенной химической реакцией является реакция окисления-восстановления. В них происходит добавление или удаление кислорода. Добавление называется окислением, а его удаление - восстановлением. Эти химические реакции используются для синтеза, анализа, а также титрования веществ.
Применение кислорода
Интересные ответы
Великий поэт появился в семье отставного майора Пушкина Сергея Львовича, и правнучки арапа Петра I Надежды Осиповны 6 июня 1799 г. Кроме него в семье была старшая сестра Ольга и младший брат Лев
Силикатная промышленность представляет собой сферу, занимающуюся производством природных соединений из разных материалов. В данной промышленности производится
Декарт - поистине великий человек, философ, физиолог, математик, физик и механик, автор аналитической геометрии и современной символики в алгебре, создатель механицизма
- Для учеников 1-11 классов и дошкольников
- Бесплатные сертификаты учителям и участникам
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
Школа БИОТОП Лаборатории непрерывного математического образования
2. Кислород как химический элемент
2.1. Характеристики и свойства кислорода………….……………………………………. 4
Что нам известно о таком простом и естественном процессе, как дыхание? Конечно, мы знаем, что дышать человек может только в атмосфере Земли. Происходит это благодаря наличию в её составе такого компонента, как кислород. Известно, что без пищи человек может выжить несколько недель, без воды – несколько дней, а вот без кислорода – максимум несколько минут (да и то, если речь идет о тренированных дайверах). Практически всё, что нас окружает и что есть в нашем организме, содержит кислород или нуждается в его поступлении для поддержания жизнедеятельности. Свойства и значение этого химического элемента продолжают изучаться, находятся новые способы его использования в интересах человека.
В данной работе мы кратко рассмотрим свойства кислорода, историю его открытия; узнаем о содержании его в различных естественных средах, а также о способах получения чистого кислорода и сферах его применения.
Кислород как химический элемент
2.1 Характеристики и свойства кислорода
Кислород - элемент второго периода 16й группы Периодической системы химических элементов Д. И. Менделеева. Обозначается буквой О (от лат. Oxygenium ). Атомный номер – 8. Кислород – химически активный неметалл, самый легкий элемент их относящихся к группе халькогенов. Молекула кислорода состоит из двух атомов, обозначается формулой О2. В обычных условиях кислород представляет собой бесцветный газ без вкуса и запаха, несколько тяжелее воздуха. При охлаждении до -182,9 С кислород переходит в жидкую форму (жидкость светло-голубого цвета). Твердый кислород (охлаждение до -218,7 С) имеет кристаллическую структуру, это вещество также голубого цвета. Кислород растворяется в воде в небольших количествах (лучше, чем азот и водород).
Кислород является очень сильным окислителем, вступает в реакцию почти со всеми элементами, кроме инертных газов, золота и платины. Большинство реакций соединения веществ с кислородом сопровождается выделением тепла и света (такие процессы называют горением).
2.2. Кислород в природе
Кислород – самый распространенный элемент земной коры. Простое вещество О2 входит в состав атмосферы, составляя по объёму 21% воздуха. Молекулярный кислород находится в воде и почве. Также много кислорода и в твердых породах Земли. Известно около 1400 минералов, где кислород содержится в связанном виде, образуя разнообразные химические соединения. Самое простое и распространенное среди них – диоксид кремния SiO 2 – основа песка.
Кислород входит в состав органических молекул, а также в силу окислительных свойств обеспечивает процесс разложения органических веществ (гниение, брожение).
Кислород в природе существует также в виде аллотропной модификации – озона – трехатомной молекулы кислорода О3. Озон – голубоватый газ с характерным запахом, образуется при электрических разрядах в атмосфере и под действием ультрафиолетового солнечного излучения. Озон присутствует в атмосфере Земли на высоте 25 км, задерживая и поглощая опасные излучения Солнца.
Открытие кислорода
Впервые кислород был выделен в 1770 году известным шведским химиком К.В. Шееле путем нагревания селитры – нитрата калия KNO 3. Два года спустя он же смог выделить кислород еще несколькими способами: взаимодействием диоксида марганца MnO 2 с серной кислотой H 2 SO 4, прокаливанием перманганата калия KMnO 4 либо оксида серебра AgO 2. Несколько позже, в 1774 году, кислород выделил англичанин Д. Пристли. Он прокаливал оксид ртути HgO .
Получение кислорода
В условиях лаборатории кислород можно получить несколькими способами: путем электролиза воды либо в результате реакции термического разложения сравнительно непрочных сложных веществ (солей, оксидов и пероксидов).
В промышленности кислород получают нехимическим путем из воздуха. Воздух сжижают при низкой температуре под высоким давлением и подвергают перегонке. Азот и кислород имеют разные температуры кипения. Сначала отделяется азот, в жидком состоянии остается кислород. Кислород хранят в сжатом виде в стальных баллонах голубого цвета.
На современных атомных подводных лодках, где электрическая энергия вырабатывается в достаточном количестве, получают кислород при помощи электролиза из воды.
Использование кислорода
Поскольку все окислительные процессы протекают быстрее в чистом кислороде, чем в воздухе, кислород широко применяют в химической промышленности для производства азотной, серной и других кислот, смазочных масел. В металлургии кислород необходим для получения высококачественной стали из чугуна.
Кислород используют для получения высоких температур – например, для сварки и резки металлов используют смесь кислорода и ацетилена.
Жидкий кислород используется для окисления ракетного топлива и при производстве взрывных работ.
В медицине применение кислорода необходимо для поддержания жизни у пациентов с затрудненным дыханием, при лечении ряда заболеваний, в составе лечебных и профилактических кислородных коктейлей.
Кислород используется для нормального функционирования человека в чуждой среде или вне атмосферы Земли: на подводных лодках, при пилотировании космических аппаратов, при восхождении в горы, погружении под воду, полётах на большой высоте, а также в экипировке спасательных служб (пожарных).
Трехатомный кислород (озон) является намного более сильным окислителем чем молекулярный кислород. Он способен обезвреживать опасные химикаты и микроорганизмы, не создавая при этом новых вредных веществ. Благодаря этому свойству его используют для очистки воды и воздуха, дезинфекции, обработки продуктов питания. Также озон широко используется в медицине и косметологии.
В земной коре находится очень много кислорода. Почти половина всех атомов в Земле - это атомы кислорода. Он также составляет около одной пятой атмосферы планеты. Считается, что кислород в больших количествах присутствует во вселенной и в солнечной системе. Кислород необходим для жизни животных и человека на Земле.
Кислород – это бесцветный, без запаха, безвкусный газ. Он становится жидкостью при температуре -182,96 ° C и имеет слегка голубоватый оттенок. Жидкий кислород можно заморозить при температуре -218,4 ° C. Существуют две аллотропные формы кислорода: нормальный кислород и озон. Элемент, который находится в атмосфере, имеет два атома в каждой молекуле, а озон имеет три атома. Кислород обладает важным химическим свойством, он поддерживает горение.
Кислород взаимодействует с другими элементами при комнатной температуре, например, ржавчина - процесс взаимодействия металла с кислородом. Он также участвует в создании оксидов, карбонатов, нитратов, сульфатов и фосфатов. Оксиды - это химические соединения, которые состоят из кислорода и одного другого элемента. Примером может служить оксид кальция или известь. Карбонаты являются соединениями, содержащими кислород, углерод и какой-то другой элемент, например, карбонат натрия или сода. Нитраты, сульфаты и фосфаты содержат кислород и другие элементы, например, азот, серу или фосфор.
У кислорода существуют три естественных изотопа: кислород-16, кислород-17 и кислород-18. Они представляют собой две или более формы элемента и имеют разные массовые числа.
Кислород применяют во многих областях, например, в ракетном топливе. При соединении водорода и кислорода, освобождается большое количество энергии, которая используется для подъема ракеты в космос. Наибольший процент использования кислорода приходится на производство металлов. Например, кислород применяют для сжигания углерода и других примесей, которые находятся в железе для производства стали. Кислород также используется в химической промышленности в качестве исходного материала при изготовлении некоторых очень важных соединений. В медицине кислород используют для проведения искусственного дыхания, в производстве лекарств, для создания искусственной атмосферы.
Доклад №2
Общие сведения
Газовидный химический элемент, который крайне необходим для обеспечения нормального течения метаболизма живых организмов, в периодической системе имеющий обозначение О, называется кислород. Открыли его дважды: в 1772 году Карл Шеел, а спустя 2 года Джозеф Пристли. Этот газообразный химический элемент не имеет ни запаха, ни вкуса и является наиболее встречающимся компонентом внешней твердой оболочки Земли. Также кислород входит в соединение воды и большого количества горнорудных пород. В воздухе объем кислорода составляет 28%. Выделить его можно в процессе ступенчатого охлаждения газовой смеси, который сопровождается поэтапным скоплением разобщенных составляющих. А также проведя электролизное разложение воды (подвергаясь воздействию непрерывного электрического тока, вода распадается на кислород и водород).
Свойства химически активного неметалла
Кислород характеризуется большой химической интенсивностью и образует смешанные субстанции, состоящие из химически связанных атомов двух и более элементов почти со всей периодической системой, исключением являются только инертные газы (криптон, аргон, неон, гелий и ксенон). Во время превращения вычленяется большое количество тепла, такая реакция носит экзотермичное течение. Кислород очень трудно растворить в воде. С увеличением температуры понижается растворимость. При снижении температуры до – 218*С кислород становится твердым.
Когда сжатый газообразный кислород соприкасается с распыленными жировыми веществами, приготовленными из субстанций растительного, животного или минерального происхождения, получается их самовозгорание. Это служит частыми источниками пожаров. Чтобы несчастные случаи не происходили, следует скрупулезно производить обезжиривание кислородной аппаратуры. Бесцветный газ обладает способностью образования взрывчатых смесей и горючих газов, если поблизости есть источник открытого огня.
Добыча и применение кислорода
Получить кислород из воздуха можно с помощью специальных установок. В них воздух проходит фильтрацию, освобождается от водорода и азота, мельчайших сухих частиц, углекислого газа и обсушивается от влажности. Переработанный воздух машиной для сжатия перемещают газ под давлением в теплообменник для сжижения. Чтобы превратить жидкий кислород в газ используют криоцилиндры либо приспособления для накачивания (выкачивания) с теплообменным аппаратом.
Используется кислород во многих отраслях:
- В медицине применяется беспримесный кислород и соединение его с углекислым газом при болезненном состоянии человека, обусловленном действием на организм экзогенных токсинов; при расстройствах жизнедеятельности, возникших вследствие попадания в организм яда; при затруднении дыхания.
- В промышленности обогащенный кислородом воздух ускоряет технические процессы. Космонавты, аквалангисты, водолазы пользуются кислородными баллонами. Применяют также для достижения высокой температуры и для окисления ракетного топлива.
- В земледелии используют для ускорения прорастания семян и повышения их всхожести – замачивают в воде, насыщенной кислородом.
В металлургической отрасли. Не представляется возможным без подачи кислорода осуществить выплавку стали и чугуна. Процедура превращения чугуна в сталь происходит быстрее и качественнее.
Кислород
Альстромерия – это многолетнее цветущее растение. Относится к семейству Альстромерии. Родиной цветка принято считать Южную Америку. Еще древние индейские племена наделяли цветок магическими свойствами.
Юпитер считается пятой по счету планетой в нашей Солнечной системе. Он поражает и удивляет своими размерами. Космические аппараты, которые ученые отправляют для изучения планеты, возвращаются с огромным запасом интересных фотоснимков.
В этом году исполняется 193 года со дня рождения одного из самых любимых мальчишками романистов, предсказавших в своих фантастических произведениях за долгое их появление таких научных

Распространённость и свойства
Прежде всего, элемент необходим для дыхания активных организмов. Он также принимает участие в разложении мёртвых животных и растений. Содержание кислорода в земной коре составляет почти 50%, содержится в различных минералах в виде оксидов и солей. В связанном виде кислород входит в химический состав воды — его процентное соотношение составляет около 89%, а также в клетки всех живых существ — растений и животных.

Компонент характеризуется высочайшей химической насыщенностью и образует гибридные субстанции, состоящие из связанных атомов двух и более компонентов вместе с почти всей периодической таблицей, за исключением только лишь инертных газов (криптон, аргон, неон, гелий и ксенон). В период изменения акцентируется огромное количество тепла, такая реакция является экзотермичной. Он весьма тяжело приготовить в воде.
С повышением температуры водорастворимость убавляется. При снижении температуры вплоть до — 218*с он становится твёрдым.
При соприкосновении сжатого кислородного газа с распылёнными жирными веществами, полученными из веществ растительного, животного или минерального происхождения, происходит их самовозгорание. Это частый источник пожаров. Во избежание несчастных случаев кислородное оборудование должно быть тщательно обезжирено.
Бесцветное вещество обладает способностью образовывать взрывоопасные смеси и легковоспламеняющиеся газы, где поблизости находится источник открытого огня.
Извлечение вещества

Элемент из атмосферы можно приобрести с помощью специализированных установок. В них воздушное пространство фильтруется, избавляется от водорода и азота, малейших сухих элементов, углекислого газа, а также высушивается от влаги. Рециркулированный воздух сокращается компрессионной машиной, а газ перед нажимом переходит в конденсатор для сжижения. Для перевоплощения жидкого воздуха в газ применяются криоцилиндры либо приспособления для откачки с теплообменником. Этот химический компонент можно приобрести как в лаборатории, так и на промышленном предприятии.
Существует несколько способов получения кислорода в лабораторных условиях:
- С помощью реакции разложения хлората калия.
- За счёт разложения пероксида водорода при его нагревании в присутствии оксида марганца, который действует как катализатор.
- Через разложение перманганата калия.
Производство кислорода в промышленности осуществляется различными способами. Современное оборудование обеспечивает приготовление вещества любой степени чистоты.
Применение элемента
Химический элемент используется для жизнеобеспечения людей, страдающих затруднённым дыханием, а также для лечения некоторых недугов. Примечательно, что при нормальном давлении чистый кислород долго не, может быть, вдыхаем. Это небезопасно для здоровья в любой области. Бывает использование компонента в авиации.
Этот химический элемент используется в стекловаренных печах в качестве компонента, улучшающего горение в них. Кроме того, благодаря веществу промышленность сокращает выбросы оксидов азота до уровня, безопасного для жизни. Теплоэлектростанции, работающие на нефти, природном газе или угле, используют кислород для сжигания топлива. Без него все промышленные предприятия просто не работали бы.
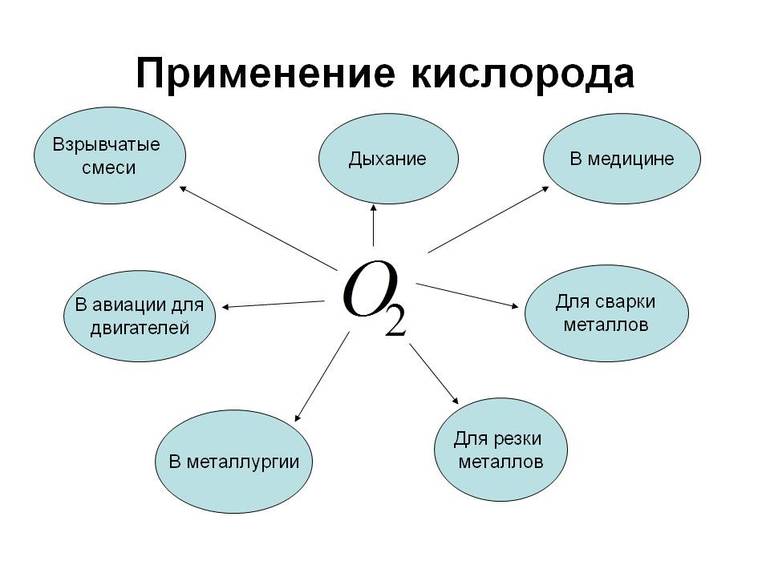
Этот химический элемент используется в спиртовании, делигнификации и других процессах, таких как:
- Отбеливание бумаги.
- Очистка сточных вод, что имеет большое значение.
- Подготовка питьевой воды в быту.
- Интенсификация сжигания отходов мусоросжигательных заводов и др.
В природе существует круговорот кислорода: в процессе фотосинтеза растения на свету превращают углекислый газ и воду в органические соединения. Этот процесс можно назвать выделением. Подобно людям и животным, растения ночью потребляют кислород из атмосферы, а потом растения вырабатывают его днём и расходуют ночью. Применение кислорода по химии 9 класса кратко рассматривают, пишут реферат с рисунками и схемами по теме.
Читайте также:

