Реферат на тему классификация химических элементов
Обновлено: 05.07.2024
Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т. д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения. В группу щелочных металлов попадал марганец, в группу кислорода и серы — ничего общего с ними не имеющий титан.
Октавы Ньюлендса
Английский учёный Джон Ньюлендс в 1864 г. опубликовал таблицу элементов, отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого.
Ньюлендс пытался придать этой зависимости, действительно имеющей место для лёгких элементов, всеобщий характер. В его таблице в горизонтальных рядах располагались сходные элементы, однако в том же ряду часто оказывались и элементы совершенно отличные по свойствам.
Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица не содержала свободных мест; в итоге закон октав был принят чрезвычайно скептически. Однако в его основе лежала правильная мысль о периодическом изменении свойств элементов с увеличением их атомного веса
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
Таблицы Олдинга и Мейра
В 1864 г. У.Олдинг опубликовал таблицу, в которой элементы были размещены согласно их атомным весам и сходству химических свойств, не сопроводив её, однако, какими-либо комментариями.
В том же 1864 г. появилась первая таблица немецкого химика Л. Мейера; в неё были включены 28 элементов, размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах сходных элементов.
Ближе к истине оказался немецкий химик Лотар Мейер. Он предложил таблицу, в которой все известные химические элементы были разбиты на шесть групп, согласно их валентности. В каждой из них находятся элементы, сходные по их атомности (валентности). В эту таблицу Мейер поместил всего 27 элементов, то есть меньше половины известных в то время. Расположение остальных элементов: B, Al, Cu, Ag и др. оставалось неясным , а структура таблицы была неопределенной .
В 1870 г. вышла работа Мейера, содержащая новую таблицу под названием “Природа элементов как функция их атомного веса”, состоявшая из девяти вертикальных столбцов. Сходные элементы располагались в горизонтальных рядах таблицы; некоторые ячейки Мейер оставил незаполненными. Таблица сопровождалась графиком зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид, прекрасно иллюстрирующий термин “периодичность”, уже предложенный к тому времени Менделеевым.
Д.И. Менделеев
В конце 1870 г. он доложил РХО статью “Естественная система элементов и применение её к указанию свойств неоткрытых элементов”, в которой предсказал свойства нескольких не открытых ещё элементов. Для предсказания свойств простых веществ и соединений Менделеев исходил из того, что свойства каждого элемента являются промежуточными между соответствующими свойствами двух соседних элементов в группе периодической таблицы (то есть сверху и снизу) и одновременно двух соседних элементов в периоде (слева и справа).
В 1871 г . в итоговой статье “Периодическая законность химических элементов” Менделеев дал следующую формулировку Периодического закона: “Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса”. Тогда же Менделеев придал своей периодической таблице вид, ставший классическим (короткий вариант).
В отличие от своих предшественников, Менделеев не только составил таблицу и указал на наличие несомненных закономерностей в численных величинах атомных весов, но и решился назвать эти закономерности общим законом природы. Он взял на себя смелость на основании предположения, что атомная масса предопределяет свойства элемента, изменить принятые атомные веса некоторых элементов и подробно описать свойства неоткрытых ещё элементов.
В начале XX века Периодическая система элементов неоднократно видоизменялась для приведения в соответствие с новейшими научными данными. Д.И. Менделеев и У. Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы. Инертные газы явились, таким образом, элементами, переходными между галогенами и щелочными металлами. Б. Браунер нашёл решение проблемы размещения в таблице редкоземельных элементов, предложив в 1902 г. помещать все РЗЭ в одну ячейку; в предложенном им длинном варианте таблицы шестой период таблицы был длиннее, чем четвёртый и пятый, которые в свою очередь длиннее, чем второй и третий периоды.
Дальнейшее развитие Периодического закона в было связано с успехами физики: установление делимости атома на основании открытия электрона и радиоактивности в конце концов позволило понять причины периодичности свойств химических элементов и создать теорию Периодической системы.
Менделеев, Ньюлендс, Шанкуртуа, Мейер – двигались по одной и той же дороге научного исследования. Все они по очереди подходили к лежавшему на пути науки драгоценному, но не обработанному камню. Каждый из них держал его в руках и каждый чувствовал, что камень этот не прост. Но один лишь гениальный Д.И.Менделеев оказался настолько проницательным, что не отбросил его в сторону, а смело принялся шлифовать и отрабатывать до тех пор, пока в руках у него не засияло во всём блеске величайшая ценность – ПЕРИОДИЧЕСКИЙ ЗАКОН ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (определение)– фундаментальный закон природы.
На данном уроке дана подробная историческая справка о попытках классификации химических элементов учеными-химиками, формируется представление о структуре периодического закона химических элементов Д.И. Менделеева, подчеркивается значение этого закона для химической науки.
I. Классификация химических элементов
1. Триады Дёберейнера
Попытки классификации химических элементов начались задолго до открытия Д.И.Менделеевым периодического закона. Естествоиспытатели в начале XIX сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно.
Триады Дёберейнера

В 1829 году немецкий химик И.В.Дёберейнер заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами.
Сущность данной классификации заключается в следующем: в каждой триаде есть средний элемент, масса атома которого будет равна средней арифметической массе двух крайних элементов.
Например, рассмотрим первую триаду: Li, Na, K.
Их атомные массы соответственно равны 7, 23, 39.

Система классификации И.В.Дёберейнера оказалась несовершенной. Некоторые триады не содержали тех элементов, которые были бы похожи с ними по химическим свойствам.
Так, например, триада, содержащая S, Se, Te , не содержала кислорода O.
Ошибка И.В.Дёберейнера заключалась в том, что он ограничил себя поиском тройственных союзов, т.е. триад.
Но И.В.Дёберейнер был первым из естествоиспытателей, который связал свойства химических элементов с их атомными массами. Все дальнейшие попытки классификации химических элементов основывались на связи масс атомов с их химическими свойствами.
2. Спираль Шанкурту

В середине XIX века появилось много работ ученых, которые пытались классифицировать химические элементы. Французский геолог и химик А.Э. Шанкуртуа в 1862 году предложил свою классификацию химических элементов.

Рис. 1. Спираль Шанкуртуа

Он расположил все известные к тому времени химические элементы в порядке возрастания их атомных масс, а полученный ряд нанес на поверхность цилиндра, по линии исходя из его основания под углом 45к плоскости основания, так называемая земная спираль. Рис.1.
После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан.
3. Октавы Ньюлендса

В 1865 году 18 августа английский ученый Дж.А.Ньюлендс расположил химические элементы в порядке возрастания их атомных масс. В результате он заметил, что каждый восьмой элемент напоминает по свойствам первый элемент. Найденную закономерность, он назвал законом октав по аналогии с семью интервалами музыкальной гаммы.Рис.2.Закон октав он сформулировал следующим образом:

Рис. 2. Октавы Ньюлендса
Он расположил элементы по семь в группы. Таким образом, он заметил, что вертикальные ряды, полученные после такого расположения, включают в себя элементы, схожие по своим химическим свойствам. Дж.А. Ньюлендс был первым, кто соотнес атомные массы химических элементов и их химические свойства и присвоил каждому элементу порядковый номер. Но все же в его таблице не было свободных мест. Он ограничил себя семью клетками в каждом периоде ,и некоторые клетки ему пришлось поместить по несколько элементов. Поэтому научный мир отнесся скептически к его открытию.
В 1864 году английский химик У. Одлинг опубликовал таблицу, в которой элементы были размещены, согласно их атомным весам и сходствам химических свойств. Но он не дал никаких комментариев к своей работе, и она не была замечена.

4. Таблица химических элементов Мейера

Рис. 3. Таблица химических элементов Мейера

5. Открытие периодического закона Д.И.Менделеевым

Рис. 4. Таблица химических элементов Менделеева
Еще алхимики пытались найти закон природы, на основе которого можно было бы систематизировать химические элементы. Но им недоставало надежных и подробных сведений об элементах. К середине XIX в. знаний о химических элементах стало достаточно, а число элементов возросло настолько, что в науке возникла естественная потребность в их классификации. Первые попытки классификации элементов на металлы и неметаллы оказались несостоятельными. Предшественники Д.И.Менделеева (И. В. Деберейнер, Дж. А. Ньюлендс, Л. Ю. Мейер) многое сделали для подготовки открытия периодического закона, но не смогли постичь истину. Дмитрий Иванович установил связь между массой элементов и их свойствами.
Открытию периодического закона предшествовало 15 лет напряженной работы. 1 марта 1869 г. Дмитрий Иванович предполагал выехать из Петербурга в губернии по делам.
Видео-фильм о Д.И. Менделееве
II. Открытие Периодического закона
Периодический закон был открыт на основе характеристики атома – относительной атомной массы.
Менделеев расположил химические элементы в порядке возрастания их атомных масс и заметил, что свойства элементов повторяются через определенный промежуток – период, Дмитрий Иванович расположил периоды друг под другом., так, чтобы сходные элементы располагались друг под другом – на одной вертикали, так была построена периодическая система элементов.
1 марта 1869г. Формулировка периодического закона Д.И. Менделеева.
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
К сожалению, сторонников периодического закона сначала было очень мало, даже среди русских ученых. Противников – много, особенно в Германии и Англии.
Открытие периодического закона – это блестящий образец научного предвидения: в 1870 г. Дмитрий Иванович предсказал существование трех еще неизвестных тогда элементов, которые назвал экасилицием, экаалюминием и экабором. Он сумел правильно предсказать и важнейшие свойства новых элементов. И вот через 5 лет, в 1875 г., французский ученый П.Э. Лекок де Буабодран, ничего не знавший о работах Дмитрия Ивановича, открыл новый металл, назвав его галлием. По ряду свойств и способу открытия галлий совпадал с экаалюминием, предсказанным Менделеевым. Но его вес оказался меньше предсказанного. Несмотря на это, Дмитрий Иванович послал во Францию письмо, настаивая на своем предсказании.
Ученый мир был ошеломлен тем, что предсказание Менделеевым свойств экаалюминияоказалось таким точным. С этого момента периодический закон начинает утверждаться в химии.
В 1879 г. Л. Нильсон в Швеции открыл скандий, в котором воплотился предсказанный Дмитрием Ивановичем экабор.
В 1886 г. К. Винклер в Германии открыл германий, который оказался экасилицием.
Но гениальность Дмитрия Ивановича Менделеева и его открытия — не только эти предсказания!
В четырёх местах периодической системы Д. И. Менделеев расположил элементы не в порядке возрастания атомных масс:
Ar – K, Co – Ni, Te – I, Th - Pa
Ещё в конце 19 века Д.И. Менделеев писал, что, по-видимому, атом состоит из других более мелких частиц. После его смерти в 1907 г. было доказано, что атом состоит из элементарных частиц. Теория строения атома подтвердила правоту Менделеева, перестановки данных элементов не в соответствии с ростом атомных масс полностью оправданы.
Современная формулировка периодического закона.
III. Периодическая система химических элементов
Графическим изображением периодического закона является периодическая система химических элементов. Это краткий конспект всей химии элементов и их соединений.
Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо):
1. Металлические свойства уменьшаются
2. Неметаллические свойства возрастают
3. Валентность элементов в формулах высших оксидов возрастает от I до VII, а в формулах летучих водородных соединений уменьшается от IV до I.
Основные принципы построения периодической системы
Как устанавливается последовательность элементов по номерам? (что положено в основу п.с.?)
Элементы расставлены в порядке увеличения их относительных атомных масс. При этом есть исключения.
Ar – K, Co – Ni, Te – I, Th - Pa
Принцип объединения элементов в группы.
Качественный признак. Сходство свойств простых веществ и однотипных сложных.
Принцип объединения элементов в периоды.
Совокупность элементов по мере роста относительной атомной массы от одного щелочного металла до другого.
На сегодняшний день открыто 118 химических элементов, каждый из которых занял свою ячейку в Периодической системе. Новые открываемые элементы имеют большую относительную атомную массу, чем уже известные и попадают в конец таблицы. В настоящее время используются длинная и короткая формы периодических таблиц.
В ячейке таблицы записывается символ химического элемента, его название и порядковый номер, значение относительной атомной массы.

Рис. Информация о химическом элементе кислороде
При изучении школьного курса химии, как правило, пользуются короткой формой Периодической таблицы. Она содержит 8 вертикальных столбцов (групп), которые нумеруются римскими цифрами. Каждая группа включает в себя главную (А) и побочную (В) подгруппы.
У элементов главных подгрупп высшая валентность, как правило, равна номеру группы. Одними из исключений этого правила являются кислород (его валентность всегда равна II) и фтор (высшая валентность которого – I).
С помощью Периодической таблицы можно определить и низшую валентность элемента. Для этого из 8 (максимального числа групп) надо вычесть номер группы, в которой находится элемент. Например, высшая валентность фосфора равна V (т. к. фосфор находится в V группе), а низшая равна III. Только это правило применимо для элементов главных подгрупп V–VII групп.
Горизонтальные ряды химических элементов в Периодической таблице называются периодами. Пока их 7. Первые три периода называют малыми (первый период содержит всего 2 хим. элемента, а 2 и 3 – по 8 элементов). Периоды 4, 5, 6, 7 называются большими.
По положению элемента в Периодической системе можно определить его принадлежность к металлам или неметаллам. Для этого в короткой форме таблицы нужно провести диагональ от бериллия к астату. Элементы главных подгрупп, находящиеся выше этой диагонали (плюс водород), относятся к неметаллам. Все остальные элементы – металлы. Инертные газы He, Ne, Ar, Kr, Xe, Rn не относят ни к металлам, ни к неметаллам.
В длинной форме таблицы можно провести диагональ от бора к астату. Все элементы, которые находятся ниже этой диагонали, образуют простые вещества металлы.

Рис. Длинная форма периодической системы химических элементов
По положению элемента в периодической системе можно получить информацию о его высшем оксиде и гидроксиде. У неметаллов высший оксид и гидроксид имеют кислотный характер, у металлов – основный, у переходных металлов оксид и гидроксид, как правило, амфотерные (см. рис.).

Рис. Связь свойств элементов и образованных ими соединений
Открытие новых химических элементов
В 1875 году П.Л. Буабодран открыл галлий. В 1879 году Л.Ф. Нильсон открыл скандий, а в 1886 году К.Винклер откывает германий. Это соответственно были экабор , экаалюминий, экасилиций, предсказанные Д. И. Менделеевым.
С этого момента периодический закон и периодическая система Д. И. Менделеева становится общепризнанной всем мировым химическим сообществом. Особая заслуга Д. И. Менделеева заключается в том, что он не только расположил химические элементы в определенной последовательности, но и дал описательную характеристику своей периодической системы. При помощи её можно было предсказывать химические свойства различных химических элементов.
Д. И. Менделеев взял на себя смелость оставить пустые клетки в своей таблице и исправить некоторые значения атомных масс химических элементов, предсказать свойства еще неоткрытых целых групп соединений. Таким образом, Д. И. Менделеев является первооткрывателем одного из главных законов природы.
2. Структура ПСХЭ
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.

Короткая форма таблицы Д.И. Менделеева (полудлинный вариант таблицы Д.И. Менделеева)
Существует ещё и длинный вариант таблицы, он похож на полудлинный, но только лантаноиды и актиноиды не вынесены за пределы таблицы.
Оригинал таблицы Д. И. Менделеева
1. Период – химические элементы, расположенные в строчку (1 – 7)
Малые (1, 2, 3) – состоят из одного ряда элементов
Большие (4, 5, 6, 7) – состоят из двух рядов – чётного и нечётного
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом, а заканчиваются благородным газом.
Во всех периодах с увеличением относительных атомных масс элементов наблюдается усиление неметаллических и ослабление металлических свойств. В больших периодах переход свойств от активного металла к благородному газу происходит более медленно (через 18 и 32 элемента), чем в малых периодах (через 8 элементов). Кроме того, в малых периодах слева направо валентность в соединениях с кислородом возрастает от 1 до 7 (например, от Na до Cl). В больших периодах вначале валентность возрастает от 1 до 8 (например, в пятом периоде от рубидия к рутению), затем происходит резкий скачок, и валентность уменьшается до 1 у серебра, потом снова возрастает.
2. Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные (А) и побочные подгруппы (Б).
Главные подгруппы состоят из элементов малых и больших периодов.
Побочные подгруппы состоят из элементов только больших периодов.
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме N, O, F).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I - III групп (кроме бора) преобладают основные свойства, с IV по VIII - кислотные.
Геохимические классификации элементов - способы систематизации химических элементов в зависимости от их встречаемости в природе или просто классификации используемые в геохимии. Таких классификаций существует несколько.
Содержание
Классификация по распространенности: петрогенные и редкие элементы………….2
Классификация по коэффициентам распределения: совместимые и несовместимые элементы……………………………………………………………………….2
Макро- и микроэлементы………………………………………………………. 2
2. Классификация Ферсмана ……………………………………………………………………3
3. Классификация Вернадского ………………………………………………………………. 3
4. Классификация Гольдшмидта………………………………………………………………. 4
5. Список используемой литературы………………………………………………………….. 6
Вложенные файлы: 1 файл
Геохимическая классификация хим.эелемнтов (1).doc
Содержание
Классификация по распространенности: петрогенные и редкие элементы………….2
Классификация по коэффициентам распределения: совместимые и несовместимые элементы………………………………………………………… …………….2
Макро- и микроэлементы…………………………………………… …………. 2
2. Классификация Ферсмана ……………………………………………………………………3
3. Классификация Вернадского ………………………………………………………………. 3
4. Классификация Гольдшмидта………………………………………………… ……………. 4
5. Список используемой литературы…………………………………………………… …….. 6
Геохимические классификации элементов - способы систематизации химических элементов в зависимости от их встречаемости в природе или просто классификации используемые в геохимии. Таких классификаций существует несколько.
1. Классификация по распространенности: петрогенные и редкие элементы
С точки зрения термодинамики компоненты системы могут быть в зависимости от концентрации могут быть разделены на две группы:
- главные, которые определяют фазовый состав системы
- второстепенные компоненты, которых слишком мало для того, что бы образовать самостоятельные фазы или повлиять на систему, и они пассивно распределяются между существующими фазами.
В природных системах распространенность элементов накладывает на состав типичных систем определенные ограничения. Из 98 элементов периодической таблицы Менделеева, встречающихся в природе наиболее распространены 12 элементов, которые в подавляющем большинстве случаев породы слагают 99% массы горных пород. Эти элементы: O, Si, Ti, Al, Mg, Fe, Ca, Na, K, P, H, C называются петрогенными (петро — порода, ген — происхождение).
Все остальные элементы относятся к редким или рассеянным элементам. Деление на редкие и петрогенные элементы достаточно условно. Большинство редких элементов при определенных условиях может концентрироваться до таких концентраций, что возникают их собственные минералы, то есть они влияют на фазовый состав системы. Однако такие системы играют ограниченную роль в важнейших геохимических процессах. Так, стронций даже в небольших количествах сильно влияет на устойчивость кальцит/арагонит. С другой стороны, при появлении в системе минералов, в которых редкий элемент основной, например, редкий элемент цирконий часто достигает концентрации достаточных для кристаллизации циркона или монацита, при этом его влияние на другие фазы всё равно остается весьма ограниченным.
Термин редкие элементы не совсем точен. Может показаться, что эти элементы встречаются реже чем другие, но одним из основных положений геохимии является наблюдение, что в любом природном веществе присутствуют все 98 элементов, однако в различных концентрациях (закон всюдности химических элементов). При этом содержание редких элементов в разных породах может различаться в сотни и тысячи раз и они часто оказываются очень чувствительными индикаторами геохимических процессов. Во многих случаях различные процессы приводя к возникновению пород с идентичным минеральным составом и содержанием петрогенных элементов, но концентрации редких элементов при этом могут различаться и позволять реконструировать историю породы.
1.1. Классификация по коэффициентам распределения: совместимые и несовместимые элементы
Редкие элементы по разному распределяются между фазами системы. Особенно важно их поведение в процессах разделение вещества, таких как плавление и кристаллизация.
1.2. Макро- и микроэлементы
В биогеохимии принято разделение элементов по их роли в строении живых организмов. Макроэлементами называются те элементы, содержание которых в живых организмах составляет больше 0,001%. Это кислород, водород, углерод, азот, фосфор, калий, кальций, сера, магний, натрий, хлор, железо и др. Эти элементы слагают плоть живых организмов.
Микроэлементами называются элементы, содержание которых мало, но они участвуют в биохимических процессах и в значительной мере определяют самочувствие живых организмов. По современным данным более 30 микроэлементов считаются необходимыми для жизнедеятельности растений и животных. Среди них алюминий, цинк, кобальт, железо, йод, селен, медь, молибден, бром, фтор.
2. Классификация Ферсмана.
Основой большинства геохимических классификаций является Периодическая таблица химических элементов Д.И. Менделеева, где атомы по их химическим свойствам разбиты на группы и ряды, и которая, поэтому может рассматриваться как наиболее ранний вариант не только химической и, но и геохимической классификации. Исходя из периодической системы различными исследователями предпринимались неоднократные попытки геохимической классификации элементов, которая давала бы возможность по положению элементов в периодической системе объяснить поведение его в природных процессах и его естественные ассоциации с другими элементами.
Такова, например, классификация, предложенная А.Е. Ферсманом. Он взял периодическую таблицу в ее развернутой форме, как это делал вначале сам Менделеев и горизонтальной чертой, проходящей между 3 и 5 периодами, разделил ее на верхнюю и нижнюю части. Нижнюю часть, в свою очередь, вертикальной чертой (по благородным газам) он разделил на правое и левое поля.
Верхнее поле – обычное – кончается на никеле (№ 28). Здесь расположены элементы, наиболее распространенные в литосфере, гидросфере и атмосфере. Левая часть этого поля занята преимущественно неметаллами (анионами), а правая – металлами (катионами).
Для нижнего левого поля характерны халькофильные металлы, преимущественно дающие соединения с серой, селеном, теллуром. Здесь преобладают элементы сульфидных месторождений (Cu, Zn, As, Sn, Pb и т.д.).
Для нижнего правого поля характерны элементы остаточных кислых магм и гранитных пегматитов – Zr, Nb, Ta, U, TR и т.д.). Однако, здесь же расположены и элементы платиновой группы, характерные для ультраосновных магм и более близкие к соседним с ними элементам верхнего (обычного) поля.
В подавляющем большинстве собственно геохимических классификаций не учитываются трансурановые элементы. Большинство авторов также не включает в них такие элементы, как Tc, Fr, At, содержания которых в природных средах ничтожно малы.
3. Классификация Вернадского.
Подразделение химических элементов по характеру их поведения в процессах миграции.
- Благородные газы – He, Ne, Ar, Kr, Xe. Соединения с другими атомами образуют исключительно редко, поэтому в природных химических процессах значительного участия не принимают.
- Благородные металлы – Ru, Rh, Pd, Os, Ir, Pt, Au. Соединения редки. Преимущественно присутствуют в форме сплавов, и образуются в основном в глубинных процессах (магматических, гидротермальных).
- Циклические элементы – H, B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Ti, V, Mn, Fe, Co, Ni, Cu, Zn, As, Se, Sr, Mo, Ag, Cd, Ba, (Be, Cr, Ge, Zr, Sn, Sb, Te, Hf, W, Re, Hg, Tl, Pb, Bi). Наиболее многочисленная группа и преобладающая по массе. Для каждого элемента характерен определённый круг химических соединений, возникающих и распадающихся в ходе природных процессов. Таким образом, каждый элемент проходит цепочку превращений, в конечном счёте возвращаясь к исходной форме нахождения – и далее. Циклы не являются полностью обратимыми, так как часть элементов постоянно выходит из круговорота (и часть так же снова в него вовлекается).
- Рассеянные элементы – Li, Sc, Ga, Br, Rb, Y, Nb, In, J, Cs, Ta. Безусловно, господствуют рассеянные атомы, не образующие химических соединений. Незначительная доля может участвовать в образовании самостоятельных минеральных соединений (большинство – в глубинных процессах, а J и Br – в гипергенных).
- Редкоземельные элементы – La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tu, Yb, Lu. Тяготеют к рассеянным. Основная черта – совместная миграция.
- Радиоактивные элементы - Po, Rn, Ra, Ac, Th, Pa, U. Основная специфика в том, что в геохимическом процессе происходит постоянное превращение одних элементов в другие, что делает процессы их химической миграции наиболее сложными.
Элементы условности данной классификации:
4. Классификация Гольдшмидта.
Наиболее широко применяемая классификация. Предложена Гольдшмидтом исходя из предположения, что Земля образовалась в результате разделения первично однородного вещества, аналогичного метеоритам, на четыре части: металл, серный расплав, силикатная часть и атмосфера с океаном. Каждый элемент имеет склонность концентрироваться в одной из этих сред, и соответственно разделены на сидерофильные, литофильные, халькофильные и атмофильные элементы. Иначе говоря, это классификация по наибольшему коэффициенту распределения элемента между четырьмя фазами.
Литофильные - Li, Be, B, O, F, Na, Mg, Al, Si, P, Cl, K, Ca, Sc, Ti, V, Cr, Mn, Br, Rb, Sr, Y, Zr, Nb, I, Cs, Ba, TR, Hf, Ta, W, At, Fr, Ra, Ac, Th, Pa, U. Включены кислород и галогены, а также ассоциирующие с ними элементы, то есть преимущественно образующие кислородные и галоидные соединения. Последние – это те, которые расположены на пиках и нисходящих участках кривых атомных объёмов, а также имеют максимальные величины энергии образования оксидных соединений.
Сидерофильные - Fe, Co, Ni, Mo, Ru, Rh, Pd, Re, Os, Ir, Pt. Ассоциируют с железом. Все принадлежат к элементам с достраивающимися d-оболочками. Занимают промежуточное положение между лито- и халькофильными: минимумы на кривой атомных объёмов, промежуточные значения энергии образования кислородных соединений. В равной мере распространены и в оксидных, и в сульфидных ассоциациях.
Атмофильные – все инертные газы, N, H. Все являются газами, свойственно по преимуществу атомарное или молекулярное (вне соединений) состояние (видимость того, что Н представляет исключение, связана с тем, что атомарный водород теряется, рассеиваясь в космическом пространстве).
Рис. 1 Гольшмидтовская классификация в периодической системе элементов
Существует и широко применяется геохимическая классификация А. И.Перельмана, основанная на особенностях поведения химических элементов в зоне гипергенеза.
В основу геохимической классификации Ю.Г. Щербакова положено разделение элементов на центробежные и центростремительные.
Кроме упомянутых геохимических классификаций существуют и многие другие (Заварицкого, Вашингтона, Берга и др.), но они, как правило, носят либо слишком общий, либо слишком частный характер и в современной геохимии практически не используются.

Предшественники Менделеева - И. Дёберейнер, Ж. Дюма, французский химик А. Шанкуртуа, английские химики У. Одлинг, Дж. Ньюлендс, Леопольд Гмелин, Баумгауэр Г. и другие установили существование групп элементов, сходных по химическим свойствам, так называемых "естественных групп".

Прообразом научной периодической системы элементов явилась таблица "Опыт системы элементов, основанной на их атомном весе и химическом сходстве", составленная Менделеевым 1 марта 1869 года
На основании характерных свойств элементы можно разделить на группы
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
МЕТАЛЛИЧЕСКИЕ
НЕМЕТАЛЛИЧЕСКИЕ
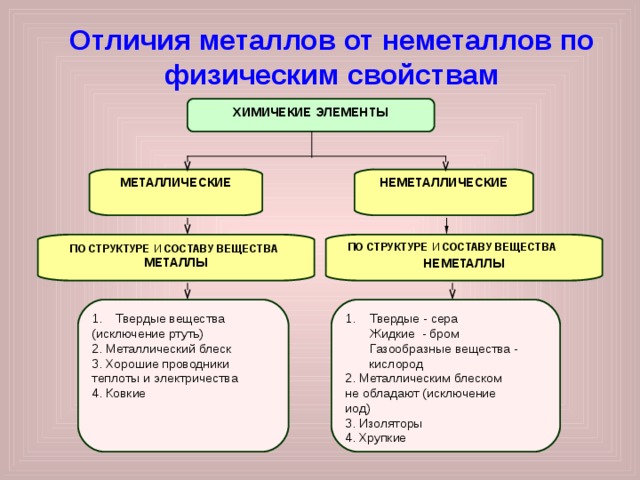
Отличия металлов от неметаллов по физическим свойствам
ХИМИЧЕКИЕ ЭЛЕМЕНТЫ
НЕМЕТАЛЛИЧЕСКИЕ
МЕТАЛЛИЧЕСКИЕ
ПО СТРУКТУРЕ И СОСТАВУ ВЕЩЕСТВА
ПО СТРУКТУРЕ И СОСТАВУ ВЕЩЕСТВА
1. Твердые - сера
Газообразные вещества - кислород
2. Металлическим блеском
не обладают (исключение
2. Металлический блеск
3. Хорошие проводники
теплоты и электричества

Металлические элементы – это вещества, обычно ковкие, пластичные, имеют характерный блеск, хорошо проводят электрический ток и тепло, окрашены в серебристо-серые цвета

Неметаллические элементы образуют простые вещества, существующие в различных агрегатных состояниях. Они имеют различную окраску и различные свойства

Если на Периодической системе химических элементов Д. И. Менделеева провести диагональ от бора к астату, то в правой верхней части Периодической системы будут находиться неметаллы (исключая элементы побочных подгрупп), а в левой нижней части - металлы (к ним также относятся элементы побочных подгрупп)
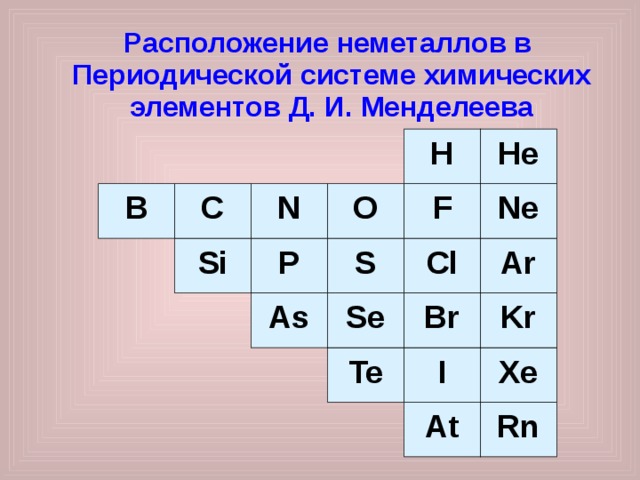
Расположение неметаллов в Периодической системе химических элементов Д. И. Менделеева

Элементы, расположенные вблизи диагонали (например, алюминий Al , титан Ti , германий Ge , ниобий Nb , сурьма Sb и др.), обладают двойственным характером.


Группа элементов, объединенных по
физическим свойствам, называется
семейством сходных элементов или
естественным семейством
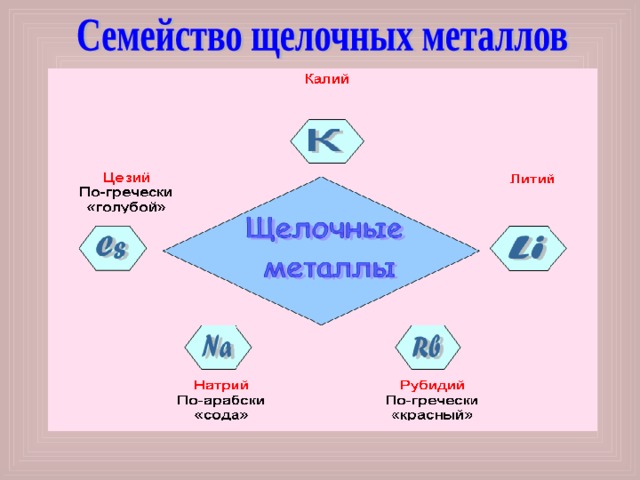

Такие металлы, как Li , Na , K , Rb , Cs реагируют с водой, образуются щелочи, поэтому эти металлы получили название щелочных металлов
2 Li + 2 H 2 O = 2 LiOH + Н 2
2Na + 2H 2 O = 2 Na OH + Н 2
2K + 2H 2 O = 2 К OH + Н 2
2 Rb + 2H 2 O = 2 Rb OH + Н 2
2 Cs + 2H 2 O = 2 Cs OH + Н 2

Щелочные металлы имеют много сходных свойств. Все они мягкие вещества, очень быстро окисляются кислородом воздуха. В соединениях щелочные металлы одновалентны. Они имеют одинаковые по составу и свойствам оксиды и гидроксиды.
Щелочные металлы относятся к наиболее активным металлам
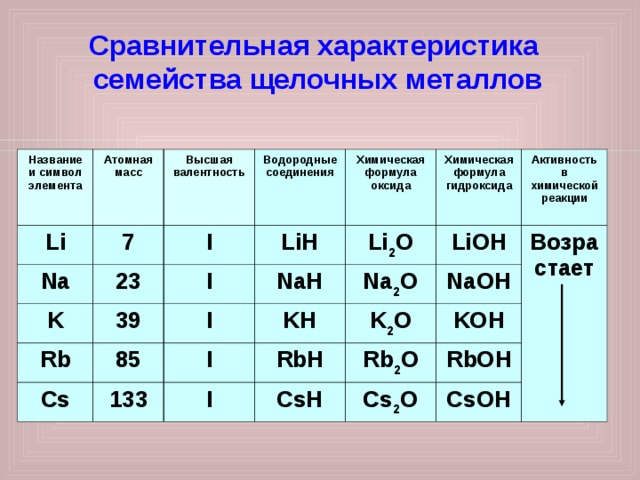
Сравнительная характеристика
семейства щелочных металлов
Название и символ элемента
Атомная масс
Высшая валентность
Водородные соединения
Химическая формула оксида
Химическая формула гидроксида
Li 2 O
Na 2 O
Активность в химической реакции
K 2 O
Rb 2 O
Cs 2 O

Сравнение реакционной способности лития, натрия и калия с водой

- Одновалентны в соединениях с водородом и в соединениях с кислородом
- Оксиды и гидроксиды - одинаковы по составу и свойствам
3. Химическая активность возрастает от лития к цезию
В подгруппу галогенов входят F , Cl , Br , I и At .
Астат – радиоактивный элемент, мало изучен. Галогены образуют простые вещества, молекулы, которых состоят из двух атомов: F 2 , Cl 2 , Br 2 , I 2 . фтор и хлор - газообразные вещества с резким запахом. Бром – жидкость, а йод – твердое вещество

Все галогены ЯДОВИТЫ! Опыты с галогенами проводят обязательно в вытяжном шкафу. Галогены составляют группу активных типичных неметаллов.
С металлами они образуют соли: фториды, хлориды, бромиды и йодиды.
Водные растворы водородных соединений являются кислотами: Н F , Н Cl , Н Br , Н I
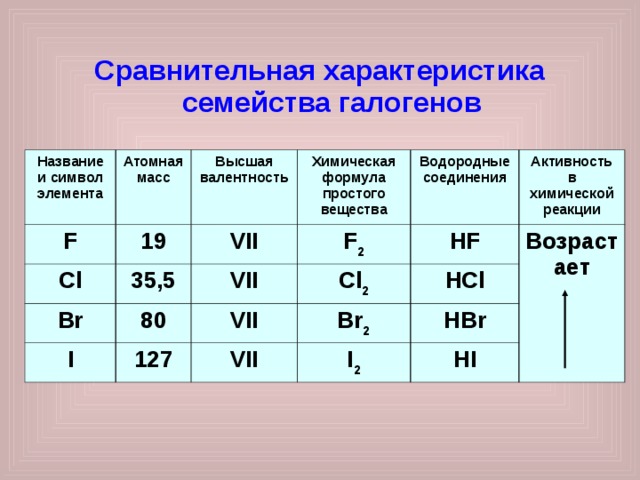
Сравнительная характеристика семейства галогенов
Название и символ элемента
Атомная масс
Высшая валентность
Химическая формула простого вещества
Водородные соединения
Активность в химической реакции

2. Химическая активность возрастает от йода к фтору

Какие элементы Периодической системы химических элементов Д.И.Менделеева относятся к металлам?
Элементы, находящиеся в левой нижней части Периодической системы химических элементов Д.И.Менделеева

Какие элементы Периодической системы химических элементов Д.И.Менделеева относятся к неметаллам?
Элементы, находящиеся в правой верхней части Периодической системы химических элементов Д.И.Менделеева

Разделите элементы на две группы:
Б) неметаллы
Se , Ca , Zn , Fr , As , Ar , Li , Rn , N , Sr .

Классификация химических элементов. Одной из первых попыток систематизации химических элементов была их классификация, т. е. распределение по классам на основе общих свойств и признаков. Еще в конце XVIII в. элементы стали делить на две группы — металлы и неметаллы. Такая классификация была основана на различии свойств простых веществ.
Вспомним общие свойства простых веществ металлов и неметаллов. Металлы хорошо проводят электрический ток и теплоту, имеют характерный металлический блеск. Многие из них пластичны, т. е. легко расплющиваются, вытягиваются, поддаются обработке, особенно в нагретом состоянии. Все металлы (кроме ртути) — твердые кристаллические вещества.
Неметаллы, как правило, плохие проводники тока, не обладают блеском и пластичностью. При обычных условиях простые вещества неметаллы могут быть твердыми (сера, фосфор), жидкими (бром), газообразными (кислород, азот).
Эти две группы простых веществ существенно различаются и по химическим свойствам. Металлы взаимодействуют с кислородом и другими неметаллами, кислотами, солями, но газообразных соединений не образуют.
Неметаллы образуют с водородом летучие соединения; взаимодействуют с кислородом, часто с образованием газообразных оксидов. С разбавленными кислотами большинство из них не реагируют.
Как доказать, что оксид, соответствующий металлу, является основным его гидроксид проявляет свойства оснований?
Поместим в пробирку небольшое количество оксида кальция. Добавим к нему воды объемом 2 см3 и хорошо встряхнем. Внесем в полученный раствор 2—3 капли раствора фенолфталеина и по появлению окраски отметим наличие щелочи в растворе. Добавив 2 капли раствора соляной кислоты, отметим изменение окраски.
Не все основные оксиды взаимодействуют с водой, однако каждому из нисоответствует гидроксид, проявляющий свойства основания. Так, оксид FeOне реагирует с водой, но ему соответствует основание Fe(OH) 2. И оксид, и основание реагируют с кислотами:
FeO + 2HCl = FeCl2 + H2O;
Fe(OH) 2 + 2HCl = FeCl2 + 2H2O.
Кислородные соединения неметаллов обычно являются кислотными оксидами, а их гидроксиды — кислотами.
Доказательством кислотных свойств этих соединений неметаллов является их способность вступать в реакции со щелочами с образованием соли и воды:
CO2 + 2KOH = K2CO3 + H2O;
H3PO4 + 3KOH = K3PO4 + 3H2O.
Кислотные свойства гидроксидов неметаллов легко доказать с помощью индикаторов (лакмуса, метилоранжа или универсального индикатора) по характерной красной окраске.
Читайте также:


