Реферат на тему ароматические углеводороды
Обновлено: 28.06.2024
Понятие ароматических углеводородов, их применение, физико-химические и пожаровзрывоопасные свойства.
Современное представление о строении молекулы бензола. Гомологический ряд бензола, номенклатура, изомерия. Токсичность аренов.
Основные химические реакции:
замещения (галогенирование, нитрование, сульфирование, алкилирование)
присоединения (водорода и галогенов);
окисления (неполное окисление, особенности процесса горения, склонность к самовозгоранию при контакте с сильными окислителями);
Правила замещения в бензольном кольце. Заместители первого и второго ряда.
Промышленные методы получения ароматических углеводородов.
Краткая характеристика основных ароматических углеводородов: толуола, бензола, ксилола, этилбензола, изопропилбензола, стирола и т.д.
Нитросоединения ароматического ряда, физико-химические и пожароопасные свойства нитробензола, толуола. Реакции их получения.
Ароматические амины: номенклатура, изомерия, способы получения, отдельные представители (анилин, дифениламин, диметиланилин).
Ароматические углеводороды (арены)
Ароматическими соединениями обычно называют карбоциклические соединения, в молекулах которых имеется особая циклическая группировка из шести углеродных атомов – бензольное ядро. Простейшим веществом, содержащим такую группировку, является углеводород бензол; все остальные ароматические соединения этого типа рассматривают как производные бензола.
Благодаря наличию в ароматических соединениях бензольного ядра они по некоторым свойствам значительно отличаются от предельных и непредельных алициклических соединений, а также и от соединений с открытой цепью. Отличительные свойства ароматических веществ, обусловленные наличием в них бензольного ядра, обычно называют ароматическими свойствами, а бензольное ядро – соответственно ароматическим ядром.
Следует отметить, что само название “ароматические соединения” теперь уже не имеет своего первоначального прямого значения. Так были названы первые изученные производные бензола, потому что они обладали ароматом или же были выделены из природных ароматических веществ. В настоящее же время к ароматическим соединениям относят многие вещества, обладающие и неприятными запахами или совсем не пахнущие, если в его молекуле содержится плоское кольцо с (4n + 2) обобщенными электронами, где n может принимать значения 0, 1, 2, 3 и т.д., - правило Хюккеля.
Ароматические углеводороды ряда бензола.
Первый представитель ароматических углеводородов – бензол – имеет состав C6H6 . Это вещество было открыто М.Фарадеем в 1825 г. в жидкости, образующейся при сжатии или охлаждении т.н. светильного газа, который получается при сухой перегонке каменного угля. Впоследствии бензол обнаружили (А.Гофман, 1845г.) в другом продукте сухой перегонки каменного угля – в каменноугольной смоле. Он оказался весьма ценным веществом и нашел широкое применение. Затем было установлено, что очень многие органические соединения являются производными бензола.
Строение бензола.
Долгое время оставался неясным вопрос о химической природе и о строении бензола. Казалось бы, что он представляет собой сильно непредельное соединение. Ведь его состав C6H6 по соотношению атомов углерода и водорода отвечает формуле CnH2n-6, тогда как соответствующий по числу углеродных атомов предельный углеводород гексан имеет состав C6H14 и отвечает формуле CnH2n+2. Однако бензол не дает характерных для непредельных соединений реакций; он, например, не обеспечивает бромной воды и раствора KMnO4, т.е. в обычных условиях не склонен к реакциям присоединения, не окисляется. Напротив, бензол в присутствии катализаторов вступает в характерные для предельных углеводородов реакции замещения, например, с галогенами:
C6H6 + Cl2 ® C6H5Cl + HCl
Выяснилось все же, что в определенных условиях бензол может вступать и в реакции присоединения. Там, в присутствии катализаторов он гидрируется, присоединяя 6 атомов водорода:
C6H6 + 3H2 ® C6H12
Под действием света бензол медленно присоединяет 6 атомов галогена:
C6H6 + 3Cl2 ® C6H6Cl6
Возможны и некоторые другие реакции присоединения, но все они протекают с трудом, во много раз менее активно, чем присоединение к двойным связям в веществах с открытой целью или в алициклических соединениях.
Далее, было установлено, что однозамещенные производные бензола C6H5X не имеют изомеров. Это показало, что все водородные и все углеродные атомы в его молекуле по своему положению равноценны, что также долго не находило объяснения.
Впервые формулу строения бензола предложил в 1865г. немецкий химик Август Кекуле. Он высказал предложение, что 6 углеродных атомов в бензоле образуют цикл, соединяясь друг с другом чередующимися простыми и двойными связями, и, кроме того, каждый из них соединен с одним атомом водорода: СН
Кекуле предположил, что двойные связи в бензоле не неподвижны; по его представлениям, они непрерывно перемещаются (осцилируют) в кольце, что можно представить схемой: СН (I) СН (II)
Формулы I и II, согласно Кекуле, СН СН СН СН
совершено равнозначны и лишь ½ ½ ½ ½
выражают 2 взаимно переходящие СН СН СН СН
фазы соединения молекулы бензола. СН СН
К этому выводу Кекуле пришел на том основании, что если бы положение двойных связей в бензольном было зафиксировано, то его двухзамещенные производные C6H4X2 с заместителями при соседних углеродах должны были бы существовать в виде изомеров по положению простых и двойных связей:
В одном (III) атомы углерода, при которых расположены заместители X, были бы соединены двойной связью, в другом (IV) – простой. Однако все попытки получить такие изомеры не увенчались успехом. С точки зрения же представлений об осцилляции связей эти изомеры не могут существовать, т.е. формулы III и IV выражают строение одного и того же вещества, для которого возможны две взаимно переходящие фазы состояния молекулы.
Формула Кекуле получила широкое распространение. Она согласуется с представлениями о четырехвалентности углерода, объясняет равноценность водородных атомов в бензоле. Наличие в последнем шестичленного цикла доказано; в частности, оно подтверждено тем, что при гидрировании бензол образует циклогексан, в свою очередь циклогексан путем дегидрирования превращается в бензол.
Однако формула Кекуле имеет существенные недостатки. Допуская, что в бензоле имеются три двойных связи, она не может объяснить, почему бензол в таком случае с трудом вступает в реакции присоединения, устойчив к действию окислителей, т.е. не проявляет свойств непредельных соединений.
Исследование бензола с применением новейших методов указывает на то, что в его молекуле между углеродными атомами нет ни обычных простых, ни обычных двойных связей. Например, изучение ароматических соединений при помощи лучей Рентгена показало, что 6 атомов углерода в бензоле, образующие цикл, лежат в одной плоскости в вершинах правильного шестиугольника и центры их находятся на равных расстояниях друг от друга, составляющих 1,40 А. Эти расстояния меньше, чем расстояния между центрами углеродных атомов, соединенных простой связью (1,54 А), и больше, чем м. соединенными двойной связью (1,34 А). Таким образом, в бензоле углеродные атомы соединены при помощи особых, равноценных между собой связей, которые были названы ароматическими связями. По природе своей они отличаются от двойных и простых связей; наличие их и обуславливает характерные свойства бензола. С точки зрения современных электронных представлений природу ароматических связей объясняют следующим образом.
Как уже было указано ранее, простая связь между атомами углерода осуществляется одной парой, а двойная – двумя парами обобщенных электронов. Одна из электронных пар двойной связи находится в таком же состоянии, как пара электронов, осуществляющая простую связь (s-связь). Вторая же электронная пара осуществляет связь особого характера (π-связь). В соответствии с формулой Кекуле в бензоле должны быть три π-связи. На самом же деле в бензоле нет обычных пар π-электронов фиксированных между двумя определенными С-атомами, как это изображает схема I. В шестичленном цикле бензола все простые связи С-С и С-Н (s-связи) лежат в одной плоскости. Облака π-электронов всех С-атомов, имеющие форму объемных восьмерок, направлены перпендикулярно плоскости бензольного кольца. Каждое из таких облаков перекрывается облаками двух соседних углеродных атомов. Это показано на следующем рисунке:
Рис. 9. Взаимное перекрывание 2р-орбиталей в молекуле бензола:
а – вид сбоку, б – вид сверху.
Плотность облаков π-электронов в бензоле равномерно распределена между всеми С-С-связями. Следовательно, π-электроны обобщены всеми углеродными атомами кольца, образуя единое кольцевое облако шести электронов (ароматический электронный секстет). Таким образом объясняется равноценность (выравненность) ароматических связей, придающих бензольному ядру характерные (ароматические) свойства. Равномерное распределение облака π-электронов и выравненность связей в бензоле иногда изображают формулой (4). И в настоящее время бензол продолжают изображать формулой Кекуле (1). Но всегда надо помнить, что она неверно отражает характер связей в бензоле.
Очень часто для простоты формулу бензола по Кекуле представляют шестиугольником с двойными связями без символов углерода и водорода (2). Иногда можно встретить изображение бензола и просто шестиугольником (3); но такой способ не рекомендуется, так принято изображать кольцо циклогексана; следовательно, в каждом его углу подразумевается группа СН2, а не СН. В последние годы, когда хотят подчеркнуть выравненность связей в бензоле, его изображают шестиугольником с кружочком внутри (4).
Гомологи бензола представляют собой его производные, образованные в результате замещения атомов водорода бензольного ядра предельными углеводородными заместителями; состав их, так же как и бензола, выражает формулой Сn Н2n-6.
Гомологи бензола, так же как и другие соединения, в которых наряду с бензольным ядром имеются ацикличические группировки (группировки жирного ряда), иногда называют жирноароматическими соединениями.
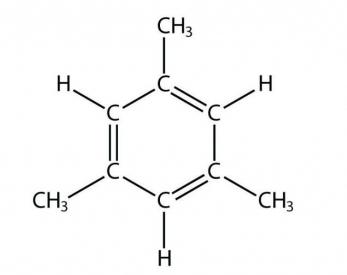
Число ароматических соединений, содержащих ядра бензола, очень велико, и они находят большое и разнообразное применение. Основой их являются ароматические углеводороды, среди которых различают: а) ароматические углеводороды ряда бензола, содержащие одно бензольное ядро (одноядерные), и б) многоядерные ароматические углеводороды, содержащие два и более бензольных ядер. Среди них различают: а) ароматические углеводороды с конденсированными бензольными ядрами; в них два или несколько ядер имеют общие углеродные атомы; б) ароматические углеводороды с неконденсированными бензольными ядрами, в которых каждое ядро изолировано, т.е. не имеет общих с другими ядрами углеродных атомов.
Все остальные одноядерные и многоядерные ароматические соединения являются замещенными производными соответствующих ароматических углеводородов.
7 b 9 b 2 7 b b 2 дифенил
6 b b 3 6 b b 3 С12Н10
a 5 10 a 4 a 5 10 a 4
нафталин антрацен —СН2—
CH3 1,1-дифенилэтан 1,3-дифенилэтан (дибензил)
Если Вам нужна помощь с академической работой (курсовая, контрольная, диплом, реферат и т.д.), обратитесь к нашим специалистам. Более 90000 специалистов готовы Вам помочь.
Ароматические углеводороды/ Арены — соединения, молекулы которых содержат одно или несколько бензольных колец.
Бензольные кольца – циклические группы атомов углерода с особым характером связей.

О бщая формула ароматических углеводородов ряда бензола:
Бензол
Бензол — 1) первый представитель класса аренов/ ароматических углеводородов; простейший ароматический углеводород.

С троение
Шесть атомов углерода, образующих правильный шестиуголник ( σ - скелет), находятся в sp 2 -гибридном состоянии. Каждый атом углерода образует при σ -связи с двумя другими атомами углерода и
одним атомом водорода, лежащие в одной плоскости.
Валентные углы между тремя σ -связями равны 120°
(см. σ -скелет молекулы бензола)
Шесть p-электронов взаимодействуют между собой, образуя единое π-электронное облако, которое изображают кружочком внутри шестичленного цикла:

Почему рисуют кружок в шестиугольнике? Это обозначение того, что все связи в молекуле одинаковые.

Дело в том, что если рисовать бензол по валентностям углерода (у каждого атома должно быть 4 связи), то надо было бы нарисовать с двойными связями.
Но!Каждая связь — это не просто черточки на бумаге. Каждая связь имеет определенные физические характеристики. Например, длинна связи.
все связи одинаковы, т.е. нет разделения на двойные и одинарные;
эти связи представляют собой промежуточный вариант между двойной и одинарной.
Если рассмотреть строение молекулы более детально, с точки зрения электронной плотности, то картина будет примерно следующая — образуется общее ∏-электронное облако и оно распространено (=делокализовано) по всей молекуле:

Слева показана плотность бензольного кольца
Делокализация – электронная плотность.
Физическое состояние
Бесцветная жидкость с характерным запахом
Температура плавления: t пл =5,5°С
Температура кипения: t кип =80,1°С
Давление: p = 0,88г/см 3 .
Не растворяется в воде, хорошо растворяется в органических растворителях.
σ-скелет молекулы бензола
Н ![]()
оменклатура гомологов бензола
Если в молекуле арена есть несколько одинаковых радикала, то применяются приставки: орто-, мета— и пара-
Все эти вещества изомерны друг другу. У бензола и его гомологов довольно много изомеров —это обусловлено как количеством атомов, так и геометрией молекулы.

Названия радикалов
В ГИА (ОГЭ) это B2 — Первоначальные сведения об органических веществах: предельных и непредельных углеводородах.
Химические свойства бензола
В первом разделе о бензоле мы рассмотрели строение молекулы и определили, что бензольное кольцо — уникальная система. И у этой системы свои характеристики, отличающиеся от свойств других углеводородов.

Первая такая характеристика — прочность бензольного кольца. Прочность не просто геометрической фигуры шестиугольника, а именно системы связей и делокализованного электронного облака.
Что это означает? Это означает, что разрушить эту систему (раскрыть кольцо) возможно при специальных условиях — давление, температура, катализатор и т.д.
Для бензола и его гомологов характерны реакции замещения.
Остальные реакции идут с трудом.
Лучше, конечно, разделить химические свойства бензола и химические свойства алкилбензолов.
По сути, алкилбензолы — вещества с двумя функциональными группами — бензольным кольцом и насыщенным алкильным радикалом, для которого более характерны свойства алканов.
Химические свойства бензола
Например: взаимодействие с бромом — качественная реакция на бензол.
C6H6 + Br2 = C6 H5Br + HBr
Нитрованиебензола (обратите внимание, в органической химии неорганические кислоты реагируют немного по-другому — с отщеплением группы -OH)
Нитрирующая смесь – смесь концентрированных азотной и серной кислот.
Реакция происходит с помощью алкилгалогенид и алкенов.
Катализаторы реакции — галогениды алюминия: AlCl3, AlBr3 и т.д.):

С6H6 + С2H5Cl → C6H5C2H5 + HCl
(гексахлоран)
Химические свойства гомологов бензола — алкилбензолов
Гомологи бензола более ракционноспособны — легче вступают в реакции
Эти реакции идут немного по-другому
С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr

Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор — соли Al(3+)
Нитрование алкилбензолов:
С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3

тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH — бензойная кислота

Гидрирование бензола и алкилбензолов:
Тут уже различий нет. При гидрировании всех аренов (температура, давление, катализатор — бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 — метилциклогексан

Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
CnH2n-6 + (3n-3)\2 O2 → nCO2 + (n-3)H2O
Получение бензола и его гомологов
Дегидрирование циклогексана: этот метод хорошо тем, что можно получить не только бензол, но и его гомологи. Для этого надо взять циклогексан с нужным количеством атомов С в боковой цепи
Получение гомологов бензола.Алкилирование бензола:
- Реакция проводится в присутствии катализатора — галогенидов алюминия, например, AlCl3:
1. Получение бензола из неорганических веществ:
Исходное вещество — карбид кальция СaC2:
CaC2 + 2H2O → Ca(OH)2 + C2H2 — ацетилен
дальше — реакция Зелинского: 3С2H2 → C6H6
Это самый короткий путь получения.
Исходное вещество — карбид алюминия Al4C3:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 — метан
2СH4 (1500 °C) → C2H2 + 3H2
дальше — реакция Зелинского
2. Получение бензола и его гомологов из других неорганических веществ:
1) получение бензола из алканов:
СH4 (1500 °C) → C2H2 (С, 600ºС) → С6H6
2) получение бензола и его гомологов из алкенов:
С2H4 → C2H2 →C6H6
Схема: алкен → дибромалкан → циклоалкан → гомолог бензола
CH2=CH-(CH2)4-CH3 + HBr → CH3-CH(Br)-(CH2)4-CH3
CH3-CH(Br)-(CH2)4-CH3 + Br2 → CH3-CH(Br)-(CH2)4-CH2Br
CH3-CH(Br)-(CH2)4-CH2Br + Zn → C6H13-СH3
C6H13-СH3 — метилциклогексан + ZnBr2
C6H13-СH3 → С6H5-CH3 + 4H2
Если у вас возникли сложности с курсовой, контрольной, дипломной, рефератом, отчетом по практике, научно-исследовательской и любой другой работой - мы готовы помочь.


ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ. ПОЛИЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование, ацилирование. Механизм реакции электрофильного замещения. Понятие о p - и s -комплексах, их строение. Энергетическая диаграмма. Влияние заместителей на направление и скорость электрофильного замещения. Галогенирование и нитрование боковых цепей. Окисление бензола и его гомологов. Озонолиз. Реакции присоединения: гидрирование, галогенирование.
Нафталин: строение, ароматичность, номенклатура. Химические свойства: реакции электрофильного замещения (галогенирование, нитрование, сульфирование, ацилирование); реакции присоединения, гидрирование, галогенирования. Окисление. a - и b -Нафтолы и нафтиламины. Бифенил, трифенилметан. Понятие об устойчивых радикалах.
В силу строения бензольного кольца для ароматических соединений ряда бензола характерны реакции электрофильного замещения.
Конкуренция между присоединением нуклеофильной частицы и отрывом протона в реакции бензониевого иона.
реакция 1 не происходит;
реакция 2 происходит:
В p -комплексе p -электронная система бензола выступает как донор электронов, а электрофильный агент действует как акцептор электронов. Однако образование и диссоциация p -комплекса происходят очень быстро, и образование p -комплекса в большинстве случаев не оказывает существенного влияния ни на скорость реакции, ни на природу подавляющего большинства образующихся соединений.
Бензол вступает в следующие реакции:
Нитрующие агенты HNO 3 , HNO 3 / H 2 SO 4 , HNO 3 и CH 3 COOH , HNO 3 /(СН 3 СО) 2 О, NO 2 BF 4 и др.
Природа нитрующих агентов:
Условия, температура, концентрация.
Одним из наиболее часто используемых катализаторов является безводный хлорид алюминия. Функция катализатора состоит в связывании с галогеном.
Для сульфирования часто применяется серная кислота, содержащая избыток SO 3 .
кислотно-основное равновесие между двумя молекулами серной кислоты.
Хотя серный ангидрид не несет положительного заряда, но он обладает дефицитом электронов, и, следовательно, является кислотой.
Поскольку бензолсульфокислота - сильная кислота, то она сильно диссоциирует. Реакция сульфирования - обратимая. При взаимодействии бензолсульфокислоты с перегретым паром при 180 0 С образуется бензол.
Алкилирование по Фриделю-Крафтсу.
Принято два возможных механизма реакции:
Во втором случае можно предполагать, что электрофилом служит алкильная группа полырного комплекса AlCl 3 с алкилгалогенидом.
1). Бензольное кольцо в обычных условиях окисляется с трудом. При действии кислорода воздуха на бензол в присутствии V 2 O 5 (пятиокись ваннадия) при температуре 400 0 С получается малеиновый ангидрид.
2). Окисление алкилпроизводных бензола идет с образованием карбоксилсодержащих бензольных производных:
4). Каталитическое окисление О 2 в присутствии медного катализатора.
Правила ориентации в бензольном кольце
Введение заместителя в молекулу бензола требует ответа на два вопроса:
Какое влияние оказывает заместитель на скорость реакции - затрудняет или ускоряет?
Куда он направляет электрофильную частицу Е + , в какое положение?
Эти вопросы связаны с перераспределением электронной плотности в бензольном кольце ( I -эффект и С-эффект).
Химия — очень увлекательная наука. Она изучает все вещества, которые существуют в природе, а их огромное множество. Они разделяются на неорганические и органические. В этой статье мы рассмотрим ароматические углеводороды, которые относятся к последней группе.
Что это такое?
Это органические вещества, которые имеют в своем составе одно или несколько бензольных ядер — устойчивых структур из шести атомов углерода, соединенных в многоугольник. Данные химические соединения обладают специфическим запахом, что можно понять из их названия. Углеводороды этой группы относятся к циклическим, в отличие от алканов, алкинов и др.
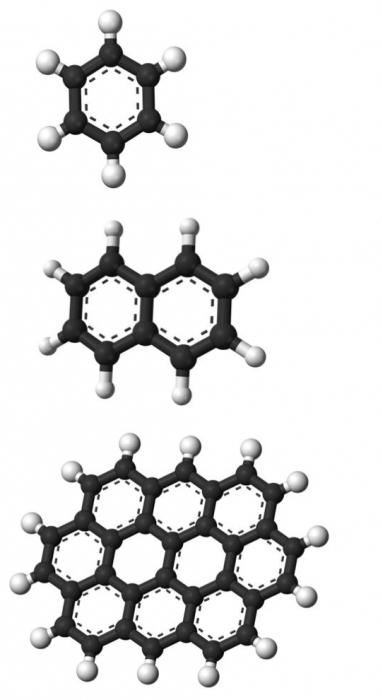
Ароматические углеводороды. Бензол
Это самое простое химическое соедиение из данной группы веществ. В состав его молекул входят шесть атомов углерода и столько же гидрогена. Все остальные ароматические углеводороды являются производными бензола и могут быть получены с его использованием. Это вещество при нормальных условиях находится в жидком состоянии, оно бесцветное, обладает специфическим сладковатым запахом, в воде не растворяется. Закипать оно начинает при температуре +80 градусов по Цельсию, а замерзать — при +5.
Химические свойства бензола и других ароматических углеводородов
Первое, на что нужно обратить внимание, — галогенирование и нитрование.
Реакции замещения
Первая из них — галогенирование. В этом случае, чтобы химическое взаимодействие могло осуществиться, нужно использовать катализатор, а именно трихлорид железа. Таким образом, если добавить к бензолу (С6Н6) хлор (Cl2), то мы получим хлорбензол (С6Н5Cl) и хлороводород (HCl), который выделится в виде прозрачного газа с резким запахом. То есть вследствие этой реакции один атом водорода замещается атомом хлора. То же самое может произойти и при добавлении к бензолу других галогенов (йода, брома и т. д.). Вторая реакция замещения — нитрование — проходит по похожему принципу. Здесь в роли катализатора выступает концентрированный раствор серной кислоты. Для проведения такого рода химической реакции к бензолу необходимо добавить нитратную кислоту (HNO3), тоже концентрированную, в результате чего образуются нитробензол (C6H5NO2) и вода. В этом случае атом гидрогена замещается группой из атома нитрогена и двух оксигена.
Реакции присоединения
Это второй тип химических взаимодействий, в которые способны вступать ароматические углеводороды. Они также существуют двух видов: галогенирование и гидрирование. Первая происходит только при наличии солнечной энергии, которая выступает в роли катализатора. Для проведения этой реакции к бензолу также необходимо добавить хлор, но в большем количестве, чем для замещения. На одну молекулу бензола должно приходиться три хлора. В результате получим гексахлорциклогексан (С6Н6Cl6), то есть к имеющимся атомам присоединится еще и шесть хлора.
Гидрирование происходит только в присутствии никеля. Для этого необходимо смешать бензол и гидроген (Н2). Пропорции те же, что и в предыдущей реакции. Вследствие этого образуется циклогексан (С6Н12). Все остальные ароматические углеводороды также могут вступать в такого типа реакции. Они происходят по такому же принципу, как и в случае с бензолом, только с образованием уже более сложных веществ.
Получение химических веществ этой группы
Начнем все так же с бензола. Его можно получить с помощью такого реагента, как ацетилен (С2Н2). Из трех молекул данного вещества под воздействием высокой температуры и катализатора образуется одна молекула нужного химического соединения.
Также бензол и некоторые другие ароматические углеводороды можно добыть из каменноугольной смолы, которая образуется во время производства металлургического кокса. К получаемым таким способом можно отнести толуол, о-ксилол, м-ксилол, фенантрен, нафталин, антрацен, флуорен, хризен, дифенил и другие. Кроме того, вещества этой группы часто добывают из продуктов переработки нефти.
Как выглядят разнообразные химические соединения этого класса?
Стирол представляет собой бесцветную жидкость с приятным запахом, малорастворимую в воде, температура кипения составляет +145 градусов по Цельсию. Нафталин — кристаллическое вещество, также мало растворяется в воде, плавится при температуре +80 градусов, а закипает при +217. Антрацен в нормальных условиях также представлен в виде кристаллов, однако уже не бесцветных, а имеющих желтую окраску. Это вещество не растворяется ни в воде, ни в органических растворителях. Температура плавления — +216 градусов по шкале Цельсия, кипения — +342. Фенантрен выглядит как блестящие кристалы, которые растворяются только в органических растворителях. Температура плавления — +101 градус, кипения — +340 градусов. Флуорен, как понятно из названия, способен к флуоресценции. Это, как и многие другие вещества данной группы, — бесцветные кристаллы, нерастворимые в воде. Температура плавления — +116, закипания — +294.
Применение ароматических углеводородов
Бензол используется при производстве красителей в качестве сырья. Также он применяется при получении взрывчатки, пестицидов, некоторых лекарств. Стирол используют в производстве полистирола (пенопласта) с помощью полимеризации исходного вещества. Последний широко применяют в строительстве: в качестве тепло- и звукоизолирующего, электроизоляционного материала. Нафталин, как и бензол, участвует в производстве пестицидов, красителей, лекарств. Кроме того, он используется в химической промышленности для получения многих органических соединений. Антрацен также применяют в изготовлении красителей. Флуорен играет роль стабилизатора полимеров. Фенантрен, как и предыдущее вещество и многие другие ароматические углеводороды, — один из компонентов красителей. Толуол широко применяют в химической промышленности для добывания органических веществ, а также для получения взрывчатки.

Характеристика и использование веществ, добываемых с помощью ароматических углеводородов
К таким в первую очередь можно отнести продукты рассмотренных химических реакций бензола. Хлорбензол, к примеру, является органическим растворителем, также используется в производстве фенола, пестицидов, органических веществ. Нитробензол является компонентом полировальных средств для металла, применяется при изготовлении некоторых краситлей и ароматизаторов, может играть роль растворителя и окислителя. Гексахлорциклогексан используется в качестве яда для борьбы с насекомыми-вредителями, а также в химической промышленности. Циклогексан применяют в производстве лакокрасочных изделий, при получении многих органических соединений, в фарамацевтической отрасли промышленности.
Заключение
Прочитав эту статью, можно сделать вывод, что все ароматические углеводороды имеют однотипную химическую структуру, что позволяет объединить их в один класс соединений. Кроме того, их физические и химические свойства также весьма похожи. Внешний вид, температуры кипения и плавления всех химических веществ данной группы не сильно отличаются. Свое применение многие ароматические углеводороды находят в одних и тех же отраслях промышленности. Вещества, которые можно получить вследствие реакций галогенирования, нитрования, гидрирования, также имеют схожие свойства и используются в похожих целях.
Читайте также:


