Реферат антибиотикотерапия в хирургии
Обновлено: 25.06.2024
Да, они удивительны. Вы хотите знать, будут ли они работать, будут ли приносить больше пользы, чем вреда, а также, не окажется ли следующее поколение антибиотиков неэффективным и токсичным.
Скептицизм — это нормальное явление в отношении любой процедуры или лекарственного препарата, но особенно в отношении антибиотиков, которые применяются почти универсально как агенты, способные предупреждать и лечить инфекции. В этом процессе явное преимущество остается за иммунитетом и лекарственными препаратами, имеющими хорошую репутацию в борьбе с инфекцией.
Антибиотики должны играть ограниченную роль в здравоохранении и нужно сдерживать их необоснованное применение, которое приносит даже больше вреда, чем лишних расходов.
2. Что вы имеете в виду, когда говорите о поколениях антибиотиков, например о цефалоспоринах третьего поколения?
Наиболее ранние антибиотики были бактериостатическими, в значительной степени из-за влияния на синтез белка; поэтому они могли сдерживать размножение микроорганизма, даже если не убивали его. Понятия инвазия (присутствие живых микробов в организме) и инфекция (размножение и распространение микроорганизмов в микроорганизме) помогают понять, как первые антибиотики могли препятствовать развитию инфекции, по были практически неспособны элиминировать микроорганизмы за короткий период лечения.
Пенициллин изменил все. Это, возможно, первый антибиотик, законно претендующий на титул "чудесного лекарства", поскольку обладал бактерицидной способностью в отношении чувствительных микроорганизмов. Пенициллины являются первым поколением бета-лактамных антибиотиков, родственно связанных с цефалоспоринами первого поколения (например, цефазолиином).
Они имеют бета-лактамную структуру, высокоактивны в отношении всего спектра грамположительных микроорганизмов и менее активны в отношении грамотрицательпых микробов. Бета-лактамные антибиотики второго поколения (например, цефокситин) помимо грамположительных аэробов перекрывают новые группы микробов, такие как Bacteroides, но малоэффективны в отношении грамотрицательпых аэробных возбудителей. Поскольку цефалоспорины третьего поколения воздействуют па некоторые грамотрицательные микробы, они были рекомендованы в качестве монотерапевтических средств для всех основных возбудителей.
В отличие от пенициллина, действительно чудодейственного лекарства, новые антибиотики быстро вызывают резистентность микроорганизмов. Наиболее легко определяемым различием между поколениями антибиотиков является их стоимость: оптовая цепа препаратов первого поколения составляет примерно 2 $/г, препаратов второго поколения 5 $/г и препаратов третьего поколения 30 $/г .
Несмотря па такую разницу в цепе, антибиотики более высокого поколения теряют часть своей потенциальной активности против первоначальных грамположительных возбудителей, для которых препараты первого поколения были действительно чудодейственными. Поэтому необходимо два грамма моксалактама чтобы достигнуть эффекта одного грамма цефазолина в отношении грамположителыюьной флоры. Не нужно быть экономистом, чтобы задать вопрос: "Что я получаю в результате 60-кратной переплаты?"
3. Какую роль играют цефалоспорины третьего поколения в профилактике хирургической инфекции?
Никакую. Здесь нет ничего удивительного! Если основной возбудитель — грамположительная флора, лучше применять препараты первого поколения. При значительном риске анаэробного заражения предпочтительны цефалоспорипы второго поколения. Оба класса этих антибиотиков гораздо дешевле, и, как считается, вызывают меньшую резистентность, чем цефалоспорипы третьего поколения, которые неоправданно дороги для профилактического применения и редко столь же эффективны, как другие средства монотерапии при установленной хирургической инфекции.
Конечно, по особым показаниям, например, при менингите в педиатрии, внутрибольничной пневмонии или других специфических инфекциях, не относящихся к хирургическим, цефалоспорины третьего поколения могут включаться или исключаться из схемы лечения.
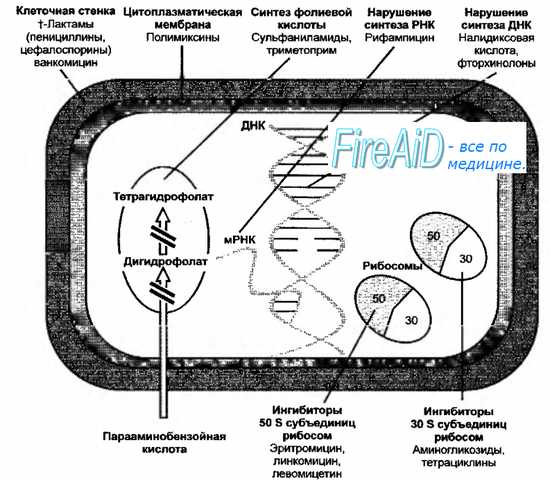
Механизм действия основных группы антибиотиков
4. Как ингибиторы ферментов в комбинации с антибиотиками повышают их антимикробный диапазон?
Микроорганизмы обладают собственными механизмами защиты. На фоне широкого использования антибиотиков микробы, способные вырабатывать ферменты, разрушающие антибактериальные препараты, достигают необычных селекционных результатов. Это именно го, что случилось с пенициллином. Появились пенициллиназы. Но умные фармацевты изменили с помощью метиловой группы структуру пенициллина, сделав новый антибиотик устойчивым к пеиициллиназам, что позволило уничтожать выживавшие за счет пенициллиназы микробы.
В результате появился метициллин, по из-за дальнейшей селекции микробов теперь мы встречаем колонии метициллин-резистентных Staphylococcus aureus. Кроме того, микробы численно превосходят фармацевтические производства и имеют более короткий жизненный цикл, чем время апробации нового препарата Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (Food and Drug Administration (FDA)). Микробы будут всегда опережать нас в своей "изобретательности" только благодаря своему количеству.
В последнее время бактерии стали вырабатывать бега-лактамазы. Ответом фармацевтической промышленности стала группа ингибиторов бета-лактамаз, таких как клавулановая кислота или сульбактам. Комбинация ингибитора бета-лактамаз с модифицированным пенициллином, таким как ампициллин, позволяет успешно бороться с бактериями, вырабатывающими бета-лактамазы, при условии, что изначально они были чувствительны к ампициллину. Повышенные дозы обычного ампициллина в течение короткого времени могут обеспечить тот же эффект и часто по более низкой цене, поскольку комбинированные препараты были разработаны гораздо позже и запатентованы.
5. Когда антибактериальная терапия является наиболее дорогой?
а) Когда антибиотики назначаются без необходимости.
б) Когда антибиотики крайне необходимы, но не действуют.
в) Когда из-за токсического воздействия па макроорганизм антибиотики приносят больше вреда, чем пользы, независимо от их антибактериального потенциала.
6. Можно ли при тяжелой хирургической патологии вместо внутривенных антибиотиков применять пероральные антибиотики?
Да, если только больные могут принимать антибиотики внутрь per os! Больные, о которых мы говорим, почти всегда ничего не могут принимать перорально; они часто находятся без сознания и, скорее всего, па искусственной вентиляции легких. Кроме того, кишечник у таких больных не работает в результате основного заболевания, последующей лапаротомии и атонии кишечника; в желудке стоит разгрузочный зонд. Антибиотики больному могли назначить для лечения панкреатита и сепсиса. Обычно в таких случаях кишечнику предоставляется полный отдых, а больные получают парентеральное питание.
Попытка использовать некоторые виды всасывающихся в кишечнике антибиотиков основана па особенностях фармакокинетики и антибактериальном спектре хинолонов, которые можно сначала вводить внутривенно, а сразу после возобновления естественного кормления перейти па пероральную форму. Почти у всех таких больных лечение начинается с внутривенного введения антибиотиков, а само начало антибактериальной терапии имеет гораздо более важное значение, чем ее окончание и фармакологическая форма, на которую переходят перед отменой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
М.Н. ЗУБКОВ, доктор медицинских наук, профессор, вице-президент Межрегиональной ассоциации клинической микробиологии и антимикробной химиотерапии (МАКМАХ). ПРОФИЛАКТИКА И ТЕРАПИЯ ХИРУРГИЧЕСКОЙ ИНФЕКЦИИ
Основная роль антибиотикопрофилактики в хирургии заключается в предупреждении инфекций, возникающих вследствие операции или других инвазивных вмешательств либо имеющих прямую связь с ними, а побочная цель - в уменьшении продолжительности и стоимости пребывания больного в стационаре.
Ее суть состоит в достижении эффективных концентраций антибиотика в операционной зоне во время ее микробного загрязнения и поддержании бактерицидного уровня препарата в течение всей операции и первых 3-4 часов после оперативного вмешательства, поскольку этот отрезок времени является решающим для размножения и адгезии на клетках хозяина попавших в рану микробов, что служит пусковым механизмом для начала инфекционно-воспалительного процесса в ране. Антибиотикопрофилактика, начатая по истечении этого периода, является запоздалой, а ее продолжение после окончания операции в большинстве случаев излишним, поскольку профилактическая роль антибиотика в основном заключается в уменьшении пороговой концентрации бактерий в ране и препятствии адгезии возбудителя.
Антибиотикопрофилактика показана там, где особенно высок риск развития послеоперационной инфекции (например, при "условно чистых" операциях на органах брюшной, грудной полости и малого таза, затрагивающих слизистые оболочки, населенные микрофлорой) или если ее последствия могут представлять угрозу здоровью и жизни больного (при некоторых "чистых" операциях, связанных с имплантацией сосудистых шунтов или искусственных протезов, когда немногочисленные и малопатогенные микроорганизмы с поверхности кожи могут проникнуть глубоко в рану и вызвать ее нагноение). Если хирург заранее уверен, что встретится с инфекцией в процессе операции (например, при "условно чистых" или "загрязненных" вмешательствах), в качестве антибактериальной защиты проводят превентивную антибиотикотерапию, которая должна быть ограничена самыми жесткими показаниями: патофизиологическими предпосылками (например, перфорация органов желудочно-кишечного тракта в результате проникающего ранения или имеющая эндогенное происхождение, сопровождающаяся загрязнением кишечной микрофлорой брюшной полости и прилегающих к ней структур); наличием входных ворот инфекции (например, открытые переломы); биологией потенциального возбудителя. Раннее назначение антибиотиков, обычно в течение 12 часов с момента перфорации или травмы, расценивается как профилактика, более позднее, когда развились признаки серьезной инфекции, - как лечение.
В большинстве случаев для профилактики послеоперационной инфекции достаточно одной дозы антибиотика (во время премедикации; вторая доза вводится при 3-часовых и более длительных операциях) либо проводят сверхкраткий курс антибиотикопрофилактики, ограниченный двумя-тремя дозами препарата. Такая тактика, основанная на многочисленных клинических и экспериментальных наблюдениях, вполне эффективна, снижает вероятность побочных действий антибиотика, ограничивает возможность развития устойчивости бактерий к химиопрепаратам, обеспечивает меньшую стоимость лечения. Профилактическое применение антибиотиков задолго до операции или более 48 часов в послеоперационном периоде ведет к нарушению биоценоза желудочно-кишечного тракта и колонизации верхних его отделов микрофлорой толстой кишки с возможным развитием эндогенной инфекции путем бактериальной транслокации условных патогенов через лимфатическую систему тонкого кишечника. Кроме того, возрастает опасность суперинфекции у оперированных больных за счет селекции антибиотикорезистентных штаммов. Поэтому антибиотик следует вводить больному в соответствующей дозе непосредственно перед операцией (за 10-15 мин. внутривенно во время наркоза либо за 40-60 мин. до операции внутримышечно) с последующими повторными инъекциями по показаниям, но не более 24-48 часов.
Для профилактики раневой инфекции чаще всего назначают цефалоспорины 1-го и 2-го поколения (препараты 3-го поколения существенно дороже и используются в основном для лечения), так как они имеют достаточный спектр бактерицидной активности против наиболее распространенных возбудителей послеоперационных осложнений, и прежде всего стафилококков; при парентеральном введении создают высокие концентрации в операционной зоне; отличаются малой токсичностью и частотой побочных действий. К числу недостатков всех цефалоспоринов следует отнести неэффективность при энтерококковой инфекции; плохое проникновение через гематоэнцефалический барьер (кроме цефтазидима и некоторых других препаратов 3-го поколения); возможное увеличение нефротоксичности в комбинации с аминогликозидами.
Помимо цефалоспоринов при высоком риске стафилококковой хирургической инфекции у ортопедических и некоторых других категорий больных применяют ванкомицин. При колоректальных операциях наряду с пероральным промыванием кишечника изотоническим раствором за сутки до операции больному назначают внутрь неомицин, 1 г + эритромицин, 1 г в 13, 14 и 22 ч., а в день операции - цефалоспорины 1-2-го поколения в/в дважды с интервалом 8 ч. При катаральном и флегмонозном аппендиците достаточно однократного применения в/в цефазолина (1 г) или цефуроксима (1,5 г) либо проведения короткого курса (2-3 дозы). При гангренозном аппендиците дополнительно вводят метронидазол, 0,5 г в/в. Если в послеоперационном периоде возникает подозрение на перитонит и/или абсцедирование, продолжают применение антибиотиков в течение 3-5 суток. Схемы профилактики при других видах операций приведены в таблице 1.
Таблица 1
ВАРИАНТЫ АНТИБИОТИКОПРОФИЛАКТИКИ (АП) РАНЕВОЙ ИНФЕКЦИИ ПРИ НЕКОТОРЫХ ВИДАХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ*
1 Первую дозу цефалоспорина вводят в/в во время вводного наркоза (за 10-15 мин. до разреза); при операциях > 3 ч антибиотик вводят повторно; при реконструктивных операциях на сосудах и нервных окончаниях АП продлевают до 2-3 сут.
2 До 3 дней, по показаниям.
3 В/в капельно в течение 1 часа.
4 Профилактика газовой гангрены.
5 АП не показана при катетеризации сердца.
6 О преимуществах нетилмицино см. в тексте.
7 Цефалоспорины 2-го поколения, активные против анаэробов.
8 При брюшном доступе повторяют по 1 г в/в через 8 ч и 16 ч.
Антибиотикопрофилактику считают неэффективной, если в области первичного операционного разреза возникла послеоперационная инфекция; если появилась необходимость дренирования операционной зоны; если в течение 4-недельного периода после первичной операции понадобилось не находящее объяснений применение антимикробных препаратов.
При уже развившейся хирургической инфекции на начальном этапе лечения назначение антибиотиков носит эмпирический характер до получения результатов бактериологического исследования материалов из раны. При этом выбор тактики химиотерапии зависит от характера хирургической патологии и локализации гнойно-воспалительного процесса, определяющих специфику раневой инфекции. Вполне естественно, что при перитонитах, где превалирует анаэробная флора в ассоциации с энтеробактериями, и при инфекциях костей и мягких тканей, где ведущую роль играют стафилококки, алгоритмы эмпирической антибиотикотерапии будут различными.
При травматических ранах с признаками нагноения назначают комбинированную терапию, учитывая лидирующее положение стафилококков и высокий удельный вес микробных ассоциаций (до 70%) при посттравматических инфекциях. Обычно используют гентамицин (4,5 мг/кг/сут) в сочетании с оксациллином (4-6 г/сут), цефазолином (3 г/сут) или линкомицином (1200-1800 мг/сут) при высоком риске развития анаэробной инфекции.
Состав микрофлоры при перитонитах
Стрептококки - 11%
Энтеробактерии - 24%
Стафилококки - 5%
Псевдомонады - 12%
Анаэробы - 48%
Состав микрофлоры при инфекциях костей и мягких тканей
Стрептококки - 7%
Энтеробактерии - 15%
Стафилококки - 60%
Псевдомонады - 8%
Анаэробы - 10%
Но особенно следует выделить антисинегнойную активность пиперациллина и тазоцина, что позволяет использовать их для лечения внутрибольничных инфекций в виде монотерапии (4 г/0,5 г тазоцина) или в комбинации с нетилмицином (4,5 г/кг/сут).
При острых интраабдоминальных инфекциях (80% из них возникает вне стационара), когда точная локализация неизвестна, лечение направляют против смешанной флоры кишечника, включающей факультативные грамотрицательные бактерии и часто встречающиеся анаэробы (Clostridium spp. и Bacteroides spp.). Одна из применяемых в настоящее время схем противоинфекционной терапии предусматривает комбинацию аминогликозида с антианаэробным препаратом (метронидазол или клиндамицин). Многие хирурги предпочитают добавлять ампициллин для воздействия на энтерококки. Назначение тазоцина по эффективности не уступает комбинированному препарату имипенем-циластатин. Широко используются также комбинации цефалоспоринов 3-го поколения с клиндамицином или метронидазолом. Парентеральную терапию продолжают до исчезновения лихорадки, снижения числа лейкоцитов крови (
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
В этой статье мы затронем одну из самых интересных тем антимикробной терапии, а именно периоперационную антибиотикопрофилактику. О нее за крайние годы сломано огромное количество копий и они, как ни странно, до сих пор продолжают ломаться.
- особенностями преподавания принципов антибактериальной терапии в ВУЗах
- и достаточно легкого отношения к самим антимикробным препаратам бесконечно меняющиеся концепции антибактериальной терапии так же накладывают свой серьезный отпечаток.
Вы, наверное, помните, не так уж давно это было, как нас учили, что за неделю до операции пациент должен получить курс антибиотиков в качестве «подготовки к оперативном вмешательству. Потом передумали и стали проводить подобный курс уже после операции, причем абсолютно всем пациентам и вне зависимости от того, есть там инфекция или ее нет. Для профилактики. Чтобы было и не думалось. И этот подход так укоренился в сознании, что за 10 лет его никак не удается переломить.
Итак, чего бояться хирурги и почему они назначают антибактериальные препараты? А бояться они нагноения раны или говоря академическим языком – инфекции в области хирургического вмешательства (ИОХВ)
ИОХВ – это инфекция разреза, органа или полости, возникающая в течение 30 дней (без имплантата) или 1 года (с имплантатом) послеоперационного периода.
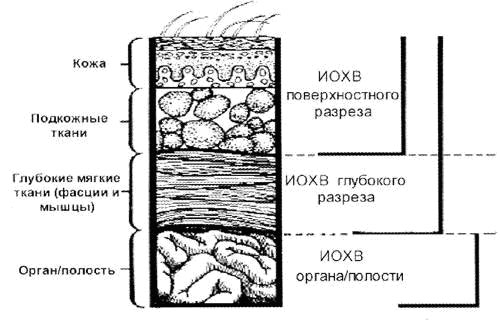
- Поверхностную ИОХВ разреза (кожа, подкожная клетчатка)
- Глубокую – ИОХВ разреза (фасция, мышцы)
- ИОХВ органа или полости
- Симптомов воспаления
- Гнойного отделяемого и лабораторное подтверждение наличия воспаления
- Достоверное микробиологическое подтверждение (окраска мазока по Граму, посев)
- необходимости вмешательство хирурга.
- Гнойное отделяемое из глубины разреза
- УЗИ и RG признаки поражения в сочетании с визуальной симптоматикой
- Спонтанное расхождение краев раны
- Присоединение глубокого поражения к поверхностному
- Необходимость хирургического вмешательства.
- Гнойного отделяемого по дренажам
- Достоверное микробиологическое подтверждение (окраска мазка по Граму, посев)
- Наличие абсцесса
Группу риска по развитию ИОХВ составляют:
- пациенты с пожилого возраста и новорожденные
- пациенты с недостатком массы тела
- больные СД
- ожирение
- сопутствующая инфекция другой локализации
- колонизация носоглотки S.aureus
- снижение местного и общего иммунитета, в т.ч. и в результате лечения.
- Особенности предоперационной подготовки – не надо брить операционное поле, это приводит к микротравматизации и увеличению риска ИОХВ
- Техника выполнения операции – при выполнении операции интернами, ординаторами и молодыми врачами, а так же в ситуациях, когда техника оперативного вмешательства еще не отточена, риски инфекции возрастают очень значительным образом.
- Несоблюдение правил асептики и антисептики
- Большая длительность операции.
- Большая кровопотеря в следствие оперативного вмешательства
- Отсутствие периоперационной антибиотикопрофилактики
- Дренирование раны
- Инфекции хирургического персонала (в том числе колонизация S.aureus)
- Степень микробной обсемененности раны
- Резистентность бактерий к антимикробной терапии.
- чистые,
- условно-чистые,
- контаминированные,
- грязные.
Чистая рана – характеризуется отсутствием признаков воспаления и вовлечения ЖКТ, МВП, дыхательных путей, а так же отсутствием технических нарушений при выполнении оперативного вмешательства.
Условно-чистая рана характеризуется вовлечением ЖКТ, мочеполовых и дыхательных путей; низкой вероятностью контаминации или незначительными техническими нарушениями при выполнении оперативного вмешательства
Контаминированная рана – имеет признаки острого негнойного воспаления; кроме того могут иметь место серьезные технические нарушения в ходе вмешательства (раны пациентов, оперированных начинающими врачами изначально должны считаться контаминированными из-за того, что техникой они еще не владеют в должном объеме)
Сюда же относится большой выброс содержимого полых органов, а также проникающие ранения со сроком менее 4 часов.
Грязные раны – характеризуются наличием гноя, предоперационной перфорацией органов и проникающими ранениями старше 4-х часов.
Итак, мы подошли к главному вопросу – когда же мы должны применить периоперационную антибиотикопрофилактику.
Периоперационную антибиотикопрофилактику мы применяем в первых трех видах ран, а в случае грязной мы с самого начала идем на антибиотикотерапию.
Почему именно тогда? В случае грязной раны возбудители могут быть какие угодно, а вот в случае первых трех, что доказано результатами многочисленных крупномасштабных исследований, ИОХВ вызовут в основном:
- Стафилококки
- Энтеробактер
- Коагулазонегативные стафилококки
- Энтерококки
- Стрептококки
- Кишечная палочка
А что же такое периоперационная антибиотикопрофилактика (ПАП) и какие цели мы перед ней ставим? Это предоперационное в/в введение антибиотика для уменьшения риска развития раневой инфекции, благодаря созданию в ране концентрации, достаточной для снижения уровня микробной контаминации тканей по ходу операционного разреза.
Давайте обратимся к очень известной картинке, которую всегда демонстрируют, когда речь идет о профилактике инфекций в хирургии:
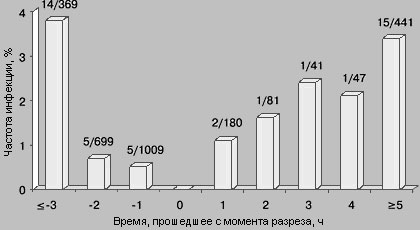
Обратите внимание, что с момента разреза контаминация тканей начинает расти в геометрической прогрессии. И введение антибиотика после операции выглядит как пальба из пушки по воробьям. При этом введение антибиотика не должно быть заблаговременным, ибо через 2-3 часа он уже будет выведен из организма, а значит и не подавит размножение микробов в ране. Таким образом, оптимальным интервалом введения, является введение антимикробного препарата за 30-40 минут до операционного разреза.
- В каких случаях следует проводить антибиотикопрофилактику?
- Какие препараты следует использовать?
- Когда необходимо начинать введение антибиотиков?
- Сколько препаратов необходимо назначить?
- Какова должна быть продолжительность антибиотикопрофилактики?
По первому пункту и третьему пунктам мы уже разобрались – профилактируем мы чистые, условно-чистые и контаминированные раны. Грязные мы начинаем сразу же лечить. А препарат вводим за 30-40 минут до разреза.
- Избирательность применения антимикробных препаратов. Т.е. препараты, применяющиеся с целью ПАП не должны больше использоваться ни в одной схеме антимикробной терапии в стационаре. Это делается для того, чтобы на максимально долгое время отсрочить развитие антибиотикорезистентности у микроорганизмов, вызывающих ИОХВ.
- Препарат должен вводится непосредственно перед операцией, за 30-40 минут до первого разреза.
- Пациентам с высокой массой тела необходимо пересчитывать дозу в сторону ее увеличения
- При длительных операциях препарат должен вводиться дважды, исходя из наиболее часто использующихся препаратов, повторная доза должна быть введена через 3-4 часа от начала оперативного вмешательства, так как это напрямую связано с фармакокинетикой антибиотика, конкретно с его периодом полувыведения (Т1/2)
- Применение ПАП более чем через 24 ч не приводит к увеличению ее эффективности. Исключением в данной ситуации являются оперативные вмешательства, проводимые молодыми врачами, осваивающими технику оперативных вмешательств. В этой ситуации антибиотикопрофилактика продляется до 72 часов.
- пациентов с трахеостомой или интубированных (для профилактики инфекций дыхательных путей);
- пациентов с постоянным мочевым катетером;
- пациентов с центральными венозными катетерами или дренажами плевральной полости;
- большинства пациентов с открытыми ранами, в том числе и ожоговыми.
Связано это с тем, что раны подвергаются постоянной контаминации и добиться там эрадикации не представляется возможным. За такими за пациентами необходим тщательный уход и контроль состояния, для того чтобы немедленно начать антибактериальную при первых же признаках инфекции
- По спектру активности – он должен включать всех наиболее часто встречающихся возбудителей
- Доза препарата должна быть обычной терапевтической (исключение – лица с ожирением)
- Время введения препарата 30-40 мин до разреза, строго!
- Кратность введения определяется Т1/2 и длительностью операции. Для основных препаратов для ПАП справедливо правило о повторном введении антибиотика через 3-4 часа от начала операции.
- легко доступен,
- дешев,
- не использоваться в схемах антибиотикотерапии в стационаре.
Почему только там? Цефазолин относится к препаратам с грам(+) активностью, он отлично воюет с грамположительными кокками, но совершенно непригоден в случае грамминус возбудителей.
Кроме того, применяя этот препарат следует помнить об общем класс-эффекте всех цефалоспоринов – лекарственные гипертермии. Примерно каждый сотый пациент выдает на цефазолин гипертермию, которая от истинной отличается тем, что проходит на фоне относительной брадикардии. Таким образом, если после АБП цефазолином у вашего пациента поднялась температура тела, а операция была чистой и в своей технике вы уверены, прежде чем паниковать и бросаться лечить его мощными антибиотиками – осмотрите рану, возьмите клинические анализы и посчитайте пульс!
Прекраснейший антибактериальный препарат, перекрывающий всех возбудителей ИОХВ и как следствие могущий использоваться при всех 3-х видах оперативных вмешательств в дозе 1,2 г в/в за 30-40 мин до разреза…
Во-вторых, его крайне сложно вывести из оборота в стационаре, так как он входит в схемы лечения многих инфекций, а что актуально конкретно для вас, так то, что он является препаратом первой линии в лечении сепсиса, тяжелых пневмоний и нейтропенических лихорадок, так же он является препаратом выбора в практике оториноларингологов. И если пациенты с подобными состояниями проходят лечение в ваших стационарах, использование амкоксициллин/клавуланата с целью ПАП принесет больше проблем, чем пользы, так как вызовет селекцию резистентных к нему штаммов. Если же подобные состояния у вас не встречаются – смело можете выводить данный препарат из общебольничной практики и использовать его в качестве периоперационной профилактики ИОХВ.
3) Ампициллин/сульбактам – перекрывает все тех же возбудителей, что и амоксициллин/клавуланат, но более дешев, легче выводится из общего оборота стационара.
Вводится по 3 г в/в за 30-40 мин до разреза. Повторная доза, если она потребуется, вводится через 3-4 часа от начала оперативного вмешательства
Отдельно следует упомянуть, что если пациент имеет в анамнезе данные об аллергических реакциях на препараты пенициллинового ряда, препаратом выбора в данной ситуации становится Клиндамицин в дозе 0,6 г.
Более подробно о методах и схемах периоперационной антибиотикопрофилактики вы можете познакомиться в следующих руководствах:
5) Антибактериальная профилактика инфекций в области хирургического вмешательства в колоректальной хирургии.
Проблема инфекций, как внебольничных, так и нозокомиальных, не может быть решена без организации соответствующей системы микробиологического контроля в стационарах [2, 3, 7]. Этот контроль (исследование) представляет собой многоступенчатый процесс, включающий:
- забор проб клинического материала и его транспортировку в лабораторию;
- проведение бактериоскопии и посева на питательные среды для выделения возбудителя и получения чистой культуры;
- идентификация выделенных культур (до вида);
- определение их чувствительности к антибактериальным препаратам.
Возбудители послеоперационной инфекции в абдоминальной хирургии сегодня хорошо известны: Enterobacteriaceae, E. coli, Proteus spp., Ps. aeruginosa, Staphylococcus spp., Enterococcus spp. Несмотря на то что в ряде случаев возбудителями послеоперационной инфекции являются типичные нозокомиальные виды микроорганизмов (Ps. aeruginosa, MRSA/ORSA, Acinеtоbacter spp.), большинство авторов не склонны считать нагноение послеоперационных ран проявлением внутрибольничной инфекции и указывают на преимущественно эндогенный (контактный, гематогенный, лимфогенный) путь инфицирования. Иными словами, состав микробной флоры при послеоперационной раневой инфекции является прямым следствием выхода сапрофитирующей микрофлоры из ареала ее обитания в результате развития воспалительного или/и некротического процесса, нарушения анатомических барьеров в процессе оперативного вмешательства, транслокации микрофлоры [4, 5].
Основные методы профилактики развития послеоперационной инфекции по сути являются методами профилактики эндогенного инфицирования и включают специфические и неспецифические мероприятия:
- неспецифические мероприятия - предоперационная коррекция нарушений гомеостаза, нормализация доставки кислорода, коррекция сопутствующих заболеваний и иммунного дисбаланса, совершенствование техники оперирования с уменьшением травматичности и продолжительности вмешательств (особенно этапов, сопровождающихся вскрытием просвета полых органов), тщательный гемостаз, использование синтетического резорбируемого монофиламентного шовного материала;
- специфические мероприятия - различные методы воздействия на вероятных возбудителей инфекционных осложнений (прежде всего использование антимикробных препаратов).
Единственным ориентиром для прогнозирования антибактериальной чувствительности могут быть данные динамического наблюдения за распространением резистентности среди микроорганизмов, циркулирующих как в лечебном учреждении, так и во внебольничной популяции.
В связи с этим становится очевидной необходимость постоянного мониторирования эндогенной микрофлоры у пациентов хирургических отделений.
Материал и методы
В микробиологической лаборатории Новомосковской городской клинической больницы (НГКБ) проведен анализ материалов, взятых от больных с хирургическими заболеваниями органов брюшной полости, госпитализированных в хирургическое отделение, и от больных с гнойными заболеваниями мягких тканей, госпитализированных в отделение гнойной хирургии.
Забор материала на исследования осуществляли в стерильных условиях, тщательно соблюдая правила асептики. Образцы для посевов забирали до начала лечения антибактериальными препаратами. Получение жизнеспособных тканей из глубоких отделов раны после ее очистки и удаления детрита признано наиболее адекватным методом для качественной и количественной оценки микробной обсемененности.
Материал маркировали и в течение 2 ч с момента забора доставляли в микробиологическую лабораторию, где эффективность антибиотика оценивали по показателю ингибиции:
- 100-95% - абсолютная ингибиция;
Результаты и обсуждение
За 2006-2008 гг. изучено более 950 образцов. В 15,2% из них рост флоры отсутствовал, в 54,2% выделена ассоциированная флора (из двух возбудителей - 37,2%, из трех - 8,5%, из четырех - 3,4%, из пяти и более возбудителей - 5,1%), в 16,9% - только монокультуры.

В этиологической структуре доминировала грамотрицательная флора (69,8%) над грамположительной (30,2%). В табл. 1 представлен видовой состав эндогенной микрофлоры, выделенной из брюшной полости.
С учетом полученных данных общие принципы антибактериальной терапии этих больных были ориентированы на грамотрицательную микрофлору - прежде всего на Enterobacteriaceae, E. coli, Kl. pneumonia, а также на энтерококки, в частности на E. faecalis. После выделения и идентификации конкретного возбудителя при необходимости осуществляли этиотропную терапию или проводили коррекцию на основании данных антибиотикограммы.

Чувствительность семейства Enterobacteriaceae к антимикробным препаратам (рис. 1) Рисунок 1. Чувствительность семейства Enterobacteriaceae к антимикробным препаратам. зависела от вида и локализации инфекционного процесса.
Чувствительность энтеробактерий к аминопенициллинам, уреидопенициллинам и триметоприм/сульфатоксазолу может быть относительно невелика, а природной чувствительностью к цефалоспоринам первого поколения обладают только E. coli и Proteus mirabilis. Степень эффективности антимикробных препаратов к энтеробактериям - возбудителям гнойно-септических инфекций, распределилась следующим образом (в %):
- Proteus spp. - амикацин - 80,9, гентамицин - 65,2, амоксициллин и доксициклин - по 10,0, ципрофлоксацин - 55,5, офлоксацин - 84,5, цефазолин - 95,5, цефоперазон - 50,0, цефтазидим - 70,4, цефепим - 75,0;
- E. coli - амикацин - 92,6, гентамицин - 75,4, ципрофлоксацин - 84,6, офлоксацин - 88,4, левофлоксацин - 88,9, цефазолин - 91,4, цефоперазон - 83,3, цефтазидим - 85,9, цефтриаксон - 99,9, цефуроксим - 99,9, цефепим - 86,8;
- Klebsiella pneumonia - амикацин - 61,9, гентамицин - 60,0, ципрофлоксацин - 62,5, офлоксацин - 71,4, левофлоксацин - 90,1, цефазолин - 58,3, цефоперазон - 84,2, цефтазидим - 91,9, цефепим - 85,2.
Поскольку микроорганизмы семейства Enterobacteriaceae способны вырабатывать одновременно несколько разновидностей аминогликозидмодифицирующих ферментов, нередко возникает перекрестная резистентность возбудителей к различным аминогликозидным препаратам. В связи с этим выявление устойчивости энтеробактерий к одному из аминогликозидов не позволяет прогнозировать устойчивость к другим антибиотикам этой группы.
Если у больного регистрировалось инфекционное заболевание с тяжелым течением, вызванное энтеробактериями, то для лечения подбирали следующие антимикробные препараты:
- цефалоспорины третьего поколения (цефотаксим, цефтриаксон) и четвертого поколения (цефепим);
- карбапенемы (имипенем или меропенем);
- аминогликозиды второго поколения (гентамицин) и/или третьего поколения (амикацин, тобрамицин или нетилмицин);
Следует иметь в виду, что ампициллин/сульбактам и амоксициллин/клавуланат обладают одинаковым спектром антимикробного действия, однако клавулановая кислота является более сильным ингибитором бета-лактамаз.

Спектр активности цефалоспоринов второго-третьего поколений несколько расширяется, преимущественно за счет Klebsiella spp. (рис. 2). Рисунок 2. Чувствительность Klebsiella spp. к цефалоспоринам второго—третьего поколений.
Природная чувствительность энтеробактерий к цефалоспоринам третьего поколения примерно одинакова, однако штаммы возбудителей, продуцирующие бета-лактамазы расширенного спектра (ESBL), могут различаться по спектру чувствительности in vitro к этим препаратам; чаще всего исследования на наличие этих ферментов проводят у штаммов Klebsiella spp. и E. coli.
Цефтазидим не используется для лечения вызванных энтеробактериями инфекций, однако служит маркером выявления бета-лактамаз расширенного спектра. Важно подчеркнуть, что все цефалоспориновые антибиотики и монобактамы клинически неэффективны в отношении образующих ESBL штаммов энтеробактерий. Цефепим может сохранять активность в отношении части продуцирующих ESBL штаммов возбудителей. Устойчивость энтеробактерий к карбапенемам встречается редко.
Enterococcus spp. характеризуются природной резистентностью ко многим антимикробным препаратам (цефалоспорины, аминогликозиды, макролиды, линкозамиды), что затрудняет проведение рациональной антимикробной терапии. Степень эффективности антибиотиков в отношении E. faecalis распределилась следующим образом (в %): амикацин - 30,0, гентамицин - 53,7, пенициллин - 56,5, ампициллин - 77,4, амоксициллин - 78,0, оксациллин - 4,2, имипенем - 51,3, ципрофлоксацин - 33,3, офлоксацин - 43,3, ванкомицин - 86,7, цефазолин - 20,3, цефоперазон - 28,6, цефотаксим - 47,1, цефтазидим - 11,1, цефуроксим - 27,3, цефепим - 39,4, азитромицин - 21,4, кларитромицин - 26,5, клиндамицин - 66,7.

Последние исследования позволили сформировать типовой перечень антимикробных препаратов, применяемых при лечении энтерококковых инфекций. Чаще всего это бета-лактамные антибиотики, однако для микроорганизмов рода Enterococcus spp. характерны выраженные видовые различия в чувствительности к препаратам этой группы. Наибольшей чувствительностью к бета-лактамам обладает E. faecalis, а E. faеcium и другие редко встречающиеся энтерококки относятся к категории природно-устойчивых (табл. 2).
Наряду с микробиологическими исследованиями брюшной полости в микробиологической лаборатории НГКБ изучались образцы от пациентов отделения гнойной хирургии с гнойными заболеваниями мягких тканей.
Установлено, что в общем микробном пейзаже гнойных ран преобладали ассоциации возбудителей - 47,6% (преимущественно из двух культур), монокультур исследовано 39,6%. Но в микробном пейзаже постинъекционных абсцессов монокультуры преобладали - 45,4%. Грамположительная микрофлора доминировала над грамотрицательной - 78,9 и 21,1% соответственно.
Ведущими возбудителями гнойных заболеваний мягких тканей явились S. aureus и коагулазонегативные стафилококки (табл. 3), среди последних преобладал S.epidermidis. Эти и другие возбудители встречались как в ассоциациях, так и в монокультурах (рис. 3). Рисунок 3. Частота обнаружения возбудителей в монокультуре и в ассоциациях.
Общие принципы эмпирической антибактериальной терапии хирургических инфекций мягких тканей были ориентированы на грамположительную кокковую микрофлору, прежде всего на Staphylococcus spp. После выделения и идентификации возбудителя осуществлялся переход на терапию с учетом данных антибиотикограммы.

В результате проведенного в микробиологической лаборатории мониторинга резистентности Staphylococcus spp./S. aureus, выделенных из инфицированных и гнойных ран, удалось сформировать список антимикробных препаратов, наиболее приемлемых для комбинированной и монотерапии данной хирургической инфекции (табл. 4).
Среди цефалоспоринов наибольшей антистафилококковой активностью отличаются препараты первого поколения (цефалотин, цефазолин и др.). В ряду цефалоспоринов от первого к третьему поколению активность несколько снижается, однако возрастает устойчивость к действию стафилококковых бета-лактамаз. Следует помнить, что оральные цефалоспорины третьего поколения (цефиксим и цефтибутен) практически неэффективны в отношении стафилококков. Активность цефалоспоринов четвертого поколения (цефепим и цефпиром) близка к активности цефалоспоринов первого поколения, однако на практике нередко превосходит последнюю в связи с высокой устойчивостью препаратов этой группы к бета-лактамазам возбудителей.
При подборе препаратов для лечения стафилококковой инфекции принимали во внимание следующие положения:
- макролиды, линкозамиды, аминогликозиды, фторхинолоны, тетрациклины, рифампицины, триметоприм/сульфаметоксазол не являются средствами выбора для монотерапии стафилококковых инфекций;
- аминогликозидные антибиотики используются для лечения смешанных стафилококковых инфекций в комбинации с изоксазололпенициллинами, цефалоспоринами или гликопептидами. При обнаружении у стафилококков резистентности к гентамицину выделенный штамм считается устойчивым ко всем аминогликозидным антибиотикам;
- чувствительность стафилококков к макролидам может быть предсказана при использовании диска с эритромицином. Между 16-членными макролидами и линкозамидами существует полная перекрестная резистентность;
- тетрациклины, амфениколы, сульфаниламидные препараты и триметоприм редко применяются для лечения стафилококковых инфекций, поскольку большинство штаммов возбудителей (особенно в госпитальных условиях) обладают резистентностью к этим препаратам.
Таким образом, мониторинг микробного пейзажа брюшной полости пациентов хирургических отделений дает возможность формирования формулярного базового списка антимикробных препаратов, определяющего основные направления эмпирической антибактериальной терапии.
При назначении антибиотиков пациентам с хирургическими заболеваниями органов брюшной полости с профилактической целью следует ориентироваться на энтеробактерии и энтерококки как на наиболее частые контаминанты брюшной полости.
При выборе антимикробного препарата для эмпирической терапии гнойных заболеваний мягких тканей следует ориентироваться на чувствительность к данному препарату наиболее вероятных возбудителей раневой инфекции - Staphylococcus spp./S. aureus.
Проведение мониторинга антибиотикорезистентности дает возможность формирования формулярного базового списка антибактериальных препаратов в отделении гнойной хирургии, приемлемых для терапии гнойных хирургических инфекций мягких тканей.
Проблема инфекций, как внебольничных, так и нозокомиальных, не может быть решена без организации соответствующей системы микробиологического контроля в стационарах [2, 3, 7]. Этот контроль (исследование) представляет собой многоступенчатый процесс, включающий:
- забор проб клинического материала и его транспортировку в лабораторию;
- проведение бактериоскопии и посева на питательные среды для выделения возбудителя и получения чистой культуры;
- идентификация выделенных культур (до вида);
- определение их чувствительности к антибактериальным препаратам.
Возбудители послеоперационной инфекции в абдоминальной хирургии сегодня хорошо известны: Enterobacteriaceae, E. coli, Proteus spp., Ps. aeruginosa, Staphylococcus spp., Enterococcus spp. Несмотря на то что в ряде случаев возбудителями послеоперационной инфекции являются типичные нозокомиальные виды микроорганизмов (Ps. aeruginosa, MRSA/ORSA, Acinеtоbacter spp.), большинство авторов не склонны считать нагноение послеоперационных ран проявлением внутрибольничной инфекции и указывают на преимущественно эндогенный (контактный, гематогенный, лимфогенный) путь инфицирования. Иными словами, состав микробной флоры при послеоперационной раневой инфекции является прямым следствием выхода сапрофитирующей микрофлоры из ареала ее обитания в результате развития воспалительного или/и некротического процесса, нарушения анатомических барьеров в процессе оперативного вмешательства, транслокации микрофлоры [4, 5].
Основные методы профилактики развития послеоперационной инфекции по сути являются методами профилактики эндогенного инфицирования и включают специфические и неспецифические мероприятия:
- неспецифические мероприятия - предоперационная коррекция нарушений гомеостаза, нормализация доставки кислорода, коррекция сопутствующих заболеваний и иммунного дисбаланса, совершенствование техники оперирования с уменьшением травматичности и продолжительности вмешательств (особенно этапов, сопровождающихся вскрытием просвета полых органов), тщательный гемостаз, использование синтетического резорбируемого монофиламентного шовного материала;
- специфические мероприятия - различные методы воздействия на вероятных возбудителей инфекционных осложнений (прежде всего использование антимикробных препаратов).
Единственным ориентиром для прогнозирования антибактериальной чувствительности могут быть данные динамического наблюдения за распространением резистентности среди микроорганизмов, циркулирующих как в лечебном учреждении, так и во внебольничной популяции.
В связи с этим становится очевидной необходимость постоянного мониторирования эндогенной микрофлоры у пациентов хирургических отделений.
Материал и методы
В микробиологической лаборатории Новомосковской городской клинической больницы (НГКБ) проведен анализ материалов, взятых от больных с хирургическими заболеваниями органов брюшной полости, госпитализированных в хирургическое отделение, и от больных с гнойными заболеваниями мягких тканей, госпитализированных в отделение гнойной хирургии.
Забор материала на исследования осуществляли в стерильных условиях, тщательно соблюдая правила асептики. Образцы для посевов забирали до начала лечения антибактериальными препаратами. Получение жизнеспособных тканей из глубоких отделов раны после ее очистки и удаления детрита признано наиболее адекватным методом для качественной и количественной оценки микробной обсемененности.
Материал маркировали и в течение 2 ч с момента забора доставляли в микробиологическую лабораторию, где эффективность антибиотика оценивали по показателю ингибиции:
- 100-95% - абсолютная ингибиция;
Результаты и обсуждение
За 2006-2008 гг. изучено более 950 образцов. В 15,2% из них рост флоры отсутствовал, в 54,2% выделена ассоциированная флора (из двух возбудителей - 37,2%, из трех - 8,5%, из четырех - 3,4%, из пяти и более возбудителей - 5,1%), в 16,9% - только монокультуры.

В этиологической структуре доминировала грамотрицательная флора (69,8%) над грамположительной (30,2%). В табл. 1 представлен видовой состав эндогенной микрофлоры, выделенной из брюшной полости.
С учетом полученных данных общие принципы антибактериальной терапии этих больных были ориентированы на грамотрицательную микрофлору - прежде всего на Enterobacteriaceae, E. coli, Kl. pneumonia, а также на энтерококки, в частности на E. faecalis. После выделения и идентификации конкретного возбудителя при необходимости осуществляли этиотропную терапию или проводили коррекцию на основании данных антибиотикограммы.

Чувствительность семейства Enterobacteriaceae к антимикробным препаратам (рис. 1) Рисунок 1. Чувствительность семейства Enterobacteriaceae к антимикробным препаратам. зависела от вида и локализации инфекционного процесса.
Чувствительность энтеробактерий к аминопенициллинам, уреидопенициллинам и триметоприм/сульфатоксазолу может быть относительно невелика, а природной чувствительностью к цефалоспоринам первого поколения обладают только E. coli и Proteus mirabilis. Степень эффективности антимикробных препаратов к энтеробактериям - возбудителям гнойно-септических инфекций, распределилась следующим образом (в %):
- Proteus spp. - амикацин - 80,9, гентамицин - 65,2, амоксициллин и доксициклин - по 10,0, ципрофлоксацин - 55,5, офлоксацин - 84,5, цефазолин - 95,5, цефоперазон - 50,0, цефтазидим - 70,4, цефепим - 75,0;
- E. coli - амикацин - 92,6, гентамицин - 75,4, ципрофлоксацин - 84,6, офлоксацин - 88,4, левофлоксацин - 88,9, цефазолин - 91,4, цефоперазон - 83,3, цефтазидим - 85,9, цефтриаксон - 99,9, цефуроксим - 99,9, цефепим - 86,8;
- Klebsiella pneumonia - амикацин - 61,9, гентамицин - 60,0, ципрофлоксацин - 62,5, офлоксацин - 71,4, левофлоксацин - 90,1, цефазолин - 58,3, цефоперазон - 84,2, цефтазидим - 91,9, цефепим - 85,2.
Поскольку микроорганизмы семейства Enterobacteriaceae способны вырабатывать одновременно несколько разновидностей аминогликозидмодифицирующих ферментов, нередко возникает перекрестная резистентность возбудителей к различным аминогликозидным препаратам. В связи с этим выявление устойчивости энтеробактерий к одному из аминогликозидов не позволяет прогнозировать устойчивость к другим антибиотикам этой группы.
Если у больного регистрировалось инфекционное заболевание с тяжелым течением, вызванное энтеробактериями, то для лечения подбирали следующие антимикробные препараты:
- цефалоспорины третьего поколения (цефотаксим, цефтриаксон) и четвертого поколения (цефепим);
- карбапенемы (имипенем или меропенем);
- аминогликозиды второго поколения (гентамицин) и/или третьего поколения (амикацин, тобрамицин или нетилмицин);
Следует иметь в виду, что ампициллин/сульбактам и амоксициллин/клавуланат обладают одинаковым спектром антимикробного действия, однако клавулановая кислота является более сильным ингибитором бета-лактамаз.

Спектр активности цефалоспоринов второго-третьего поколений несколько расширяется, преимущественно за счет Klebsiella spp. (рис. 2). Рисунок 2. Чувствительность Klebsiella spp. к цефалоспоринам второго—третьего поколений.
Природная чувствительность энтеробактерий к цефалоспоринам третьего поколения примерно одинакова, однако штаммы возбудителей, продуцирующие бета-лактамазы расширенного спектра (ESBL), могут различаться по спектру чувствительности in vitro к этим препаратам; чаще всего исследования на наличие этих ферментов проводят у штаммов Klebsiella spp. и E. coli.
Цефтазидим не используется для лечения вызванных энтеробактериями инфекций, однако служит маркером выявления бета-лактамаз расширенного спектра. Важно подчеркнуть, что все цефалоспориновые антибиотики и монобактамы клинически неэффективны в отношении образующих ESBL штаммов энтеробактерий. Цефепим может сохранять активность в отношении части продуцирующих ESBL штаммов возбудителей. Устойчивость энтеробактерий к карбапенемам встречается редко.
Enterococcus spp. характеризуются природной резистентностью ко многим антимикробным препаратам (цефалоспорины, аминогликозиды, макролиды, линкозамиды), что затрудняет проведение рациональной антимикробной терапии. Степень эффективности антибиотиков в отношении E. faecalis распределилась следующим образом (в %): амикацин - 30,0, гентамицин - 53,7, пенициллин - 56,5, ампициллин - 77,4, амоксициллин - 78,0, оксациллин - 4,2, имипенем - 51,3, ципрофлоксацин - 33,3, офлоксацин - 43,3, ванкомицин - 86,7, цефазолин - 20,3, цефоперазон - 28,6, цефотаксим - 47,1, цефтазидим - 11,1, цефуроксим - 27,3, цефепим - 39,4, азитромицин - 21,4, кларитромицин - 26,5, клиндамицин - 66,7.

Последние исследования позволили сформировать типовой перечень антимикробных препаратов, применяемых при лечении энтерококковых инфекций. Чаще всего это бета-лактамные антибиотики, однако для микроорганизмов рода Enterococcus spp. характерны выраженные видовые различия в чувствительности к препаратам этой группы. Наибольшей чувствительностью к бета-лактамам обладает E. faecalis, а E. faеcium и другие редко встречающиеся энтерококки относятся к категории природно-устойчивых (табл. 2).
Наряду с микробиологическими исследованиями брюшной полости в микробиологической лаборатории НГКБ изучались образцы от пациентов отделения гнойной хирургии с гнойными заболеваниями мягких тканей.
Установлено, что в общем микробном пейзаже гнойных ран преобладали ассоциации возбудителей - 47,6% (преимущественно из двух культур), монокультур исследовано 39,6%. Но в микробном пейзаже постинъекционных абсцессов монокультуры преобладали - 45,4%. Грамположительная микрофлора доминировала над грамотрицательной - 78,9 и 21,1% соответственно.
Ведущими возбудителями гнойных заболеваний мягких тканей явились S. aureus и коагулазонегативные стафилококки (табл. 3), среди последних преобладал S.epidermidis. Эти и другие возбудители встречались как в ассоциациях, так и в монокультурах (рис. 3). Рисунок 3. Частота обнаружения возбудителей в монокультуре и в ассоциациях.
Общие принципы эмпирической антибактериальной терапии хирургических инфекций мягких тканей были ориентированы на грамположительную кокковую микрофлору, прежде всего на Staphylococcus spp. После выделения и идентификации возбудителя осуществлялся переход на терапию с учетом данных антибиотикограммы.

В результате проведенного в микробиологической лаборатории мониторинга резистентности Staphylococcus spp./S. aureus, выделенных из инфицированных и гнойных ран, удалось сформировать список антимикробных препаратов, наиболее приемлемых для комбинированной и монотерапии данной хирургической инфекции (табл. 4).
Среди цефалоспоринов наибольшей антистафилококковой активностью отличаются препараты первого поколения (цефалотин, цефазолин и др.). В ряду цефалоспоринов от первого к третьему поколению активность несколько снижается, однако возрастает устойчивость к действию стафилококковых бета-лактамаз. Следует помнить, что оральные цефалоспорины третьего поколения (цефиксим и цефтибутен) практически неэффективны в отношении стафилококков. Активность цефалоспоринов четвертого поколения (цефепим и цефпиром) близка к активности цефалоспоринов первого поколения, однако на практике нередко превосходит последнюю в связи с высокой устойчивостью препаратов этой группы к бета-лактамазам возбудителей.
При подборе препаратов для лечения стафилококковой инфекции принимали во внимание следующие положения:
- макролиды, линкозамиды, аминогликозиды, фторхинолоны, тетрациклины, рифампицины, триметоприм/сульфаметоксазол не являются средствами выбора для монотерапии стафилококковых инфекций;
- аминогликозидные антибиотики используются для лечения смешанных стафилококковых инфекций в комбинации с изоксазололпенициллинами, цефалоспоринами или гликопептидами. При обнаружении у стафилококков резистентности к гентамицину выделенный штамм считается устойчивым ко всем аминогликозидным антибиотикам;
- чувствительность стафилококков к макролидам может быть предсказана при использовании диска с эритромицином. Между 16-членными макролидами и линкозамидами существует полная перекрестная резистентность;
- тетрациклины, амфениколы, сульфаниламидные препараты и триметоприм редко применяются для лечения стафилококковых инфекций, поскольку большинство штаммов возбудителей (особенно в госпитальных условиях) обладают резистентностью к этим препаратам.
Таким образом, мониторинг микробного пейзажа брюшной полости пациентов хирургических отделений дает возможность формирования формулярного базового списка антимикробных препаратов, определяющего основные направления эмпирической антибактериальной терапии.
При назначении антибиотиков пациентам с хирургическими заболеваниями органов брюшной полости с профилактической целью следует ориентироваться на энтеробактерии и энтерококки как на наиболее частые контаминанты брюшной полости.
При выборе антимикробного препарата для эмпирической терапии гнойных заболеваний мягких тканей следует ориентироваться на чувствительность к данному препарату наиболее вероятных возбудителей раневой инфекции - Staphylococcus spp./S. aureus.
Проведение мониторинга антибиотикорезистентности дает возможность формирования формулярного базового списка антибактериальных препаратов в отделении гнойной хирургии, приемлемых для терапии гнойных хирургических инфекций мягких тканей.
Читайте также:

