Прямая гидратация олефинов реферат
Обновлено: 06.07.2024
Этанол принадлежит к числу многотоннажных и широко применяемых продуктов органического синтеза. Этиловый спирт широко используют в различных областях промышленности и прежде всего в химической. Из него получают синтетический каучук, уксусную кислоту, красители, эссенции, фотопленку, порох, пластмассы. Спирт является хорошим растворителем и антисептиком. Поэтому он находит применение в медицине, парфюмерии. В больших количествах этиловый спирт идет для получения спиртоводочных изделий.
Содержание
Введение 3
1. Теоретические основы процесса 4
1.1. Назначение процесса, характеристики сырья и получаемых продуктов 4
1.2. Физико – химическая характеристика процесса 15
1.3. Применяемые катализаторы 18
1.4. Влияние параметров технологического режима на процесс прямой гидратации 19
2. Аппаратурное оформление 24
2.1. Описание технологической схемы процесса 24
2.2. Описание конструкций основных аппаратов 33
3.Расчетный раздел 36
3.1. Расчет материального баланса процесса 36
3.2.Расчет материального баланса реактора 41
3.3.Расчет числа реакторов-гидрататоров 44
Список используемой литературы 45
Работа состоит из 1 файл
получение этанола.doc
Производство спиртов переработкой сульфидных щелоков
Сульфитные щелока представляют собой отходы целлюлозно-бумажного производства. На каждую тонну вырабатываемой целлюлозы образуется 8—12 кг сульфитных щелоков, содержащих 10—12% сухого вещества (лигнин, углеводы, белки, смолы, жиры, окись кальция и др.). При переработке 1 т древесной пульпы получают 80—100 л спирта.
Из сульфитных щелоков острым паром отгоняют сернистый газ и другие летучие вещества, затем нейтрализуют щелок известковым молоком и направляют в батарею бродильных чанов, где щелок последовательно перетекает из одного чана в другой. Брожение проводят при 30°С в течение примерно 20 ч при интенсивном перемешивании щелока с дрожжами. По окончании брожения сахарный раствор (бражку) отделяют в сепараторах от дрожжей и подают на дистилляцию.
Синтетический этиловый спирт значительно дешевле спирта, получаемого из пищевого сырья. Фактическая себестоимость спирта из пищевого сырья более чем в два раза превышает себестоимость спирта, полученного из этилена.
Производство спиртов сернокислотной гидратацией
Реакция присоединения воды к этилену была открыта Фарадеем в
1825—1828 гг. Он нашел, что при действии серной кислоты на этилен, содержащийся в светильном газе, наряду с диэтиловым эфиром и другими продуктами образуется этиловый спирт. Впоследствии было установлено, что первым продуктом присоединения серной кислоты к этилену является этилсерная кислота, которая при гидролизе превращается в этанол. В 1873 г. А. М. Бутлеров и В. Горяинов детально изучили сернокислотную гидратацию этилена и предсказали техническое значение этого процесса. В начале 30-х годов в Советском Союзе М. А. Далиным с сотрудниками были проведены исследования сернокислотной гидратации олефинов и в 1936 г. в Баку была создана первая в СССР промышленная установка по получению этилового спирта из нефтяных газов.
Сернокислотная гидратация олефинов является обратимым процессом. Она протекает в две стадии:
олефин алкилсульфат спирт
Первая стадия—взаимодействие олефинов с серной кислотой — протекает через образование карбоний- иона, т. е. как электрофильное замещение по правилу Марковникова. Поэтому сернокислотная гидратация олефинов выше С2 позволяет получать только вторичные и третичные спирты.
Серная кислота в этом процессе играет роль и катализатора и реагента. Сначала происходит отщепление протона от молекулы кислоты
Под действием его из молекулы олефина образуется карбоний-ион
который далее реагирует с серной кислотой с отщеплением от нее протона и образованием алкилсульфата:
Если в системе присутствует вода; могут также образовываться ионы алкоксония, которые разлагаются с образованием спирта:
Наряду с этим протекает ряд побочных реакций: а) образование диалкилсульфатов:
б) образование простых эфиров из двух молекул спирта с отщеплением воды
причем предполагается, что фактически сначала спирт реагирует с карбоний-ионом, а потом от продукта присоединения отщепляется протон:
в) образование карбонильных соединений (альдегидов) при дегидрировании спирта:
г) полимеризация олефинов:
Из-за этих побочных реакций при гидратации олефинов наряду со спиртами получаются небольшие количества эфиров, альдегидов и полимеров. Кроме того, образование нерасщепляющихся сульфопроизводных приводит к повышенному расходу серной кислоты.
Вторая стадия — гидролиз алкилсульфатов водой, осуществляемый при, нагревании острым паром; одновременно происходит отгонка спирта и разбавление серной кислоты до концентрации почти вдвое меньшей, чем исходная. Существенной особенностью процесса является расщепление при гидролизе на спирт и кислоту не только моноалкил-, но и диалкилсульфатов:
Селективностъ превращения олефина в спирт при сернокислотной гидратации составляет 85—95%, а общая степень конверсии олефина превышает 97%.
Процесс сернокислотной гидратации связан с необходимостью упаривать большой объем (до 4 т на 1 т этанола) образующейся разбавленной до 40—50% серной кислоты, что экономически нецелесообразно. Поэтому, в настоящее время сернокислотная гидратация сохранила свое значение только для получения изопропанола и изобутанолов, производимых в относительно небольших количествах. Для производства этанола используется исключительно метод прямой гидратации.
Условия процесса абсорбции алкенов серной кислотой при сернокислотной гидратации зависят от реакционной способности алкена и выбираются так, чтобы свести к минимуму побочные реакции его полимеризации. В таблице 1 приведен режим абсорбции алкенов различного строения серной кислотой при сернокислотной гидратации.
Таблица 2 - Условия процесса абсорбции алкенов
Рисунок 2 - Распределение серной кислоты в компонентах реакционной смеси в зависимости от соотношения C2H4 : H2SO4 (концентрация кислоты 90%, температура 80°С). 1 – свободная серная кислота; 2,3 – связанная в этилсерную кислоту(2) и в диэтилсульфат(3).
Исходным сырьем служит газ, содержащий 47—50 вес.% этилена, 50—52 вес.% этана и около 1 вес.°/о примесей. Нагретый газ оташается 96 – 98% серной кислоты.
Описанный более старый способ получения этилового спирта через этилсульфаты уступает по экономическим показателям процессу прямой гидратации этилена( таблица 3).
Таблица 3 – Расходные показатели процессов производства этилового спирта
Сернокислотная гидратация этилена
Прямая гидратация этилена
Сернокислотная гидратация этилена
Прямая гидратация этилена
Носитель для катализатора, кг
Электроэнергия, квт ч
Серная кислота (олеум), т
Фосфорная кислота, кг
Производство спиртов прямой гидратацией (взаимодействие с водой в присутствии катализатора)
Данный процесс может быть реализован в двух вариантах: парофазном и жидкофазном. В промышленности преимущественно используют парофазный каталитический процесс, осуществляемый по циклической схеме. Этот способ – прямая каталитическая гидратация этилена перегретым паром – является более экономичным, в отличии от сернокислотной гидратации (отсутствие расхода серной кислоты или установок по ее регенерации, более высокий выход спирта ( 95%), меньшая коррозия аппаратуры), и на нём мы остановимся подробнее.
Гидратация в паровой фазе этилена представляет гетерогенно-каталитическую обратимую экзотермическую реакцию, протекающую по уравнению:
Реакция гидратации протекает с выделением тепла и уменьшением объема. Константа равновесия этой реакции выражается уравнением:
lg Kp = 2093/T – 6,304 + (103/T – 62500/T 2 )P
Из уравнения следует, что равновесная степень превращения этилена возрастает с понижением температуры и повышением давления (рисунок 3).
Рисунок 3 – Влияние температуры и давления на степень превращения этилена в этанол при реакции гидратации. Т3 > Т2 > Т1
Однако применение высокого давления повышает затраты на аппаратуру и энергию, а при низких температурах скорость реакции весьма мала. Оптимальными условиями процесса являются: температура 260—300°С, давление 7—8 МПа, объемная скорость парогазовой смеси 1800—2500 ч -1 .
Содержание в этилене инертных примесей отрицательно влияет как на скорость реакции, так и на равновесную степень превращения. Поэтому газ, поступающий на гидратацию, должен содержать не менее 85% об. этилена. В этих условиях степень превращения этилена за один проход составляет не более 6%, поэтому процесс гидратации строится по циркуляционной схеме. При этом общий выход этанола по этилену достигает 95%.
При гидратации этилена, наряду с основной реакцией (а) протекают побочные реакции дегидратации этанола до диэтилового эфира:
дегидрирования до ацетальдегида:
а также реакции образования олигомеров различного состава.
Селективность процесса гидратации по этанолу возрастает при увеличении отношения Н2О:С2Н4 и уменьшении температуры и снижается с приближением системы к состоянию равновесия. Поэтому степень конверсии этилена невыгодно доводить до величины, близкой к равновесной.
Механизм процесса прямой гидратации этилена на данном катализаторе описывается следующими стадиями:
- Стадия физического растворения этилена в пленке фосфорной кислоты на твердом носителе;
- Стадия образования этилкарбокатиона
- Стадия взаимодействия этилкарбокатиона с водой
Основной особенностью процесса прямой гидратации этилена является малая степень конверсии этилена за один проход – не выше 4,5%. Этим обусловлена необходимость рециркуляции значительных его количеств. Ввиду высокой кратности циркуляции этилена, в системе возможно накопление инертных примесей, поэтому содержание их в исходном этилене не должно превышать 2 – 5%. Эти примеси представляют собой метан и этан. В результате циркуляции не превращённого этилена концентрация примесей в циркулирующем этилене возрастает, а концентрация этилена снижается. Заданную концентрацию этилена в циркуляционном газе поддерживают путём отдувки части циркулирующего газа в систему газофракционирования. Поскольку в циркулирующем этилене инертных примесей больше, чем в свежем, при отдувке можно вывести из системы все поступающие туда примеси.
Большие объёмы циркулирующего газа нужно охлаждать после реакции и вновь нагревать перед подачей в реактор, поэтому при гидратации большую роль играет выбор эффективных способов охлаждения, подогрева и парообразования. Важное значение в процесс имеет также регенерация тепла, необходимая для снижения расхода пара или топлива на нагрев сырья и уменьшение расхода воды на охлаждение продуктов. Кроме того при рациональной схеме регенерации тепла может быть значительно понижен или полностью исключён расход пара высокого давления, необходимо для проведения собственной гидратации.
Реакция прямой гидратации этилена идёт с выделением значительного количества тепла. Однако вследствие низкой конверсии этилена выделяющееся тепло расходуется на нагревание самого этилена и водяного пара, причём в реакторе адиабатического типа перепад температуры паро-газовой смеси не превышает 18 - 20°C, что вполне допустимо. Поэтому проблема отвода тепла в этом процессе не возникает.
Прямая гидратация олефинов протекает при высоком давлении и высокой температуре в присутствии некоторых катализаторов, среди которых наиболее активны главным образом разнообразные комбинации на основе фосфорной кислоты или ее солей. При проведении реакции прямой гидратации олефинов наблюдается следующая закономерность: чем больше углеродных атомов в углеводороде, тем ниже давление и температура, необходимые для гидратации. Однако гидратация пропилена и бутиленов осложняется реакциями полимеризации, которые для этих углеводородов могут даже проеобладать, вследствие чего основным продуктом реакции будет не спирт, а соответствующий полимер. [3]
При прямой гидратации олефинов донором протонов служит концентрированная фосфорная кислота, содержащаяся в порах кремнеземного носителя. Последний обычно имеет форму небольших шариков или цилиндров, и реакцию ведут как типичный гетерогеннокаталитический процесс на стационарном катализаторе. Однако гидратация в отличие от большинства таких процессов протекает не на твердой поверхности катализатора, а в жидкой фазе кислоты, находящейся в порах носителя. [4]
Катализатором прямой гидратации олефинов может служить серная кислота в виде 10 % - ного водного раствора при высоком давлении и температуре. В этих условиях абсорбция олефина и гидролиз алкилсерной кислоты происходит одновременно и процесс идет в одну стадию. Для жидкофазного процесса испытывались также водные растворы соляной и фосфорной кислот, но ввиду сильной коррозии аппаратуры они не приобрели практического значения. [5]
Катализатором прямой гидратации олефинов может служить серная кислота в виде 10 % - ного водного раствора при высоком давлении и температуре. В этих условиях абсорбция олефина и гидролиз алкилсерной кислоты происходят одновременно и процесс идет в одну стадию. Для жидкофазного процесса испытывались также водные растворы соляной и фосфорной кислот, но ввиду сильной коррозии аппаратуры они не приобрели практического значения. [6]
Реакцию прямой гидратации олефинов желательно проводить, как уже говорилось, при невысоких температурах. Однако практически выбор температуры лимитируется скоростью реакции и активностью применяемых катализаторов. В табл. 2 приведена зависимость равновесной степени превращения этилена в этанол от температуры при разных давлениях. [7]
Процесс прямой гидратации олефинов экзотермический и обратимый. Равновесная степень конверсии олефина снижается с повышением температуры, но если понизить температуру, реакция идет слишком медленно. [8]
Процесс прямой гидратации олефинов может быть осуществлен как в чисто газовой фазе, так и в смеси газовой и жидкой фаз, что диктуется особенностями используемого катализатора. Водостойкие катализаторы, допускающие наличие значительных количеств воды в жидкости и газе позволяют вести процесс в смешанной фазе. [9]
При прямой гидратации олефинов применяются катализаторы на основе минеральных кислот и их солей и на основе окислов тяжелых металлов и гетеро-поликислот. [10]
Катализаторов для прямой гидратации олефинов и особенно этилена предложено огромное число, но большинство из них малоактивно. [12]
Катализаторов для прямой гидратации олефинов и особенно этилена предложено огромное число, но большинство из них малоактивно. [14]
К катализаторам прямой гидратации олефинов относятся неорганические вещества: 1) соли кислот, например фосфаты; 2) кислоты, например фосфорная или серная; 3) окис-ные катализаторы, например окислы вольфрама, ванадия, алюминия; 4) активированные алюмосиликаты, а также органические вещества: пиридин, хинолин, сульфокислоты. [15]

Этилен СН2=СН2, пропилен СН2=С=СН2, бутилен СН3-СН2-СН=СН2, бутадиен (дивинил) СН2=СН-СН-СН2 будучи очень реакционно способными соединениями, играют важную роль в промышленности органического синтеза. Из многочисленных реакций, в которые вступают олефины, наибольшее практическое значение имеют процессы полимеризации (полиэтилен, полипропилен, полиизобутилен, и др.), гидратации (спирты), хлорирования (дихлорэтан, хлористый аллил и т. п.), окисления (окись этилена), оксосинтеза и некоторые другие реакции.
Широкое распространение получили процессы гидратации олефиновых углеводородов. Таким способом получаются этиловый, изопропиловый, и другие спирты. Этиловый спирт (этанол, метилкарбинол, винный спирт) С2Н5ОН, мол.в. 46,07 — важнейший представитель предельных одноатомных спиртов. Этиловый спирт — бесцветная, легко подвижная жидкость со жгучим вкусом и характерным запахом;т. кип. 78,3° С; т. затв. —112°С; плотность 0,789 г/см3; границы взрывоопасных концентраций этилового спирта в воздухе 3,28–18,95 об. %; предельно допустимая концентрация паров этилового спирта в воздухе 1000 мг/м. Этиловый спирт смешивается в любых соотношениях с водой, спиртами, эфиром, глицерином, бензином и др. Органическими растворителями, горит бесцветным пламенем.
Этиловый спирт по объему производства занимает первое место среди всех других органических продуктов. Он широко применяется как растворитель и как исходное соединение для различных синтезов. Особенно большие количества этилового спирта расходуются в производстве синтетического каучука.
Этиловый спирт используется также как исходный продукт для производства этилацетата, диэтилового эфира и многих других продуктов органического синтеза. Этиловый спирт может быть получен одним из следующих методов: брожением пищевого сырья (зерна, картофеля и др.), а также отходов сахарного производства — мелассы; гидролизом растительных материалов, переработкой сульфитного щелока, гидратацией этилена [4].
Наибольшее значение имеют получение этилового спирта гидратацией этилена и сбраживанием сельскохозяйственного сырья и продуктов его переработки. Сущность спиртового брожения состоит в том, что виноградный сахар (глюкоза) С6Н1206 в присутствии вещества, вызывающего брожение, через ряд стадий превращается в этиловый спирт и двуокись углерода:

В промышленности для получения спирта пользуются не природным виноградным сахаром, а крахмалом картофеля, хлебных злаков, отходами сахарных заводов. Крахмал предварительно осахаривают под действием особого энзима — диастаза, находящегося в солоде (проросших зернах ячменя или ржи). Осахаривание идет с присоединением воды к крахмалу; при этом образуется дисахарид — мальтоза С12Н22О11:

В процессе брожения под влиянием энзима мальтоза гидролизуется в глюкозу:

Глюкозу потом подвергают спиртовому брожению. Мальтоза, как и зимаза, вырабатывается быстроразмножающимися дрожжевыми грибками.
Основными видами пищевого сырья для получения этилового спирта являются картофель и зерновые культуры. Пищевое сырье вначале очищают от пыли, грязи и механических примесей, оболочку толстокожурного зерна разрушают на вальцах, жерновах или других приспособлениях, после чего очищенный материал разваривают острым паром под давлением в течение 45–110 мин (в зависимости от вида сырья); при этом к зерну прибавляют воду. После разваривания массу выпускают через выдувное отверстие разваривающего аппарата; при этом происходит перепад давления от 4–5 ат до 0,2–0,5 ат (избыточных), вследствие чего оболочки клеток разрываются и сырье превращается в однородную жидкую массу, поступающую в заторный чан. В этот же чан для осахаривания крахмала вводят ферментативный препарат — солод, который получают из проращенного в особых условиях зерна (ячменя, ржи, проса). После добавления солода массу выдерживают 10–15 мин при 61 для ее стерилизации, а также растворения и осахаривания крахмала. По окончании осахаривания массу охлаждают до 30, после чего в нее вводят дрожжи. Полученную массу охлаждают до 22–26 град. (двухсуточное брожение) или 15–18 град. (трехсуточное брожение) и перекачивают в бродильные чаны. Кроме этилового спирта при брожении образуются: глицерин, янтарная кислота, метиловый спирт, сивушные масла, сложные эфиры и др.
Длительность брожения при непрерывном методе составляет 60–65 часов, содержание э. с. в зрелой бражке 8–10об. %. Бражка поступает в брагоперегонный аппарат, из которого отгоняют этиловый спирт и летучие примеси. Остающийся в аппарате твердый продукт — барда (4,5–7,4 %), используется на корм скоту. Крепость получаемого при перегонке спирта-сырца должна быть не менее 88 % (объемн.) Из спирта-сырца очисткой его от примесей получают спирт-ректификат (95,5 %). На рис.1 приведена схема производства этилового спирта из пищевого сырья, включающая процессы разваривания и осахаривания крахмала [4].
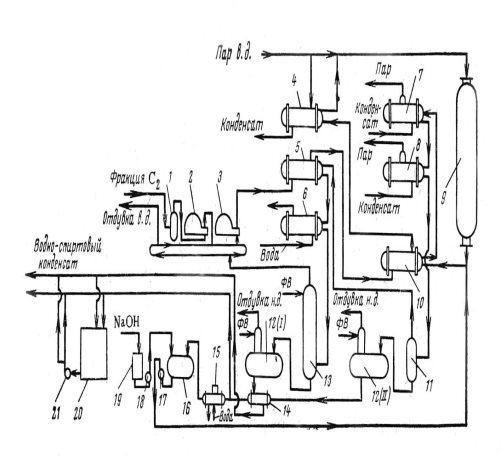
Рис. 1. Схема отделения прямой гидратации этилена: 1 — буфер; 2 — компрессор свежего этилена; 3 — компрессор циркулирующего газа; 4 — паровой подогреватель; 5, 10, 14 — теплообменники; 6, 15 — холодильники; 7,8 — котлы-утилизаторы, 9 — реактор; 11 — сепаратор; 12(1), 12(11) — газоотделители; 13 — скруббер; 16, 20 — ёмкости; 17, 18, 21 — насосы; 19 — сборник; ФВ — фузельная вода
Разработан новый способ получения этанола — прямая гидратация этилена, сделав его тем самым более экономичным. Более того, прямая гидратация позволяет получить более высокий выход продукта и отличается высокой экологичностью.
При производстве синтетического этилового спирта сырьем служит этилен, который получается при пиролизе газового сырья или нефтяных дистилляторов. Для получения этилового спирта этилен подвергается сернокислотной или прямой гидратации на твердых фосфорнокислых катализаторах. Трудовые затраты при производстве этилового спирта из пищевых продуктов или древесных опилок очень велики, поэтому значительно выгоднее исходить из дешевого углеводородного сырья и получать спирт гидратацией этилена [2].
Прямая гидратация этилена имеет ряд преимуществ перед сернокислотным методом: исключение расхода серной кислоты и минимальные потребности в других реагентах, кроме этилена и водяного пара, одностадийность процесса, более высокий выход спирта. Недостатками прямой гидратации является частая замена катализатора и использование более дорогих концентрированных этиленовых фракций. Процесс синтеза этилового спирта прямой гидратацией этилена технически более прогрессивен, чем сернокислотной гидратацией, поэтому он получил значительно большее распространение в промышленности. Характерной особенностью процесса прямой гидратацией этилена является низкая конверсия исходного сырья — порядка 5 % за один проход. Таким образом, для полного использования этилена он должен быть пропущен через систему 18–20 раз.
Присоединение воды к олефинам всегда происходит по правилу Марковникова. Поэтому первичный спирт можно получить только из этилена; из других олефинов получаются вторичные или третичные спирты [3].
Прямой гидратацией этилена называется обратимый экзотермический процесс непосредственного (без образования промежуточных продуктов) присоединения воды к этилену в присутствии катализатора с образованием этилового спирта:
Степень превращения этилена за один проход через реактор составляет 3,5–4,8 %. Непрореагировавший этилен возвращается в реактор (рециркулирует), пары воды и спирта конденсируются в системе теплообменников и холодильников, а циркулирующий газ при этом охлаждается. Водно-спиртовый конденсат отделяют от циркулирующего газа в сепараторах и направляют на ректификацию. Из всего количества этилена, вступившего в реакцию, только 95–98,5 % превращается в спирт, а остальное — в диэтиловый эфир, ацетальдегид, полимеры. С целью повышения степени превращения этилена в спирт поддерживают высокую концентрацию этилена в циркулирующем газе (90 % масс, и более). При этом необходимо, чтобы концентрация этилена в свежей этиленовой фракции, поступающей с газоразделительной установки, была равна 99 % (масс) [1].
При ректификации водно-спиртового конденсата из него получают 93–94 %-ный спирт. Из выделенного концентрированного спирта удаляют небольшие количества ацетилена.
Производство этилового спирта в нашей стране играет важную роль в народном хозяйстве.
Гидратация этилена — наиболее эффективный способ производства этилового спирта, позволяющий экономить по сравнению с его получением из пищевого сырья на 1т этилового спирта около 4 т зерна или до 12 т картофеля.
На получение 1 т этилового спирта из пищевого сырья затрачивается от 160 чел.-час (из зерна) до 280 чел.-час. (из картофеля), из нефтехимического сырья — 10 чел.-час.; значительно меньше капитальных затрат потребуется на строительство заводов синтетического этилового спирта по сравнению с заводами пищевого этилового спирта.
Метод получения этилового спирта сернокислотной гидратацией этилена в настоящее время несколько устарел, кроме того он является небезопасным. Опасность данного метода обуславливается прежде всего использованием концентрированной серной кислоты и жёсткими технологическими параметрами процесса. Использование того или иного способа производства во многом обуславливается качеством сырья, а именно — содержанием этилена в исходной фракции.
Прямая гидратация этилена имеет ряд преимуществ перед сернокислотным методом: исключение расхода серной кислоты и минимальные потребности в других реагентах, кроме этилена и водяного пара. Кроме того, процесс прямой гидратации этилена протекает в одну стадию, что обуславливает более высокий выход спирта.
Основные термины (генерируются автоматически): этиловый спирт, прямая гидратация этилена, пищевое сырье, циркулирующий газ, гидратация этилена, осахаривание крахмала, присоединение воды, прямая гидратация, спирт, этилен.
Процессы гидратации непредельных углеводородов очень широко используются в промышленности органического синтеза для получения кислородсодержащих соединений. Этим методом из олефинов получают одноатомные спирты, в частности гидратацией этилена — этиловый спирт:

Все олефины, за исключением этилена, при гидратации образуют вторичные или третичные спирты. Так как присоединение воды к олефинам всегда происходит по правилу Марковникова. Правило Марковникова находит объяснение с позиции электронной теории органических реакций. Вследствие того, что электроотрицательность углерода больше, чем водорода, углерод в метильной группе СН3 несет на себе некоторый отрицательный заряд. Это приводит к сдвигу σ-электронов связи Н3С – СН в направлении центрального атома углерода. Этот сдвиг в свою очередь влечет за собой гораздо большее смещение подвижных π-электронов двойной связи в направлении, указанной изогнутой стрелкой:

Таким образом, электронные сдвиги НС, Н3ССН вызывают сильный сдвиг электронов двойной связи, т.е. поляризацию со сдвигом электронной плотности к атому углерода, не соединенному с алкильной группой:

Протон присоединяется к тому ненасыщенному атому углерода, который несет частичный отрицательный заряд. Ясно, что им будет атом углерода, связанный с меньшим числом алкильных групп (более насыщенный водородом). Анионная часть реагента направляется к атому углерода с наименьшей электронной плотностью — к наименее гидрогенизованному.
1.2 Термодинамика и кинетика процесса
Рассмотрим равновесие основной реакции: гидратации - внутримолекулярной дегидратации:

Она протекает с выделением тепла (∆Н°298 = -46 кДж/моль), следовательно, ее равновесие смещается вправо при понижении температуры. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутена в зависимости от температуры представлено графически на рис. 59. Видно, что равновесие невыгодно для гидратации олефинов, так как при 150—300°С,

Рис. 1 Температурная зависимость изменения энергии Гиббса для гидратации этилена (1), пропилена (2) и изобутена (3)
Рис. 2 Зависимость равновесной степени конверсии этилена в этанол от давления при разных температурах и. соотношении С2Н4:Н2О= =1:1
когда катализаторы процесса достаточно активны, ∆G° имеет большую положительную величину и равновесие смещено в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
Как показывает стехиометрия реакций, на их равновесие можно влиять, изменяя давление. Гидратации олефинов благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так, последняя при 250-300 °С и атмосферном давлении составляет всего 0,1-0,2 %, что совершенно неприемлемо для практических целей, но при 7-8 МПа и тех же температурах она возрастает до 12-20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис. 60, причем аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления.
Следует отметить, что при приближении к равновесию скорость гидратации и селективность падают, что делает невыгодным проведение реакции до степеней конверсии, близких к равновесным.
Скорость реакции зависит от строения олефина и длины его углеродной цепи. С наибольшей скоростью протекает гидратация олефинов разветвленного строения. Чем короче углеродная цепь олефина, тем труднее присоединяется к нему вода; наиболее трудно гидратируется этилен. Олефины по изменению реакционной способности можно расположить в следующий ряд, который объясняется электрофильным механизмом гидратации, определяемым сравнительной стабильностью промежуточных карбокатионов:


Данные о зависимости константы равновесия реакций гидратации некоторых олефинов от температуры и о тепловом эффекте реакций приведены в таблице.
Графически зависимость константы равновесия от температуры показана на рис. 108.
Читайте также:

