Обезболивание в травматологии реферат
Обновлено: 05.07.2024
Проводниковая анестезия – это один из видов анастезии, при котором выполняется блокирование нервной передачи в той области тела, где планируется выполнение операции, что проявляется полным обездвиживанием и обезболиванием.
Синонимы проводниковой анестезии: блокада нервов, периферическая анестезия, нервная анестезия, стволовая анестезия, нервная блокада, проводниковый наркоз.
Проводниковая анестезия является одной из разновидностей регионарной анастезии.
Что чувствует пациент во время проводниковой анестезии
В месте проведения проводниковой анестезии пациент может испытывать различные ощущения. В момент прокола иглой – либо небольшой дискомфорт, либо некоторую болезненность, выраженность которой не больше, чем боль, ощущаемая при взятии на анализ крови из вены. В момент введения местного анестетика в обезболиваемой области могут возникать чувства тяжести, распирания, жара. Если при проведении проводниковой анестезии не возникает никаких технических сложностей, то продолжительность неприятных ощущений исчисляется всего лишь несколькими секундами.
При проведении операции проводниковая анестезия гарантирует полное отсутствие боли при ясном сознании пациента. Если же пациент чувствует беспокойство и хочет поспать, то проводниковая анестезия может быть скомбинирована с седацией.
Как работает проводниковая анестезия
Обезболивание при проводниковой анестезии достигается благодаря блокаде нерва или группы нервов, по которым идёт передача болевого импульса от источника боли (места операции) к головному мозгу, обрабатывающему этот сигнал и выдающему его нам уже непосредственно в виде ощущения боли. В зависимости от того, какой именно нерв будет блокирован – анестезия той или иной области тела и наступит.
Как выполняется проводниковая анестезия
Технически проводниковая анестезия представляет собой один или несколько уколов раствора местного анестетика в область, где расположен необходимый для блокады нерв. Для того чтобы регионарная анестезия подействовала, лекарственный препарат должен быть введен в непосредственной близости от нерва - в нескольких долях миллиметра от него. Если местный анестетик будет введен чуть дальше нерва, то анестезия не разовьётся, а пациент при операции будет ощущать боль, что потребует изменения тактики анестезии, в частности, применения другого вида наркоза. В том случае, когда местный анестетик будет введен непосредственно в сам нерв, может развиться такое осложнение анастезии, как нейропатия (см. ниже).
Какие операции можно проводить под проводниковой анестезией
К сожалению, в силу анатомических особенностей организма человека при помощи проводниковой анестезии можно обезболить не любую часть тела. Поэтому примерный перечень основных операций, которые могут быть обезболены при помощи проводниковой анестезии, будет следующим: операции на верхних и нижних конечностях, операции по удалению паховой или бедренной грыжи, некоторые операции на половых органах, операции на щитовидной железе, операции на сонных артериях, стоматологические операции.
Какие бывают осложнения проводниковой анестезии
К наиболее серьёзным осложнениям проводниковой анестезии относятся развитие нейропатии, а также возникновение неблагоприятной реакции на местный анестетик.
Неблагоприятная реакция на местный анестетик проявляется или развитием аллергической реакции, или системной реакцией организма. Системная реакция организма возникает при случайном непреднамеренном введении раствора местного анестетика в кровеносный сосуд, она может проявиться сердечной аритмией, головокружением, слабостью, потерей сознания. Аллергическая реакция на местный анестетик - явление крайне редкое, встречающееся примерно в 1 случае на 50000 анестезий.
Что делает проводниковую анестезию максимально безопасной
Максимально безопасной и эффективной проводниковую анестезию делает использование при её проведении ультразвука.
Ультразвук помогает выполнять проводниковую анестезию под контролем зрения, а не вслепую, как это было раньше (и иногда ещё встречается на просторах нашей родины). Использование ультразвукового аппарата помогает видеть нерв и иглу, а, следовательно, позволяет ввести местный анестетик в необходимую зону.
Использование ультразвука в проводниковой анестезии позволяют свести к минимуму риск развития нейропатии, случайного внутрисосудистого введения местного анестетика и, что самое главное, значительно повысить успешность выполнения нервного блока, получив, таким образом, стопроцентное качественное обезболивание.
оперативного вмешательства, затем производится обкладывание области блокады стерильным бельем. Предварительно тонкой инъекционной иглой 0,5% раствором новокаина обезболивается кожа. Затем через анестезированный участок вводят в соответствующем направлении длинную иглу большего диаметра, предпосылая 0,25% раствор новокаина. Перед введением требуемой дозы новокаина необходимой концентрации (0,25%, 0,5% или 1%) в ткани для выполнения блокады обязательно потягивают поршень шприца на себя для предупреждения внутрисосудистого введения препарата (аспирационная проба). Высшая разовая доза новокаина при проведении блокад — 600 мг сухого вещества (240 мл 0,25% раствора, 120 мл 0,5% раствора, 60 мл 1% раствора).
При блокаде места перелома длинных трубчатых костей в гематому, образующуюся в зоне закрытого перелома, вводят 30—40 мл 1% раствора новокаина (рис. 4.1). Новокаин применяется в высокой концентрации, поскольку он разбавляется содержимым гематомы, а также для уменьшения количества раствора, вводимого в травматический очаг с отечными тканями. Попасть иглой в гематому бывает не всегда просто, поэтому поиск области перелома первоначально ведут с использованием 0,25% раствора новокаина, периодически подсасывая поршень шприца. Признаком попадания иглы в гематому является появление в шприце жидкой крови или микросвертков.
Футлярные блокады производят в пределах здоровых тканей про-ксимальнее области перелома кости.
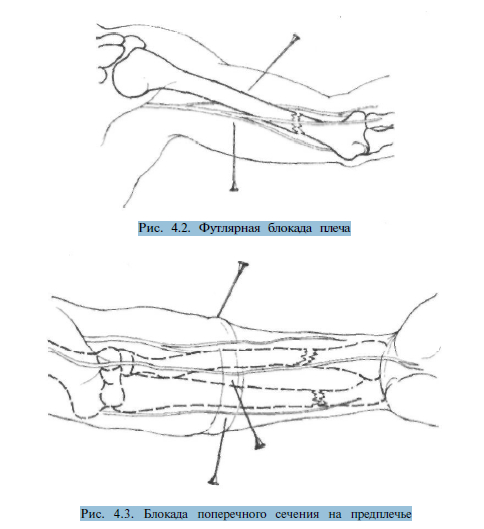
Ф утлярную блокаду плеча производят путем введения по 60-80 мл 0,25% раствора новокаина в футляр сгибателей и в футляр разгибателей. Первая точка вкола иглы располагается в средней трети передней поверхности плеча. Верхняя конечность при этом согнута в локтевом суставе. Предпосылая движению иглы раствор местного анестетика, проходят через двуглавую мышцу плеча до кости и вводят вышеуказанное количество препарата. После выпрямления конечности вводят аналогичное количество новокаина в футляр разгибателей, пройдя иглой трехглавую мышцу плеча до кости (рис. 4.2).
Первая точка вкола при футлярной блокаде бедра располагается на его передней поверхности, в его верхней или средней трети. Игла продвигается в сагиттальной плоскости до кости, после чего в передний футляр вводится 90-120 мл 0,25% раствора новокаина. Вторая точка вкола находится на наружной поверхности бедра, в верхней или средней трети. Длинная игла продвигается в горизонтальной плоскости докости, затем подается назад на 0,5-1 см и продвигается на 1 см кзади от кости, в задний футляр, куда вводится 120 мл 0,25% раствора новокаина.
Блокады поперечного сечения применяются на уровне плеча или предплечья проксимальнее области повреждения. Находящиеся на одном уровне 3-4 точки вкола иглы равноудалены друг от друга. Продвигая иглу вглубь тканей вводят по 50-60 мл 0,25% раствора новокаина из каждой точки вкола (рис. 4.3).
Блокада седалищного нерва осуществляется при положении раненого на спине. Точка вкола иглы находится на 3—4 см дистальнее большого вертела и на 1 см кзади от пальпируемой в этой зоне бедренной кости. После обезболивания кожи длинная игла продвигается горизонтально до бедренной кости, а затем еще на 1 см кзади от нее. В этом положении иглы вводится 80—90 мл 0,5% раствора новокаина (рис. 4.5).

Точка вкола иглы при блокаде большеберцового нерва располагается на 8—10 см дистальнее нижнего края надколенника и на 2 см кнаружи от гребня большеберцо-вой кости. Игла продвигается вертикально спереди назад на глубину примерно 5-6 см до ощущения прокола межкостной мембраны, после чего вводится 50-60 мл 0,5% раствора новокаина. Поскольку между волокнами межкостной мембраны имеются промежутки, прокол ее иногда может не ощущаться врачом. Тогда ориентируются на глубину введенной иглы (рис. 4.6).
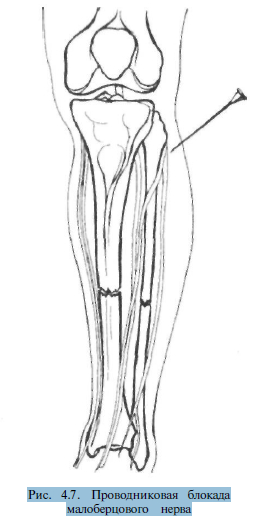
Блокада малоберцового нерва осуществляется из точки, расположенной на 0,5—1 см кзади от головки малоберцовой кости. Игла продвигается горизонтально на глубину 3-4 см до шейки малоберцовой кости. Затем вводится 30—40 мл 0,5% раствора новокаина (рис. 4.7).
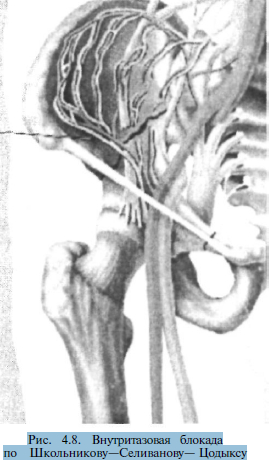
Внутритазовая блокада (по способу Школьникова— Селиванова—Цодыкса) проводится путем вкола длинной иглы на 1 см ме-диальнее передней верхней ости подвздошной кости с последующим продвижением вдоль гребня этой кости в направлении кзади и несколько медиально на глубину 6—8 см. Введение иглы производится до кости, з атем игла чуть вытягивается назад, изменяет направление и продвигается глубже и кнутри вновь до ощущения кости (рис. 4.8). Такая техника блокады необходима, чтобы избежать повреждения крупных сосудов таза и органов брюшной полости. Вводится 100-120 мл 0,25% раствора новокаина с одной стороны.
При переломах ребер производится межреберная проводниковая блокада. Раненый лежит на здоровом боку. Блокаду осуществляют в области углов ребер (на середине расстояния от остистых отростков грудных позвонков до медиального края лопатки). При поднятой руке становится доступен угол IV ребра. Пальпируется нижний край угла сломанного ребра, где и располагается точка вкола. Кожа в этом месте смещается краниа-льно. Игла длиной 3-5 см вводится до упора в ребро. Затем смещенная кожа отпускается, при этом игла перемещается к нижнему краю ребра. Достигнув нижнего края ребра, игла продвигается вглубь на 3 мм, при этом она проходит наружную межреберную мышцу. После обязательного выполнения аспирационной пробы (близость париетальной плевры, межреберных сосудов) вводится 10 мл 0,5% раствора новокаина. С учетом зон сочетанной и перекрестной иннервации межреберная блокада выполняется не только на уровне поврежденного ребра, но и в области выше- и нижележащих ребер.
При множественных переломах ребер выполняется паравертебраль-ная блокада. У раненого в положении лежа на боку пальпируют остистые отростки. Точка вкола иглы располагается на 6 см латеральнее линии остистых отростков. Игла продвигается в задне-переднем направлении и несколько медиально с отклонением павильона иглы на 45° кнаружи от сагиттальной плоскости. После контакта иглы с телом позвонка ее подтягивают на 1—2 мм, проводят аспирационную пробу и вводят 10 мл 0,5% раствора новокаина. Затем иглу подтягивают еще на 1 см и повторяют инъекцию 10 мл 0,5% раствора новокаина.
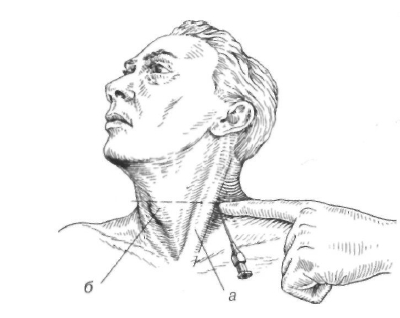
Шейная вагосимпатическая блокада (по А. В. Вишневскому) выполняется у раненых с повреждением органов груди. Раненый лежит на спине, под шейно-грудной отдел позвоночника подложен валик, голова повернута в сторону, противоположную блокаде. Верхняя на стороне блокады оттягивается книзу. Точка вкола у заднего края грудиноключично-сосцевидной (рис. 4.9а), тотчас ниже верхнего края щитовидного хряща (Указательным пальцем левой руки, помещенным вблизи точки врач осуществляет давление спереди назад, упираясь в поперечный VI шейного позвонка. Игла, вколотая у конца пальца, спереди назад, несколько кверху и медиально, по направлению к передней поверхности позвоночника. После достижения она подается назад на 5 мм. Вводится 40 мл 0,25% новокаина, при этом блокируются блуждающий и диафрагмальный нервы, пограничный симпатический ствол. После выполнения на стороне ее проведения отмечаются покраснение половины инъецированность сосудов склеры, положительный симптом Бернара — Горнера (птоз, миоз, энофтальм). Одновременное выполнение вагосимпатической блокады раненому с обеих сторон недопустимо возможного угнетения дыхания за счет блокады обоих диафрагмальных нервов и паралича диафрагмы.
При выполнении блокад возможны следующие осложнения:
1. Снижение артериального давления вследствие вазоплегического действия местного анестетика, что клинически проявляется коллапсом или углублением травматического шока. Для предупреждения осложнения раненому в состоянии шока новокаиновые блокады проводиться на фоне инфузионной терапии. Лечение развившейся гипотензии осуществляется немедленным внутривенным норадреналина (2 мл 0,2% раствора, разведенного в 400 мл 5% глюкозы, скорость введения 60 капель в минуту), 400 мл реополиглю-кина или полиглюкина.
2. Аллергические реакции — от крапивницы до анафилактического шока. Для предупреждения их у всех раненых с сохраненнымем перед выполнением блокады обязательно следует собрать краткий аллергологический анамнез. Лечение анафилактического шока включает немедленное внутривенное введение норадреналина, 2 мл 1% раствора димедрола, 90 мг преднизолона или соответствующую дозу других глюкокортикоидных гормонов, 10 мл 10% раствора хлористого кальция, 400 мл реополиглюкина.
4. Попадание иглы в артерию. Иглу следует извлечь и прижать пальцем артерию на 2—3 мин; блокаду выполнить из другой точки, еще раз оценить правильность выбранных ориентиров.
На этапе оказания квалифицированной медицинской помощи для обезболивания в предоперационном периоде преимущественно применяют проводниковые блокады.
Так же, как на предыдущем этапе эвакуации, наркотические анальгетики (морфин, фентанил, промедол) используются только при неэффективности других обезболивающих средств и если они не применялись ранее. Для седатации и дополнительной умеренной нейровеге-тативной стабилизации, наряду с димедролом, феназепамом используют дроперидол (при стабильной гемодинамике).
После оперативных вмешательств следует стремиться проводить обезболивание сочетанием ненаркотических анальгетиков, нейролептиков, седативных и антигистаминных препаратов. Наркотические анальгетики должны вводиться по строгим показаниям. Из методов регионарного обезболивания в послеоперационном периоде применяются проводниковые блокады и длительная эпидуральная блокада.

В табл. 4.1 приведена сравнительная характеристика наркотических анальгетиков, применяемых на передовых этапах медицинской эвакуации.
На этапе оказания специализированной медицинской помощи при
обезболивании у раненых широко применяются все существующие методы регионарного обезболивания, в том числе длительные блокады различных нервных образований. Используются различные группы ненаркотических и наркотических обезболивающих препаратов. Перспективное значение имеют наркотические анальгетики — частичные агонисты опиоидных рецепторов (бупранал), характеризующиеся высокой анальгетической активностью и минимальными побочными эффектами.
В травматологии и ортопедии применимы все общие принципы анестезиологии, однако данную область хирургии характеризует разнообразнейший спектр оперативных вмешательств и крайняя вариабельность возрастного состава пациентов. Данные особенности требуют индивидуального подхода при выборе оптимального метода анестезии при том или ином типе операции у каждого конкретного пациента.
Между травматологическими и ортопедическими операциями много общего, но существуют и значительные различия. Пациенты, получившие скелетные травмы (в том числе и сочетанные), зачастую оперируются в экстренном порядке, без соответствующей подготовки, на фоне гиповолемии (вплоть до гиповолемического шока). Ортопедические же операции имеют плановый характер, бывают обширными, травматичными, часто сопровождаются массивной кровопотерей, но, как правило, имеют своей задаче улучшение качества жизни, а не ее спасение.
Ни в одной специальности преимущества интра- и послеоперационного применения регионарной анестезии и анальгезии (РА) не выражены настолько отчетливо, как в травматологии и ортопедии. Кроме того, они подтверждены в значительном количестве международных контролируемых клинических исследований. Доказано положительное влияние РА на объем интраоперационной кровопотери и частоту тромбозов глубоких вен (ТГВ), а также тромбоэмболий легочной артерии (ТЭЛА). Значительную роль методы РА играют в предупреждении и лечении боли после перенесенных ортопедо-травматологических операций.
РА в травматологии.
Эффективное обезболивание должно проводиться в максимально ранние сроки после получения травмы. Применение опиоидных анальгетиков ограничено опасностью угнетения дыхания, особенно у пациентов пожилого и старческого возраста. Нестероидные противовоспалительные препараты (НПВП) обладают достаточно хорошим анальгетическим эффектом, но они относительно противопоказаны у пациентов с гиповолемией (возможно ухудшение почечного кровотока).
Идеальным вариантом для обезболивания при острой травме является регионарная анальгезия. Блокада бедренного нерва обеспечивает адекватное обезболивание при диафизарных переломах бедра. Блокада межреберных нервов эффективна при множественных переломах ребер, однако продолжительность ее действия невелика. Поэтому идеальным выбором в данной ситуации является длительная высокая эпидуральная анальгезия (ЭА). Адекватное обезболивание при помощи высокой ЭА позволяет обеспечить адекватные параметры самостоятельного дыхания и избежать перевода пациентов на ИВЛ.
Травмы таза.
Чаще всего пациенты с травмами таза поступают в клинику с признаками шока 3-й степени и, помимо стандартной инфузионной терапии, нуждаются в экстренной гемотрансфузии 2-3 доз эритроцитарной массы. Наружная фиксация (является экстренным хирургическим вмешательством) может быть выполнена как в условиях общей, так и в условиях регионарной анестезии. Выраженная гиповолемия является противопоказанием для спинальной анестезии (СА), поэтому методом выбора является ЭА. Пациенты с травмой таза нуждаются в обезболивании на протяжении нескольких суток. Пролонгированная ЭА позволяет обеспечить адекватное обезболивание и в послеоперационном периоде. Поворот пациента на бок для пункции и катетеризации эпидурального пространства в данной ситуации затруднен из-за выраженного болевого синдрома, поэтому данная манипуляция может быть выполнена в условиях в/в анальго-седации мидазоламом (5-10 мг) и кетамином (1-1,5 мг/кг).
Альтернативным (или дополнительным) методом обезболивания при травмах таза является назначение НПВП: лорноксикама (ксефокама) в дозе 16-24 мг/сут в/м или в/в, кеторолака 30 мг 3-4 р/сут в/м или в/в, кетопрофена 100 мг 2-3 р/сут в/м.
Операции при переломах шейки бедра.
Переломы шейки бедра характерны для пациентов пожилого и старческого возраста (чаще женщин) на фоне остеопороза. Трехмесячная летальность составляет около 12%, в течение года этот показатель возрастает до 21%.
Пациенты с переломами шейки бедра более или менее длительное время находятся в состоянии иммобилизации, что сопровождается развитием гиповолемии, возможна гипостатическая пневмония и т.д. Необходима своевременная диагностика и максимально возможная коррекция функций жизненно важных органов. Большое значение имеет тип предстоящей операции. Фиксация канюлированными винтами представляет собой малоинвазивное, непродолжительное по времени вмешательство, сопровождающееся минимальной кровопотерей. Гемиартропластика – длительная процедура, по травматичности приближающаяся к тотальному эндопротезированию тазобедренных суставов (ТЭТС). Фиксация динамическими винтами представляет собой промежуточное по длительности и травматичности вмешательство.
Возможно проведение как общей, так и регионарной анестезии. Для интраоперационной анестезии приемлемы ЭА, СА, блокада поясничного сплетения, блок 3-в-1. Вопрос о проведении седации решается индивидуально.
СА и ЭА снижают частоту послеоперационного ТГВ и вероятность послеоперационных расстройств психики. В то же время, СА может вызвать интраоперационную гипотензию. Поворот пациента на бок для эпидуральной или субарахноидальной пункции может быть достаточно болезненным. При этом целесообразно в/в введение малых доз кетамина и мидазолама (см выше).
Поверхностная общая анестезия в комбинации с блокадой поясничного сплетения или блоком 3-в-1 может быть методом выбора у пациентов с сердечно-сосудистой патологией, а также у пациентов, контакт с которыми затруднен. Такая односторонняя блокада оказывает меньшее влияние на гемодинамику, по сравнению с нейроаксиальными блокадами.
Операции при диафизарных переломах бедра.
Операции при сочетанных травмах.
Пациенты, получившие тяжелые сочетанные травмы, чаще всего нуждаются в длительных хирургических вмешательствах, выполняемых специалистами различного профиля. В большинстве случаев они переводятся на ИВЛ.
Регионарная анестезия может быть применена в качестве компонента общей анестезии, хотя экстренный характер вмешательства, нестабильность гемодинамики и нарушения свертываемости зачастую делают ее неприемлемой.
Рекомендуется избегать продленной регионарной анестезии / анальгезии у пациентов с риском развития компартмент-синдрома. Компартмент-синдром является серьезным осложнением, угрожающим жизнеспособности конечности при травме. Риск особенно высок при переломах костей предплечья и большеберцовой кости. Мышцы, нервы и сосуды конечностей находятся в достаточно плотных фасциальных футлярах. Когда давление внутри фасциального футляра превышает давление в капиллярах, микроциркуляция в них прекращается, что ведет к локальной ишемии мышц и нервов. Если давление не снижается в течение нескольких часов – развиваются необратимые ишемические изменения в виде некроза мышц с развитием контрактуры, поражения нервов и сосудов. Основными симптомами компартмент-синдрома являются: боль в пораженной части конечности, усиливающаяся при пассивном растяжении мышц, напряженный отек в области компартмента с тугим натяжением фасции и кожи и парестезии в зоне иннервации нервов, проходящих через зону компартмента.
Боль является начальным признаком развития компартмент-синдрома, поэтому рекомендуется избегать регионарных блокад и эпидуральной анестезии / анальгезии у пациентов с риском его развития.
Контингент пациентов в ортопедии весьма разнообразен – от новорожденных с врожденными аномалиями опорно-двигательного аппарата до обездвиженных больных пожилого и старческого возраста с полиорганной недостаточностью. Ряд операций, выполняемых по поводу спортивных травм (восстановление передней крестообразной связки, операции по поводу повреждения менисков и т.п.) привычно ассоциируется с пациентами молодого и среднего возраста, в то время как средний возраст пациентов, нуждающихся в протезировании крупных суставов, превышает 70 лет. Естественно, что свыше 40% пациентов данной группы имеют серьезную сопутствующую патологию сердечно-сосудистой, дыхательной системы, сахарный диабет и т.д. Подвижность этих больных существенно ограничена, что может маскировать снижение толерантности к физическим нагрузкам, обусловленное сопутствующими заболеваниями.
Тотальное эндопротезирование тазобедренного сустава.
ТЭТС является эталонной ортопедической операцией, в наибольшей степени демонстрирующей влияние выбора оптимального метода анестезии и периоперационной интенсивной терапии на исход хирургического лечения и частоту осложнений, в том числе летальных.
СА идеально удовлетворяет требованиям анестезии при ТЭТС, обеспечивая хорошую релаксацию мышц, необходимую для манипуляций на конечности. Недостатком данного метода является невозможность его пролонгации на послеоперационный период. Поэтому оптимальным методом анестезии представляется комбинированная спинально-эпидуральная анестезия (СЭА). При СЭА спинальный компонент обеспечивает адекватную анестезию во время операции, а эпидуральный – послеоперационную анальгезию. Для профилактики гипотензии перед спинальной пункцией проводится в/в преднагрузка – 600-800 мл 0,9% физиологического раствора.
ТЭТС сопряжено с тремя опасными осложнениями: интраоперационной кровопотерей, синдромом имплантации цемента в костную ткань, ТЭЛА.
Проведение СЭА при операциях ТЭТС позволяет снизить объем интраоперационной кровопотери практически в 2 раза. Данный эффект в большей степени обусловлен симпатической блокадой, в меньшей степени снижением системного АД. Есть данные, о том, что на фоне СЭА снижается внутрикостное давление.
Выявлено 2,5-5-кратное снижение частоты тромбозов глубоких вен бедра, 1,5-кратное снижение частоты тромбозов глубоких вен голени и 3-кратное снижение частоты ТЭЛА у пациентов, перенесших ТЭТС в условиях СЭА с последующей эпидуральной инфузией местных анестетиков в течение 24 часов, по сравнению с теми, кто был оперирован под общей анестезией и получал опиоиды в послеоперационном периоде.
Тотальное эндопротезирование коленного сустава (ТЭКС).
Пациенты, нуждающиеся в ТЭКС, обычно страдают тяжелым остеоартритом или ревматоидным артритом. При тяжелом остеоартрите коленных суставов часто наблюдаются дегенеративные изменения других суставов, несущих большую нагрузку. Особенно это касается поясничного отдела позвоночника. В связи с этим, пункция эпидурального и субарахноидального пространства может быть сопряжена с техническими трудностями.
Послеоперационный болевой синдром (в отличие от ТЭТС) отличается высокой интенсивностью, в связи с чем пациенты, перенесшие ТЭКС, в послеоперационном периоде нуждаются в назначении значительных доз опиоидных анальгетиков или, что предпочтительнее, эпидуральной инфузии местных анестетиков.
В связи с этим, комбинированная СЭА представляется оптимальным методом анестезии / анальгезии при ТЭКС.
Артроскопические операции на нижних конечностях.
Чаще всего данным операциям подвергаются пациенты молодого возраста, не имеющие сопутствующей патологии.
Эти операции зачастую выполняются в амбулаторных условиях. В связи с этим, выбор метода анестезии должен осуществляться с учетом ранней активизации и выписки пациента домой. С применением артроскопической техники выполняются следующие вмешательства: диагностическая артроскопия, операции на менисках, удаление свободного фрагмента мениска, синовиэктомия, реконструктивные операции на связочном аппарате.
При амбулаторных вмешательствах для своевременной выписки пациентов необходимо в ранние сроки активизировать больного, купировать болевой синдром, предотвратить тошноту и рвоту. Внутрисуставное введение ропивакаина или (20 мл 0,75% раствора) обеспечивает адекватную анальгезию в течение нескольких часов после операции. Добавление к этому раствору 5-10 мг морфина позволяет продлить анальгетический эффект. Анальгетический эффект морфина обусловлен его взаимодействием с периферическими опиатными рецепторами. Альтернативой является назначение НПВП.
Короткие артроскопические операции могут быть выполнены под местной или внутривенной анестезией пропофолом и фентанилом.
Блокада бедренного нерва, как компонент анестезии, позволяет существенно снизить интенсивность послеоперационной боли.
Операции на голеностопном суставе . Послеоперационный болевой синдром наиболее выражен после операции артродеза, что снижает целесообразность применения СА в данном случае. Применяется методика, сочетающая общую анестезию и блокаду бедренного нерва. Блокада бедренного нерва (выполняется за 40 минут до разреза) в сочетании с седацией может быть и самостоятельным методом анестезии. При использовании в самостоятельном виде блокаду бедренного нерва дополняют блокадой подкожного нерва (дистальная ветвь бедренного нерва, иннервирующая кожу книзу от медиальной лодыжки).
Операции на плече и предплечье.
Большинство операций на верхней конечности может быть выполнено в условиях РА – блокады плечевого сплетения (БПС). Успех БПС зависит от трех основных условий: а) знания анатомии плечевого сплетения, а также распределения моторной и сенсорной иннервации верхней конечности, б) технических навыков безопасного и точного проведения иглы в фасциальный футляр плечевого сплетения, в) введения необходимого объема раствора местного анестетика соответствующей концентрации.
Предпочтительным местным анестетиком для блокады плечевого сплетения является ропивакаин, использование которого ассоциируется с меньшими нарушениями атриовентрикулярной проводимости, меньшей частотой желудочковых тахикардий по сравнению с бупивакаином.
Ропивакаин, в отличие от бупивакаина, является чистым левовращающим изомером, что определяет его меньшую кардиотоксичность. Кроме того, при случайном внутрисосудистом введении токсическое воздействие на ЦНС проявляется раньше, чем кардиотоксичность, что позволяет принять соответствующие меры.
Объем МА должен быть достаточным для заполнения футляра плечевого сплетения. Использование меньших объемов характеризуется медленным развитием блока и снижением его эффективности. Считается, что для достижения 99% частоты адекватного блока плечевого сплетения необходимо около 40 мл раствора местного анестетика (1,5% лидокаина, 0,5% бупивакаина, 0,75% ропивакаина).
Использование больших объемов достаточно безопасно, так как распространение введенного местного анестетика в основном ограничено пределами фасциального футляра сплетения. Площадь, с которой осуществляется абсорбция МА, невелика. Эта особенность выгодно отличает блокаду плечевого сплетения от интерплевральной анальгезии, эпидуральной или межреберной блокады, при которых площадь абсорбции достаточно высока.
Операции на кисти.
- Beattie W., Badner N., Choi P. Epidural analgesia reduces postoperative myocardial infarction: a meta-analysis. // Anesth.Analg. – 2001.- V.93.- P.853-858.
- Connolly D . Ortopaedic anaesthesia . // Anaesthesia . – 2003.- V .58.- P .1189-1193.
- Parker M., Handoll H., Griffiths R. Anesthesia for hip fracture surgery in adults (Cochrane Review). In: The Cochrane Library, Issue 2, Oxford: Update Software, 2001.
- Sharrock N., Cazan M., Hargett M. Changes in mortality after total hip and knee replacement over a ten year period. // Anesth.Analg. – 1995.- V.80.-P.242-248.
- Urwin S., Parker M., Griffits R. General versus regional anaesthesia for hip fracture surgery: a meta analysis of randomized trial. // Brit.Med.J. – 2000.- V.84.- P.450-455.
Регионарная анестезия и лечение боли. Тематический сборник. Москва-Тверь 2004 г., стр.221-229
Современные принципы и возможности обезболивания в травматологии и ортопедии

Авторы: Рушай А.К., Отдел политравмы и костно-гнойной инфекции НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького
Версия для печати
В работе приведены принципы терапии болевого синдрома в практике травматолога. Определение характера боли, индивидуальных особенностей каждого клинического случая, использование мультимодального принципа лечения являются современной тактикой и обеспечивают хорошие результаты в подавляющем большинстве случаев.
У роботі наведені засади терапії больового синдрому в практиці травматолога. Встановлення характеру болі, індивідуальних особливостей кожного кліничного випадку, застосування мультимодального принципу лікування є сучасною тактикою та забезпечують добрі результати у більшості випадків.
The paper presents the principles of treatment of pain syndrome in the practice of traumatologist. Determining the nature of pain, the individual characteristics of each clinical case, the use of multimodal treatment principles are the modern tactics and provide good results in most cases.
Актуальность
На современном этапе проблема лечения острой послеоперационной боли остается актуальной. Значительная часть пациентов, перенесших хирургические вмешательства, страдает от послеоперационной боли. Более половины пациентов оценивают послеоперационную боль выше 5 баллов по 10-балльной визуально-аналоговой шкале (ВАШ). Хроническая боль является во всех случаях патологическим состоянием, приводящим к дезадаптации и снижению качества жизни пациента. В настоящее время не существует анальгетика, который бы безопасно и надежно воздействовал на все механизмы боли. Идеальное обезболивание — это отличные результаты обезболивания без нежелательных явлений (побочных эффектов).
Целью работы является улучшение качества лечения болевого синдрома в периоперационном периоде у травматологических больных.
Задачи:
— уточнить особенности и характер болевого синдрома у травматологических больных;
— на основе современных представлений разработать комплексное лечение и внедрить его в практику;
— оценить эффективность предложенного лечения.
Современные подходы к проведению обезболивания у травматологических больных
Упрощенно боль у травматологических больных делится на такие виды:
— ноцицептивная боль (после травмы, воспалительная боль, висцеральная боль);
— нейропатическая боль (при диабетической полинейропатии, травмах нервных стволов, воспалении их);
— смешанная боль (туннельные синдромы, онкологические боли, радикулопатии).
Чаще всего боль носит ноцицептивный характер (боль повреждения). Процесс этот многоэтапный.
Формирование болевого стимула на периферии называется трансдукцией. Происходит она в специфических болевых рецепторах. Ими богаты кожа и слизистые, надкостница, эндотелий сосудов. Первичная гипералгезия развивается в зоне поврежденных тканей открытого перелома, где выделяющиеся из поврежденных клеток и окончаний С-афферентных волокон медиаторы боли (алгогены) сенситизируют периферические ноцицепторы. Возникает болевая импульсация.
Процесс трансмиссии заключается в передаче сформировавшегося болевого импульса по афферентным волокнам в интегративные центры центральной нервной системы. Задние рога спинного мозга являются ключевой структурой в формировании болевого сигнала. Здесь происходит не только усиление его интенсивности, но и модуляция болевого импульса.
Модуляция — воздействие на передачу болевой информации с периферических волокон на спинномозговые нейроны путем пресинаптического торможения и облегчения. Модулированный ноцицептивный сигнал распространяется по восходящему пути к коре головного мозга. Значительное место в обработке болевой информации отводится ретикулярной формации и гипоталамусу.
Перцепция — восприятие болевого импульса отдельными участками коры головного мозга.
Современным подходом в проведении обезболивания при повреждениях является мультимодальное обезболивание. Такой принцип предполагает применение различных по химической структуре, механизму действия и точкам воздействия препаратов. Их синергизм позволяет уменьшить отрицательное воздействие на организм и получить желаемый эффект в меньших дозировках.
Предшествующая, или упреждающая, анестезия (pre-emptive anesthesia) предполагает повышение болевого порога, комфортное состояние пациента еще до операции и в послеоперационном периоде в результате предшествующего применения относительно небольших доз современных препаратов. Уровень анальгезии должен контролироваться самим пациентом.
Составными частями мультимодального обезболивания являются:
— нестероидные противовоспалительные препараты (НПВП);
— вспомогательные лекарственные средства.
К анестезиологической защите пациентов в периоперационном периоде существуют определенные требования — европейский стандарт, рекомендации Американского общества по лечению боли:
1. Охват всех уровней ноцицепции (мультимодальность).
2. Непрерывность анестезиологической защиты до, во время и после операции.
3. Индивидуальный выбор безопасных средств разных уровней.
Опиоиды являются основой послеоперационного обезболивания и одними из наиболее длительно применяемых препаратов. Опиоидный компонент остается основой защиты от боли на центральном (сегментарном и надсегментарном) уровне, однако не может обеспечить полную анестезиологическую защиту.
Длительное и широкое применение опиоидов обусловлено их положительными качествами:
— эффективны при тяжелой боли;
— не вызывают гастроинтестинальных кровотечений;
— не имеют эффекта насыщения.
В последнее время общепризнанным направлением в алгологии является тенденция к отказу от опиоидных препаратов или снижению их количества. Это связано с наличием побочных, нежелательных эффектов, к которым относятся:
— риск привыкания и зависимости;
— риск тяжелых побочных эффектов — побочные влияния на желудочно-кишечный тракт (ЖКТ), угнетение сознания, затрудненное мочеиспускание в послеоперационном периоде, депрессия дыхания.
Опиоидные анальгетики не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гипералгезию. Поэтому общие анестетики в сочетании с опиоидными анальгетиками не способны полностью защитить пациента от боли при операционной травме. Существует необходимость воздействовать также на неопиоидные механизмы развития боли. Поэтому регионарная анестезия местными анестетиками в любом варианте (местная, проводниковая, спинальная или эпидуральная) должна обязательно присутствовать в мультимодальном обезболивании травматологических больных.
В последние десятилетия наблюдается отчетливая тенденция к усилению роли неопиоидного компонента в мультимодальной анальгезии, в частности усиливается роль нестероидных противовоспалительных препаратов и парацетамола. Обусловлено это несколькими причинами.
С одной стороны, опиоидные анальгетики не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гипералгезию. Вот почему общие анестетики снимают лишь ощущение, переживание боли.
С другой стороны, антиноцицептивную защиту организма целесообразно начинать на предоперационном этапе с применения ингибиторов алгогенов. Имеющее важнейшее значение в механизмах центральной сенситизации, а следовательно, и в формировании хронической боли тканевое воспаление является показанием для включения в схему лечения послеоперационной боли НПВП. В течение длительного периода времени НПВП считали периферическими анальгетиками, способными через обратимую блокаду циклооксигеназы (ЦОГ) подавлять синтез медиаторов воспаления, в первую очередь простагландинов, в тканях. Затем были получены доказательства центрального действия НПВП. В частности, показано, что НПВП угнетают таламический ответ на ноцицептивную стимуляцию и препятствуют повышению концентрации простагландинов в спинномозговой жидкости, что тормозит развитие вторичной гипералгезии.
В процессе воспаления ключевую роль играет арахидоновая кислота и продукты ее обмена. Существующий арахидоновый каскад регулируется циклооксигеназами. Нестероидные противовоспалительные препараты угнетают (ингибируют) ЦОГ-1 и ЦОГ-2.
ЦОГ-1 является конституциональной и защитной в слизистой желудка и кишечника, почках и тромбоцитах. ЦОГ-2 — индуцированная, определяется в зоне воспаления, макрофагах и синовиоцитах.
Существующие первоначально НПВП воздействовали как на ЦОГ-1, так и на ЦОГ-2. Поэтому выраженный клинический эффект классических НПВП сопровождался и высоким риском нежелательных эффектов ингибирования ЦОГ-1 — осложнений со стороны слизистых ЖКТ, кровоточивости и т.д.
Минимизация нежелательных эффектов шла следующими путями. Синтезировались молекулы с выраженным обезболивающим эффектом уже в минимальных дозировках, которые не обладали нежелательными эффектами, например лорноксикам (Ксефокам ® ).
Механизм действия лорноксикама — сбалансированное ингибирование ЦОГ-1 и ЦОГ-2; ингибирование активных форм кислорода, окиси азота и интерлейкина-6; стимуляция выработки эндогенных опиатов — эндорфина и динорфина (при внутривенном введении). Биодоступность 97–100 %. Препарат имеет короткий период полувыведения — 4 часа. Отсутствует риск кумуляции. Не активирует внутрипеченочные ферменты. Преимуществом его является и то, что имеется несколько форм выпуска. Это позволяет обеспечить преемственность терапии. Не требуется коррекции дозы в группах повышенного риска (пожилые, пациенты с нарушениями функции печени и почек).
Другим направлением являлся синтез селективных ингибиторов ЦОГ-2, специфических ингибиторов.
В последнее время у нас появилась возможность использования внутривенной формы парацетамола.
Нами было предложено и широко внедрено эффективное комбинированное анестезиологическое пособие и послеоперационное обезболивание у больных с открытыми переломами голени или травматическим остеомиелитом после них.
Материалы и методы
Анестезия у травматологических больных с переломами костей нижних конечностей соответствовала определенным требованиям. Она была простой и надежной, малотоксичной, максимально длительной. Факторы иммунитета при этом не подавлялись. Так как важным этапом развития воспаления является нарушение микроциркуляции в очаге и пораженном сегменте, то важным было ее длительное улучшение. Наиболее полно всем этим требованиям соответствовала спинномозговая анестезия, которая и применялась нами у этих больных. От общепринятой методики она отличалась применением препарата Ксефокам ® с целью премедикации и обезболивания в ближайшем послеоперационном периоде. Интраоперационно и вечером всем пострадавшим вводили внутривенно капельно раствор парацетамола.
Однако боль у травматологических больных не всегда была связана с повреждением. Часто это смешанная боль — ноцицептивная с нейропатическим компонентом. Наиболее часто она возникает в случаях переломов или вмешательств вблизи суставов, при хронических воспалительных процессах, на фоне заболеваний позвоночника, хронических интоксикаций или сосудистых заболеваний. Общепринятым стало мнение, что в развитии нейропатической боли предрасполагающими факторами являются сосудистые заболевания, преморбидные дегенеративные изменения в мышечно-сухожильно-периартикулярных тканях, остеохондроз позвоночника. Высокий удельный вес пострадавших старших возрастных категорий подразумевает высокий удельный вес этой патологии.
Для диагностики нейропатического компонента используются различные шкалы. Примером служит переведенный и адаптированный опросник DN4.
Во время беседы выясняются следующие моменты:
— ощущение жжения, болезненное ощущение холода, ощущение как от удара током;
— пощипывание, ощущение ползания мурашек, покалывания, онемения, зуда;
— определяли понижение чувствительности к прикосновению или покалыванию.
В лечении смешанных болевых синдромов необходимо воздействие на оба компонента боли, ноцицептивный и нейропатический.
Обоснованным в комплексном лечении нейропатической боли является применение антидепрессантов, антиконвульсантов, местных анестетиков, а также блокаторов калиевых каналов.
Перспективным и пока еще мало применяемым в Украине является направление нормализации обменных процессов в нервном волокне, стимуляция регенерации пораженных структур. С этой целью применяются антиоксиданты (Актовегин, берлитион), коферменты (витамины группы В — Нейробион), нуклеотиды (Келтикан).
В основе развития нейропатического компонента боли лежит демиелинизация — повреждение, связанное с потерей миелина и относительным открытием аксона. Происходит нарушение функции периферического нерва (проведение импульса). Наступает аномальная возбудимость путей центральной и периферической нервной системы. Функция миелина — повышение скорости, c которой импульс распространяется вдоль нерва.
Келтикан представляет собой комбинацию двух молекул нуклеотидов: цитидинмонофосфата и уридинтрифосфата. Келтикан уменьшает боль, нормализует глубокую и поверхностную чувствительность, повышает силу.
Коферменты (витамины группы В — Нейробион) являются неотъемлемой частью лечения нейропатического компонента боли. Снижая болевой синдром, они участвуют в нормализации обменных процессов в нервном волокне. Той же цели служат и антиоксиданты (Актовегин и альфа-липоевая кислота).
Полученные результаты и их обсуждение
Согласно проведенному исследованию ноцицептивной боли (по ВАШ), большинство прооперированных травматологических больных оценивало свое состояние как удовлетворительное (4,6 ± 0,5 балла). Использование опросника DN4 позволило определить нейропатический компонент различной выраженности у 54,6 % больных в первые сутки после операции. К 7–14-м суткам лишь у 21,6 % больных он носил выраженный характер, причем у одного пациента это была четко выраженная фантомная боль после ампутации. В этих случаях курс лечения был продлен еще на 7 суток, после чего был получен положительный эффект.
Таким образом, полученные нами результаты свидетельствуют о высокой эффективности предложенной нами лечебной тактики для профилактики болевого синдрома у травматологических больных в периоперационном периоде. Малотравматичное вмешательство, введение в нерв раствора лидокаина при ампутациях, проведение предшествующего мультимодального ноцицептивного обезболивания в сочетании с профилактикой нейропатического болевого компонента (коферменты, антиоксиданты и нуклеотиды) позволили нам получить в подавляющем большинстве случаев хорошие результаты.
Выводы
1. Профилактика и лечение боли у травматологических больных в периоперационном периоде должны быть комплексными.
2. Предшествующая мультимодальная анестезия и ранняя профилактика нейропатического компонента с использованием препарата Келтикан ® являются основными составляющими предложенного подхода.
3. В подавляющем большинстве случаев нами получены хорошие результаты.
1. Павленко А.Ю., Хижняк А.А. Болевой синдром: патофизиологические механизмы развития и методы воздействия на этапах оказания медицинской помощи // Медицина неотложных состояний. — 2006. — № 1 — С. 29-39.
2. Овечкин А.М. Послеоперационный болевой синдром: клинико-патофизиологическое значение и перспективные направления терапии // Consilium medicum. — 2005. — Т. 7, № 6. — С. 32-36.
3. Современные тенденции лечения послеоперационной боли. Материалы заседания круглого стола, посвященного проблеме послеоперационной боли и способам ее решения. Москва, 8 ноября 2005 г. // Consilium medicum. — 2005. — Т. 7, № 6. — С. 37-41.
4. Moreland L.W., St. Clair E.W. The use of analgesics in the management of pain in rheumatic diseases // Rheum. Dis. Clin. North Am. — 1999. — 25. — 153-191.
5. Atcheson R., Rowbotham D.J. Pharmacology of acute and chronic pain // Rawal N., ed. Management of Acute and Chronic Pain. — London, England: BMJ Books, 1998. — 23-50.
6. Power I., Barratt S. Analgesic agents for the postoperative period. Nonopioids // Surg. Clin. North Am. — 1999. — 79. — 275-295.
7. EuroPain — European Minimum Standards for the Management of Postoperative Pain. 1998. Adapted from Needleman P. et al. // J. Rheumatol. — 1997. — 24 (Suppl. 49). — 7.
8. Clark D., Layton D., Shakir S. Do some inhibitors of COX-2 increase the risk of thromboembolic events? Linking pharmacology with pharmacoepidimiology // Drug Saf. — 2004. — 27. — 427-56.
9. Noveck R.J. et al. // Clin. Drug Invest. — 2001. — 21(7). — 465-476.
10. DYNASTAT Summary of Product Characteristics. 2002. — Pharmacia Europe EEIG, High Wycombe, Buckinghamshire, UK.
11. Integrated Summary of Safety Information. August 26, 2000. — Pfizer Inc., New York, NY.
12. Hubbard R.C. et al. // Br. J. Anaesth. — 2003. — 90. — 166-172.
14. Barden J., Edwards J., Moore A., McQuay H. Single dose oral paracetamol (acetaminophen) for postoperative pain (Cochrane Review). The Cochrane Library. — Chichester: John Wiley & Sons, 2004.
16. Bombardier C., Laine L., Reicin A. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis // N. Engl. J. Med. — 2000. — 343. — 1520-8.
17. Brodner G., Mertes N., Buerkle H. Acute pain management: analysis, implications and consequences after prospective experience with 6349 surgical patients // Eur. J. Anaesth. — 2000. — 17. — 566-75.
18. Dolin S., Cashman J., Bland J. Effectiveness of acute postoperative pain management: I. Evidence from published data // Br. J. Anaesth. — 2002. — 89. — 409-23.
20. Backonja M.M., Stacey B. Neuropathic pain symptoms relative to overall pain rating // J. Pain. — 2004. — 5 (9). — 491-497.
21. Бысов М.В., Рушай А.К. Раннее лечение нейропатической боли у больных с переломами лучевой кости в типичном месте // Зб. наук. праць XV з’їзду ортопедів-травматологів України. Дніпропетровськ, 16–18 вересня 2010 р. — С. 258.
Читайте также:

