Нэк у новорожденных реферат
Обновлено: 04.07.2024
Язвенный некротизирующий энтероколит представляет собой некротическое воспаление, которое отмечается преимущественно у недоношенных детей после введения энтерального питания.
Точные патофизиологические механизмы пока еще плохо изучены, но известно, что основными факторами риска ЯНЭК являются недоношенность, бактериальная колонизация, энтеральное питание и нарушение кровотока в кишечнике.
Известно, что кишечник плода подвергается воздействию амниотической жидкости, содержащей гормоны и пептиды, которые могут играть определенную роль в созревании кишечника. На стадии плода кишечник в норме защищен благодаря стерильному окружению и может быть не готов ко встрече с бактериальной инфекцией.
К моменту начала бактериальной колонизации и энтерального питания ЖКТ недоношенного ребенка может еще не достичь стадии полного созревания, что ведет к увеличению риска возникновения ЯНЭК. Одна из гипотез заключается в том, что повреждение кишечника при ЯНЭК может быть результатом колонизации особо чувствительного кишечника недоношенного ребенка патогенными бактериями, что приводит к повреждению слизистой оболочки и вызывает чрезмерную воспалительную реакцию.
Желудочно-кишечный тракт недоношенного ребенка отличается незрелостью. Такие дети подвергаются воздействию меньшего количества микроорганизмов, способствующих созреванию кишечника, и, напротив, имеют контакт с большим спектром патогенных микроорганизмов, повышающих в совокупности риск возникновения сепсиса или ЯНЭК. Более того, имеющиеся на настоящий момент данные позволяют говорить о неспособности незрелого кишечника плода или недоношенного ребенка подавлять воспалительный ответ.
Эпителиальные клетки незрелого кишечника проявляют чрезмерный ответ на действие как эндогенных медиаторов воспаления (например, TNF-a или IL-1b), так и экзогенных медиаторов воспаления (например, бактерий). Такой чрезмерный ответ может отмечаться при действии как комменсальных, так и патогенных бактерий. Исследования, в которых сравнивали ответы эпителиальных клеток кишечника плода и взрослого человека, показали отсутствие различий в экспрессии рецепторов на эти медиаторы воспаления, но у незрелых энтероцитов была отмечена стимуляция NFKB-сигнала из-за сниженной экспрессии его ингибитора IкВ.
К тому же было показано, что иммунные клетки собственной пластинки слизистой оболочки (lamina propria) или периферической крови могут ограничивать экспрессию провоспалительных генов, несмотря на индукцию NFKB-сигнала бактериями. Таким образом, недоношенные дети с незрелой иммунной системой составляют группу риска по формированию провоспалительного ответа в дальнейшей жизни.
Увеличение NFKB-сигнала ведет к повышению продукции IL-8 — хемокина, который стимулирует миграцию нейтрофилов из сосудов в интерстиций, может напрямую активировать нейтрофилы и регулировать экспрессию молекул адгезии нейтрофилов. Таким образом, рекрутируя и активируя иммунные клетки, IL-8 может играть важную роль в воспалении. Исследования, проведенные ранее, показали, что уровень IL-8 сыворотки значительно увеличивается в первые 24 час в случае тяжелого течения ЯНЭК.
Данные гистологических исследований кишки, полученные при ее резекции по поводу острого ЯНЭК, показывают стимуляцию мРНК IL-8 во всех слоях слизистой и мышечной оболочек и кишечном эпителии по сравнению с изменениями, выявленными у детей с другими воспалительными заболеваниями или без таковых.
Проведенные исследования также демонстрируют различный ответ на действие бактериальных токсинов у незрелых энтероцитов ребенка и зрелых энтероцитов взрослого. Было показано повышение экспрессии рецепторов на токсин холеры и снижение ее на токсин Шига и токсин A Clostridium difficile.
В дополнение к этому последние исследования выявили увеличенное поступление токсина в незрелые энтероциты. Путем эндоцитоза, проходя через клатриновую сеть, токсин быстро попадает в незрелые энтероциты, что отличается от более медленного попадания токсина посредством кавеол и рафт в энтероциты взрослого. Этим можно объяснить более быстрое течение заболевания у младенцев по сравнению с детьми старшего возраста. Ускоренный эндоцитоз может увеличивать способность клеток быстро растущего незрелого кишечника поглощать интактные гормоны и факторы роста.
В то же время незрелый кишечник не в состоянии дифференцировать полезные вещества и вредные микроорганизмы, токсины и антигены, что увеличивает риск возможного негативного воздействия.

Пути взаимодействующих протеинов обозначены стрелками. Слева указаны функциональные классы ферментов.
ATF — трансмембранный фактортранскрипции;
IкВ — ингибитор каппа В;
IкК — IкВ-киназа;
IRAK — киназа, ассоциированная с рецептором IL-1;
IRF — фактор транскрипции, индуцирующий интерфероновый ответ;
МАМР — ассоциированные с микроорганизмами молекулярные паттерны;
МАРК — митоген-активируемая протеинкиназа;
МАРКК — киназа МАРК;
МАРККК — киназа киназы МАРК;
NFkB — нуклеарный фактор каппа В;
TLR — Toll-подобные рецепторы;
TRAF6 — ассоциированный с TNF фактор 6.
Роль бактерий в развитии язвенного некротизирующего энтероколита (ЯНЭК)
Несмотря на то что описаны многие случаи ЯНЭК, до сих пор не выявлена связь этого заболевания с каким-либо определенным микроорганизмом. Неясно, являются ли бактерии первичным фактором возникновения ЯНЭК или они играют роль пассивного участника, проникающего в стенку кишечника при нарушении барьерной функции его слизистой оболочки. Присутствие бактерий является предпосылкой к возникновению ЯНЭК; в исследованиях показана роль профилактического назначения антибиотиков в снижении частоты возникновения ЯНЭК.
Таким образом, ведущая роль при лечении ЯНЭК принадлежит антибактериальной терапии. Однако нельзя считать ЯНЭК инфекционной патологией в чистом виде. Более правильно говорить о чрезмерном воспалительном ответе на присутствие бактерий с развитием септического процесса или без такового, поскольку лишь у 30% детей с этой патологией посевы крови оказываются положительными.
РА-1 обусловливает повышенную проницаемость кишечного эпителия для цитотоксинов псевдомонад. Более того, было показано, что этот фактор вирулентности может быть индуцирован супернатантом из культуры эпителиальных клеток кишки при гипоксии. Это позволило говорить о чувствительности бактерий к фактору, секретируемому в окружающую бактерии среду, что может способствовать трансформации этих микроорганизмов в более вирулентные фенотипы.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения

Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Классификация НЭК новорожденных
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
В зависимости от массивности поражения различают следующие варианты НЭК:
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Прогноз и профилактика НЭК новорожденных
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
В лекции представлены вопросы эпидемиологии, этиологии, патогенеза, патоморфологии, ранней диагностики некротизирующего энтероколита новорожденных (НЭК). Рассмотрены также принципы профилактики и комплексного лечения заболевания. Большое внимание уделяется проблемам нутритивной поддержки при профилактике и лечении НЭК, а также реабилитации новорожденных, перенесших данное патологическое состояние.
Neonatal necrotizing enterocolitis
The lecture presents issues of epidemiology, etiology, pathogenesis, and pathomorphology, early diagnosis of neonatal necrotizing enterocolitis (NEC). It was also consider the principles of prevention and comprehensive treatment of the disease. Much attention is paid to nutritional support in prevention and treatment of NEC, as well as the rehabilitation of infants who underwent this pathological state.
Некротизирующий энтероколит (НЭК) новорожденных — наиболее частая причина постнатальной критической ситуации воспалительного генеза. Долгое время в качестве синонимов НЭК фигурировали такие патологические состояния, как функциональная кишечная непроходимость, внутрибрюшной абсцесс, спонтанная перфорация подвздошной кишки, аппендицит, некротический колит новорожденных с перфорацией, ишемический энтероколит, инфаркт кишечника новорожденных. Таким образом, почти до второй половины прошлого века данное патологическое состояние не было очерчено как нозологическая форма. В настоящее время НЭК нашел свое место в МКБ-10 под рубрикой Р.77.
С клинической точки зрения НЭК представляет собой широкий спектр вариантов течения заболевания: от случаев, заканчивающихся благополучно, без каких-либо последствий, до тяжелых форм, осложняющихся некрозом кишечника, перфорацией, перитонитом и сепсисом, приводящим, как правило, к летальному исходу.
Факторы риска:
1. Гипоксия плода и новорожденного.
2. Тяжелые инфекции матери.
3. Фетальный дистресс.
4. Реанимационные мероприятия в неонатальном периоде.
5. Повторные апноэ.
7. Катетер, длительно стоящий в пупочных сосудах.
8. Заменные трансфузии при гемолитической болезни новорожденных (ГБН).
9. Кормление гиперосмолярными смесями.
10. Форсированные объемы питания.
12. Патологическая контаминация кишечника.
13. Кокаиновая интоксикация плода и новорожденного.
Патофизиология и паторморфология. Доминирующей точкой зрения считается ишемия кишечника с последующей бактериальной инвазией. Болезнь может развиться в результате воздействия одного, но очень сильного агента или комбинации факторов. Эти агенты или факторы инициируют патологию путем повреждения защитного барьера кишечника — слизистой. Повреждение может быть прямым и косвенным. Прямое повреждение — воздействие бактерий непосредственно на слизистую. Косвенное повреждение слизистой оболочки — результат локальной гипоксии клеточного эпителия (сосудистая обструкция) или результат генерализованной гипоксии (асфиксия в родах, сердечно-легочные заболевания). При повреждении слизистой эндогенные бактерии из просвета кишки внедряются в его стенку, тем самым запуская каскад воспалительных реакций, и вызывают дополнительные повреждения с возможным окончательным некрозом кишки. НЭК может локализоваться в одном сегменте кишки (50%) или в нескольких сегментах, обычно в терминальном отделе подвздошной кишки и следующей за ней — толстой.
Патогенез НЭК является многокомпонентным. Материалы большинства исследований привели к заключению, что НЭК — конечный результат нарушения кровообращения в кишечной стенке вследствие различных причин, среди которых доминирует гипоксия с последующим вазоспазмом в мезентериальных сосудах и нарушением перфузии и реперфузии стенки (постгипоксическая ишемия кишечника). Показано, что даже короткий эпизод ишемии нарушает барьер слизистой оболочки, вследствие чего проницаемость эпителия резко увеличивается. При снижении перфузии через мезентериальные сосуды выделяются свободные радикалы, которые очень токсичны для внутриклеточных структур, таких как лизосомы и митохондрии.
Существуют и ятрогенные механизмы развития НЭК. Так, внутривенное использование гиперосмолярных лекарственных веществ повреждает слизистую оболочку кишечника. Известно, что ксантины (теофиллин и аминофиллин) замедляют перистальтику и, кроме того, могут вызвать повреждение энтероцитов, продуцируя токсичные свободные радикалы. Есть публикации о связи НЭК с применением гидрокарбоната натрия, кальциевых добавок.
Пероральное использование больших доз витамина Е при лечении ретинопатии у недоношенных повышает риск НЭК. Избыточные дозы внутривенного кальция, вызывая вазоспазм, способствуют развитию НЭК. Аналогично действует индометацин, блокируя синтез простагландинов.
Среди микроорганизмов, играющих этиологическую роль, значение имеет не только облигатно патогенная, но и нормальная флора кишечника новорожденных, которая может стать для данных детей инвазивной. Существует множество работ о роли Clostridia в патогенезе как НЭК, так и газовой гангрены кишечника. Примечательно, что у недоношенных детей с отрицательным результатом посева крови и перитонеальной жидкости на культуру Clostridia лечение, как правило, ограничивается медикаментозными препаратами, в то время как все пациенты с высевом Clostridia требуют хирургического лечения. У детей, пораженных С. Perfringens, заболевание протекает обычно в молниеносной форме с выраженным пневматозом кишечника, гангреной, перфорацией и летальным исходом. С. Butyricum — менее вирулентна. С.difficile является одной из наиболее частых причин антибиотико-ассоциированной диареи и, в частности, отсроченного некротического колита. Многие эпидемиологические исследования последних лет подтверждают возможную роль всего спектра анаэробов данной группы в генезе НЭК, хотя подчеркивается отсутствие единого бактериального агента. Грибы рода Candida в качестве возможного возбудителя НЭК выявляют у детей, заболевших уже в конце периода новорожденности и находившихся до этого на длительной антибактериальной терапии. Известно, что коагулазо-негативные стафилококки являются высоко патогенными как у взрослых пациентов, так и у детей, особенно находящихся в отделениях интенсивной терапии новорожденных. Столь же неблагоприятную роль в развитии НЭК может сыграть вирусная инфекция: коронавирусы, ротавирусы и вирусы Коксаки типа В2. Описаны случаи сочетания активной цитомегаловирусной инфекции и НЭК.
Таким образом, являясь полиморфным заболеванием, НЭК чаще всего вызывается комбинацией вирусно-бактериальных, бактериально-грибковых возбудителей, обусловливающей усиление их взаимной вирулентности у детей с перинатальными факторами риска. Тем не менее инфекция всегда вторична на фоне незрелости и постгипоксического поражения кишечника. Даже положительная гемокультура не может бесспорно ответить на вопрос, является ли выделенный патоген первичным или он попал в циркуляцию вследствие ишемического повреждения слизистой оболочки кишки.
Клиническая картина НЭК имеет как специфические, так и неспецифические симптомы. Последние обусловлены физиологической незрелостью и включают такие ранние признаки, как неусвоение пищи, большой остаточный объем в желудке при его ревизии, вздутие живота. Затем появляются поздние неспецифические симптомы: нестабильная температура тела, повторные апноэ, брадикардия, летаргия, гипогликемия и шок. Кормление усугубляет имеющиеся клинические нарушения. Типично развитие симптоматики в первые 6 недель с пиком заболеваемости между 5-10-м днями жизни. Более специфические симптомы связаны с поражением ЖКТ: срыгивание после кормления (более 70%), рвота (более 70%), кровь в прямой кишке (79-86%) и диарея (4-26%). По мере прогрессирования болезни при пальпации выявляется болезненность и перерастянутые кишечные петли, иногда крепитация брюшной стенки. Отек и гиперемия передней брюшной стенки свидетельствуют уже о перитоните. У маловесных детей заболевание прогрессирует очень быстро с развитием гемоколита, напряжением мышц передней брюшной стенки (поздние признаки). Терминальная стадия характеризуется развитием септического шока с летальным исходом. Таким образом, НЭК характеризуется определенной стадийностью процесса, которая должна учитываться при выборе тактики терапии.
Стадии НЭК: 1-я стадия — продромальная (стадия растяжения передней брюшной стенки). Общее состояние еще удовлетворительное, хотя у детей, перенесших внутриутробную гипоксию и угрожаемых по реализации инфицирования, состояние после рождения может быть тяжелым за счет неврологических расстройств, нарушений дыхания и сердечно-сосудистой деятельности. Может иметь место мраморность кожных покровов, единичные приступы апноэ, срыгивания и снижение толерантности к пище. Живот вздут и чувствителен при пальпации, стул слизистый, без запаха и видимых примесей крови. Выделение данной стадии важно, т.к. позволяет своевременно корректировать тактику выхаживания новорожденных из группы риска и избежать хирургического вмешательства.
2-я стадия — клинических проявлений НЭК. Первые симптомы в зависимости от тяжести морфологических изменений появляются на 6-9-е сутки жизни детей. Эта стадия характеризуется симптомами дистонии и дискинезии ЖКТ, спазмом сфинктеров; характерно вялое сосание, частые срыгивания молоком, периодически с примесью желчи, быстро прогрессирующая потеря массы тела. В последующем появляется вздутие живота, болезненность при пальпации, чаще — справа. Стул с тенденцией к задержке, частый, малыми порциями со слизью. Дисбактериоз является непременным атрибутом НЭК.
4-я стадия — перфоративного перитонита, характеризуется симптомами перитонеального шока, исчезновением печеночной тупости и наличием газа под куполом диафрагмы.
Лабораторно-инструментальная диагностика. У детей с НЭК обычно имеет место нейтро-, тромбоцитопения и метаболический ацидоз. Уже на 1-й стадии заболевания количество нейтрофилов может быть меньше, чем 1500 клеток в мм 3 . Нейтропения связана с грамотрицательной септицемией и с супрессией костного мозга. Тромбоцитопения ассоциирована с грамотрицательными бактериями и продуктами воспаления (липополисахариды, ФНО) и различными другими цитокинами. Наиболее информативным показателем является динамика тромбоцитов. Тромбоцитопения связана с их деструкцией и обусловлена грамотрицательной септицемией. Устойчивая корреляция наблюдается между внезапным падением числа тромбоцитов, ухудшением состояния и гангреной кишечника. У некоторых детей с НЭК отмечается ДВС. Метаболический ацидоз — характерный признак НЭК и может рассматриваться как маркер некроза кишечной стенки. При обследовании детей, находящихся на искусственном вскармливании, отмечается повышенное выделение лактозы с каловыми массами. Отклонение от нормы показателей теста на лактазную недостаточность отмечается уже за 1-4 дня до начала клинических проявлений НЭК, характерно повышение в сыворотке гексозаминидазы. Достоверный признак-определение IgА в копрофильтрате. Перспективный метод диагностики — определение концентрации IL — 1: увеличение более 150 000 пкг/мл достоверно указывает на НЭК. Для уточнения стадии НЭК и его прогноза большое значение имеет использование доступного современного теста — прокальцитонина (ПКТ). При уровне ПКТ выше 2 нг/мл высока вероятность бактериального сепсиса.
Ультразвуковая диагностика (УЗИ) помогает диагностировать некроз кишки, свободную жидкость в брюшной полости и газ в портальной системе печени. Простота выполнения, хорошая переносимость и отсутствие ионизирующей радиации делают этот метод диагностики в настоящее время незаменимым тестом в комплексной диагностике, нередко помогая решать вопрос и об оперативном вмешательстве. УЗИ может также установить и локализацию свободной жидкости в брюшной полости с целью проведения парацентеза. Существуют два основополагающих признака для данной патологии: высокоэхогенные частицы (микропузыри) в воротной вене, бляшки в печеночной паренхиме.
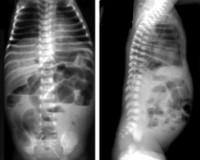
Рентгенологические признаки НЭК: неравномерное вздутие кишечных петель, пневматоз кишечной стенки (линейный или кистозный), газ в портальной системе печени, пневмоперитонеум, внутрибрюшная жидкость. Пневматоз и газ в портальной системе печени — самые частые рентгенологические признаки НЭК. На совокупности клинических и рентгенологических данных строятся алгоритмы диагностики НЭК, детализирующие стадии заболевания по тяжести.
Алгоритм диагностики НЭК (Walsh и Kliegman, 1986)
1а и 1б ст. — отмена энтерального питания, постановка назогастрального зонда и постоянная декомпрессия желудка путем активной аспирации под низким отрицательным давлением, инфузионная терапия для проведения парентерального питания, антибиотики в течение трех дней;
2а ст. — то же, антибиотики в течение 7-10 дней;
2б ст. — то же, антибиотики в течение 14 дней;
3а ст. — то же, дополнительно кардиотоники, ИВЛ, парацентез;
3б ст. — то же, что и выше, обязательное хирургическое вмешательство.
Антибактериальная терапия. В лечении НЭК антибактериальная терапия занимает одно из ведущих мест. Несмотря на то, что посев крови и определение чувствительности к антибиотикам необходимы еще до введения препаратов, их следует назначать, не дожидаясь результатов бактериологического исследования. Предпочтительнее внутривенное введение антибиотиков широкого спектра действия, в последующем — антибиотики, действующие против анаэробов, это объясняется тем, что последние колонизируют кишечник новорожденного обычно с 1-й по 2-ю неделю. Антибиотики должны действовать не только против бактерий, встречающихся при НЭК, но и против нозокомиальной флоры. В настоящее время, если у пациентов из крови и кала высевается коагулазо-негативный стафилококк, рекомендуются комбинации ванкомицина + гентамицина или ванкомицина + цефалоспоринов 3-го поколения. В то же время комбинация ванкомицин + цефалоспорины 3-го поколения используется с осторожностью, если в посевах продолжается рост бактерий, так как возможна вторичная грибковая колонизация и развитие сепсиса.
В связи с высокой смертностью от грибкового сепсиса всем больным с неспецифическими клиническими проявлениями и отсутствием явного бактериального источника необходимо проведение противогрибковой терапии.
В последние годы терапия внутривенным иммуноглобулином (ВВИГ) играет решающую роль в комплексной терапии НЭК, т.к. позволяет значительно улучшить его прогноз. Разовая суточная доза — 0,4 г/кг, курсовая — 2 г. Продолжительность курса — 3-5 дней. Альтернативой — могут быть Октагам, Эндобулиния, при возможности предпочтение следует отдавать ВВИГ, обогащенному антителами IgM, IgA — Пентаглобин.
Исходя из этого, для профилактики НЭК и его осложнений большое значение имеет использование пробиотиков. Существуют данные литературы, неоспоримо доказывающие, что альтернативы назначению пробиотиков при вскармливании недоношенных детей нет. Еще в середине прошлого века бифидумбактерин входил в стандарты выхаживания новорожденных данной группы и рекомендовался всем недоношенным, начиная с 10-14 дней жизни, т.к. дети, рожденные раньше срока, имеют все факторы риска, ведущие к дисбиозу кишечника, следовательно, и НЭК. Кроме того, эти дети, как правило, появляются на свет путем кесарева сечения и имеют значительно более низкое содержание лактобактерий в кишечнике по сравнению с новорожденными, родившимися естественным путем. Достоверное сокращение частоты НЭК при ежедневном применении новорожденным группы риска пробиотиков было показано многими зарубежными и отечественными исследователями.
Показания к оперативному лечению: опухолевидное образование брюшной полости, свидетельствующее о наличии внутрибрюшного абсцесса или конгломерата некротизированных кишечных петель, воспалительные изменения брюшной стенки. Уплотнение, отек или фиброзное воспаление подкожной клетчатки брюшной стенки — грозные признаки, которые обычно появляются при наличии подлежащего абсцесса, перитонита или гангрены кишки. Из рентгенологических признаков о гангрене кишки свидетельствуют статичная петля кишки, наличие кишечных петель разных размеров, асцит и газ в портальной системе печени; лабораторные данные — остро возникшая тромбоцитопения, коагуляционные нарушения, тяжелая гипонатриемия и стойкий ацидоз, подтверждающие наличие некроза кишечной стенки; данные абдоминального парацентеза, свидетельствующие о некрозе кишечной стенки (мутная жидкость коричневого цвета, выявление при окраске по Граму внеклеточных бактерий, большое число лейкоцитов, преобладание в лейкограмме нейтрофилов). Положительный результат парацентеза высоко специфичен для кишечного некроза — получение при аспирации более 0,5 мл коричневой или желто-коричневой жидкости, содержащей бактерии. Негативный результат парацентеза — редкость, однако встречается при некрозе стенки кишки, если есть прикрытая перфорация или повреждение кишки протекает без перфорации.
Предоперационная подготовка. Общие условия для проведения предоперационной подготовки включают: адекватную вентиляцию легких, лечение шока, антибактериальную терапию, коррекцию анемии и коагулопатии. Напряженный пневмоперитонеум препятствует адекватной вентиляции и является показанием к выполнению лапароцентеза. Предоперационная подготовка длится не более 1-2 часов. Если состояние ребенка не улучшается за это время, переходят к операции или дренируют брюшную полость. В операционной необходимо избегать охлаждения, поэтому ребенок укладывается на подогреваемый матрац, а температура вводимых растворов должна быть 38 градусов С. Послеоперационный уход предпочтительнее выполнять в условиях ОПН, интергрированного в многопрофильную детскую больницу.
Реабилитация детей, перенесших НЭК, очень сложный и трудоемкий процесс, который не ограничивается ликвидацией проблем, связанных с поражением кишечника, и включает мероприятия, направленные на нормализацию всех функций организма и обеспечения ребенку приемлемого качества жизни, поскольку почти все пациенты с НЭК имеют еще и целый комплекс других видов патологии. Отсюда отсутствие комплексного подхода в диагностике и лечении сопутствующих состояний может сыграть пагубную роль в будущей жизни ребенка даже при хороших результатах лечения НЭК. Речь идет прежде всего о неврологических нарушениях, риске бронхолегочной дисплазии (БЛД) и ретролентальной фиброплазии, являющихся непременным атрибутом незрелости детей. Поэтому пациенты с НЭК должны по направлению участкового педиатра осматриваться неврологом, окулистом, гастроэнтерологом и другими специалистами, в помощи которых они нуждаются.
Введение прикорма детям, перенесшим НЭК, также должно учитывать степень незрелости и сопутствующие состояния. Пищевые добавки (соки, желток) и прикормы (каши, овощное пюре) вводят: недоношенным массой >2 кг — на 1-2 недели раньше, а при массе

Некротический энтероколит является приобретенным заболеванием, прежде всего у недоношенных или больных новорожденных, и характеризуется некрозом слизистой оболочки или даже более глубоких слоев кишечника. Его развитие является самой частой опасностью для младенцев со стороны желудочно-кишечного тракта. Симптомы и признаки включают непереносимость пищи, вялость, неустойчивость температуры, непроходимость кишечника, вздутие живота, рвоту с примесью желчи, кровавый стул, редуцирующие вещества в стуле, апноэ и иногда признаки сепсиса. Диагноз клинический; подтверждают методами визуализации. Лечение в первую очередь поддерживающее и включает аспирацию содержимого желудка через назогастральный зонд, парентеральное введение жидкостей, полное парентеральное питание, антибиотики, изоляцию в случае инфекционных заболеваний и иногда хирургическое вмешательство.
Факторы риска
Асфиксия при рождении
Изменение микробиома кишечника (дисбиоз)
Кормление молоком нечеловеческого происхождения
Как правило, присутствуют три кишечных фактора:
Предшествующий ишемический инсульт
Внутрипросветный субстрат (те, энтеральное питание)
Этиология
Точная этиология некротического энтероколита не выяснена. Однако предрасполагающими факторами являются повышенная проницаемость и недоразвитая иммунная функция незрелого кишечного тракта. Считается, что ишемический инсульт повреждает слизистую оболочку кишечника, что приводит к повышенной проницаемости кишечника и делает его восприимчивым к бактериальной инвазии. Некротический энтероколит редко возникает до начала применения энтерального питания и менее распространен среди младенцев на грудном вскармливании. Однако, как только было начато кормление, в просвете кишечника появляется достаточно субстрата для распространения бактерий, которые могут проникнуть в поврежденную стенку кишечника, вырабатывая газообразный водород. Газ может собираться в кишечной стенке (пневматоз кишечника) или попадать в воротную вену. Дисбактериоз (изменение микробиома кишечника), например, возникающий после лечения антибиотиками или препаратами снижающими кислотность, также может быть способствующим фактором, так как при нем возрастает количество условно-патогенных бактерий.
Первоначальный ишемический инсульт может быть результатом спазма брыжеечных артерий, вызванного бескислородным инсультом, запускающим примитивный дайвинг-рефлекс, который заметно уменьшает кишечный кровоток. Кишечная ишемия может также быть результатом низкого кровотока во время обменного переливания крови, при сепсисе или из-за использования гиперосмолярных смесей. Точно так же врожденный порок сердца с уменьшенным системным кровотоком или насыщением кислородом артериальной крови может привести к кишечной гипоксии/ишемии и предрасполагает к развитию некротизирующего энтероколита.
Некротизирующий энтероколит может возникнуть как группа случаев или как вспышки в отделениях интенсивной терапии новорожденных. Некоторые группы случаев, скорее всего, связаны с конкретными возбудителями (например, с Klebsiella, Escherichia coli, коагулазонегативными стафилококками), но тем не менее специфический патоген при этом часто бывает не идентифицирован.
Осложнения некротического энтероколита

Некроз начинается в слизистой оболочке и может прогрессировать до вовлечения стенки кишечника на всю толщину, что приводит к кишечной перфорации Острая перфорация желудочно-кишечного тракта Перфорация может происходить на любом уровне желудочно-кишечного тракта; при этом содержимое желудка или кишечника поступает в полость брюшины. Причины различны. Клинические симптомы развиваются. Прочитайте дополнительные сведения с последующим перитонитом Перитонит Боль в животе – часто встречающийся симптом, который не всегда имеет очень важное значение. Однако острая и выраженная боль практически всегда служит признаком заболевания органов брюшной полости. Прочитайте дополнительные сведения и часто свободным воздухом в брюшной полости. Перфорация встречается чаще всего в подвздошной кишке; толстая кишка и проксимальные отделы тонкого кишечника поражаются реже. У 20–30% младенцев развивается сепсис Неонатальный сепсис Неонатальный сепсис является инвазивной инфекцией, как правило, бактериальной, развивающейся в неонатальном периоде. Симптомы сепсиса многообразны, неспецифичны и включают снижение спонтанной. Прочитайте дополнительные сведения и возможен смертельный исход.
Клинические проявления
У младенцев могут быть трудности с кормлением, остатки крови и желчи в желудке (после кормления), которые могут перейти в желчную рвоту, кишечная непроходимость проявляется вздутием живота или же большим количеством крови в стуле. Сепсис может проявляться вялостью, нестабильностью температуры, учащенными приступами апноэ и метаболическим ацидозом.
Читайте также:

